一株干酪乳桿菌ZW-63A產高光學純L-乳酸的發酵優化研究
吳再強,鄒慧斌 ,季更生,張汝兵,咸 漠
(1.江蘇科技大學生物與化學工程學院,江蘇鎮江212018;2.中科院青島生物能源與過程研究所,山東青島266101)
乳酸的構型可以分為L-乳酸、D-乳酸和DL-乳酸[1],廣泛應用于食品、醫藥、輕紡、化工和環保等領域[2]。近年來,利用高品質的L-乳酸聚合生產的生物可降解塑料及醫療活性材料正被迅速推廣應用[3],向世界展示了L-乳酸的巨大發展前景。由于我國在L-乳酸的質量和產量上都不能滿足市場日益增長的需求,且產品多為消旋的 DL-乳酸,品質較低[2],因此對L-乳酸的工業發酵工藝進行優化研究,對于提高我國 L-乳酸的產量和品質具有重要的意義[2-4]。秦浩等[2]以乳酸菌 G-02為出發菌株,采用 DES和NTG誘變處理,采用高溫高糖培養基進行篩選,最后獲得一株L-乳酸菌G-04,在搖瓶發酵條件下發酵液中可積累L-乳酸151g/L。高年發等[5]以野生型乳酸乳桿菌干酪亞種進行發酵,乳酸產量最高為143.8g/L。但他們都沒有對L-乳酸進行光學純度分析。Se-Kwon Moon[10]等篩選得到一株 Lactobacillus paracasei subs p.paracasei CHB2121,經過發酵優化后,L-乳酸的光學純度達到96.6%。本實驗研究了一株干酪乳桿菌的種子培養方式、中和劑添加方式和培養基組等對L-乳酸產量和光學純度的影響,旨在為工業化生產L-乳酸發酵工藝的進一步優化提供一定的借鑒依據。
1 材料與方法
1.1 材料與儀器
干酪乳桿菌(Lactobacillus casei)ZW-63A 中國科學院青島生物能源與過程研究所生物基化學品團隊篩選,選育與保藏;葡萄糖、乙酸鈉、碳酸鈣、吐溫-80等試劑 均是分析純,國藥集團;蛋白胨、酵母粉 OXOID公司;L-乳酸標樣 山東省科學院。
Cary 50 UV-Vis型紫外分光光度計 Varian公司;GSP-9080MBE型隔水式恒溫培養箱 上海博迅實業有限公司醫療設備廠;6-16型臺式高速離心機Sigma公司;SW-CJ-1FD超凈工作臺 蘇州安泰空氣技術有限公司;SBA-40D生物傳感分析儀 山東省科學院生物研究所;DHG9076A電熱恒溫鼓風干燥箱 上海精宏實驗設備有限公司;ZHWY-1102C雙層小容量恒溫搖床 上海智誠公司。
1.2 實驗方法
1.2.1 發酵工藝最優工藝參數的確定 在做單因素實驗時,依次改變葡萄糖、酵母粉、乙酸鈉和磷酸二氫鉀的添加量,同時改變種子培養方式、碳酸鈣添加方式以及改變裝液量,在單因素實驗中,每個梯度都設置三個平行的搖瓶實驗,取三個平行實驗的平均值作為測量結果,以L-乳酸產量和菌體OD值為評價指標進行實驗分析。通過前面的單因素實驗結果分析,最后確定葡萄糖、酵母粉和乙酸鈉三個因素設計三因素三水平的響應面分析實驗[6-8],實驗設計中的水平和編碼見表1。

表1 Box-Behnken設計各因子及其編碼值Table 1 Each variable at different levels in Box-behnken design
1.2.2 響應面模型的分析驗證 將響應面優化后的最佳結果進行實驗驗證[6],在最優的發酵條件下,設置三個平行的搖瓶的實驗,首先用 Design-Expert 8.0.7軟件將優化實驗數據與響應面模型進行擬合,得到擬合二次多項式回歸方程,對該模型進行回歸方程分析和方差分析,確定出其極值點以及取得極值相應自變量的取值,按照模型優化出來的最優工藝參數進行發酵驗證實驗,以驗證模型的可靠性,并確定最后的優化結果[7-8]。
1.2.3 乳酸的分析方法 L-乳酸含量的測定時,先將發酵液混勻,移取100μL的發酵液稀釋到500倍,10000r/min離心1min,采用生物傳感分析儀測定,將三個平行的搖瓶實驗測定后取其平均值;乳酸的光學純度用高效液相色譜法(手性分離柱)進行測定,首先移取100μL混勻的發酵液稀釋至100倍,然后用0.22μm的濾膜過濾,乳酸光學純度測定條件:采用Sumichiral OA-5000 4.6mm×150mm手性分離柱,流動相為2mmol/L CuSO45%異丙醇,流速為1mL/min,柱溫 35℃,紫外檢測波長 236nm[10]。
1.2.4 菌體濃度的測定 先將發酵過后的發酵液室溫下靜置30min,移取發酵液中的上清液100μL稀釋至50倍,利用分光光度計在波長600nm處測定菌體的 OD 值[9-10],將三個平行的搖瓶實驗的樣品測定后取其平均值作為OD值的測定結果,發酵液中菌體的總OD值=OD600×稀釋倍數。
1.3 數據統計分析
所有實驗均進行3次重復,取其平均值,平均值和標準偏差的統計分析由Microsoft Excel 2010軟件進行處理。除響應面分析外的繪圖由Origin 8.5軟件統計分析實驗數據完成。響應面數據分析采用統計分析軟件Design-Expert 8.0.7。
2 結果與分析
2.1 確定種子培養方式與接種時間
如圖1所示,種子的培養方式一定程度上會影響菌體濃度,本實驗采取以下四種培養方式:靜置培養;振蕩培養;靜置12h再振蕩培養;振蕩12h再靜置培養。由圖1可以看出,采取靜置12h再振蕩培養的菌體濃度最高,并且在培養到20h時菌體濃度達到最高,在16~20h菌體進入對數生長期,20h之后菌體濃度變化不大,菌體已進入穩定期,為了減少菌體接種到發酵培養基中培養的延遲期,同時為了保證接入發酵培養的種子的活力,防止菌種衰亡老化,選擇將種子培養到18、20、22h分別接入到發酵培養基中,結果如圖2所示。其中選擇將種子培養到20h時,乳酸產量最高,菌體濃度最低,葡萄糖消耗量最多,而培養到18h接種時,菌體濃度最高,乳酸產量最低,說明高密度發酵不利于乳酸的產生,因此,種子的培養方式采取先靜置再振蕩培養的方式(靜置12h+振蕩8h)最佳。
2.2 單因素實驗結果與分析
2.2.1 不同碳源及其濃度對乳酸發酵的影響 碳源是產物乳酸的最終骨架結構來源,由圖3所示,葡萄糖作為碳源時乳酸產量明顯高于蔗糖和麥芽糖的,蔗糖和麥芽糖對L-乳酸發酵影響相差不大,因此選擇葡萄糖作為乳酸發酵的最佳碳源。碳源濃度的大小也會對乳酸發酵產生影響,初始發酵培養基中葡萄糖濃度的大小一定程度上決定了乳酸的產量[11],由圖4所示,當裝液量為100mL,葡萄糖添加量為16g時,乳酸產量最高,大于16g時乳酸產量反而下降,可能是由于過高的葡萄糖濃度致使發酵液的滲透壓增大,使得菌體不能夠較好的生長繁殖和進行正常的新陳代謝,從而導致最終菌體生長的濃度過低和乳酸產量過低。
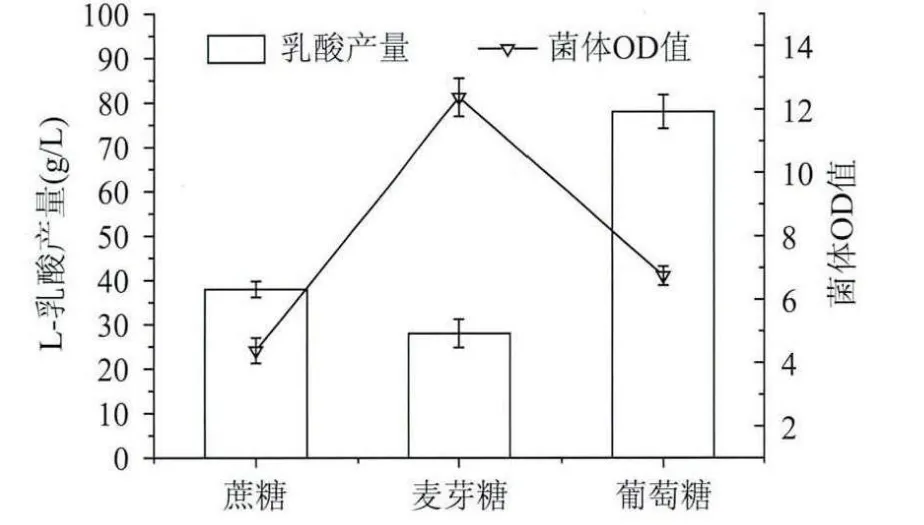
圖3 不同碳源對L-乳酸發酵的影響Fig.3 Effect of different carbon sources on L-lactic acid fermentation
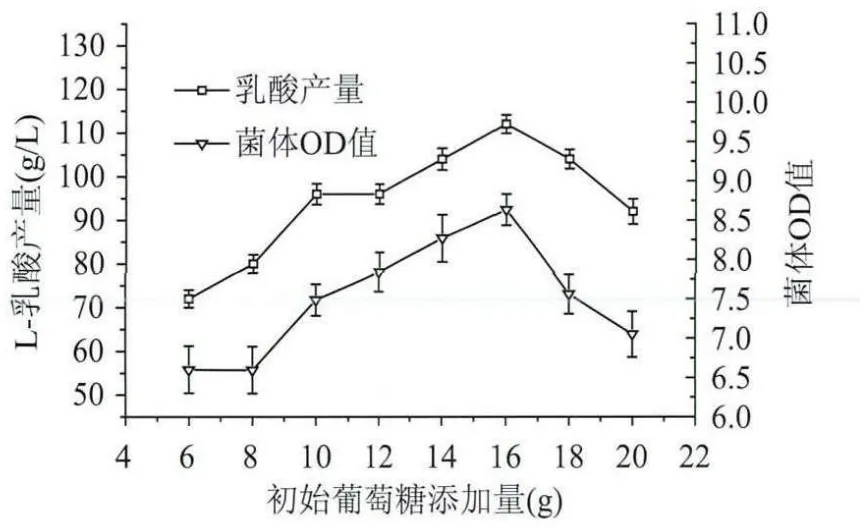
圖4 初始葡萄糖添加量對L-乳酸發酵的影響Fig.4 Effect of different glucose concentration on L-lactic acid fermentation
2.2.2 碳酸鈣添加方式對乳酸發酵的影響 由于在乳酸發酵過程中菌體不斷向外環境產生大量的L-乳酸,造成發酵液中酸性過大,能夠抑制后續乳酸的產生[12],為了研究碳酸鈣的添加方式對乳酸發酵的影響,設計了四種不同碳酸鈣添加方式對乳酸發酵影響的實驗,4種方式分別為:不加碳酸鈣;一次性添加10g碳酸鈣;首先添加5g碳酸鈣培養1d后再添加5g碳酸鈣;首先添加5g碳酸鈣培養2d后再添加5g碳酸鈣。結果如圖5所示,選擇發酵培養前一次性添加10g碳酸鈣,菌體濃度最高以及乳酸產量也是最高,而不加碳酸鈣時乳酸產量明顯低于添加碳酸鈣的乳酸產量,說明添加碳酸鈣對促進乳酸產量的提高具有很大作用,因此選用過一次性添加10g碳酸鈣的添加方式不僅可以減少操作工序,還能夠提高發酵速度,在發酵過程中需要振蕩,以使碳酸鈣能夠充分中和乳酸[12]。

圖5 不同碳酸鈣添加方式對L-乳酸發酵的影響Fig.5 Effect of different calcium carbonate on L-lactic acid fermentation
2.2.3 不同裝液量對乳酸發酵的影響 由圖6可以看出,當裝液量為100mL時,乳酸產量最高,可能是當裝液量太少時,溶氧過多不利于厭氧發酵乳酸的產生,當裝液量太多時由于底層的碳酸鈣粉末不能與產生的乳酸充分中和,從而使乳酸的積累對發酵生產乳酸起到了抑制作用。
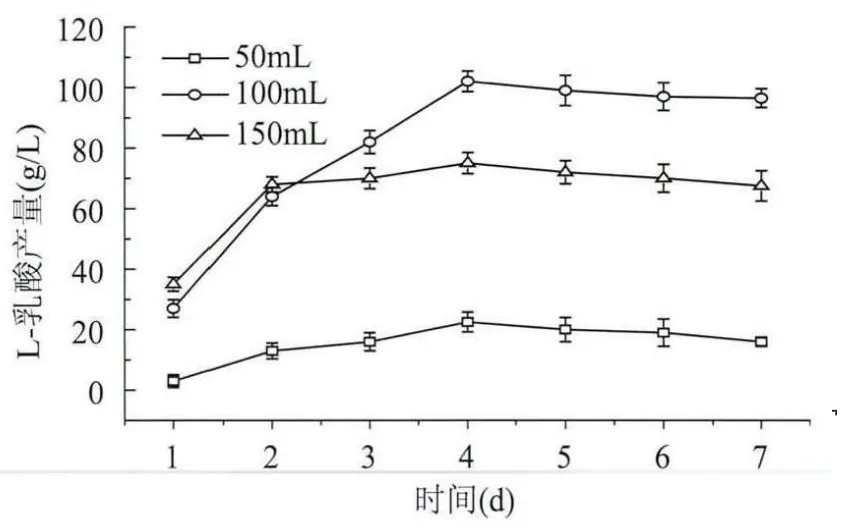
圖6 不同裝液量對L-乳酸發酵的影響Fig.6 Effect of different liquid medium volume on L-lactic acid fermentation
2.2.4 不同氮源及其氮源濃度對乳酸發酵的影響[11-14]向發酵培養基中加入不同的氮源,分別為蛋白胨、酵母粉、蛋白胨+酵母粉,三種不同的氮源,裝液量為100mL,當氮源加入量相同,37℃搖床厭氧發酵96h,通過圖7結果所示,酵母粉作為單一氮源時,乳酸產量反而高于蛋白胨+酵母粉的混合氮源,當只加蛋白胨時乳酸產量明顯低于其它兩種方式,而且通過圖7可以看出蛋白胨作為氮源時菌體生長的OD值明顯低于其它兩種培養方式,可能是高濃度的氮抑制了菌的生長和乳酸的產生。由于只加酵母粉作為氮源乳酸產量和OD值都高于蛋白胨+酵母粉的添加方式,且只添加酵母粉還能夠解決經濟成本,因此選用酵母粉作為氮源發酵生產L-乳酸最佳。
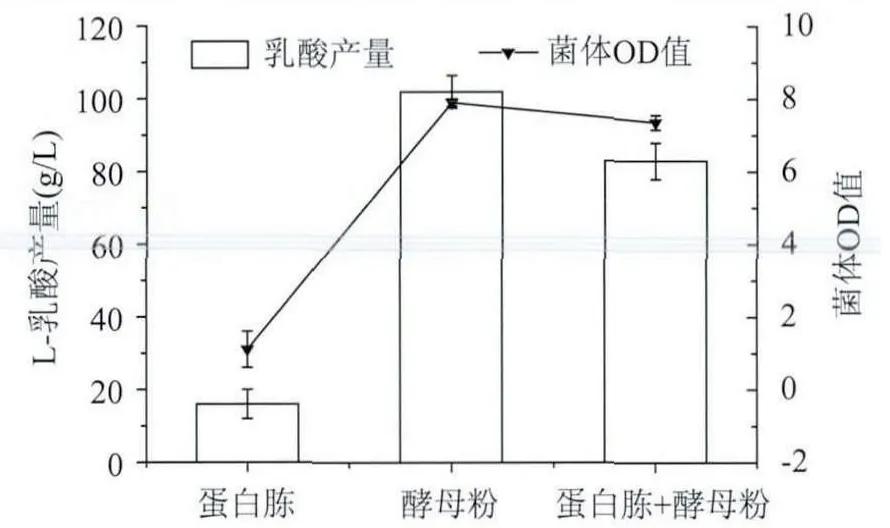
圖7 不同氮源對L-乳酸發酵的影響Fig.7 Effect of different nitrogen sources on L-lactic acid fermentation
確定酵母粉為最佳氮源后,對酵母粉添加量做進一步優化,裝液量為100mL,結果如圖8所示,當酵母粉添加量為1、2g時乳酸產量最高,從節約經濟成本上考慮,選擇添加量為1g較好,因此酵母粉添加量為1g。
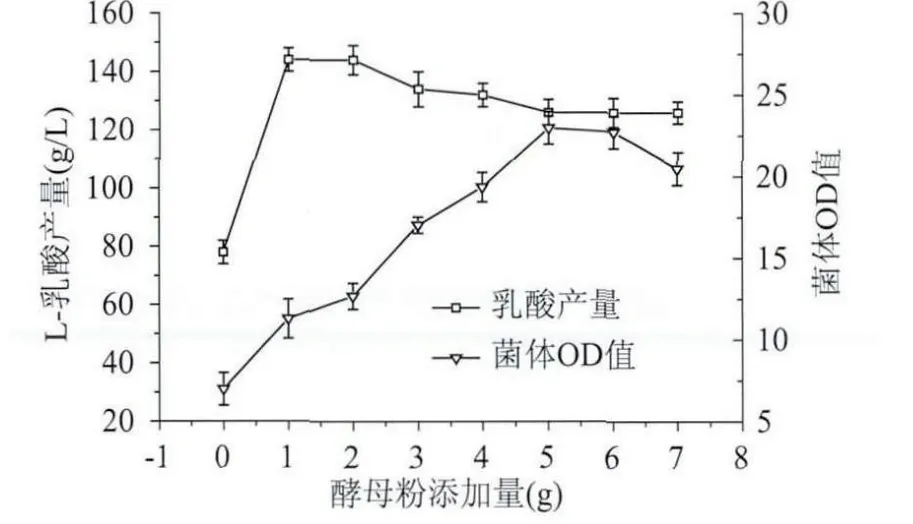
圖8 不同酵母粉添加量對L-乳酸發酵的影響Fig.8 Effect of different yeast extract concentration on L-lactic acid fermentation
2.2.5 不同乙酸鈉添加量對乳酸發酵的影響 裝液量為100mL,接種量為10%,實驗結果如圖9所示。從圖9中可以看出,當乙酸鈉添加量為0.2g時,乳酸的產量最高,當乙酸鈉添加量超過0.4g時菌體濃度逐漸降低,說明可能是高濃度的乙酸鈉不利于菌體生長和L-乳酸的產生。

圖9 不同乙酸鈉添加量對L-乳酸發酵的影響Fig.9 Effect of different sodium acetate anhydrous concentration on L-lactic acid fermentation
2.2.6 磷酸二氫鉀添加量對乳酸發酵的影響 裝液量為100mL,實驗結果如圖10所示。當磷酸二氫鉀添加量為0.1g時乳酸的產量最高,而菌體的濃度是隨著磷酸二氫鉀的添加量逐漸降低的,說明磷酸二氫鉀的加入是不利于干酪乳桿菌菌體的生長,但是添加0.1g是有利于乳酸產量的增加,可能是菌體代謝過程中一定的磷酸鹽有助于菌體進行代謝產乳酸。
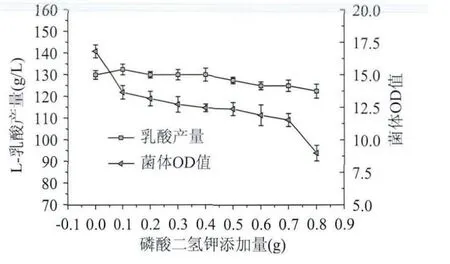
圖10 不同磷酸二氫鉀添加量對L-乳酸發酵的影響Fig.10 Effect of different KH2PO4concentration on L-lactic acid fermentation
2.3 發酵培養基的響應面優化
2.3.1 響應面實驗設計及結果 在單因素實驗的基礎上,選定葡萄糖、酵母粉和乙酸鈉這三個對L-乳酸產量影響較大的變量進行進一步的優化,各因素的中心點水平的值根據單因素優化的最佳值來確定,采用B-B實驗進行三因素三水平的響應面分析,實驗包括12個析因實驗和3個中心實驗,應用Design-Expert8.0.7.1對葡萄糖、酵母粉和乙酸鈉這三個因素進行優化。
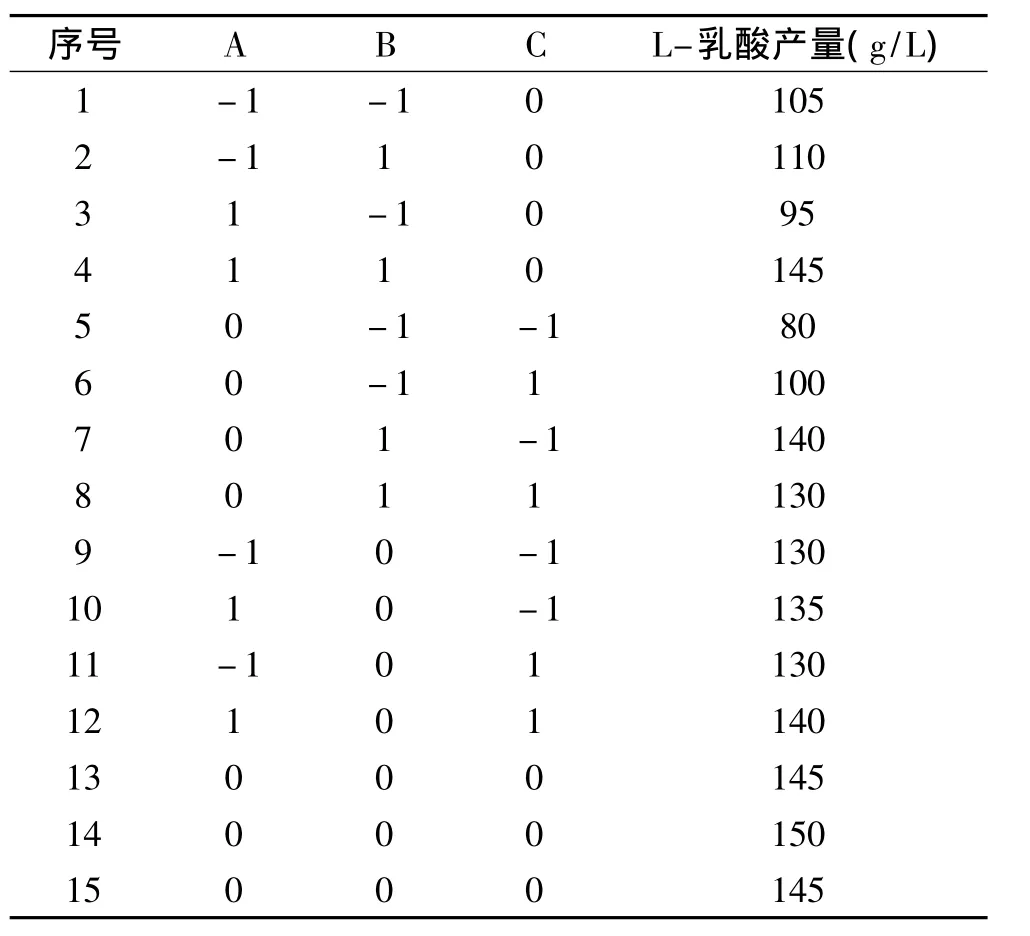
表2 三因素三水平的B-B實驗設計及結果Table 2 Designs and the results of Box-Behnken
二次回歸方程為:Y=146.67+5.00A+18.12B+1.88C+11.25AB+1.25AC-7.50BC-5.83A2-27.08B2-7.08C2,此方程為編碼值的方程,式中 A、B、C、分別為葡萄糖、酵母粉、乙酸鈉。該回歸方程的方差分析如表3,三個因素影響顯著性的順序為:酵母粉>葡萄糖>乙酸鈉。其中模型p=0.0023<0.05,失擬項p=0.1318>0.05,說明該模型回歸顯著,而失擬不顯著。另外該方程系數R2=0.9096,說明回歸方程的擬合程度較好,預測值與實測值之間具有較高的相關性,可以應用于L-乳酸產量的理論預測。

表3 回歸模型方差分析Table 3 ANOVA of quadratic polynomial model
在獲得回歸非線性模型后,為求得三個因素的最佳值,根據所得到的回歸模擬方程分別對各變量求一階偏導數,并令其為0,得到一個三元一次方程組[15],解此方程組可得到模型的極值(此值為各因素實際值):A(葡萄糖)=17.85g/100mL,B(酵母粉)=1.27g/100mL,C(乙酸鈉)=0.19g/100mL。即當葡萄糖、酵母粉、乙酸鈉分別為 17.85、1.27、0.19g/100mL時,理論值L-乳酸產量為153.38g/L。
2.3.2 各因素之間的交互作用 葡萄糖、酵母粉、乙酸鈉這三個因素之間的兩個獨立變量之間的交互作用見圖11~圖13,當研究兩個獨立變量之間交互作用時,此時的第3個變量的編碼值為0,第3個變量取中心點值[15]。

圖11 Y=f(A,B)的響應面圖Fig.11 The response surface chart of Y=f(A,B)
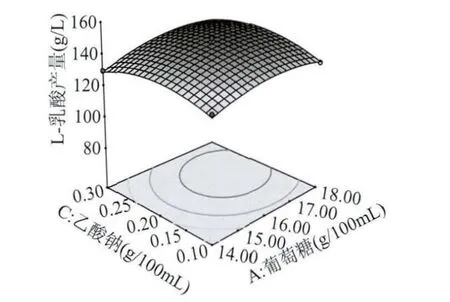
圖12 Y=f(A,C)的響應面圖Fig.12 The response surface chart of Y=f(A,C)
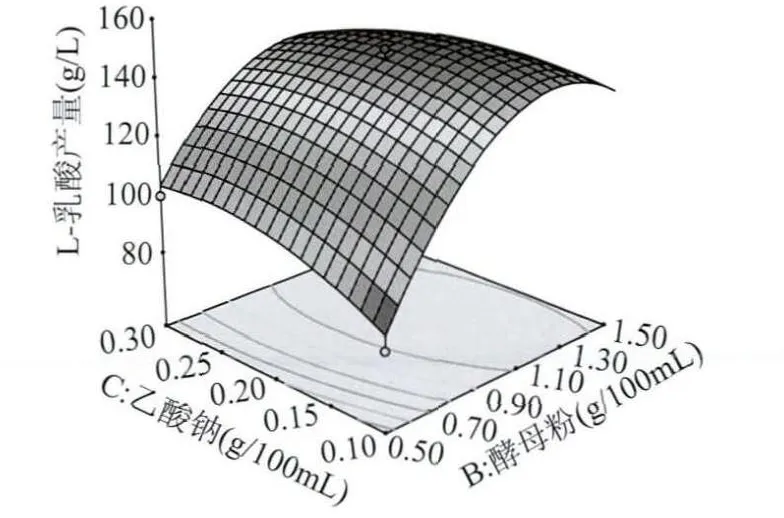
圖13 Y=f(B,C)的響應面圖Fig.13 The response surface chart of Y=f(B,C)
2.3.3 驗證實驗分析 根據上述優化后,干酪乳桿菌的發酵培養基為(g/100mL):葡萄糖17.85,酵母粉1.27,乙酸鈉 0.19,磷酸二氫鉀 0.1,MgSO4·7H2O 0.02,MnSO4·H2O 0.005,吐溫-80 1mL,一次性添加CaCO310g/100mL。液體種子培養基先靜置培養12h再振蕩培養到20h接種到發酵培養基中,發酵條件為:裝液量 100mL,接種量 10%,溫度 37℃,轉速150r/min,培養時間96h,在此條件下進行實驗,三個平行的搖瓶實驗測得的 L-乳酸產量為:145、155、140g/L,平均值為146.67g/L,與理論預測值153.38g/L比較接近,是優化前乳酸產量的2.03倍。驗證實驗結果說明了實驗設計和響應面分析法能夠較好的模擬干酪乳桿菌發酵生產L-乳酸的發酵條件,結果可靠。通過單因素和響應面實驗優化后,使得本實驗室篩選得到的野生型干酪乳桿菌發酵生產L-乳酸的產量達到146.67g/L,在搖瓶水平上L-乳酸產量略微高于目前相關文獻[5]報道的同類野生型干酪乳桿菌的最高L-乳酸產量143.8g/L,說明該菌株有較好的工業應用前景。
經過單因素和響應面優化后,干酪乳桿菌在優化后的最優條件下進行發酵96h后,乳酸的色譜圖如圖14所示,從圖中可以看出L-乳酸出峰時間為17.953min,D-乳酸的出峰時間為 23.738min,L-乳酸的色譜峰面積為11244.4,D-乳酸的色譜峰面積為443.379,經計算得L-乳酸的光學純度為96.21%,比優化前的光學純度提高了6.09%,同時優化后的L-乳酸光學純度接近于相關文獻[10]報道的同類野生型干酪乳酸菌的高光學純度96.6%。
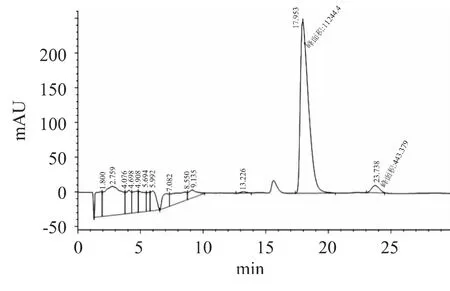
圖14 乳酸的光學純度分析色譜圖Fig.14 Chiral analysis of lactic acid
3 結論
采用單因素實驗和Box-Behnken中心組合原理以及響應面分析法對干酪乳桿菌ZW-63A發酵條件進行了優化,使L-乳酸產量有了較大幅度的提高,葡萄糖、酵母粉和乙酸鈉這三個因素對L-乳酸產量擬合出的回歸模型經檢驗證明該模型合理可靠,能較好的預測L-乳酸的產量,通過模型系數顯著性檢驗,得到的因素主效應關系為:酵母粉>葡萄糖>乙酸鈉,由該模型確定的最佳條件為葡萄糖17.85g,酵母粉1.27g,乙酸鈉0.19g,在此條件下,得到的L-乳酸產量為146.67g/L,是優化前的2.03倍。本實驗的重要性和突破性在于,發現了種子培養方式、中和劑添加方式和培養基組成能夠影響L-乳酸的產量和光學純度,對實驗室篩選得到的野生型干酪乳桿菌,通過單因素和響應面實驗優化后,在搖瓶水平上,L-乳酸的產量略微高于目前相關文獻[5]報道的同類野生型干酪乳桿菌的最高L-乳酸產量143.8g/L,同時優化后的L-乳酸光學純度提高到96.21%,接近于相關文獻[10]報道的同類野生型干酪乳酸菌的L-乳酸高光學純度96.6%,說明該菌株有較好的工業應用前景。
[1]張嬋嬋,潘麗軍,趙丹丹.細菌發酵產L-乳酸優良菌株的選育[J].農產品加工,2006(10):23-26.
[2]秦浩,張偉國,葛向陽,等.高產L-乳酸干酪乳桿菌的選育及發酵條件研究[J].食品工業科技,2011,32(7):223-225.
[3]周劍,虞龍.產L-乳酸凝結芽孢桿菌發酵條件的初步研究[J].氨基酸和生物資源,2005,27(1):70-73.
[4]高江婧,嚴群,阮文全.一株產L-乳酸菌株的篩選、鑒定及營養條件的初步研究[J].食品與生物技術學報,2010,29(3):453-456.
[5]]高年發,晉明芬,張健.玉米粉細菌發酵L-乳酸的研究[J].農業工程學報,2007,23(6):233-236.
[6]徐坤,王濤.響應面法優化混合發酵法控制郫縣豆瓣中黃曲霉毒素B1含量的最佳制曲研究[J].中國釀造,2009(11):28-31.
[7]葛菁萍,劉國明,楊曉峰,等.休哈塔假絲酵母HDYXHT-01利用木糖生產乙醇的發酵工藝優化[J].生物工程學報,2011,27(3):404-411.
[8]Altaf M,Venkateshwar M,Srijana M,et al.An Economic approach for L-(+)lactic acid fermentation by Lactobacillus amylophilus GV6 using inexpensive carbon and nitrogen source[J].Journal of Applied Microbiology,2007,103:372-380.
[9]Xi- Yu Cheng,Chun- Zhao Liu.Hydrogen Production via Thermophilic Fermentation of Cornstalk by Clostridium thermocellum[J].Energy fuels,2011,25:1714-1720.
[10]Se-Kwon Moon,Young-Jung Wee,Gi-Wook Choi.A novel lactic acid bacteriumfor the production of high purity L-lactic acid Lactobacillus paracasei subsp.paracasei CHB2121[J].Journal of BioScience and Bioengineering 2012,114(2):155-159.
[11]Ying Meng,Yanfen Xue,Bo Yu,et al.Efficient production of L-lactic acid with high optical purity by alkaliphilic Bacillus sp.WL-S20[J].Bioresource Technology,2012,116:334-339.
[12]黃谷亮,秦菊霞,李楠,等.干酪乳桿菌產L-乳酸發酵條件的研究[J].廣西大學學報:自然科學報,2007,32(4):376-379.
[13]Lijun Chen,Aiwu Zeng,Haibo Dong,et al.A novel process for recovery and refining of L-lactic acid from fermentation broth[J].Bioresource Technology,2012,112:280-284.
[14]KenjiOkano,Tsutomu Tanaka,Chiaki Ogino,et al.Biotechnological production of enantiomertic pure lactic acid from renewable resources:recent achievements,perspectives,and limits[J].Appl Microbiol Biotechnol,2010,85:413-423.
[15]Lei Yu,Ting Lei,Xioadong Ren,et al.Response surface optimization of L-(+)-lactic acid production using corn steep liquor as an alternative nitrogen source by lactobacillus rhamnosus CGMCC 1466[J].Biochemical Engineering Journal,2008,39:496-502.

