柚皮苷調控心肌核因子 NF-κB炎癥信號通路對糖尿病心肌病大鼠防治作用①
游 瓊 吳 鏗 涂焰明 李 騰 莫海亮 葉少強 黃瑞娜 梁建光
(廣東醫學院附屬醫院心血管內科,湛江524001)
近年來大量研究發現糖尿病及糖尿病心肌病心肌組織中伴有大量的炎性細胞浸潤,炎癥因子的異常表達,提示炎癥反應參與了糖尿病心肌病的發病[1-5]。NF-кB的激活與糖尿病心肌病的發生及發展密切相關,其作為糖尿病心肌病發病機制的一個許多相關途徑中的中心因子,對高血糖狀態下的心肌結構、功能的改變起重要作用,NF-κB激活后可調控多種炎性因子、細胞因子(如 TNF-α、IL-6、IL-1β)的表達,從而參與心肌的炎性損傷[1]。柚皮苷,草藥骨碎補、枳實和橘紅的主要有效成分,其糖苷配體是 4',5,7-羥基黃酮,糖基為鼠李糖基 β-1,2-葡萄糖。已作為抗炎、抗病毒、鎮痛、減少血栓廣泛應用于臨床,另外還有報道其具有降血糖、降血脂、降血壓等藥理活性[6]。本課題組前期的實驗研究表明柚皮苷對糖尿病大鼠的心肌損傷具有明顯的改善作用,其機制與柚皮苷改善胰島素抵抗、阻斷FFA活化等作用有關[7]。鑒于NF-кB通路激活誘導的炎性反應在糖尿病心肌病發病中的重要作用,柚皮苷在調節心肌糖脂代謝基礎上是否進一步抑制了NF-кB的激活以減輕心肌炎性反應、阻抑糖尿病心肌病的發生、發展呢?值得進一步探討研究。
1 材料與方法
1.1 主要材料
1.1.1 動物 Wistar大鼠,雄性,體重(160±20)克,SPF級,合格評號SCXK粵2006-0015,由南方醫科大學實驗動物中心提供。飼養于廣東醫學院動物實驗室,飼養條件為恒溫(24±2)℃,相對濕度50% ~70%,飼養環境符合實驗動物環境設施要求。
1.1.2 藥物 Naringin粉沫(廣東省梅雁藍藻公司,純度98%);鏈脲佐菌素(STZ,美國Sigma公司);血糖、胰島素試紙(強生‘中國'醫療器材有限公司);糖化血清蛋白測試盒(南京建成生物工程研究所);低密度、高密度脂蛋白膽固醇試劑盒、總膽固醇試劑盒、甘油三酯(北京北化康東臨床試劑有限公司);游離脂肪酸測定試劑盒(北京普利萊基因技術有限公司);生物素標記山羊抗兔IgG/小IgG二抗試劑盒(北京中杉金橋生物技術有限公司);NF-κB多克隆抗體試劑盒(北京博奧森生物技術有限公司)。
1.2 方法
1.2.1 建模 實驗分為正常對照組(NC組)、模型對照組(MC組)。NC組一直采用基礎飼料喂養;MC組采用高糖高脂飼料喂養6周誘導大鼠IR狀態,然后一次性給予腹腔注射1%鏈脲佐菌素30 mg/kg(pH=4.5,4℃配制,隨配隨用)部分破壞胰島β細胞功能,72小時后連續2次空腹血糖 ≥11.1 mmol/L,胰島素敏感指數降低,且有多飲、多尿、多食現象確定為糖尿病模型,持續高糖高脂飼料喂養6周。于實驗結束時禁食12小時,麻醉,腹主動脈采血后迅速取出心臟,用生理鹽水制成10%的組織勻漿,檢測相關指標,糖尿病模型組大鼠心肌細胞形態學異常改變可認為DC建模成功[8]。共46只大鼠完成實驗,NC組10只,MC組36只(建模成功率100%,無死亡)。
1.2.2 分組給藥 MC大鼠分為4組:Naringin高、中、低劑量組(NH、NM、NL組)和模型對照組(MC組),每組9只。在確定2型糖尿病模型成功后開始給藥,參考 Naringin對 Wistar大鼠系列實驗研究[9-11],將 NH、NM、NL 組分別設置為 10、20、40 mg/kg;正常組(NC組)和MC組則予以等體積的蒸餾水。
1.2.3 放射免疫分析外周血炎癥因子 斷尾取血,將3 ml血以3 500 r/min離心10分鐘,取上清-70℃保存,按試劑盒說明書操作分別進行放射免疫分析法檢測 TNF-α、IL-6、IL-1β。
1.2.4 免疫組織化學法測定 取心肌組織切片,常規脫蠟至水,3%過氧化氫(H2O2)處理清楚內源性過氧化物酶。將切片浸入0.01 mol/L,pH=6.0的枸櫞酸緩沖液中,高壓加熱修復3分鐘后。按試劑盒說明書操作進行免疫組織化學法檢測心肌NF-κB表達。采用Motic 6.0數碼醫學圖像分析系統測定灰度值及陽性光密度。
1.2.5 心肌組織的形態學觀察 動物處死后,進行組織取材、固定、脫水、透明、浸蠟、石蠟包埋、切片,常規HE染色,光鏡下觀察心肌細胞形態,透射電鏡觀察心肌細胞超微結構,每張切片觀察10個視野。
1.3 統計學方法 所有數據以x±s表示,采用SPSS13.0軟件進行統計分析,所有數據進行正態分布檢驗。統計學方法采用兩組間的比較采用t檢驗,多組間的比較采用One-Way ANOVA分析法,其中兩兩比較用SNK法,并進行方差齊性檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠脂糖代謝指標比較 與正常對照組相比,模型對照組空腹血糖(FBG)、糖化血紅蛋白(HbAlc)、空腹胰島素(FINS)、胰島素敏感指數(HOMA-IR)以及游離脂肪酸(FFA)、膽固醇(CHOL)、低密度脂蛋白(LDL-C)、甘油三酯(TG)均顯著升高(P<0.05);而在NH、NM組的糖脂代謝指標不同程度降低,差異有統計學意義(P<0.05)。結果提示,Naringin呈劑量依賴性改善DC糖脂代謝的作用。HOMA-IR=(FBG×FINS)/22.5,見表1。
2.2 各組大鼠心肌形態學改變 糖尿病心肌病(DC組)大鼠心肌細胞和線粒體排列紊亂,肌纖維排列紊亂,心肌細胞肥大、線粒體腫脹明顯,嵴變寬,細胞核固縮、裂解;高劑量柚皮苷治療組(HN組)大鼠心肌纖維呈短柱狀,心肌細胞排列整齊,致密,細胞核呈橢圓形,線粒體腫脹不明顯,嵴間隙無增寬,排列有序,接近正常,中劑量柚皮苷組(MN組)次之,低劑量柚皮苷干預組(LN組)無明顯差異,且呈顯著濃度依賴性,見圖1、2。
2.3 各組大鼠NF-κB及其下游炎癥因子改變 糖尿病心肌病(DC組)大鼠心肌NF-κB蛋白及外周血
TNF-α、IL-6、IL-1β分泌增加,不同劑量柚皮苷治療后使其表達不同程度下降,僅高劑量柚皮苷組(HN組)降低水平有統計學差異(P<0.05),見圖3、表2。

表1 各組大鼠脂糖代謝指標(x±s)Tab.1 The comparison of lipid sugar metabolism index in six groups(x±s)

表2 各組大鼠心肌NF-κB的陽性平均光密度以及外周血炎癥因子(x±s)Tab.2 The comparison of myocardium NF-κB positive vascular density and peripheral inflammation factors in six groups(x±s)
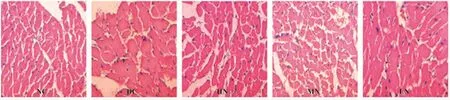
圖1 各組大鼠心肌HE染色比較(×400)Fig.1 The comparison of HE staining of myocardiumin different groups(×400)

圖2 各組大鼠心肌超微結構比較(×8 900)Fig.2 The comparison of myocardial cell perspective electron microscope in different groups(×8 900)
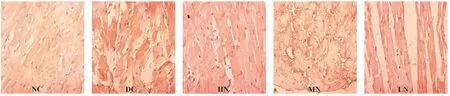
圖3 各組大鼠心肌NF-κB蛋白免疫組化比較(×400)Fig.3 The comparison of NF-κB expression of myocardium in different group(×400)
3 討論
基于糖尿病心肌病的“消渴、胸痹”癥狀歸屬于“消渴病心積”范疇。在臨床辯證中,消渴病長期陰虛燥熱、脾虛失運、痰濕內生、氣陰兩虛、陰損及陽、陰陽兩虛等累及心臟,提示糖尿病心肌病中醫病機多屬“氣陰兩虛、痰瘀互結、心脈痹阻”。根據中醫“消補兼施、同治心絡中痰瘀”的理論,國醫大師鄧鐵濤方劑中擅用理氣健脾中藥化橘紅治本病[12]。經化橘紅提取分離測定及體外篩選等實驗摸索,我們擬定以其有效成分柚皮苷治療本病。本實驗高糖高脂喂養和一次性腹腔注射低劑量STZ建立的糖尿病心肌病大鼠模型糖脂代謝障礙和心肌形態學損傷明顯,而高、中劑量柚皮苷治療6周后明顯改善。該結果與以往的報道類似[7,13]。
NF-κB是對炎癥、免疫調節較為敏感的轉錄因子,在氧化還原反應過程中起著重要作用。高血糖誘導NF-κB通路激活對心血管的作用機制具有特異性:如對微血管,高血糖可引起AGE的形成及蛋白激酶C(PKC)的激活,從而激活NF-κB導致微循環病變[14],而在心肌細胞器,2型糖尿病 NF-κB 的激活,而導致氧化應激的增加,并引起心肌線粒體功能障礙及心功能不全[15]。糖尿病狀態時,NF-κB活化可產生大量的炎癥介質(如 TNF-α、IL-6、IL-1β等),引起炎癥反應的發生,同時激活NF-κB信號通路的級聯反應,從而擴大心肌局部炎癥損傷。而我們前期研究提示糖尿病心肌病心肌損傷與糖尿病機體內免疫炎癥反應密切相關,而不是單純血糖、血脂升高及心功能不全的直接后果,其作用機制可能是多方面的因素共同啟動宿主劇烈的免疫炎癥應答,通過TLR4激動后介導NF-κB信號轉導途徑引起細胞功能紊亂[3]。因此,柚皮苷單一改善糖脂代謝障礙并不能完全解析其對糖尿病心肌病心肌損傷的防治作用,本實驗進步研究提示心肌組織NF-κB蛋白的表達和外周血TNF-α、IL-6、IL-1β含量增加,觀察到了心肌組織NF-κB途徑的轉錄激活,而高、中劑量柚皮苷治療6周明顯抑制了糖尿病心肌病的NF-κB以及其下游細胞因子的上調,說明柚皮苷可能呈劑量依賴性阻斷糖尿病心肌病的NF-κB途徑的激活,最終防治心肌形態學損傷。
綜上所述,高糖誘導NF-κB信號通路的級聯反應參與糖尿病心肌病的發生發展過程,柚皮苷呈劑量依賴性對糖尿病心肌病具有明顯的防治作用,其可能機制是有效地改善心肌糖脂代謝,下調了轉錄因子NF-κB的表達,繼而抑制了NF-κB通路的激活。
1 Lorenzo O,Picatoste B,Ares-Carrasco S et al.Potential role of nuclear factor κB in diabetic cardiomyopathy.[J]Mediators Inflamm,2011;2011:652097.
2 Boudina S,Abel E D.Diabetic cardiomyopathy,causes and effects[J].Rev Endocr Metab Disord,2010;11(1):31-39.
3 吳 鏗,游 瓊,莫海亮 et al.糖尿病心肌病外周血單核細胞Toll樣受體4、腫瘤壞死因子-α的表達及其與心肌灌注的相關性[J].中華心血管病雜志,2011;39(6):503-507.
4 Aneja A,Tang W H,Bansilal S et al.Diabetic cardiomyopathy:insights into pathogenesis,diagnostic challenges,and therapeutic options.[J]Am J Med,2008;121(9):748-757.
5 Boudina S,Abel E D.Diabetic cardiomyopathy revisited[J].Circulation,2007;115(25):3213-3223.
6 游 瓊,吳 鏗.柚皮苷的心血管藥理作用[J].廣東醫學,2010;31(22):3006-3008.
7 吳 鏗,游 瓊,黃瑞娜 et al.柚皮苷能夠通過調控心肌PPARγ表達對糖尿病心肌病大鼠模型心肌損傷起著防治作用[J].中國藥理學通報,2012;28(4):526-530.
8 董世芬,洪 纓,樊江波et al.實驗性2型糖尿病心肌病大鼠模型的建立與評價[J].中國實驗動物學報,2009;17(4):246-251.
9 Rajadurai M,Stanely Mainzen,Prince P.Preventive effect of naringin on cardiac markers,electrocardiographic patterns and lysosomal hydrolases in normal and isoproterenol-induced myocardial infarction in Wistar rats[J].Toxicology,2007;230(2-3):178-188.
10 Rajadurai M,Prince P S.Preventive effect of naringin on cardiac mitochondrial enzymes during isoproterenol-induced myocardial infarction in rats:a transmission electron microscopic study[J].J Biochem Mol Toxicol,2007;21(6):354-361.
11 Rajadurai M,Prince P S.Naringin ameliorates mitochondrial lipid peroxides,antioxidants and lipids in isoproterenol-induced myocardial infarction in Wistar rats [J].Phytother Res,2009;23(3):358-362.
12 邱仕君.鄧鐵濤醫案與研究[M].北京:人民衛生出版社,2009:86-87.
13 梁建光,吳 鏗.柚皮苷對糖尿病心肌病大鼠心肌超微結構和缺氧誘導因子1α的影響[J].國際心血管病雜志,2012;39(2):113-117.
14 Picchi A,Capobianco S,Qiu T et al.Coronary microvascular dysfunction in diabetes mellitus:A Review[J].World J Cardiol,2010;2(11):377-390.
15 Mariappan N,Elks C M,Sriramula S et al.NF-kappaB-induced Oxidative stress contributes to mitochondrial and cardiac dysfunction in type Ⅱ diabetes[J].Cardiovasc Res,2010;85:473-483.