Pax6在翼狀胬肉上皮鱗狀化生中的表達及臨床意義
黃海東,王明月,郭 穎,管 迪,李鴻甫,尹 祿
目前翼狀胬肉的發病機制尚未明確,流行病學的調查結果顯示,翼狀胬肉多發生于生活在多塵、日照強烈及炎熱等環境的人群中,一些戶外工作者也容易發生翼狀胬肉[1]。有研究者用大劑量的紫外線照射大鼠,結果發現大鼠角膜基質血管形成、前彈力層變性、上皮增生,因此認為紫外線與翼狀胬肉的發生關系密切,這可能是環境因素中最重要的因素[2]。Pax6是一種與眼球發育有關的基因,無論是低等線蟲還是高等生物人類的眼球發育中,Pax6均發揮了一定的作用,而基因突變可以引發嚴重異常發育。近些年來,隨著研究的深入,已經證實了在晶體及視網膜發育中Pax6的重要性,但關于眼表面上皮細胞中Pax6異常表達的研究很少。筆者應用免疫組織化學法對Pax6在翼狀胬肉中的表達情況進行了檢測,同時用 K19、K10、MUC5AC檢測翼狀胬肉上皮鱗狀分化,探討Pax6在翼狀胬肉上皮鱗狀化生中的表達,現報告如下。
1 資料與方法
1.1 臨床資料 選擇2011年5月—2012年7月我院眼科25例翼狀胬肉標本為觀察組,均符合翼狀胬肉診斷標準[3];同時選擇25例健康眼結膜標本為對照組,眼科檢查除外沙眼、過敏性結膜炎、慢性淚囊炎、瞼緣炎以及患有其他眼部病變的病例,所有入選病例均無眼科長期用藥史。其中觀察組男11例,女14例,年齡30~65(45.3±10.4)歲,右眼10例,左眼15例。對照組男12例,女13例,年齡33~69(45.6±11.5)歲,右眼9例,左眼16例。兩組眼結膜標本提供者在年齡、性別上無統計學差異(P>0.05),具有可比性。
1.2 方法
1.2.1 翼狀胬肉手術方法:常規消毒手術部位,采用表面麻醉,將2%的利多卡因注射于翼狀胬肉結膜下,用剪刀在顯微鏡下將正常眼結膜與翼狀胬肉分離,剪除分離的翼狀胬肉,同時將變性的結膜下組織清除,必要時可應用燒灼止血。然后沿0.5 mm透明角膜區劃切,剝離包括胬肉頭部的角膜淺層,在球結膜上方取一塊游離球結膜組織植片(包括角膜緣上皮組織),拖到原胬肉植床處,將組織植片展平,與相應角膜緣對應。將植片對位間斷縫合,于鞏膜淺層固定。手術完畢后將妥布霉素地塞米松眼膏涂至結膜囊,包扎手術眼部。
1.2.2 免疫組織化學染色法:選擇鼠抗人單克隆抗體 Pax6、K19 及 K10、MUC5AC,DAPI、OCT 包埋劑,FITC標記的山羊抗鼠IgG二抗,冰凍切片機(Leica CM1850),倒置熒光顯微鏡(Nikon TE2000)。用4%多聚甲醛固定組織切片15 min,然后置于過氧化氫甲醇溶液(0~3%)中30 min,將內源性過氧化物酶滅活。用PBS清洗標本3次,每次清洗5 min,將第一抗體(已經過血清稀釋液稀釋)加入,在4℃冰箱中孵育過夜,將抗體吸除,PBS清洗3次,每次清洗15 min。將生物素標記兔抗鼠二抗(已經過血清稀釋液稀釋)滴加入標本中,在室溫下孵育1 h,然后吸除抗體,再次用PBS洗滌,每次清洗5 min,共清洗3次。加入親和素-生物素-過氧化物酶復合物(ABC),孵育 30 min,用 PBS洗滌,每次清洗5 min,共清洗3次。二氨基聯苯胺(DAB)顯色50 s,反應終止。用乙醇梯度脫水,二甲苯透明,封片(中性樹膠)。在光鏡下進行觀察并照相。PBS代替一抗行陰性對照。
1.3 評價標準 根據 Pax6、K19、K10及MUC5AC在正常眼結膜組織及翼狀胬肉兩組標本中的表達情況及吸光度值評價Pax6在翼狀胬肉上皮鱗狀化生中的表達。
1.4 統計學處理 采用SPSS 13.0統計學軟件處理數據,計量資料結果以均數±標準差(±s)表示,采用t檢驗,α=0.05為檢驗水準。
2 結果
2.1 Pax6陽性表達情況及吸光度值比較 對照組上皮細胞全層均有 Pax6大量表達,吸光度值為46710±3712;觀察組上皮細胞Pax6表達量顯著降低,以基底層上皮細胞丟失的Pax6最顯著,吸光度值為31984±5413,兩組比較差異有統計學意義(t=5.011,P=0.000)。
2.2 上皮細胞表型K19、K10陽性表達吸光度值比較 兩組K10及K19陽性表達吸光度值比較差異有統計學意義(P=0.000),見表1。
2.3 黏蛋白MUC5AC陽性表達情況及吸光度值比較 觀察組MUC5AC陽性表達吸光度值平均為702±894;對照組MUC5AC陽性表達吸光度值平均為7132±2784。兩組比較差異有統計學意義(t=5.136,P=0.000)。
表1 翼狀胬肉與正常眼結膜標本上皮細胞表型K19、K10陽性表達吸光度值比較(±s)
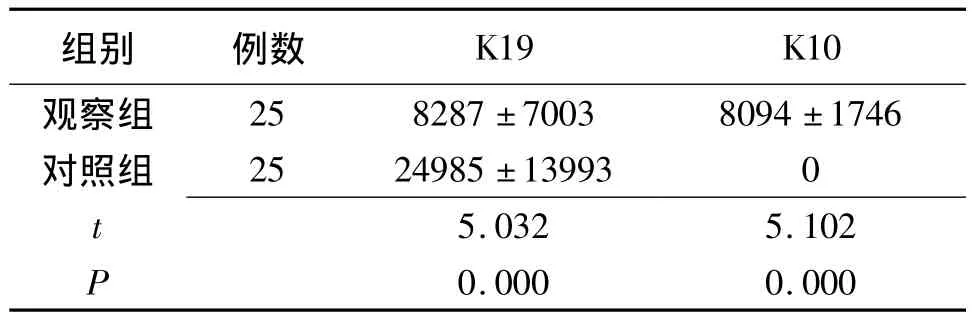
表1 翼狀胬肉與正常眼結膜標本上皮細胞表型K19、K10陽性表達吸光度值比較(±s)
注:觀察組:翼狀胬肉標本,對照組:健康眼結膜標本
組別 例數K19 K10觀察組25 8287±7003 8094±1746對照組 25 24985±13993 0 5.032 5.102 P t 0.000 0.000
3 討論
在各種生物眼睛發育的過程中均有Pax6轉錄因子的存在,甚至是在果蠅等昆蟲中,Pax6都是眼睛分化過程的要素之一[4]。含有配對盒基因序列是Pax基因家族共同的特點,人們首先在果蠅體節基因發現該結構。相關的研究表明,脊椎動物共有Paxl-Pax99組Pax基因,Pax6是人類無虹膜基因,約25 kb,由至少14個外顯子組成。無論在非脊椎動物還是脊椎動物中,Pax6基因均十分保守,在生物生長及發育具有重要意義。到目前為止,人們發現了70余種與鼠眼發育相關的、已經定位的基因,其中最重要的基因即為Pax6,其具有高度保守的表達方式,在遺傳性眼病的發病過程中發揮一定作用[5-6]。
鱗狀上皮化生是一種病理過程,是Stevens-Jobnson綜合征、維生素A缺乏綜合征、熱/化學傷、干燥綜合征、眼類天皰瘡等多種嚴重眼科疾病出現干眼表現的標志。李明淵等[7]對50例翼狀胬肉患者眼表變化進行了檢查,發現所有患者翼狀胬肉表面的結膜均有不同程度的鱗狀上皮化生。K19作為角質蛋白是細胞的骨架蛋白[8],在正常結膜上皮中,是一種重要的組成蛋白[9]。在正常結膜上皮中,K10并不表達,在角化上皮中是終末分化標志物。MUC5AC是淚膜黏液層的重要組成成分,具有維持淚膜穩定性的重要作用,還對淚膜在眼表分布起促進作用[10]。MUC5AC在正常結膜組織上皮表皮層中呈簇狀散在或者單個分布,在翼狀胬肉組織中表達明顯減弱,大多數上皮并無MUC5AC表達。本研究結果證實,MUC5AC及K19在翼狀胬肉上皮中的表達下降明顯,而K10則出現了較多的陽性表達,進一步說明翼狀胬肉上皮有鱗狀上皮化生發生[11]。Pax6在胚胎眼發育中是起主導作用的基因,在眼組織多種類型的上皮細胞中均有表達。出生后,Pax6主要在眼部晶狀體上皮細胞、角結膜、視網膜無長突細胞、虹膜等處表達,而在皮膚上皮中無表達[12]。眼球發育很可能因為Pax6基因突變而出現異常,導致遺傳性角膜炎、先天性無虹膜等疾病發生。本實驗主要研究翼狀胬肉發病過程中Pax6上皮鱗狀化生中的意義,發現正常眼結膜上皮細胞全層均有Pax6大量表達,翼狀胬肉上皮細胞Pax6表達量顯著降低,以基底層上皮細胞丟失的Pax6最顯著。
綜上所述,Pax6基因具有調控并維持眼表面結膜上皮表型正常的作用,其表達下降可能促進翼狀胬肉出現鱗狀上皮化生[13]。因此,治療翼狀胬肉時采用基因治療技術[14-16],應用分化抑制劑或者將Pax6基因導入翼狀胬肉異常分化的上皮中,應該能夠成為治療翼狀胬肉的有效方法[17-22]。
[1]鄧瑩瑩,周霞,孫榮,等.翼狀胬肉手術前后對比敏感度和角膜地形圖改變的比較[J].臨床眼科雜志,2013,21(2):117-119.
[2]趙堪興,楊培增.眼科學[M].7版.北京:人民衛生出版社,2010:102-103.
[3]梅永新,沈建國.翼狀胬肉逆行切除聯合角膜緣干細胞移植術的療效觀察[J].中國現代醫生,2011,49(6):23-24.
[4]楊真龍,賈卉,施小茹,等.西藏翼狀胬肉的流行病學調查[J].吉林醫學雜志,2008,28(15):1660-1662.
[5]李奇觀,黃偉梅,陳思敏,等.翼狀胬肉手術方式對眼前節屈光狀態改變的臨床研究[J].國際眼科雜志,2013,13(4):680-682.
[6]張海俠,欒春生,胡艷波.翼狀胬肉切除聯合球結膜瓣移植術后發生角膜上皮缺損[J].臨床誤診誤治,2010,23(9):879.
[7]李明淵,唐仁泓.HIF-1與VEGF在翼狀胬肉中的表達及意義[J].眼科研究,2009,27(3):213-215.
[8]王新宇,許愛娥,傅麗芳,等.毛囊外根鞘細胞的分離培養及鑒定[J].中國現代醫生,2013,51(6):1-3,6,封3.
[9]李淑琳.翼狀胬肉發病機制的研究進展[J].眼科研究,2009,27(3):247-250.
[10]Li W,Chen Y T,Hayashida Y,et al.Down-regulation of Pax6 is associated with abnorm al difierentiation of corn eal epithelial cells in severe ocular surface diseases[J].J Pathol,2008,214(1):114-122.
[11]張伶俐,劉虹.谷氨酰轉移酶2與基質金屬蛋白酶2和白細胞分化抗原24對翼狀胬肉復發的影響[J].中國醫藥,2012,7(8):1029-1030.
[12]Dong N,Li W,Lin H,et al.Abnormal epithelial differentiation and tear film alteration in pinguecula[J].Invest Ophthalmol Vis Sci,2009,50(6):2710-2715.
[13]Chui J,Di Girolamo N,Wakefield D,et al.The pathogenes is of pterygium:current concepts and the ir therapeutic implications[J].Ocu Surf,2008,6(1):24-43.
[14]單保生.微創翼狀胬肉切除聯合自體角膜緣干細胞移植治療翼狀胬肉[J].中國煤炭工業醫學雜志,2013,16(5):754-755.
[15]高浩溟,李建國,魏巍.自體游離球結膜瓣移植治療翼狀胬肉的臨床觀察[J].中國醫藥,2012,7(9):1162-1163.
[16]肖興爽,張艷玲,于志濤.翼狀胬肉切除聯合自體角膜緣干細胞移植療效觀察[J].中國煤炭工業醫學雜志,2011,14(9):1305-1306.
[17]劉志英,余金龍.Bcl-2、Ki-67、VEGF在翼狀胬肉中的表達[J].農墾醫學,2008,30(6):458-461.
[18]董諾,李程,李煒,等.Pax6在翼狀胬肉上皮鱗狀化生中的異常表達[J].眼科學報,2010,25(1):45-47.
[19]Mery G,Maalouf T,George J L,et al.Limbal-conjunetival autograft in pterygium surgery[J].J Fr Ophthalmol,2010,33(2):92-98.
[20]Kheirkhah A,Sail H,Molaei S,et al.Effects ofpterygium surgery on front and back corneal astigmatism[J].Can Ophthalmol,2012,47(5):423-428.
[21]Takdcs A I,Nagy Z.Microkeratome-assisted anterior lamellar keratoplasty for the removal of corneal scar,caused by pterygium[J].Orv Hetil,2009,150(25):1167-1171.
[22]Wu P L,Kuo C N,Hsu H L,et al.Effect of pterygium surgery on refractive Spheroey inder power and corneal topography[J].Ophthalmic Surg Lasers Imaging,2009,40(1):32-37.

