含能配合物2,6-二氨基-3,5-二硝基吡啶-1-氧化物合鈷バ的合成、晶體結構及催化性能
劉進劍 劉祖亮 成 健 方 東 王 俊
(1南京理工大學化工學院,南京 210094)
(2鹽城師范學院,鹽城 224002)
能量特性和使用性能之間相互制約、對立統一的固有矛盾影響著含能材料技術發展的整個過程,使含能材料沿著提高能量和使用更加安全可靠這一主要方向發展。因此,世界各國競相開展高能鈍感含能材料的研究,如二硝基酞胺按(AND)、1,3,3-三硝基氮雜環丁烷(TNAZ)、六硝基六氮雜異伍茲烷(CL-20)等等一系列新的含能材料的產生[1-3]。Ritter和Licht[4]以2,6-二氨基吡啶為原料,通過硝化和氧化得 到 2,6-二 氨 基-3,5-二 硝 基 吡 啶-1-氧 化 物(ANPyO),結構與TATB相似,是一種新型的高能鈍感炸藥。
以含能化合物為配體合成的有一定爆炸性能的含能配合物具有良好的安定性和強烈的爆炸性,可用作軍用、民用火工品、爆破器材的起爆藥、起爆裝藥及含能催化劑,它的出現,預示著鈍感、含能、環保材料的一個重要發展方向[5-7]。BNCP是高氯酸·四氨·雙(5-硝基四唑)與鈷形成的配合物,它具有光敏特性和可靠的起爆能力,應用于激光起爆系統[8]。NTO與銅、鉛形成的配合物對雙基火箭推進劑的燃燒具有很好的調節作用,是一類性能優良的含能催化劑[9-10]。ANPyO具有含氮量高、穩定性好、感度低、能量高的優點,是一種性能優良的含能配體,可以與銅,鎳,鐵等過渡金屬形成含能配合物[11]。本文制備了ANPyO的Coバ配合物,通過單晶解析分析了它的結構;測試了其感度和熱分解特性;用Kissinger法和Ozawa-Doyle法計算了配合物熱分解過程中的表觀活化能和指前因子;同時研究了配合物對高氯酸銨(AP)熱分解性能的影響,結果表明,[Co(ANPyO)3]對AP熱分解具有良好的催化效果。
1 實驗部分
1.1 試劑與儀器
ANPyO為實驗室合成[12],為黃色粉末狀小顆粒,密度為 1.878 g·cm-3,熔融分解點大于 340 ℃。 其它試劑均為市售化學純或分析純產品。
CAD4型四圓單晶X-射線衍射儀(荷蘭ENRAF NONIUS公司);DSC823e差示掃描量熱儀 (瑞士METTLERTOLED 公司),試樣量為 1.16 mg,升溫速率 20 K·min-1, 升溫區間 50~500 ℃,N2流量為 30 mL·min-1; 熱重分析儀 (瑞士 METTLER TOLEDO TGA/SDTA851e熱分析儀),試樣量為 1 mg,升溫速率 20 K·min-1, 升溫區間 50~600 ℃,N2流量為30 mL·min-1;MAGNA-760型傅立葉變換紅外光譜分析儀(KBr壓片)(美國NICOLET公司);德國Vario EL III CHNOS元素分析儀;MEL-TEMP熔點儀(美瑞泰克集團-先德科技儀器),溫度計未經校正。
1.2 配合物[Co(ANPyO)3]的合成
將0.15 mol的ANPyO固體粉末分散在1 L乙酸中,懸浮液體呈光亮的黃色。攪拌下,將0.05 mol固體硝酸鈷Co(NO3)2·6H2O加入其中,升溫至80℃,回流1.5 h。冷卻,抽濾,并用50 mL乙酸清洗3次。在空氣中干燥24 h,在真空狀態下,繼續干燥得到31.34 g 紫黑色粉末,產率為 89.372%(以 ANPyO 為標 準)。 元 素 分 析 計 算 值 (%):C 25.68,H 1.71,N 29.96; 實測值 (%):C 25.65,H 1.75,N 29.92。 IR,(KBr,cm-1):3 612,3 420,3 303,3 072,1 601,1457,1316,1236,1048,805,746。熔點大于 300℃。
取0.1 g純凈的紫黑色產品加入10 mL DMF中,攪拌下加熱至溶質全部溶解,呈澄清的褐色溶液,冷卻至室溫,過濾掉析出的固體。將濾液置于25℃的恒溫單晶培養箱中,靜置數周后得到可用于X射線衍射分析用紫黑色單晶。
1.3 晶體結構測定
選取尺寸為 0.2 mm×0.1 mm×0.1 mm 的單晶,在四圓單晶衍射儀上用石墨單色化的Mo Kα射線(λ=0.071 073 nm)輻射,晶胞參數用回擺照相測定,用回擺法收集整個倒易空間的衍射數據。于293(2)K用ω/2θ方式掃描, 在 θ為 1.55°~25.37°收集衍射點7535 個(0≤h≤14,-15≤k≤14,-17≤l≤17),其中獨立衍射點7009個。I>2σ衍射點3632個全部數據經Lp校正和經驗吸收校正。晶體結構采用SHELXS-97程序由直接法解出,結構精修采用SHELXL-97[13]程序,對氫原子和非氫原子分別采用各向同性和各向異性溫度因子進行全矩陣最小二乘法修正。其晶體學參數和結構優化參數如表1所示。

表1 [Co(ANPyO)3]·3DMF的晶體學參數和結構優化參數Table l Crystal data and structure refinement of[Co(ANPyO)3]·3DMF
2 結果與討論
2.1 晶體結構分析
由單晶衍射可知,晶體的分子式為[Co(ANPyO)3]·3DMF。3個DMF分子是以結晶溶劑的形式存在。溶液中存在的 H+和 NO3-將 Co2+氧化成 Co3+,[Co(ANPyO)3]的相對分子質量為701.34,顏色為紫黑色,在水、甲醇、乙醇等溶劑中溶解度不高,在DMF、DMSO中有非常好的溶解度。[Co(ANPyO)3]·3DMF的分子結構圖見圖1,[Co(ANPyO)3]·3DMF的晶胞堆積圖見圖2,[Co(ANPyO)3]·3DMF的主要鍵長和鍵角見表2。
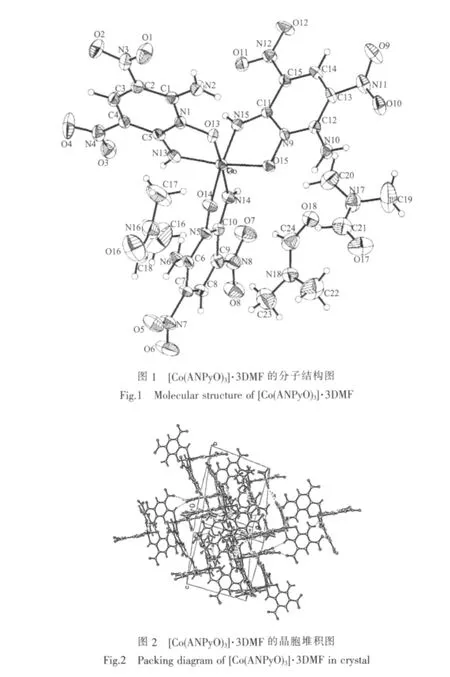
表2 [Co(ANPyO)3]·3DMF的主要鍵長和鍵角Table 2 Main bond lengths(nm)and bond angles(°)for[Co(ANPyO)3]·3DMF
由分子結構分析可知,化合物的分子式應表達為[Co(ANPyO)3],鈷離子位于分子中心。ANPyO作為雙齒配體,以分子中的一位氨基氮原子和氮氧基氧原子與中心鈷離子形成配位鍵,其中參與配位的氨基中的1個H脫去。3個脫去質子的ANPyO與鈷離子配位形成六配位的八面體結構。由表2可知,Co3+與其周圍3個氧原子和3個氮原子所形成的鍵角均偏離90°或180°,這說明Co3+與配體形成了畸變的八面體結構,這可能是由于配體的空間位阻過大所致。
由表2可知,整個分子中C=N,N=O鍵的鍵長比常規 C=N、N=O 鍵長(0.127 0、0.120 0 nm)要長,而C-N鍵的鍵長比一般C-N鍵的鍵長(0.1470 nm)要短些,C=N、N=O、C-N鍵長趨于平均化,正是配體共軛效應的結果。鈷原子與配體中氮原子和氧原子連結的鍵長分別為 Co-N(15)為 0.187 6 nm,Co-N(13)為0.188 1 nm,Co-N(14) 為 0.188 5 nm,Co-O(13)為0.189 4 nm,Co-O(14) 為 0.190 1 nm,Co-O(15)為0.191 3 nm;與標準的Co-N鍵和Co-O鍵的鍵長有出入,這是螯合效應影響的結果。
在化合物分子中,每個脫去質子ANPyO都與鈷離子配位形成五元螯合環,在每個五元環中,5個原子具有較好的共面性。由于分子中具有多個穩定的螯合環,因而分子結構穩定,這就決定了其性質也相當穩定,如耐熱性好、不吸濕、不水解等。同時,結構分析證明,該配合物結構中沒有配位水和結晶水存在,有利于結構穩定,因此也增強了其性質上的穩定性,宏觀上表現為其作為含能材料的安全、鈍感等特性。
2.2 熱分解分析
在 20 K·min-1線性升溫條件下,[Co(ANPyO)3]的典型DSC和TG-DTG曲線分別見圖3,圖4。
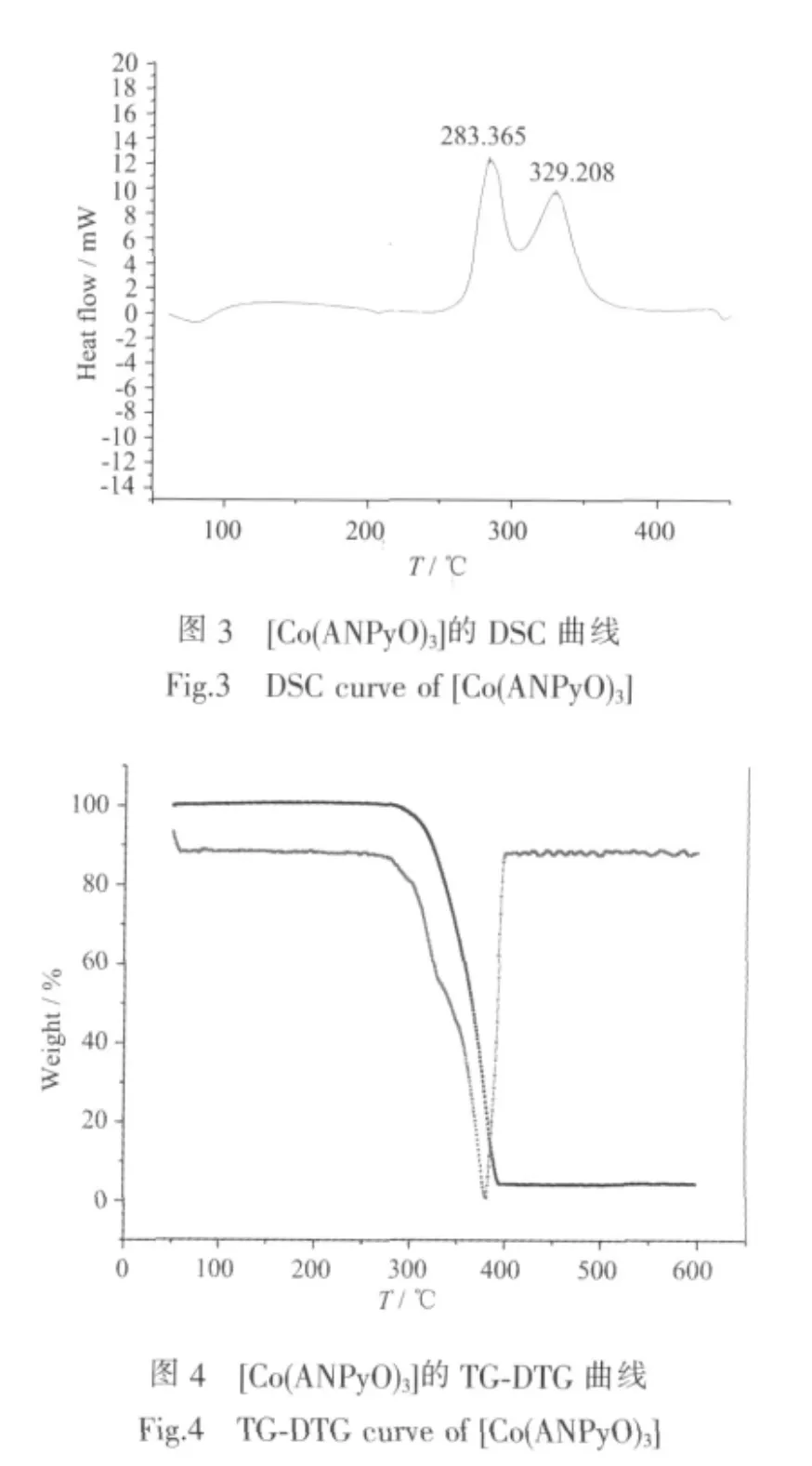
由圖3和圖4可知,配合物在50~600℃范圍內的熱分解分為3個階段。DSC曲線表明,第一階段為緩慢吸熱過程,從加熱開始,終于94.42℃,峰頂溫度為80.36℃。對于相應的TG-DTG曲線,沒有明顯的變化,表明這一階段為配合物的吸熱熔融過程,無質量損失。第二階段為放熱分解過程,始于252.84 ℃,終于 304.88 ℃,峰頂溫度為 283.36 ℃。對應于TG-DTG曲線上表現為一為緩慢失重過程,失重率為3.0221%,推測為Co-N,Co-O鍵發生了斷裂,3個五元螯合環破裂。第三階段同樣為一放熱分解過程,始于 304.88 ℃,終于 393.21 ℃,峰頂溫度為329.31℃。對應于TG-DTG曲線上表現為一劇烈的質量損失過程,失重率達93.2502%,最大質量損失出現在380.96℃。這一階段反應劇烈,配體各化學鍵均斷裂,熱分解最終產物大部分為氣體產物,有少許殘渣剩余。
DSC曲線顯示,第二、三階段為連續的放熱分解過程,對應于TG-DTG曲線上表現為2個連續的質量損失過程,表明前階段沒有完全分解,下一階段立即進行。隨著溫度的升高,樣品殘渣逐漸變小,化合物在397.88℃時質量損失96.2723%,剩余殘渣的質量分數為3.7277%。
2.3 [Co(ANPyO)3]非等溫反應動力學分析
用Kissinger法和Ozawa-Doyle法對[Co(ANPyO)3]熱分解過程中第一放熱峰的表觀活化能(E)和指前因子(A)進行計算。Kissinger[14]方程和 Ozawa-Doyle[15-16]方程分別為:
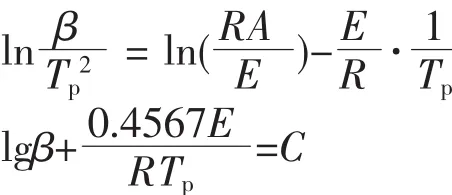
式中:Tp為溫度峰值(K);R 為氣體常數(8.314 J·mol-1·K-1);β 為線性升溫速率(K·min-1);C 為常數。
[Co(ANPyO)3]在不同升溫速率下放熱過程的峰頂溫度Tp、表觀活化能Ek和Eo、指前因子Ak以及線性相關系數rk和ro如表3所示。由表3可見,用Kissinger法和Ozawa-Doyle法算得的活化能非常接近。通過算得的Ek和ln Ak,可將配合物熱分解過程的 阿 累 尼 斯 方 程 表 示 為 :ln K=49.08-224.12×103/(RT)。
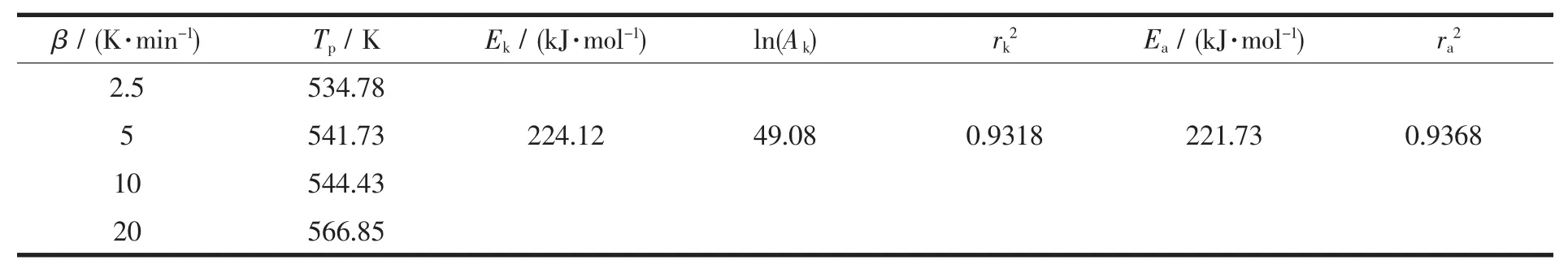
表3 [Co(ANPyO)3]非等溫反應動力學參數Table 3 Nonisothermal reaction kinetic parameters for[Co(ANPyO)3]
2.4 感度性能測試
WL-1 型落錘儀:錘重(2 500±10)g,落高(250±1)cm,試樣重50 mg;WM-1型摩擦感度儀:錘重(1500±1.5)g,擺角 90°,表壓 4 MPa,滑柱移動距離 1.5~2 mm,試樣重20 mg。操作方法參照GJB772.206-89《炸藥試驗方法、撞擊感度測定、爆炸概率法》與GJB772.208-91《炸藥試驗方法、摩擦感度測定、爆炸概率法》。沖擊波感度實驗操作方法參照GJB 772.207-90《炸藥試驗方法、沖擊波感度測定、卡片式隔板法》。
對[Co(ANPyO)3]的部分感度進行了測試,并與ANPyO的性能進行了對比。結果說明其感度相對ANPyO有一定程度的降低,具體數據列于表4。
ANPyO分子結構呈平面狀,氨基氫原子與硝基氧原子、氮氧基氧原子分別形成分子內、分子間氫鍵,導致晶體呈層狀或片狀結構。本文選擇過渡金屬Co作為滲合劑,將Co3+離子“楔入”配體平面的分子層之間,一方面利用過渡金屬的d空軌道吸納π電子,形成結合力較強的配位鍵,減弱或消除分子層間的電性排斥作用;另一方面,配位鍵的形成使分子層之間的距離縮小,層間分子的自由度降低,從而使配合物穩定性提高,安全性能提高。

表4 [Co(ANPyO)3]與ANPyO感度性能對比Table 4 Sensitivity performance contrasting of[Co(ANPyO)3]and ANPyO
2.5 應用性能研究
高氯酸銨(AP)作為復合固體推進劑的高能組分,它在AP系推進劑中占有60%~80%的比例,其熱分解特性與推進劑燃燒特性密切相關,因此研究催化劑對AP熱分解的催化作用對預估催化劑對AP系推進劑的催化效果具有重要意義[17-18]。本文將[Co(ANPyO)3]與AP按照1∶3的質量比混合,用DSC測定AP及混合物的熱分析曲線,根據特征峰的峰形和峰位變化研究配合物對AP熱分解的影響,所得曲線見圖5。
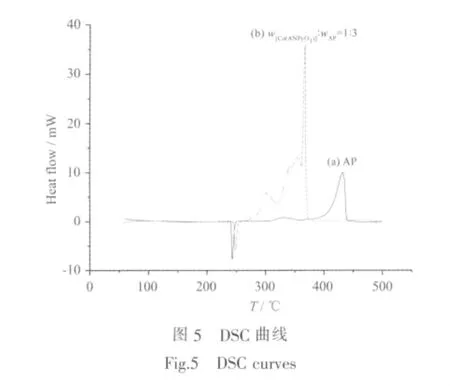
在20 K·min-1線性升溫條件下,純品AP的DSC曲線可看出,AP的熱分解過程主要包括1個吸熱過程和2個放熱過程。吸熱峰發生在236~252℃之間,峰頂溫度為242.99℃,為AP的晶型轉變溫度;隨著溫度的升高,出現一個緩慢的放熱分解峰和一個劇烈的放熱分解峰,發生在300~442℃,峰頂溫度分別為 329.40 和 431.35 ℃。由配合物與 AP 按照 1∶3 的質量比混合后所得的DSC曲線中,配合物對AP的熔解吸熱峰的峰頂溫度為248.12℃,后移了5.13℃,對AP的晶型轉變溫度沒有明顯的影響;隨后出現的放熱過程為兩物質的交叉放熱過程,其中AP分解反應的起始溫度、高溫分解峰溫和AP分解的終止溫度都明顯提前,特別是高溫分解峰溫為366.20℃,提前了65.15℃,而且熱分解反應的激烈程度也大大提高。這說明[Co(ANPyO)3]可以加速AP的分解,使AP的熱分解溫度提前,分解速度加快,具有良好的催化效果。
3 結 論
本文以 2,6-二氨基-3,5-二硝基吡啶-1-氧化物(ANPyO)為配體,制備出含能配合物[Co(ANPyO)3],并通過元素、紅外、單晶衍射、DSC和TG-DTG等手段對其結構和熱分解性能進行了分析。測試了配合物的撞擊感度、沖擊波感度和摩擦感度,結果表明[Co(ANPyO)3]比配體ANPyO鈍感。DSC實驗表明,[Co(ANPyO)3]對高氯酸銨(AP)的熱分解過程具有非常好的催化效果。
[1]ZHANGCY.Chemi.Phys.,2006,324:547-555
[2]Sikder A K,Sikder N.J.Hazard.Mater.,2004,A112:1-15
[3]Hollins R A,Merwin L H,Gilardi R,et al.J.Heterocyclic Chem.,1996,33:895-904
[4]Heinrich H,Licht.Propellants,Explos.,Pyrotech.,2002,25(3):126-132
[5]FU Yang(傅楊),LIU Yan(劉炎),CHEN Xing-Guo(陳興 國),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(7):1133-1140
[6]Xia Z Q,Chen S P,Wei Q,et al.J.Solid State Chem.,2011,184(7):1777-1783
[7]ZHANG Tong-Lai(張同來),WANG Shao-Zong(王紹宗),YANG Li(楊 利 ),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,10(22):1819-1823
[8]SHENG Di-Lun(盛滌倫),LI Ji-Zhen(李吉禎),ZHANG La(張 蠟),et al.Chinese J.Energ.Chem.(Hanneng Cailiao),2000,8(3):100-103
[8]Singh G,Felix SP.J.Hazard.Mater.,2002,90(1):1-17
[9]MA Hai-Xia(馬海霞),SONG Ji-Rong(宋紀蓉),DONG Wu(董武),et al.Acta Chim.Sinica(Huaxue Xuebao),2004,62(12):1139-1143
[10]LIU Jin-Jian(劉進劍),LIU Zu-Liang(劉祖亮),CHENG Jian(成健).Chinese J.Explos.and Propel.(Huozhayao Xuebao),2012,35(2):36-40
[11]CHENGJian(成健),YAO Qi-Zheng(姚其正),LIU Zu-Liang(劉祖亮).Chinese J.Energ.Chem.(Hanneng Cailiao),2008,11:1943-1947
[12]Sheldrick GM.University of Gottingen,Gottingen,Germany,1997.
[13]Kissinger H E.Anal.Chem.,1957,29(11):1702-1706
[14]Ozawa T.Bull.Chem.Soc.Jpn.,1965,38(11):1881-1885
[15]Doyle CD J.J.Appl.Polym.Sci.,1961,5(15):285-292
[16]Ebrahim A G,Yashar A K,Rahimi R,et al.Powder Techn.,2012,217:330-339
[17]DUAN Hong-Zhen(段紅珍),LIN Xiang-Yang(藺向陽),LIU Guan-Peng(劉 冠 鵬 ),et al.Chinese J.Chem.Eng.(Zhongguo Huaxue Gongcheng Xuebao),2008,16(2):325-328

