重組人血管內(nèi)皮生長因子(VEGF)單克隆抗體的制備
徐多多,李思靜,李芳芊,潘鵬濤,吳 靖,王 麗
(東北師范大學(xué)遺傳與細胞研究所,吉林 長春 130024)
血管內(nèi)皮生長因子(VEGF)是一種誘導(dǎo)血管生成及增加血管透性的重要蛋白質(zhì),最早是在1989年由Leunq等人在牛的垂體星狀細胞培養(yǎng)液中提純出來的[1],是一種重要的促血管生成因子.研究證明它是一種同源二聚體糖蛋白[2],由兩個相同多肽鏈通過二硫鍵構(gòu)成.細胞在生長過程中需要這種生長因子的促進作用,尤其是腫瘤細胞在生長和轉(zhuǎn)移過程中更離不開VEGF的作用.近年來許多學(xué)者的研究發(fā)現(xiàn),腫瘤患者血清中VEGF蛋白含量明顯高于健康人[3-5];此外,血管的生成及細胞增生程度也與VEGF的表達水平有著密切關(guān)系[6],且其過度表達影響腫瘤的轉(zhuǎn)移和侵襲.基于以上理論基礎(chǔ),本文應(yīng)用雜交瘤技術(shù)制備了VEGF單克隆抗體,以為開發(fā)檢測VEGF的試劑奠定基礎(chǔ).
1 材料與方法
1.1 材料
雌性BALB/c小鼠,購于吉林大學(xué)公共衛(wèi)生基礎(chǔ)醫(yī)學(xué)院實驗動物中心;小鼠骨髓瘤細胞(SP2/0)、重組質(zhì)粒pET28a(+)-VEGF、大腸桿菌DH5α、BL21由本實驗室保存;Ni-NTA瓊脂糖凝膠購自德國QIAGEN公司;IPTG購自鼎國生物有限公司;尿素、Na2HPO4·12H2O、NaH2PO4·2H2O、咪唑、PEG4000購自上海生工;羊抗鼠IgG-HRP二抗購自北京中杉金橋生物公司;弗氏完全佐劑、弗氏不完全佐劑、HAT培養(yǎng)基(50×)、HT培養(yǎng)基(50×)購自美國Sigma公司.
1.2 VEGF蛋白的誘導(dǎo)表達及純化
將pET28a(+)-VEGF表達質(zhì)粒轉(zhuǎn)化至大腸桿菌,挑取單菌落,接種至LB培養(yǎng)基中,37℃,100r/min振蕩培養(yǎng)過夜.第2天,接種新的LB培養(yǎng)基,200r/min擴大培養(yǎng)4h后,加入IPTG(終濃度1mmol/L),37℃,200r/min誘導(dǎo)表達4h,離心收集菌體并進行超聲破碎,8mol/L尿素溶解沉淀,4℃過夜,離心,棄沉淀留上清.將含有目的蛋白的上清液上鎳柱,分別用濃度為20,40,100,200,500mmol/L的咪唑(用8mol/L尿素溶液配制,pH=7.4)洗脫,收集各個濃度的洗脫液,電泳分析,選出條帶比較單一的樣品收集并純化.
1.3 免疫動物
小鼠免疫按常規(guī)方法進行,初次免疫用30μg的VEGF蛋白與等體積的弗氏完全佐劑混合,乳化后免疫BALB/c小鼠.以后每隔2周,采用VEGF蛋白與等體積的弗氏不完全佐劑混合后進行免疫,共免疫3次.
1.4 雜交瘤細胞融合
提前兩周復(fù)蘇SP2/0骨髓瘤細胞,融合前一天取BALB/c小鼠腹腔巨噬細胞制備飼養(yǎng)細胞.加強免疫3d后進行細胞融合,將SP2/0細胞與脾細胞按1∶10的比例(體積比)于50mL離心管中混合,1min內(nèi)緩慢滴入1mL預(yù)熱的50%PEG4000,37℃水浴中靜置5min,用無血清RPMI-1640培養(yǎng)基終止作用,離心收集細胞.首先將細胞懸于含HAT的選擇培養(yǎng)基中,接種于96孔細胞培養(yǎng)板中,每孔加1~2滴細胞懸液使得接種細胞密度為1~2個/孔,培養(yǎng)10d后更換HT培養(yǎng)基,兩周后,改用一般培養(yǎng)基.
1.5 雜交瘤細胞篩選及克隆化
待雜交瘤細胞生長至孔底面積1/10以上時,用VEGF(0.5μg/mL)包被ELISA板,用ELISA方法篩選陽性克隆孔.同時設(shè)SP2/0骨髓瘤細胞上清液作為陰性對照.D(450)值大于或等于陰性孔的2.1倍即為陽性孔.選取D(450)值相對較高的培養(yǎng)孔進行克隆,采用有限稀釋法進行4次亞克隆,獲得能夠穩(wěn)定分泌VEGF單克隆抗體的雜交瘤細胞株.
1.6 腹水的制備、純化、效價測定及特異性驗證
1.6.1 腹水制備
按常規(guī)方法將0.5mL無菌液體石蠟注射到小鼠腹腔,一周后,再將0.5mL雜交瘤細胞((2~5)×106個/mL)懸液注射到小鼠腹腔.同時用SP2/0細胞制備陰性腹水.10~20d后,當觀察到小鼠腹部明顯膨隆、波動感明顯且小鼠狀態(tài)較差時,收集腹水.
1.6.2 腹水純化
采用G蛋白(Protein G)親和層析法對腹水抗體進行純化.將磷酸鈉鹽結(jié)合緩沖液裝入5mL注射器中,用10mL結(jié)合緩沖液洗柱,流速為1mL/min;將腹水與結(jié)合緩沖液按照1∶2(體積比)稀釋,上樣,流速1mL/min,然后用10mL結(jié)合緩沖液洗柱;用Bradford試劑檢測,直到流出液中沒有蛋白為止.用洗脫緩沖液洗柱,收集樣品,-40℃保存.
1.6.3 效價測定
采用間接ELISA方法測定純化的VEGF單克隆抗體效價.用制備的VEGF蛋白包被ELISA板,濃度為0.5μg/mL,每孔100μL,4℃過夜;37℃封閉1h,拍干后加入倍比稀釋的抗體100μL,另用骨髓瘤細胞制備的腹水作為陰性對照,用抗體稀釋液作為空白對照,37℃孵育1h;洗滌后加入羊抗鼠IgG-HRP,37℃反應(yīng)45min,加底物顯色,最后用2mol/L的硫酸終止反應(yīng).用酶標儀測定波長450nm處樣品(P)、陰性對照孔(N)及空白對照(B)的D(450)值,計算P/N 比值,并選定P/N≥2.1為陽性,其中P/N≥2.1時陽性血清的最大稀釋倍數(shù)即為抗體效價.
1.6.4 單克隆抗體特異性驗證
用Western blot方法對VEGF單克隆抗體的特異性進行鑒定.首先將VEGF蛋白進行SDS-PAGE,然后將其電轉(zhuǎn)至PVDF膜上,用封閉液進行封閉,洗滌后將純化的單克隆抗體作為一抗,羊抗鼠IgG-HRP作為二抗,最后用AEC底物顯色.
2 結(jié)果
2.1 VEGF蛋白SDS-PAGE及Western blot分析
目的蛋白經(jīng)過NTA-Ni2+親和層析及咪唑梯度洗脫后,在相對分子質(zhì)量20000~31000之間出現(xiàn)了一條單一的目的帶(見圖1),純度達到90%以上,滿足實驗要求.純化后的VEGF蛋白再經(jīng)過SDS-PAGE進行分離,將凝膠上的純化蛋白轉(zhuǎn)移至PVDF膜上,利用商品化VEGF單克隆抗體進行特異性分析,結(jié)果表明,純化后的VEGF蛋白在對應(yīng)位置出現(xiàn)了明顯的單一雜交條帶(見圖1),證實制備的VEGF蛋白具有抗原性能夠特異性識別VEGF抗體.
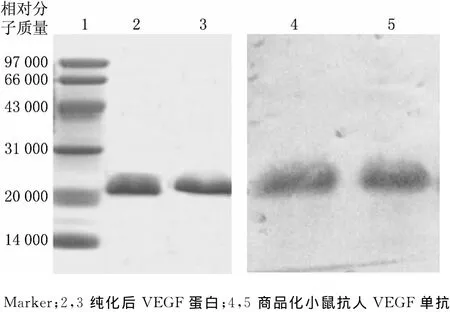
圖1 純化后VEGF蛋白SDS-PAGE及Western blot分析
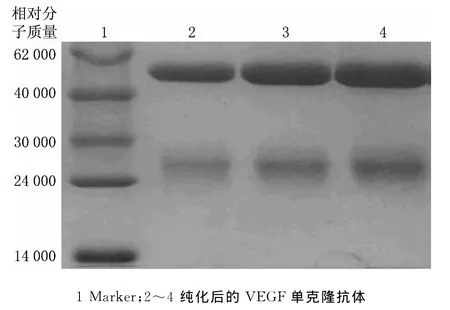
圖2 G蛋白親和純化后腹水抗體SDS-PAGE
2.2 單克隆抗體制備純化結(jié)果
采用小鼠腹腔注射的方法制備腹水,利用IgG能與G蛋白特異性結(jié)合的特性,使IgG先吸附于瓊脂糖凝膠上,再使用洗脫緩沖液將IgG洗脫,從而達到對腹水抗體純化的目的.將洗脫液進行SDS-PAGE分析,結(jié)果如圖2所示.從圖2中可以清晰看到抗體的輕鏈、重鏈,且雜蛋白含量非常少,表明純化后的腹水抗體純度高,可滿足后續(xù)實驗要求.
2.3 單克隆抗體的效價測定
采用間接ELISA方法對純化后的腹水抗體進行效價測定,結(jié)果見圖3.從圖3可以看出,純化后的腹水抗體的D(450)值與陰性對照的D(450)值之比大于或等于2.1的最高稀釋倍數(shù)為1024.因此,腹水抗體純化后效價達到1∶1024.
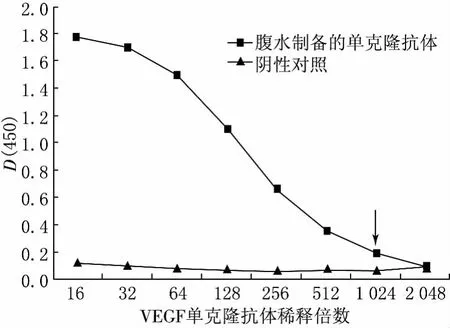
圖3 純化后VEGF單克隆抗體效價檢測結(jié)果

圖4 Western blot鑒定制備的單克隆抗體特異性
2.4 單克隆抗體特異性鑒定
應(yīng)用Western blot方法對獲得的單克隆抗體進行特異性分析,結(jié)果見圖4.結(jié)果顯示,單克隆抗體能與VEGF蛋白發(fā)生特異性反應(yīng),而陰性對照無特異性條帶出現(xiàn),表明純化后的單克隆抗體能夠特異性識別目的蛋白.
3 討論
VEGF是目前發(fā)現(xiàn)的最強烈的血管生成因子,參與促進血管內(nèi)皮細胞增殖、誘導(dǎo)腫瘤血管生成、維持腫瘤繼續(xù)生長等諸多生理及病理過程[8].VEGF是肝素結(jié)合型二聚體糖蛋白,有5種剪接異構(gòu)體,分別包括121,145,165,189,206個氨基酸,其中VEGF165是體內(nèi)最豐富的亞型,具有較強的生物活性[9].因此,本實驗選擇免疫原時,采用的是VEGF165蛋白.
細胞融合是制備單克隆抗體過程中關(guān)鍵的一步,融合率高低和后續(xù)的陽性雜交瘤細胞的篩選密切相關(guān).因此在細胞融合前要做好充足的準備,如提前復(fù)蘇骨髓瘤細胞使得融合時可生長到最佳狀態(tài),提前一天制備飼養(yǎng)細胞以及免疫后的小鼠脾細胞要充分研磨等.
細胞融合后,首先使用HAT培養(yǎng)基進行篩選,雜交瘤細胞生長的同時阻斷其他融合細胞或未融合細胞的生長與繁殖.本實驗主要采用間接ELISA的方法進行篩選,并獲得了特異性及靈敏性較高的細胞株.細胞融合后選擇適合的檢測時間也是很重要的,過早會因陽性細胞少而出現(xiàn)假陽性,過晚可能會使檢測細胞株中混有不分泌抗體的陰性克隆細胞,而這些細胞具有代謝上的優(yōu)勢,它會與陽性細胞競爭營養(yǎng)成分,進而導(dǎo)致陽性細胞死亡.本研究是在融合后的第10天,觀察到部分雜交瘤細胞生長至孔底面積的1/10時,開始對其進行檢測.為避免陽性細胞株轉(zhuǎn)變成陰性,應(yīng)該在篩選出陽性孔后盡快進行亞克隆.另外,由于初次篩選出的雜交瘤細胞中的染色體極不穩(wěn)定,易丟失,從而喪失分泌抗體的能力,所以,一般要經(jīng)過3~4次的克隆、亞克隆才能篩選出能夠穩(wěn)定分泌抗體的陽性雜交瘤細胞.
本研究以高純度的VEGF作為抗原反復(fù)免疫小鼠,按常規(guī)單克隆抗體制備技術(shù)篩選出1株可分泌VEGF抗體的雜交瘤細胞,并通過制備腹水的方法成功獲得了高純度的VEGF單克隆抗體.經(jīng)ELISA和Western blot檢測,抗體具有高特異性,效價達到1∶1024,為下一步開發(fā)基于血清VEGF蛋白的檢測試劑奠定了基礎(chǔ).
[1]LEPELLETIER Y,CAMARA-CLAYETTE V,JIN H,et al.Prevention of mantle lymphoma tumor establishment by routing transferrin receptor toward lysosomal compartments[J].Cancer Res,2007,67(3):1145-1154.
[2]FERRARA N,HENZEL W.Pituitary follicular cells secret a novel heprin-binding growth factor specific for vascular endothelial cells[J].Biochem Biophys Res COMMUN,1989,161:851-858.
[3]YAMAMOTO Y,TOI M,KONDO S,et al.Concentrations of vascular endothelial growth factor in the sera of normal controls and cancer patients[J].Clin Cancer Res,1996,2(5):821 -826.
[4]HASEGAWA Y,TAKANASHI S,OKUDERA K,et al.Vascular endothelial growth factor level as a prognostic determinant of small cell lung cancer in Japanese patients[J].Intern Med,2005,44(1):26-34.
[5]SHIMADA H,TAKEDA A,NABEYA Y,et al.Clinical significance of serum vascular endothelial growth factor in esophagcal squamous cell carcinoma[J].Cancer,2001,92(3):663-689.
[6]PAULOVICH A G,HARTWELL L H.A checkpoint regulates the rate of progression through S phase in S.cerevisiae in response to DNA damage[J].Cell,1995,82(5):841-847.
[7]KOHLER G,MILSTEIN C.Continuous cultures of fused cells secreting antibody of predefined specificity[J].Nature,1975(256):495-497.
[8]王彥敏.血管生因子 VEGF研究進展 [J].河北醫(yī)藥,2010,32:1456-1458.
[9]石琦,單冰,高晨,等.血管內(nèi)皮生長因子(VEGF)單克隆抗的制備及鑒定[J].細胞與分子免疫學(xué)雜志,2008,24(2):142-146.

