番茄紅素抗氧化應激效應對大鼠脊髓損傷后運動功能恢復的影響①
李曉,羅晨禹,楊拯,謝少華,張堯,楊海燕,馬延仃,張藝,胡雯思,卓睿,李亞光
脊髓損傷(spinal cord injury,SCI)是一種嚴重危害人類中樞神經系統的疾病,致殘率和死亡率都很高。據統計,每年大約新增30萬脊髓損傷患者。因此,我們必須開展基礎研究,以期為脊髓損傷的臨床治療提供新思路和新方法。脊髓損傷的主要病理改變包括由原發性損傷導致出血、缺血和缺氧等引起的一系列繼發性損傷,如Ca2+聚集、興奮性氨基酸的釋放、大量自由基產生、脂質過氧化反應、炎癥反應和細胞凋亡等[1-3]。而這些繼發性損害是加重脊髓神經功能喪失的關鍵因素。因此,在脊髓損傷早期,有效地控制脊髓的繼發性損傷是一個重要的研究方向。
研究表明,氧化應激效應在脊髓損傷的病理改變中發揮重要作用,與脊髓損傷時脊髓及脊髓所支配區域的損傷有密切的聯系[4]。番茄紅素(lycopene,LP)是一種開鏈式的不飽和類胡蘿卜素,屬于天然脂溶性色素,它具有極強的抗氧化和清除自由基的能力,其抗氧化性能在天然類胡蘿卜素中最強[5-6]。
本實驗采用測定脊髓損傷模型血清中超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量和后肢運動功能評價的方法,探討番茄紅素對脊髓損傷后大鼠運動功能恢復的影響。
1 材料與方法
1.1 實驗動物與分組
健康、清潔級成年Sprague-Dawley大鼠36只,雌性(雌性大鼠尿道短,尿道感染、水腫發生概率低,不易形成尿道阻塞,有利于脊髓損傷術后護理,可提高術后大鼠生存率),體重(230±20)g,由四川大學實驗動物中心提供,許可證號:SCXK(川)-10-2006。將36只大鼠按Allen法造脊髓損傷模型后隨機分為3組:對照組(A組)、甲潑尼龍琥珀酸鈉治療組(B組)和番茄紅素治療組(C組),每組12只。每組再隨機按1 d、3 d、7 d分成3個亞組,每個時間點4只。
1.2 主要試劑和儀器
6%番茄紅素油樹脂(新疆瑞德萊福生物科技有限公司),批號:HY1007261;注射用甲潑尼龍琥珀酸鈉(天津藥業焦作有限公司),批號:10031501;戊巴比妥鈉(德國進口分裝,北京化學試劑公司),批號:100808;注射用青霉素鈉(瑞陽制藥有限公司),批號:10013101;氯化鈉注射液(安徽雙鶴藥業有限責任公司),批號:110120 2E;丙二醛(MDA)試劑盒(南京建成生物工程研究所),批號:20111217。超氧化物歧化酶(SOD)試劑盒(南京建成生物工程研究所),批號:20111217;自制數字式脊髓損傷動物模型制備儀;TGL-16G臺式離心機(上海安亭科學儀器廠);721E型可見分光光度計(上海光譜儀器有限公司)。
1.3 模型制備
選取正常Sprague-Dawley大鼠,用1.5%戊巴比妥鈉(30 mg/kg)腹腔注射麻醉,俯臥位固定,背部去毛,常規消毒鋪巾。以T9棘突為中心做背部正中切口,長約2 cm,然后用手術刀緊靠棘突兩邊切開背部肌肉,明確T9的位置,接著小心去除T9椎骨上的肌肉。之后進行椎板切除術,先用有齒鑷剝離T9棘突和椎間軟組織,再用無齒鑷小心剝開錐板,并適當修剪兩側錐板,充分暴露脊髓,用自制數字式脊髓損傷動物模型制備儀打擊器制成脊髓損傷模型,打擊強度為10 g×25 mm,打擊后即刻見鼠尾痙攣性擺動,雙后肢及軀體發生不同程度抽搐,隨后完全松弛,標志模型制備成功,之后逐層縫合切口。由于手術過程中有一定出血而使大鼠血容量減少,術后立即以9 ml/kg腹腔注射氯化鈉注射液,并腹腔注射青霉素以防感染,待動物清醒后放回飼養籠中飼養。術后大鼠自由飲水、進食,保持適宜室溫和濕度,定時清潔籠具,并保持大鼠身體干燥,每天擠壓膀胱排尿3次,直至恢復自主排尿;術后連續3 d每天腹腔注射青霉素8×104U。
1.4 治療方法
A組:造模成功后不給予任何藥物治療。B組:造模成功后30 min按首次劑量30 mg/kg腹腔注射甲潑尼龍琥珀酸鈉,此后按5.4 mg/kg?h每6小時注射1次,共4次。C組:造模成功后30 min灌胃溶有番茄紅素油樹脂的色拉油2 ml(按20 mg/kg番茄紅素配制)[7],此后每天灌胃1次。
1.5 評定方法
每組大鼠按1 d、3 d和7 d亞組進行評定,內容如下。
1.5.1 斜板試驗[8]將大鼠置于自制墊有橡膠墊的斜板上,使大鼠身體縱軸與斜板縱軸平行,頭朝斜板抬高側,斜板傾斜角度從0°開始緩慢上升。記錄大鼠停留在斜板上維持至少5 s時的最大角度,每次測試3遍,取其平均值。采用雙人雙盲法,每次評分由熟悉評分標準但與實驗無關的人員完成。
1.5.2 BBB評分[9]將大鼠排空膀胱后置于寬大活動場地,采用雙人雙盲法觀察其后肢運動情況,聯合考察大鼠后肢各關節活動、后肢的步態和協調功能、運動時爪子的精細運動。取左右兩側肢體評分平均值,作為最后得分。
1.5.3 血清中SOD和MDA測定 大鼠均于行為測試完成后,戊巴比妥鈉麻醉,經右心室取血3 ml,立即3000 r/min離心15 min,取上清液,存于-20℃冰箱。SOD和MDA分別采用黃嘌呤氧化法和硫代巴比妥酸檢測,操作方法按試劑盒說明進行。
1.6 統計學分析
2 結果
2.1 一般情況
大鼠術后蘇醒,靜臥少動,氣息較微,雙后肢運動功能喪失,肌張力降為零,無食欲,不進水,尿失禁或下腹部膨隆,發生尿潴留,呈現不完全性脊髓損傷的表現。術后前3 d,大鼠活動、進食較少,尿潴留比較嚴重,部分伴血尿及腹部脹氣,此后飲食逐漸增加,活動逐漸增多。由于實驗期間護理良好,5~7 d后,所有大鼠能夠基本恢復自主排尿,且傷口未見感染,身體未出現壓瘡,36只大鼠均進入結果分析。
2.2 斜板試驗
術后1 d、3 d,C組斜板試驗評分均高于A組(P<0.05),7 d無顯著性差異(P>0.05)。術后1 d、3 d、7 d,B組斜板試驗評分均高于A組(P<0.05)。見表1。
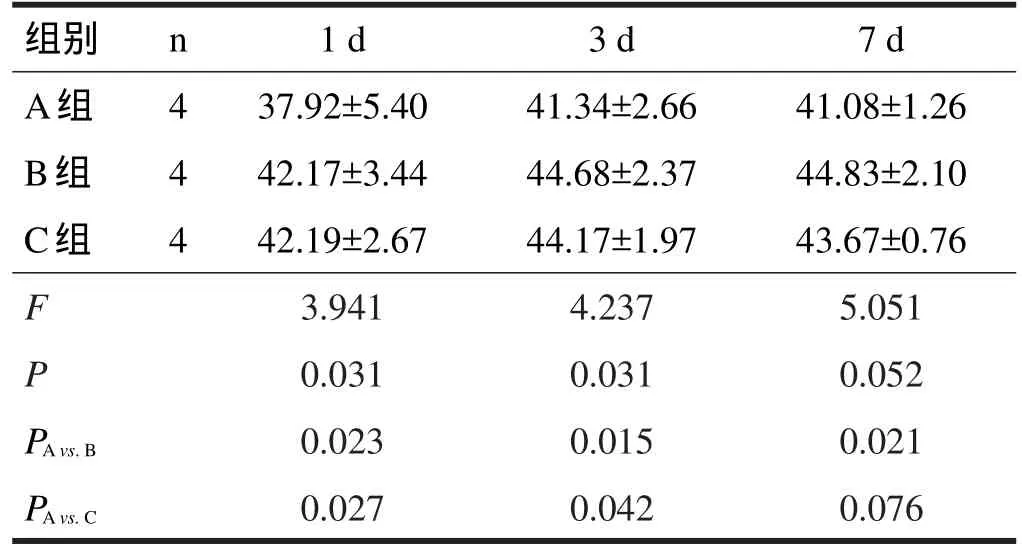
表1 脊髓損傷大鼠斜板評分結果
2.3 BBB評分
術前所有大鼠評分均為21分。術后1 d、3 d、7 d,C組與A組相比,BBB評分均增高(P<0.05),B組術后1 d、7 d評分明顯高于A組(P<0.01),3 d雖也高于A組,但無顯著性差異(P>0.05)。見表2。

表2 脊髓損傷大鼠BBB評分結果
2.4 SOD
術后1 d、3 d、7 d,C組與A組相比,SOD活性升高(P<0.05)。術后1 d,B組SOD活性與A組無顯著性差異(P>0.05);術后3 d、7 d,B組SOD活性升高(P<0.05)。見表3。
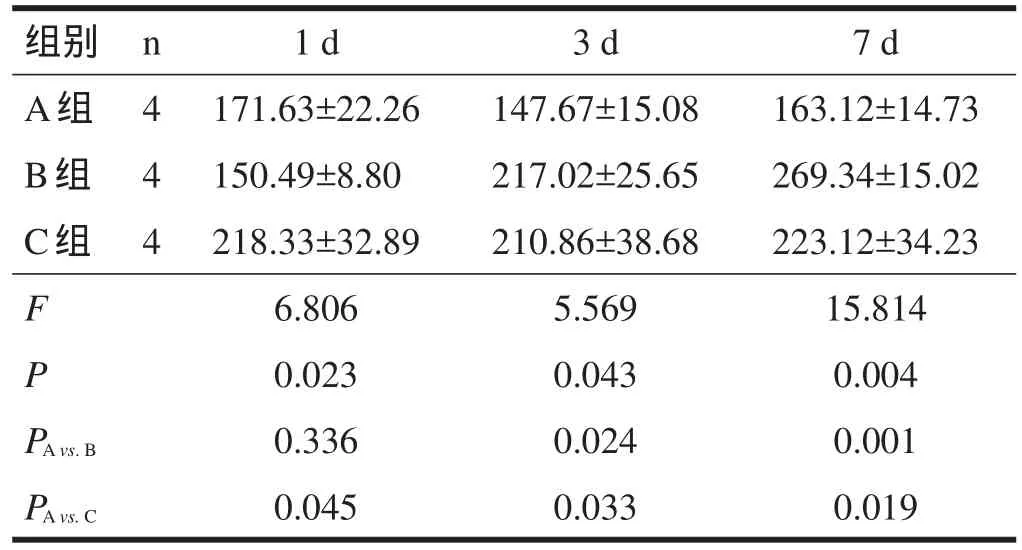
表3 脊髓損傷大鼠SOD活性測試結果(U/ml)
2.5 MDA
術后1 d,B組MDA含量較A組降低(P<0.05),C組與A組無顯著性差異(P>0.05)。術后3 d,C組MDA含量低于A組(P<0.05),但B組與A組無顯著性差異(P>0.05)。術后7 d,C組、B組MDA含量均顯著低于A組(P<0.001)。見表4。
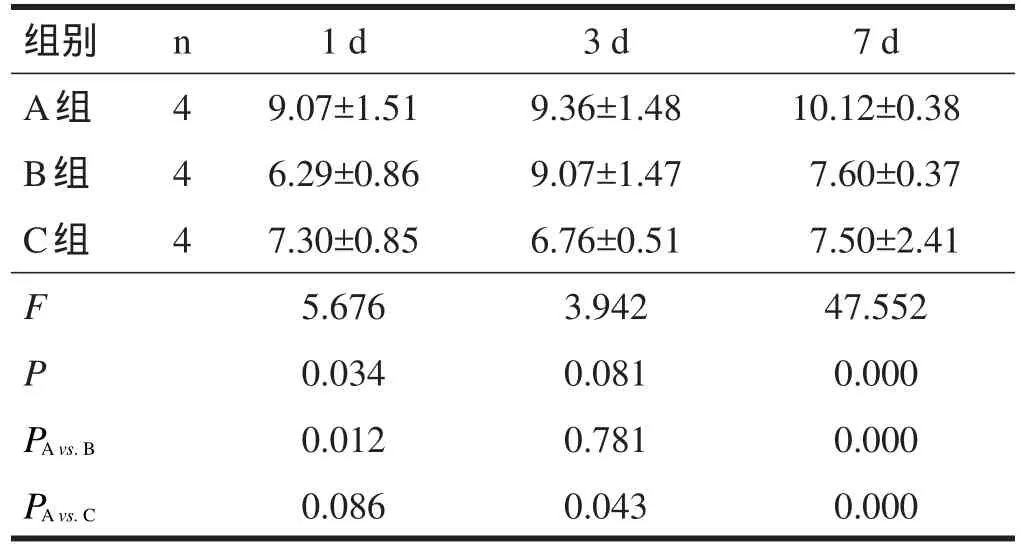
表4 脊髓損傷大鼠MDA含量測定結果(nmol/ml)
3 討論
番茄紅素是一種開鏈式不飽和類胡蘿卜素,主要存在于番茄、西瓜、葡萄、柚、木瓜、石榴、秋橄欖等植物中,動物機體自身不能合成,只能從食物中攝取。作為一種功能性色素,番茄紅素具有多種生物學效應,其中抗氧化作用受到廣泛關注。
研究表明,番茄紅素的抗氧化性能是天然類胡蘿卜素中最強的,抗氧化能力是β-胡蘿卜素的2倍,維生素E的100倍[10]。動物實驗表明,番茄紅素能提高大鼠超氧化物歧化酶、過氧化氫酶、谷胱苷肽過氧化物酶以及谷胱苷肽還原酶的活性,從而提高其抗氧化能力,降低對毒物的敏感性[11]。有報道顯示,番茄紅素通過其高效猝滅單線氧態和清除自由基的能力,抑制活性氧(ROS)的產生,有效地減少顆粒物對細胞DNA的損傷[12]。Rao等發現食用番茄紅素2周后可顯著降低體內蛋白、脂類和脂蛋白的氧化損傷[6]。Porrini等的實驗表明,在給一組成年女性補充番茄紅素后,淋巴細胞抗氧化應激效應能力顯著增強[13]。因此多食用富含番茄紅素的食品對保持人體健康很有益處。
國內外學者研究發現,番茄紅素還可以對抗大鼠缺血再灌注腦組織損傷、動脈粥樣硬化、大鼠急性肺損傷、H2O2誘導的成骨細胞損傷、小鼠肝纖維化、癌細胞增殖等。這些都與番茄紅素的抗氧化和清除自由基的能力有關。綜上所述,番茄紅素可以通過其高效猝滅單線氧態和清除自由基的能力,抑制活性氧的產生,清除自由基,減少脂質的過氧化,減輕細胞的氧化程度來直接保護細胞。
眾所周知,脊髓損傷后的治療仍為世界醫學界的難題。近年來,國內外學者對脊髓損傷的損傷機制進行了廣泛的探討和研究,認識到脊髓損傷在原發損傷的基礎上發展一系列的進行性病理改變,而這種繼發性的病理改變將加重脊髓損傷,甚至造成脊髓的不可逆傷害[14]。大量研究顯示,脊髓損傷后氧化應激反應是引起脊髓組織繼發性損傷的主要因素之一[15]。因為脊髓損傷后產生并釋放大量的氧自由基[16],而脊髓神經元細胞膜結構中含有豐富的脂質,所產生的氧自由基性質極不穩定,能攻擊生物膜中的多不飽和脂肪酸,引發脂質過氧化反應,破壞膜結構的通透性與完整性,導致細胞變性壞死。SOD是細胞內主要的抗氧化酶和自由基清除劑,能保護細胞對抗氧自由基的侵害,其水平的高低,反映出內源性氧自由基清除系統功能的強弱[17]。MDA是脂質過氧化的最終產物,測定MDA含量可直接反映體內氧自由基生成水平,其含量高低是組織細胞損傷的重要標志[18]。因此,通過MDA含量和SOD活性的測定可以間接反映體內抗氧化應激效應的能力。
本研究結果顯示,番茄紅素能顯著提高脊髓損傷模型血清中SOD水平,抑制MDA產生,有效對抗氧自由基介導脂質過氧化反應,減輕脊髓損傷后自由基對脊髓血管及神經細胞等的繼發損傷,發揮其對脊髓損傷保護和治療作用,從而有效促進脊髓損傷大鼠運動功能的恢復。本實驗為番茄紅素臨床應用提供了理論基礎,但它對脊髓損傷的治療效果是否呈劑量依賴尚不清楚。有報道顯示,在高濃度下,番茄紅素清除自由基的能力喪失,推測是由高濃度時形成更多的番茄紅素過氧化基團以及番茄紅素自氧化速度加快造成[19]。因此,探索番茄紅素治療脊髓損傷的最佳劑量,還需更全面和深入的研究。
[1]邱有波,袁夢郎,楊拯,等.硫酸鎂聯合單唾液酸神經節苷脂對脊髓損傷大鼠運動功能恢復的影響[J].中國康復理論與實踐,2011,17(2):137-140.
[2]Tator CH,Fehlings MG.Review of the secondary injury theory of acute spinal cord trauma with emphasis on vascular mechanisms[J].J Neurosurg,1991,75(1):15-26.
[3]Young W.Secondary injury mechanisms in acute spinal cord injury[J].J Emerg Med,1993,11(Suppl 1):13-22.
[4]Engelhard K,Werner C,Eberspacher E,et al.Influence of propofol on neuronal damage and apoptotic factors after incomplete cerebral ischemia and reperfusion in rats:a long-term observation[J].Anesthesiology,2004,101(4):912-917.
[5]Rao AV,Agarwal S.Role of lycopene as antioxidant caroteniod in the prevention of chronic disease:a review[J].Nutrition Research,1999,19(2):305-323.
[6]Rao AV,Shen H.Effect of low dose lycopene intake on lycopene bioavailability and oxidative stress[J].Nutrition Research,2002,22(10):1125-1131.
[7]魏延,沈新南,麥嘉儀,等.番茄紅素對腦缺血再灌注大鼠活性氧及缺氧損傷的影響[J].中國預防醫學雜志,2010,44(1):34-38.
[8]Basso DM,Beattie MS,Bresnahan JC,et al.MASCIS evaluation of open field locomotor scores:effects of experience and team work on reliability.Multicenter Animal Spinal Cord Injury Study[J].J Neurotrauma,1996,13(7):343-359.
[9]Rivlin AS,Tator CH.Objective clinical assessment of motor function after experimental spinal cord injury in rat[J].J Neurosurg,1977,47:577-581.
[10]仲偉鑒.β-胡蘿卜素的癌癥化學預防機理研究進展[J].衛生研究,2002,31(5):398-401.
[11]Porrini M,Riso P,Bmsaniolino A,et al.Daily intake of a formulated tomato drink affects carotenoid plasma and lymphocyte concentrations and improves cellular antioxidant protection[J].Br J Nutr,2005,93(1):93-99.
[12]姜薇,趙曉紅,米生權,等.番茄紅素對大氣可吸人顆粒物致人肺成纖維細胞DNA損傷的保護作用[J].環境與職業醫學,2008,25(6):568-571.
[13]Porrini M,Riso P.Lymphocyte lycopene concentration and DNA protection from oxidative damage is increased in women after a short period of tomato consumption[J].J Nutr,2000,130(2):189-192.
[14]Dumont RJ,Okonkwo DO,Verma S,et al.Acute spinal cord injury,part I:pathophysiologic mechanisms[J].Clin Neuropharmacol,2001,24(5):254-264.
[15]Hall ED.Lipid antioxidants in acute central nervous system injury[J].Ann Emerg Med,1993,22(6):1022-1027.
[16]Hall ED.Inhibition of lipid peroxidation in CNS trauma[J].J Neurotrauma,1991,8(1):31-40.
[17]Afonso V,Champy R,Mitrovic D,et al.Reactive oxygen species and superoxide dismutases:role in joint diseases[J].Joint Bone Spine,2007,74(4):324-329.
[18]Kontos HA,Wei EP.Superoxide production in experimental brain injury[J].J Neurosurg,1986,64(5):803-807.
[19]Eichler O,Sies H,Stahl W.Divergent optimum levels of lycopene,beta-carotene and lutein protecting against UVB irradiation in human fibroblastst[J].Photochem Photobiol,2002,75(5):503-506.

