蜂蜇傷戰士血清相關蛋白分析
眭維國,李鳳艷,陳潔晶,歐明林,張 岳,林 華,薛 雯,戴 勇
近年來,被毒蜂蜇傷而導致傷亡的病例越來越多。據報道,在美國每年至少有50人因為昆蟲叮咬死亡,但實際死亡人數可能遠不止這個數。因為很多突然死亡的病例被誤認為是其他原因引起的[1]。蜂蜇傷多發生于山區,夏秋季較為常見。毒蜂尤其是黃蜂蜇傷可并發過敏性休克及多臟器功能性損害,表現為血管內溶血、橫紋肌溶解、急性腎功能衰竭、肝臟損害(肝功能異常甚至肝功能衰竭)、心臟損害(心肌炎、心律失常、心肌梗死)、彌散性血管內凝血(DIC)、神經系統損害(腦梗死、腦炎、神經病變、腦脊髓神經根炎等),其中以腎臟損害最常見,嚴重時常危及生命。黃蜂毒液為堿性,主要成分有組胺、血清毒、兒茶酚胺、黃蜂激肽素、磷脂酶A、磷脂酶B、透明質酸酶、蛋白酶、膽堿酯酶、蜂毒多肽、5-羥色胺[2-3]。
蜂蜇傷會導致過敏性反應,被蜂蜇傷發生過敏性反應的成年患者有3%立即死亡[4]。已有報道指出:蜂類體內的糖蛋白(如水解磷脂酶A2和透明質酸酶)就是蜂毒過敏原。但有關過敏反應的機制尚不明確。被蜂蜇傷患者機體有差異蛋白質表達,這些蛋白質能夠威脅患者生命。Dombrowski等[5]發現,一些可溶性的、與膜相關的血清蛋白組成了復雜的人類補體網絡系統,也與蜂蜇傷患者的過敏反應相關。蛋白質組學的研究已經被引入進了幾乎所有的生物醫藥研究領域。本實驗從蛋白組學角度出發,通過分析蜂蜇傷戰士與正常人之間存在的差異表達蛋白,尋找中毒者機體損傷機制中新的相關生物標記。
1 材料與方法
1.1 一般資料 蜂蜇傷組:血清樣本來源于解放軍181醫院于2008年10月—2010年2月收集的11例蜂蜇傷標本,其中男9例,女2例。年齡20~43(31.7±8.5)歲。正常對照組:8名正常人血清樣本來源于解放軍181醫院體檢中心。所有正常人無被蜂蜇傷病史,且均為蜂毒實驗反應陰性受試者。男6例,女2例。年齡20~50(39.6±9.6)歲。全部對象于早晨6∶00~8∶30空腹采集靜脈血。蜂蜇傷組和正常對照組的一般資料無統計學差異(P>0.05),具有可比性。
蜂蜇傷部位一般以頭部最為常見,其次是頸部和四肢。蜂毒進入血液后7例表現為過敏反應,嚴重者導致過敏性休克。4例由于就診不及時導致腎、肝等臟器不同程度并發癥的產生。最少的1例被蟄傷15處,多者達到100處。臨床診斷指標:尿素氮(BUN)201.18~466.66 mmol/L,尿酸(UN)54.00~ 110.02 μmol/L,血 肌 酐 (Cr)2.33~5.45 μmol/L。
1.2 試劑與儀器 ProteoSeekTMAlbumin/IgG Removal試劑盒、DTT、IAA、溴酚藍、考馬斯亮藍 R250染液、銀反應溶液、乙腈(ACN)。
Ettan IPGphor 3等電聚焦儀(GE Healthcare)、SE600垂直電泳儀(GE Healthcare)、2D Proexpress凝膠掃描系統(Perkin Elmer)、Image Master 2D 5.0凝膠分析軟件(GE Healthcare)。
1.3 方法
1.3.1 血清中總蛋白質的抽提:靜脈血置于室溫下30 min后,3000 r/min離心 15 min。根據 Proteo-SeekTMAlbumin/IgG Removal試劑盒說明進行高豐度蛋白的去除。蛋白質濃度的定量使用Bradford蛋白測定法,-80℃保存。
1.3.2 蛋白質濃度定量-Bradford法:臨用前將5×Bradford用超純水稀釋為1×Bradford,并用0.45 μm濾膜過濾避光待用。用超純水30倍稀釋樣品,并以樣品稀釋倍數稀釋溶解緩沖液,用2.76 mg/ml BSA稀釋液配制為 0.1、0.2、0.3、0.4、0.5 mg/ml溶液。取稀釋后樣品、標準蛋白溶液、超純水各10 μl于96孔板,加190 μl 1×Bradford試劑混勻,振蕩5 min,用酶標儀于波長為595 nm處測定吸光度值。以BSA濃度為橫坐標,吸光度值為縱坐標作標準曲線,查得稀釋后樣品濃度,乘以樣品稀釋倍數即得樣品蛋白濃度。
1.3.3 二維聚丙烯酰胺凝膠電泳
1.3.3.1 固相pH梯度等電聚焦:分析型凝膠取相當于90 μg(銀染)或500 μg(考染)蛋白的細胞裂解液上清,加入水化液至總體積250 μl,混勻后均勻分布在主動水化的膠條槽內。取出膠條,剝去保護膜,將膠面朝下,按酸性端靠近膠條槽正極方向覆蓋在樣品上,避免產生氣泡。在膠條上方從兩端添加1.5 ml礦物油,蓋上膠條槽蓋,水平放置在等電聚焦儀Ettan IPGphor 3上。實驗選擇pH梯度4~9的13 cm固化pH梯度條進行雙向凝膠電泳(2-DE)。恒溫20℃按如下條件自動進行主動水化和等電聚焦:Step30 V ×12 h,Step100 V ×2 h,Step200 V ×1 h,Step500 V ×1 h,Grd1000 V ×1 h,Grd 3000 V ×1 h,Grd 8000 V ×3 h,Step 8000 V 至總伏小時數(Vh)達到分析型為45 KVh,制備型凝膠65 KVh時聚焦結束。
1.3.3.2 還原和烷基化:取出膠條,用少許超純水清洗膠條背面的礦物油并吸干殘余水分,膠條在含1%DTT(w/v)的平衡液中搖床水平振蕩平衡15 min,并用少許超純水潤洗1次,吸干殘余水分,置于2.5%IAA(w/v)平衡液中搖床水平振蕩平衡15 min,平衡液體積均為10 ml。
1.3.3.3 十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE):平衡結束后移至12.5%的SDS-PAGE上端,進行第二向垂直平板SDS-PAGE(SE600)。電泳條件:溫度15℃,恒功率1 w/膠,電泳30 min,然后調至11 w/膠電泳至溴酚藍移動至膠下緣約5 mm處停止。
1.3.4 染色
1.3.4.1 銀染(分析型凝膠):室溫下,搖床上進行,固定液固定30 min后棄去固定液,加入敏化液,敏化30 min后用超純水沖洗3次,每次10 min。加入銀反應溶液,反應20 min,加入終止液,終止10 min。
1.3.4.2 考染(制備型凝膠):室溫下,搖床上進行,用考馬斯亮藍R250染液染色4 h;將凝膠轉入脫色液中,平緩搖動4~8 h,其間更換脫色液3~4次。直至凝膠背景合適,蛋白質點鮮明為止。
1.3.5 SDS-PAGE凝膠掃描及圖像分析:染色后的SDS-PAGE凝膠均用2D Proexpress凝膠掃描系統進行掃描。Image Master 2D Platinum 5.0分析軟件對圖像進行強度校正、點檢測、背景消減、匹配、量化。蛋白點檢測參數設置為:平滑值:4,顯著值:2.5,最小面積:50。在分析型凝膠上通過比較找出對照組與處理組之間產生2.0倍以上差異表達的蛋白質點,并在制備型凝膠圖像上同步標注。
1.3.6 基質輔助激光解析電離飛行時間質譜(MALDI-TOF-MS)鑒定:將200 μl槍頭約1 cm 處剪斷,將所需蛋白點用已剪斷的槍頭切點后進行水洗、平衡、脫色、再平衡處理離心去液體后加100 μl DTT于56℃震蕩60 min,冷卻棄去上層液體。100 μl 55 mM IAA于暗處室溫震蕩30 min,棄上清。加100 μl ACN于通風柜中靜置10 min膠粒變成細小白色,除上清,干燥2~5 min。最后在抽真空狀態下進行胰蛋白酶消化實驗[6]后進行點樣,進行MALDITOF-MS分析。
1.3.7 數據庫檢索:將進行MALDI-TOF-MS實驗后所得到的數據結合Image Master 2D 5.0軟件分析的圖譜找到表達不同的蛋白點并將其分類,通過SWISS-PROT和NCBInr數據庫查找差異表達蛋白質并進行功能分析[7]。
2 結果
2.1 2DE結果 通過2-DE實驗和銀染以及考染后得到兩組血清雙向凝膠電泳圖,見圖1。使用Image Master 2D 5.0圖像分析軟件在蜂蜇傷組血清中檢測出(312±18)個蛋白質點,在正常對照組中檢測出(256±20)個蛋白質點。從圖中可知在蜂蜇傷組中新增5個蛋白點,3個蛋白點上調,7個蛋白點下調。
2.2 MALDI-TOF-MS蛋白驗證結果 分析得到17種差異表達蛋白的名稱。蜂蜇傷組新增5個蛋白點,具體見表1。3個上調蛋白點見表2。7個下調蛋白點見表3。8個蛋白點無法進行鑒定可能由于銀染或者誤差引起。從數據庫中查得蛋白的PI與2-DE實驗的范圍相同,證明實驗的準確性。其中有一些相同蛋白由于他們酸堿性的改變導致相同蛋白質的PI和分子量不同從而分布在不同位置上,例如圖中的蛋白點14、15、16。這些蛋白廣泛分布在蜂蜇傷組血清中,并且存在不同程度的表達,其生物學功能(見表1~3)包括與抗原結合、激活肽酶、與細胞骨架蛋白質結合、激活跨膜轉運蛋白、細胞骨架結構成分的組成等,其對蜂毒研究發揮重要的作用。

圖1 正常對照組(A)和蜂蜇傷組(B)血清雙向凝膠電泳圖(IEF pH 4~9)等電聚焦PH方向為由圖頂部自上而下
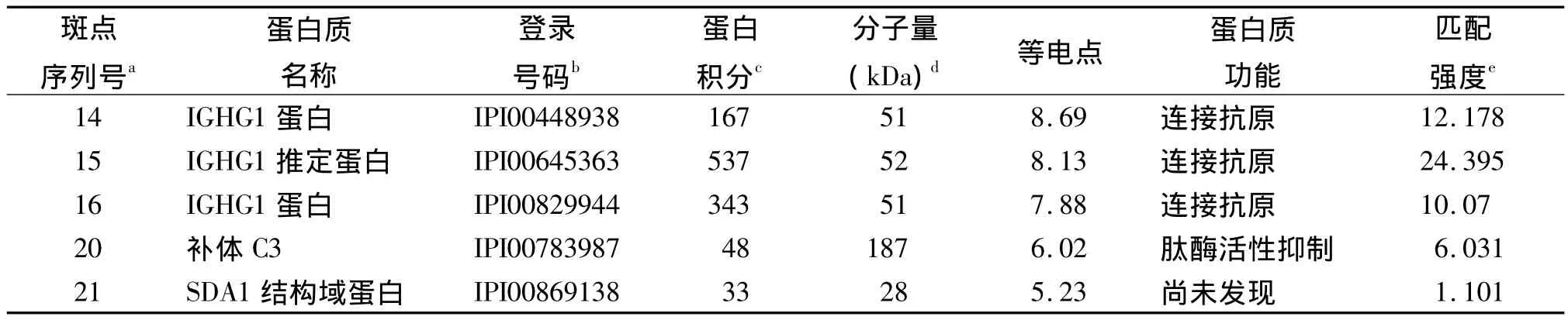
表1 通過MALDI-TOF MS和MS/MS聯合分析確定蜂蜇傷組出現的新蛋白點

表2 通過MALDI-TOF MS和MS/MS聯合分析確定蜂蜇傷組表達上調的蛋白點
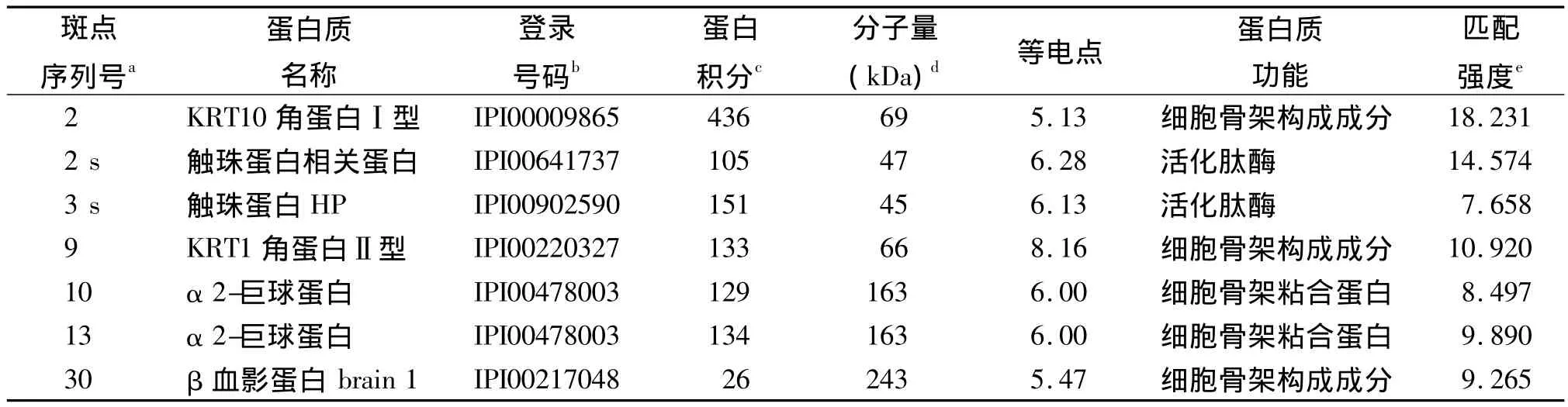
表3 通過MALDI-TOF MS和MS/MS聯合分析確定蜂蜇傷組表達下調的蛋白點
3 討論
蜂蜇傷多發生于夏季,由于此季節經常外出活動容易遭到蜂類襲擊,蜂毒進入血液之后產生過敏性反應,嚴重者可導致身體臟器受損,進而發生多臟器功能障礙綜合征(MODS)甚至導致死亡。另外,根據不同的蜇傷部位和個體免疫能力會產生不同癥狀,有人產生嚴重的過敏性反應但有些人卻不會[8]。有報道表明,蜂蜇傷后2 s內將其毒刺拔出其中毒程度明顯下降,同時應立即就醫,從而減輕惡化程度。
蜂毒所含毒素主要成分是生物胺類、激肽類和酶類。生物胺類如組胺、5-羥色胺及乙酰膽堿是引起局部疼痛的主要物質,酶類如磷酸酶和透明質酸酶等可引起變態反應;肽類如神經毒素對周圍神經及中樞神經有毒性作用,特別是含有21個氨基酸組成的肽類[9]。可引起溶血、橫紋肌溶解及凝血功能障礙。破裂紅細胞碎片及肌溶蛋白對腎小管阻塞和毒性作用可致腎小管壞死、急性腎衰竭。重度蜂蜇傷后容易發生MODS,發生的順序以腎臟及血液系統出現最早,其次為消化道、循環系統、肝臟、呼吸系統、神經系統,受累臟器越多,死亡概率越大[10]。腎臟及血液系統均早期受累,器官功能衰竭也最嚴重。有研究表明隨蜂蜇傷中毒程度的加重,血清細胞因子水平升高[11-12]。它們作為細胞因子網絡中的調節因子可調控體內多種炎性細胞因子的產生和活性,協同參與了蜂蜇傷中毒的發生、發展過程并影響預后。及時采取有效措施清除血中蜂毒毒素及急性腎功能衰竭后潴留的代謝毒素。降低炎癥細胞因子水平,減輕過于強烈、持久的全身性炎癥反應造成的器官損傷才是搶救重度毒蜂蜇傷患者的關鍵。
本實驗利用2-DE與MALDI-TOF-MS技術對我院2年來11例蜂蜇傷患者的血清中蛋白進行鑒定。2-DE技術可以將組織和血清樣本中的蛋白準確并有效的分離檢測出來[13]。通過數據庫查找得到在蜂蜇傷患者中有5種新增蛋白,IGHG1蛋白,SDA1蛋白域,C3補體;3個上調蛋白點為IGKC蛋白,甲狀腺素轉運蛋白;7個下調蛋白點為KRT10角蛋白Ⅰ型、觸珠蛋白相關蛋白、觸珠蛋白HP、HPR蛋白、Ⅱ型角蛋白KRT1、α2-巨球蛋白、β血影蛋白brain 1。從SWISS-PROT和NCBI數據庫中可知5種新增蛋白具有與抗原結合和抑制肽酶激活的作用,由表1可知IGHG1蛋白存在于不同的蛋白點中同時由于酸堿性的改變出現不同的PI和分子量的不同。3個上調的蛋白點所表達的功能與新增蛋白點有著相似的功能并且產生著重要的作用。其中甲狀腺素轉運蛋白(TTR)會影響人的神經系統[14]。TTR被認為是疾病特異性肽,其內源性高表達蛋白的片段與疾病發生相關聯[15]。實驗發現產生細胞骨架功能的蛋白KRT1角蛋白II型、α2-巨球蛋白、β血影蛋白brain 1產生明顯的下調。Webb等[16]曾報道α2-巨球蛋白與蜂蜇傷患者中毒相關聯,但是SDA1蛋白域的生物學功能還不能確定,故還需進一步研究。
[1] Kalogeromitros D,Makris M,Koti I,et al.A simple 3-day"rush"venom immunotherapy protocol:documentation of safety[J].Allergol Immunopathol(Madr),2010,38(2):69-73.
[2] Toro K,Borka K,Kardos M,et al.Expression and Function of C5a Receptor in a Fatal Anaphylaxis After Honey Bee Sting[J].J Forensic Sci,2011,56(2):526-528.
[3] Dai Y,Hu C,Wang L,et al.Serum peptidome patterns of human systemic lupus erythematosus based on magnetic bead separation and MALDI-TOF mass spectrometry analysis[J].Scand J Rheumatol,2010,39(3):240-246.
[4] Golden D B.Insect sting anaphylaxis[J].Immunol Allergy Clin North Am,2007,27(2):261-272.
[5] Dombrowski Y,Peric M,Koglin S,et al.Honey bee(Apis mellifera)venom induces AIM2 inflammasome activation in human keratinocytes[J].Allergy,2012,67(11):1400-1407.
[6] Collet B,Guitton N,Sa?kali S,et al.Differential analysis of glioblastoma multiforme proteome by a 2D-DIGE approach[J].Proteome Sci,2011,9(1):16.
[7] Dai Y,Hu C,Huang Y,et al.A proteomic study of peripheral blood mononuclear cells in systemic lupus erythematosus[J].Lupus,2008,17(9):799-804.
[8] Karakis G P,Sin B,Tutkak H,et al.Genetic aspect of venom allergy:association with HLA classⅠand classⅡ antigens[J].Ann Agric Environ Med,2010,17(1):119-123.
[9] Müller U R.Hymenoptera venom proteins and peptides for diagnosis and treatment of venom allergic patients[J].Inflamm Allergy Drug Targets,2011,10(5):420-428.
[10] Rudders S A,Banerji A,Katzman D P,et al.Multiple epinephrine doses for stinging insect hypersensitivity reactions treated in the emergency department[J].Ann Allergy Asthma Immunol,2010,105(1):85-93.
[11] Nandi M,Sarkar S.Acute kidney injury following multiple wasp stings[J].Pediatr Nephrol,2012,27(12):2315-2317.
[12] Przybilla B,Ru?ff F.Insect stings:clinical features and management[J].Dtsch Arztebl Int,2012,109(13):238-248.
[13] Issaq H,Veenstra T.Two-dimensional polyacrylamide gel eletroforesis(2D-PAGE):advances and perspectives[J].Biotechniques,2008,44(5):697-698.
[14] Fleming C E,Nunes A F,Sousa M M.Transthyretin:more than meets the eye[J].Prog Neurobiol,2009,89(3):266-276.
[15] Santos L D,Pieroni M,Menegasso A,et al.A new scenario of bioprospecting of Hymenoptera venoms through proteomic approach[J].J Venom Anim Toxins Incl Trop Dis,2011,17(4):364-377.
[16] Webb D J,Gonias S L.A modified human alpha 2-macroglobulin derivative that binds tumor necrosis factor-alpha and interleukin-1 beta with high affinity in vitro and reverses lipopolysaccharide toxicity in vivo in mice[J].Lab Invest,1998,78(8):939-948.

