淺析弱酸弱堿鹽水解的程度和結果
盛 榮
(揚州市江都區育才中學 江蘇 揚州 225200)
弱酸弱堿鹽中陰、陽離子的水解反應可以相互促進,其中某些鹽的水解反應可以完全進行生成相應的難溶或易揮發的弱酸和弱堿,這樣的過程也就是通常所說的雙水解[1]。對于雙水解反應的定義教科書中并未明確給出,多數參考書中強調能完全進行的才可稱為雙水解,如按此定義,就需要先確定水解程度的大小,而這通常是根據有無該鹽的溶液存在加以判斷,將Al3+與HCO3-之類混合后即可發生劇烈反應的離子歸入雙水解反應是毫無異議的,但對于在水溶液中不能表現出明顯現象的離子間的水解情況則是眾說不一,學生經常對(NH4)2CO3之類熟悉的弱酸弱堿鹽究竟有無發生雙水解感到困惑。此疑問其實是將水解進行的程度和水解后的結果等同看待造成的,以下對幾種弱酸弱堿鹽的水解做近似計算以分析其區別。
一、醋酸銨的水解
1.CH3COONH4的水解常數Kh
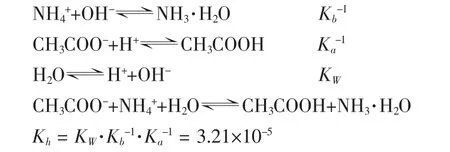
由以上數據可見,醋酸銨的水解常數Kh不大,其水解趨勢很弱,但仍然比CH3COO-和NH4+的水解常數大5個數量級(NH4++H2O?NH3·H2O+H+的 Kh= KW·Kb-1=5.65×10-10、CH3COO-+H2O?CH3COOH + OH-的 Kh=KW·Ka-1= 5.68×10-10), 說明 CH3COO-和 NH4+的水解相互促進[2]。
2.CH3COONH4的水解程度和結果
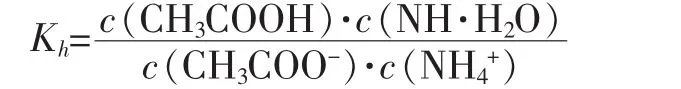
因為Kb與Ka相近,所以

可得醋酸銨的水解度:
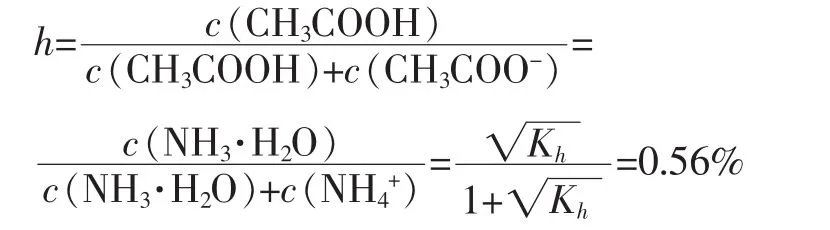
如此小的水解度對其溶液存在有何影響呢?以其飽和溶液計算:醋酸銨在水中的溶解度為148g(4℃),水解后 100g 水中約含 NH3·H2O、CH3COOH 各 0.011 mol,而常用濃氨水濃度為14.8 mol∕L,醋酸更是可與水互溶,不會有大量NH3、CH3COOH從溶液中逸出;而稀溶液中NH3·H2O、CH3COOH濃度更小,更不易逸出。因此醋酸銨水溶液可較穩定存在,溶質仍主要保持NH4+和CH3COO-形式。
二、Al3+與 HCO3-的水解
1.水解程度

因Kh很大,該反應可較徹底進行。由多次方程直接求解h不易,以下反向驗算水解結果。設a mol的Al3+與3amol的HCO3-在1L溶液中充分反應,由于有CO2逸出,反應后得H2CO3(CO2)的飽和溶液,25℃時其總濃度約為0.04 mol∕L,再設生成 Al(OH)3為 x mol∕L,則有:
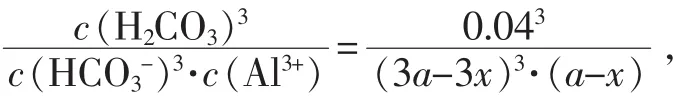
2.機理討論
有文章對Al3+與HCO3-溶液混合時的反應機理做了分析,意圖辨別雙水解反應是按下列哪條途徑進行:①先由 H2O 電離為 H+和 OH-, 再分別由 Al3+和 OH-、HCO3-和H+結合促進水電離而使反應完全;②先由Al3+和HCO3-分別水解生成 H+和 OH-, 再由 H+和 OH-結合而促進反應完全[3]。筆者以為僅從這幾個反應的平衡常數判斷反應的機理并不適當,因為平衡常數是熱力學中用以說明反應程度的物理量;而反應機理的研究則是動力學領域,需要分析反應級數、中間產物、基元反應等內容,僅由平衡常數不足以得出結論。實際上溶液中離子間的結合一般為快速反應,不同的反應機理難以在直接可見的現象上反映出來;而從熱力學角度分析上述三式的加和與 Al3++3H2O?Al (OH)3+3H+、3HCO3-+3H2O?3H2CO3+3OH-、3H++3OH-?3H2O三式的加和是等價的,這些方程式只表示始、終態之間物質的轉變,不能表示反應機理。筆者以為中學階段認識到H+和OH-、Al3+和OH-、HCO3-和 H+相互結合而促進反應完全即可[4],無需也無法辨明微觀反應機理。
三、NH4HCO3的水解
NH4++HCO3-+H2O?NH3·H2O+H2CO3的 Kh=1.31×10-3,h = 3.5%
(HCO3-的水解常數比 NH4+大 40 倍左右, 即 HCO3-的水解程度更大一些,不過它們均比雙水解反應的Kh小得多,本文忽略此區別做近似計算,下同。)
15℃時 NH4HCO3飽和溶液濃度約為 2.17 mol∕L,水解后 H2CO3(CO2)濃度為 0.076mol∕L,與其飽和溶液濃度接近,穩定性很差,可有CO2逸出(NH3溶解度大于CO2,但因有刺激性氣味更易被感知)而使溶液組成改變,此結果與NH4HCO3飽和溶液在15℃以上液相與固相組成不一的資料記載相符[5]。如溫度升高,氣體溶解度減小而逸出,NH4HCO3也就發生了分解。
四、(NH4)2CO3的水解
NH4++CO32-+H2O?NH3·H2O+HCO3-的 Kh= 10.1,設(NH4)2CO3濃度為 a mol∕L,水解后溶液中 NH3·H2O濃度為x mol∕L,則有:
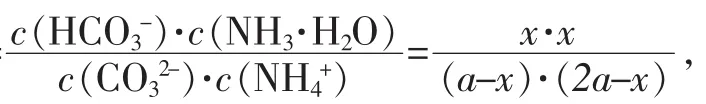
再進行二次水解:NH4++HCO3-+H2O?NH3·H2O+H2CO3,設水解后溶液中 H2CO3(CO2)濃度為 y mol∕L,則有:
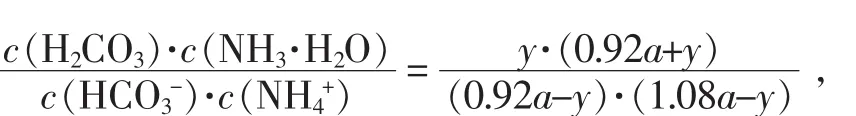
五、結論
1.由于弱酸根離子與弱堿陽離子水解的相互促進,弱酸弱堿鹽的水解程度大幅增加。
2.不同弱酸弱堿鹽的水解程度大小不一。一般來講Al3+、Fe3+等的弱酸鹽由于對應氫氧化物Ksp極小而近于完全水解,碳酸鹽、硫化物等也由于 HCO3-、HS-的 Ka很小而水解程度較高。(由于Kh的確定需要具體數據,h大于多少才認為是反應完全也無明確標準,筆者更傾向將弱酸陰離子和弱堿陽離子之間相互促進的水解都稱為雙水解,而不一定強調反應完全。)
3.水解結果(水解后是否有該鹽的溶液存在)由水解程度大小和水解產物有無脫離溶液兩方面共同決定。一般來說有Ksp極小的沉淀生成的弱酸弱堿鹽不能存在于水溶液中(如硫化鋁、碳酸鐵、硅酸銨等);但如果水解產物未脫離溶液,即使水解程度較高也還是有溶液存在(如碳酸銨、硫化銨等),但構成固體的離子不能在溶液中大量存在,即溶液中的溶質不同于固體組成;對于碳酸氫銨、碳酸氫鎂之類水解程度不太高但產物易脫離溶液的則要依據具體的溫度、濃度分別判斷。
[1] 陸軍.關于雙水解反應的研究性學習報告——基于《化學反應原理》模塊的知識[J].中學化學教學參考,2010,(3):29-30
[2] 北京師范大學無機化學教研室等.無機化學 (上冊)[M].第三版.北京:高等教育出版社,1992:99-107
[3] 張德山,蔣盛邦.對碳酸鈉和氯化鋁在溶液中反應是“雙水解”的商榷[J].化學教育,1989,(2):46-48
[4] 陸燕海,林肅浩.給泡沫滅火器加注幾則教學參考[J].化學教學,2010,(9):74-76
[5] 劉芳,王淑娟,張曦等.碳酸氫銨溶液解吸二氧化碳研究[J].環境科學學報,2009,29 (9):1886-1890

