杜氏鹽藻基因FLA8原核表達載體的構建和表達*
侯永杰,李慶華,薛樂勛
鄭州大學生物工程系細胞生物學研究室 鄭州 450001
驅動蛋白是一種具有保守馬達結構域的蛋白,實驗[1]證實驅動蛋白的作用是結合在微管和鞭毛上,參與小囊泡和細胞器的轉運[2]、紡錘體的形成和延伸[3]、染色體的分離和微管的形成[4-5]等。在驅動蛋白家族中,驅動蛋白2是惟一由異源動力亞基組成的復合物,其由兩個動力亞基(FLA8,FLA10)和一個非動力亞基(KAP)組成。FLA8作為藻類驅動蛋白2中的一個動力亞基,具有正末端指向性,牽引完成鞭毛內的正向運輸[6]。而鞭毛作為細胞表面上特殊功能的細胞器通過組裝和解聚來保持鞭毛的動態平衡。研究[7]表明,鞭毛功能異常常伴隨人類疾病的發生,如組織的左右不對稱、多囊腎和多指/多趾等。因此,研究驅動蛋白家族中的FLA8基因能夠更清楚地闡述鞭毛組裝的異常與人類疾病的相關性。作者構建了杜氏鹽藻基因FLA8的原核表達載體,并對誘導其表達的條件進行了探索。
1 材料與方法
1.1主要試劑及儀器杜氏鹽藻藻株為UTEX-LB-1644,購自美國德州大學;表達載體pET28a(+)、工程菌DH5α和DE3為鄭州大學生物工程系細胞生物學研究室保存,HRP-山羊抗兔IgG購自北京中杉金橋生物技術服務有限公司。載體pMD-T購自北京天根生物技術公司;LA Taq DNA聚合酶、限制性內切酶NdeⅠ和Hind Ⅲ、T4 DNA連接酶購自TaKaRa公司;X-Gal和IPTG購自上海生工生物工程技術服務有限公司;凝膠回收試劑盒和質粒DNA小提試劑盒購自Axygen公司。電泳儀(北京六一實驗儀器廠),PCR儀(Biometra公司),凝膠成像儀(Synoptics公司)。
1.2杜氏鹽藻FLA8基因的擴增根據已知的杜氏鹽藻FLA8 cDNA序列設計合成引物。上游引物序列:5’-GGAATTCCATATGATGAGCAGCGGAGC CAATCC-3’;下游引物序列:5’-CCCAAGCTTTCAT GCAGGCTTAGAAGAC-3’;上、下游引物近5’端分別為添加NdeⅠ和Hind Ⅲ酶切位點。PCR反應體系:LA Taq酶0.5 μL,上、下游引物(100 μmol/L)各0.5 μL,dNTP(10 nmol/L)4 μL,10×LA Buffer 5 μL,模板cDNA 1 μL,加ddH2O至48.5 μL。反應條件:95 ℃預變性3 min;94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸50 s,30個循環;72 ℃延伸10 min,4 ℃終止反應。PCR反應結束后,10 g/L的瓊脂糖凝膠電泳檢測擴增結果。
1.3目的基因與pMD-T的連接和鑒定大量擴增的PCR產物經過凝膠電泳分離后,依照凝膠回收試劑盒說明對目的基因片段進行凝膠回收,然后將目的基因與帶有T末端的pMD-T載體進行連接。轉化到大腸桿菌感受態細胞DH5α中,通過含有X-Gal和IPTG 的Amp+抗性的LB平板進行藍白斑篩選。挑取白色的單克隆擴大培養后提取質粒進行雙酶切鑒定,將鑒定正確的命名為pMD-T-FLA8并送華大基因生物公司測序。將測序結果用DNAMAN軟件與GenBank上登錄的基因對比。
1.4pET28-FLA8載體的構建和鑒定用限制性內切酶NdeⅠ和Hind Ⅲ切割空載體pET28a(+)和克隆載體pMD-T-FLA8,經過10 g/L瓊脂糖凝膠電泳分離后,回收FLA8的基因片段和線性載體pET28a(+),用T4 DNA連接酶于16 ℃水浴中過夜連接。然后轉化到大腸桿菌感受態細胞DE3中,涂布在含有Kan+抗性的LB平板上,37 ℃過夜培養直到有單克隆出現。挑取單克隆擴大培養后提取質粒進行酶切鑒定,將鑒定正確的質粒送華大基因生物公司測序。
1.5目的基因的原核表達將轉化有pET28a-FLA8的大腸桿菌DE3在1 mmol/L IPTG下誘導,于37 ℃振蕩培養,取對數生長期的菌液離心,進行SDS-PAGE電泳,以確定目的基因是否表達。
1.6目的蛋白的可溶性檢測取誘導蛋白1.5 mL離心棄上清,用1×PBS緩沖液將沉淀洗滌2~3次,12 000 r/min離心1 min。用1×PBS緩沖液重懸菌體后超聲破碎離心,將上清轉移到另一潔凈的EP管中。將2×SDS-PAGE 蛋白質凝膠上樣緩沖液分別加入上清液及沉淀中,100 ℃沸水浴中煮沸 10 min 進行瓊脂糖凝膠電泳,觀察目的蛋白是以包涵體沉淀為主還是以可溶性上清為主。
1.7目的蛋白的Westernblot檢測含有目的基因的載體和空載體分別在大腸桿菌中表達,取菌破碎后進行SDS-PAGE電泳,將電泳條帶點轉移到NC膜上,TBST洗膜3次。加兔抗FLA8抗體(稀釋12 000 倍)過夜孵育,再用TBST洗膜3次,用110 000 的辣根過氧化物酶標記的山羊抗兔二抗與NC膜雜交,室溫振蕩孵育1 h,用TBST洗膜3次,ECL發光顯影成像。
2 結果
2.1杜氏鹽藻FLA8基因PCR擴增結果擴增后得到一條大小為2 355 bp的片段(圖1)。

圖1 PCR擴增結果
2.2克隆載體pMD-T-FLA8的鑒定pMD-T-FLA8雙酶切結果見圖2,提示與目的基因開放閱讀框和已知載體的大小基本一致。

圖2 pMD-T-FLA8載體酶切鑒定結果
2.3pET28-FLA8和鑒定雙酶切質粒得到2 300和5 000 bp的片段各1條(圖3),其大小與FLA8的開放閱讀框和線性表達載體pET28a(+)的大小相接近。
2.4目的基因的原核表達見圖4。
2.5目的蛋白的可溶性檢測結果目的蛋白主要以包涵體形式存在,見圖5。
2.6目的蛋白的Westernblot檢測結果Western blot結果顯示,在87 000可見一條特異較高的條帶(圖6)。
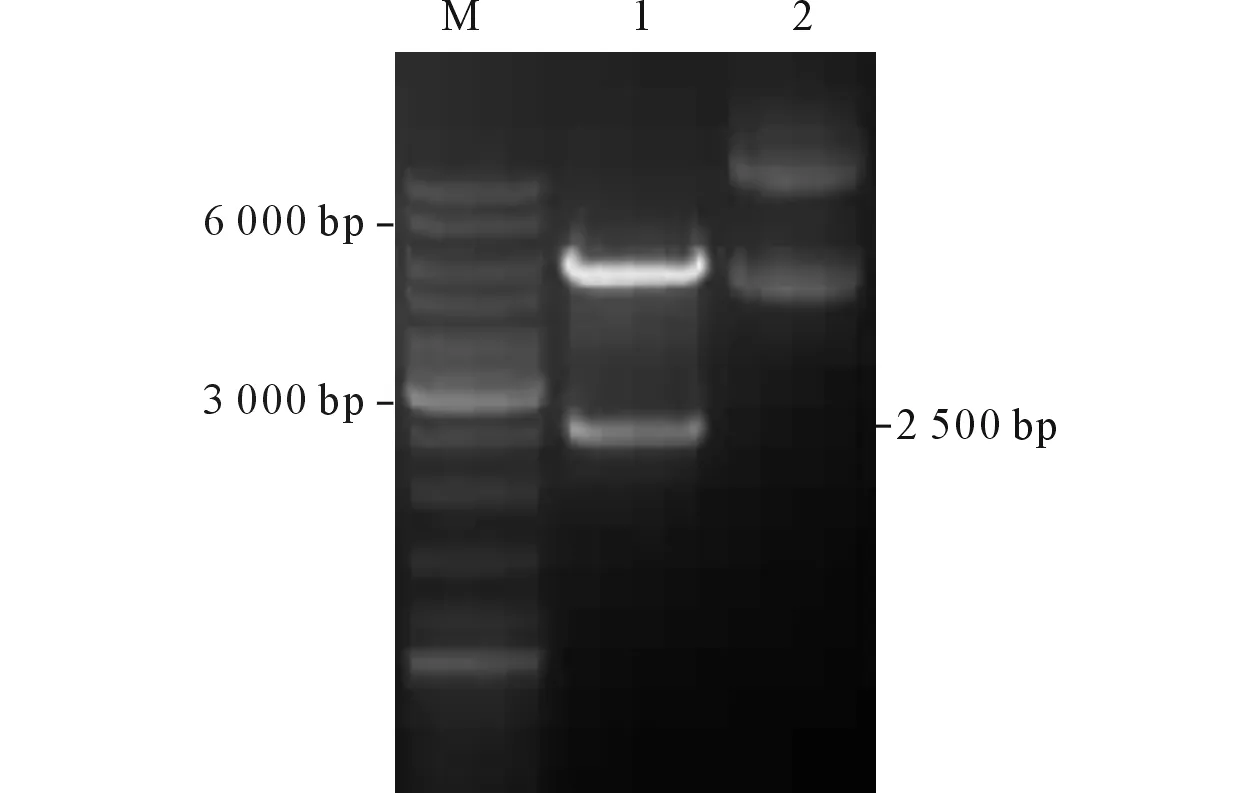
圖3 pET28-FLA8載體的雙酶切結果
M:Marker;1:pET28a(+)-FLA8雙酶切結果;2:pET28a(+)-FLA8質粒。
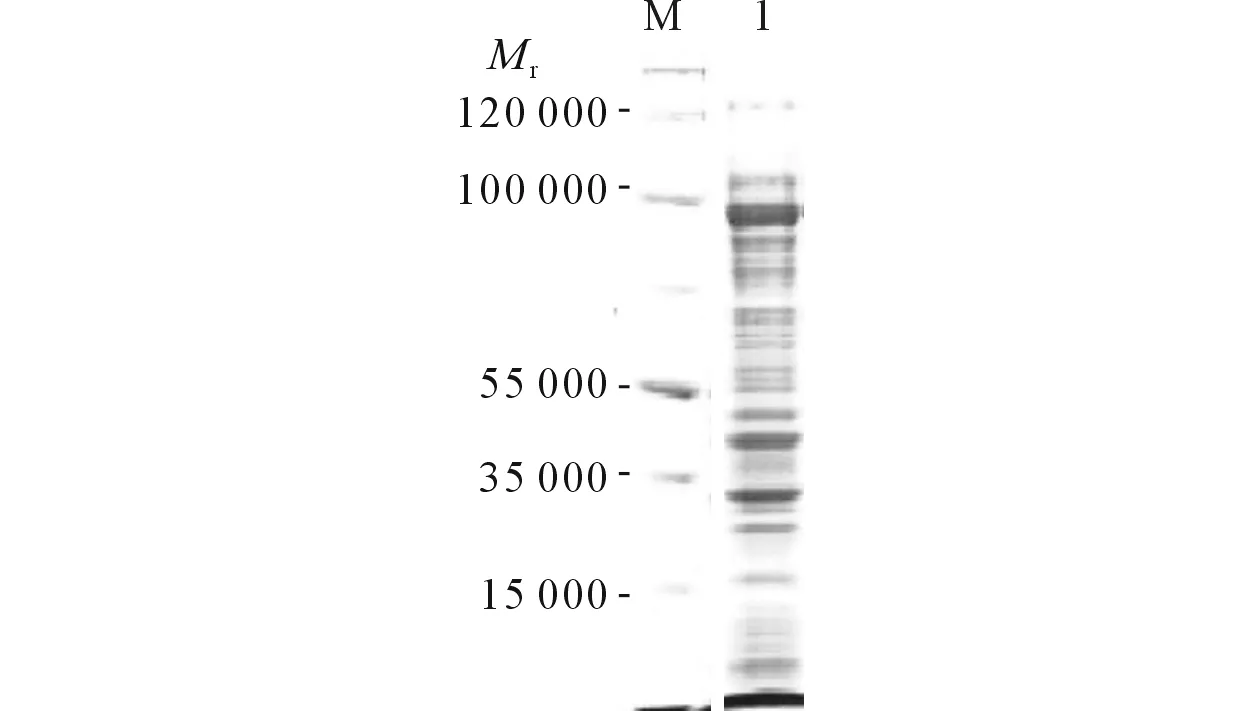
圖4 目的基因的原核表達
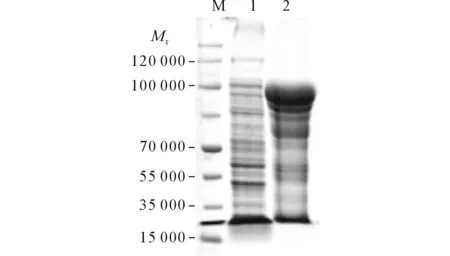
圖5 目的蛋白的可溶性檢測
M:蛋白Marker;1:菌體裂解后的包涵體沉淀;2菌體裂解后的上清。
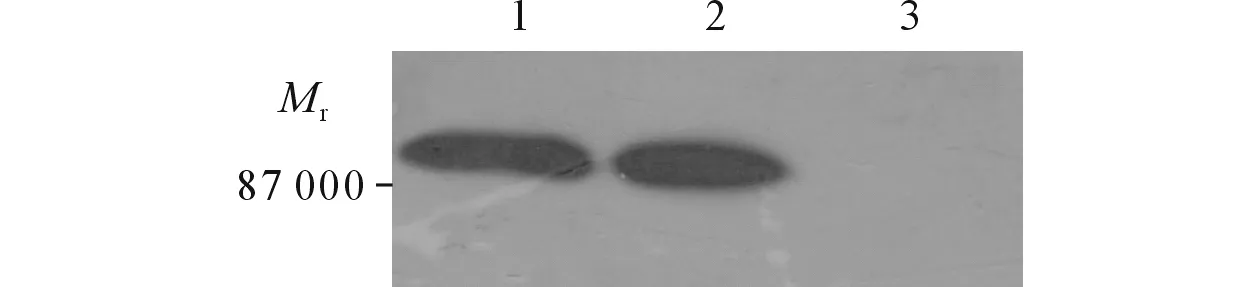
圖6 目的蛋白的Western blot檢測結果
3 討論
研究[8]證明了衣藻中的驅動蛋白2與鞭毛內運輸有關。鞭毛內運輸顆粒作為運輸體,能夠將鞭毛組裝所需“貨物”運輸到鞭毛組裝部位。鞭毛有動力蛋白和驅動蛋白兩個馬達蛋白。驅動蛋白能在ATP酶水解能量的驅動下,使“貨物”沿細胞骨架微管蛋白從基底部運送至鞭毛頂端,在鞭毛的正向端卸下“貨物”,用來組裝微管。另外,驅動蛋白還能參與細胞器或小囊泡的轉運、微管的形成、染色體的分離和紡錘體的形成和延伸等[9-12]。作為驅動蛋白2中的兩個動力亞基,FLA10的功能研究相對較多,但是對動力亞基FLA8的研究相對較少。因此,研究FLA8的功能可以更廣泛地了解驅動蛋白2在鞭毛內運輸中的功能,馬達蛋白的轉換以及鞭毛內運輸的機制。作者克隆了杜氏鹽藻的FLA8基因,將其連接到原核表達載體,并成功誘導其蛋白表達。以上結果有助于在基因和蛋白質水平研究杜氏鹽藻。
[1]Sawin KE,LeGuellec K,Philippe M,et al.Mitotic spindle organization by a plus-end-directed microtubule motor[J].Nature,1992,359(6395):540
[2]Barton NR,Goldstein LS.Going mobile:microtubule motors and chromosome segregation[J].Proc Natl Acad Sci USA,1996,93(5):1735
[3]Moore JD,Endow SA.Kinesin proteins:a phylum of motors for microtubule-based motility[J]Bioessays,1996,18(3):207
[4]Wein H,Foss M,Brady B.DSK1,a novel kinesin-related protein from the diaom Cylindrotheca fusiformis that is involved in anaphase spindle elongation[J].J Cell Biol,1996,133(3):595
[5]Raich WB,Moran AN,Rothman JH.Cytokinesis and midzone microtubule organization in Caenorhabditis elegans require the kinesin-like protein ZEM-4[J].Mol Biol Cell,1998,9(8):2037
[6]李俊平,劉岷,毛麗紅,等.杜氏鹽藻FLA8基因全長的克隆及鑒定[J].鄭州大學學報:醫學版,2011,46(6):828
[7]Eley L,Yates LM,Goodship JA.Cilia and disease[J].Curr Opin Genet Develop,2005,15(3):308
[8]Marande W,Kohl L.Flagellar kinesin in protests[J].Future Microbiol,2011,6(2):231
[9]Pazour GJ,Witman GB.The vertebrate primary cilium is a sensory organelle[J].Curr Opin Cell Biol,2003,15(1):105
[10]Rosenbaum JL,Witman GB.Intraflagellar transport[J].Nat Rev Mol Cell Biol,2002,3(11):813
[11]Scholey JM.Intraflagellar transport[J].Annu Rev Cell Dev Biol,2003,19:423
[12]Qin H,Diener DR,Geimer S,et al.Intraflagellar transport(IFT)cargo:IFT transports flagellar precursors to the tip and turnover products to the cell body[J].J Cell Biol,2004,164(2):255

