杜氏鹽藻糖原合成酶激酶3 cDNA片段的克隆及其在鞭毛再生中的功能*
毛麗紅,李慶華,韓 康,王瑞莉,龔方華,薛樂勛1,#
1)鄭州大學生物工程系細胞生物學研究室 鄭州 450001 2)鄭州大學第一附屬醫院細胞生物學研究室 鄭州 450052
糖原合成酶激酶3(glycogen synthase kinase 3,GSK3)是一種多功能的絲/蘇氨酸蛋白激酶,它可以抑制糖原合成酶的活性,導致胰島素抵抗,從而調節體內糖代謝水平[1]。GSK3還在Wnt信號通路中發揮重要作用,它通過與APC、Axin、CK1和β-catenin形成復合體,使β-catenin發生磷酸化,從而影響下游轉錄因子[2]。它還參與Hedgehog、Notch、mTOR等其他信號轉導途徑,并對各種細胞過程進行調控,包括細胞增殖、細胞凋亡、神經元功能及胚胎發育等[3-4]。鞭毛是廣泛存在于多種細胞表面、結構保守的細胞器,它在介導細胞運動、感知外界環境及胞內信號傳遞的過程中發揮重要作用。鞭毛的組裝是一個雙向的、動態的組裝過程,非常有利于鞭毛維持在合適的長度[5]。然而一旦這個過程發生異常,鞭毛出現缺陷或丟失,就有可能引發多種疾病,如多囊腎、癌癥等。因此研究鞭毛長度調控機制對了解這些疾病的發生具有重要的意義。目前已有研究[6]證明,采用GSK3的抑制劑LiCl能夠使衣藻鞭毛延長,表明衣藻中GSK3對鞭毛組裝和維持鞭毛長度具有一定的調控作用。杜氏鹽藻作為一種高度耐鹽的單細胞綠藻,具有一對等長的鞭毛,且易于觀察研究。該研究克隆杜氏鹽藻GSK3 cDNA序列,并通過實時熒光定量的方法初步探討杜氏鹽藻GSK3與鞭毛的關系。
1 材料與方法
1.1藻株與培養杜氏鹽藻UTEX LB-1644購自美國德克薩斯州大學,采用改良型液體培養基于26 ℃、4 500 Lux光照強度下在HPG光照培養箱中培養,光暗周期各為12 h。
1.2主要試劑限制性內切酶、3’RACE試劑盒、T4 DNA連接酶和pMD18-T載體均購自TaKaRa公司,逆轉錄試劑盒為Fermentas公司產品,實時熒光定量染料購自全式金公司。
1.3杜氏鹽藻GSK3cDNA片段的克隆與鑒定
1.3.1 總cDNA模板的制備 取對數生長期鹽藻細胞10 mL,1 000 r/min離心10 min收集細胞,培養基洗滌2遍后離心收集細胞于無RNase離心管中。Trizol裂解法提取鹽藻總RNA,用瓊脂糖凝膠電泳和分光光度計檢測所提RNA的質量和濃度。最后按逆轉錄試劑盒說明將RNA逆轉錄成cDNA模板。
1.3.2 GSK3基因片段的擴增 根據轉錄組測序得到的2個短片段分別設計上下游引物:上游 5’-TGG TGGATGGGGACCTCA-3’(18 bp),下游 5’-GCCGCC GAAGATGAGCTC-3’(18 bp)。PCR擴增兩片段間的序列,反應條件:94 ℃預變性3 min;94 ℃變性30 s,50~60 ℃退火30 s,72 ℃延伸1 min;反應30個循環后72 ℃延伸10 min,4 ℃終止反應。PCR產物經瓊脂糖凝膠電泳分離后膠回收,回收片段與pMD18-T載體16 ℃過夜連接。然后轉化E.coliDH5α進行藍白斑篩選,挑取陽性單克隆擴大培養并提取質粒,EcoRⅠ、HindⅢ雙酶切鑒定,取插入片段大小正確的單克隆菌液送測序,進一步進行鑒定。
1.3.3 3’RACE法擴增GSK3 3’端序列 根據已擴增的GSK3片段設計3’RACE上游引物:外側5’-CCTGGTGCTGGAGTTCGT-3’(18 bp),內側5’-ACTA
CACTGCTGCCATTGAT-3’(20 bp)。下游引物為3’RACE試劑盒自帶的引物:外側 5’-TACCGTCGTTC
CACTAGTGATTT-3’(23 bp)和內側 5’-CGCGGATCC TCCACTAGTGATTTCACTATAGG-3’(32 bp)。提取鹽藻總RNA,使用3’RACE 接頭引物進行逆轉錄制備模板,按試劑盒說明上的程序進行巢式PCR反應。PCR產物經瓊脂糖凝膠電泳、膠回收、連接及轉化后,提取質粒,EcoRⅠ、HindⅢ雙酶切鑒定正確的單克隆菌樣送測序。
1.3.4 利用抑制消減雜交模板擴增5’端序列 將Tester cDNA模板PCR 引物5’-AAGCAGTGGTATCA ACGCAGAGTAC-3’(25 bp)作為上游引物。根據已知片段設計的特異性引物:外側5’-ACTCTGCCACC ACGCAGC-3’(18 bp),內側5’-AGGAGCACGGTAG TAACG-3’(18 bp),作為下游引物。以Tester cDNA為模板,按常規反應體系和程序進行巢式PCR,所得片段連入載體后,經藍白斑篩選,質粒提取,EcoRⅠ、HindⅢ雙酶切鑒定,最后送測序。
1.3.5 GSK3 cDNA總長的驗證 根據拼接后cDNA片段兩端序列設計引物,PCR擴增得到GSK3 cDNA總長,回收后連入pMD18-T載體,質粒用BamHⅠ、HindⅢ酶切鑒定后送測序。
1.4實時熒光定量PCR法檢測GSK3在鞭毛再生中的變化采用pH休克法脫去杜氏鹽藻鞭毛[7],在去鞭毛后的300 min內,每隔30 min取一次鹽藻,將其收集于無RNase離心管中,加Trizol裂解提取RNA,逆轉錄為cDNA。設計引物:上游5’-GGGGCAAACAAGCAGACG-3’(18 bp),下游5’-CG GATGGTCCACCATCTT-3’(18 bp),以GAPDH作為內參,未脫鞭毛鹽藻作為對照,進行實時熒光定量PCR,導出數據計算2-ΔΔCt值進行定量分析,其中Ct為擴增產物達到設定閾值所經歷的循環數。
2 結果
2.1杜氏鹽藻GSK3cDNA片段結果分析
2.1.1 GSK3片段的擴增及鑒定 PCR擴增得到一段長為605 bp的序列(圖1A),大小與推測值相符。膠回收后與pMD18-T載體連接,轉化后提取的質粒進行雙酶切鑒定,結果見圖1B。
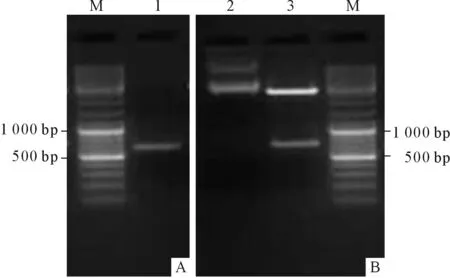
圖1 GSK3片段的擴增和鑒定結果
A:PCR結果;B:雙酶切鑒定結果;M:Marker;1:GSK3;2:pMD18-T-GSK3;3:pMD18-T和GSK3。
2.1.2 3’RACE和5’端cDNA序列擴增結果 3’RACE PCR擴增得到長為1 195 bp片段(圖2A),測序結果顯示含完整的polyA尾,回收片段與pMD18-T載體連接,質粒經雙酶切鑒定,結果見圖2B。5’端PCR擴增得到899 bp片段(圖3A),酶切鑒定結果見圖3B。
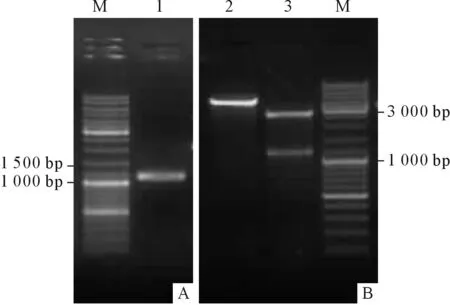
圖2 3’RACE擴增和鑒定結果
A:PCR結果;B:雙酶切鑒定結果;M:Marker;1:3’RACE PCR產物;2:pMD18-T-3’GSK3;3:pMD18-T和3’GSK3。

圖3 5’端cDNA擴增和鑒定結果
A:PCR結果;B:雙酶切鑒定結果;M:Marker;1:5’端PCR產物;2:pMD18-T-5’GSK3;3:pMD18-T和5’GSK3。
2.1.3 GSK3 cDNA總長序列分析結果 拼接后得到GSK3 cDNA總長為2 116 bp(圖4),其中包括737 bp的3’UTR和1 158 bp的開放閱讀框,編碼386個氨基酸。氨基酸序列經比對后與萊茵衣藻的同源性為86%。

圖4 GSK3 cDNA總長的擴增結果
2.2實時熒光定量PCR結果與未脫鞭毛組相比,在去鞭毛后的300 min內GSK3基因轉錄量明顯升高,并在120 min時達到最高水平(圖5)。

圖5 GSK3實時熒光定量PCR結果
3 討論
杜氏鹽藻是一種無細胞壁的單細胞真核綠藻,具有一對等長的鞭毛[8],長度約為13 μm,鞭毛具有典型的“9+2”結構。因其結構簡單,生長周期短,鞭毛形態易于觀察,所以非常適合作為研究鞭毛/纖毛長度調控機制的模型生物。然而,由于杜氏鹽藻的基因組序列尚未公布,且已得到全序列的鞭毛相關基因較少,因此給鞭毛調控機制和功能的研究帶來了諸多不便。該研究通過擴增GSK3 cDNA序列,得到了完整的開放閱讀框,編碼386個氨基酸,經在NCBI上比對發現其氨基酸序列與衣藻、團藻等具有較高的同源性,說明GSK3在不同物種中高度保守,而這種高保守性也正是GSK3維持自身激酶活性所必需的。
一直以來,關于GSK3的研究層出不窮,作為一個多功能基因,它不僅是維持體內糖代謝的關鍵酶,而且還是多種細胞信號通路的關鍵因子。GSK3還可以通過使微管相關蛋白Tau、MAP-1B和APC發生磷酸化來調控微管的動力學作用,從而影響軸索的生長[9]。另外,GSK3可以通過分解驅動蛋白1,進而選擇性地抑制順向軸絲運輸及其與貨物蛋白間的相互作用[10]。雖然這些研究已經證明GSK3對維持微管的穩定性及鞭毛內運輸具有一定的調控作用,但對于它在鞭毛生長中的作用以及長度調控的機制目前尚不清楚。所以,作者通過實時熒光定量PCR方法研究了GSK3在轉錄水平上與鞭毛再生的關系,結果顯示GSK3的轉錄量明顯升高,甚至比對照組高20多倍,表明GSK3在鞭毛再生中發揮重要作用。雖然已有研究[6]表明,GSK3的活性形式在鞭毛內大量存在且其活性抑制劑LiCl能夠使衣藻鞭毛延長。但是,在杜氏鹽藻中,鋰處理后鞭毛長度并未出現明顯的延伸,因此,作者推測杜氏鹽藻GSK3可能不參與鞭毛長度的維持,只是在鞭毛生長過程中發揮調控作用。另外,GSK3是否通過參與鞭毛內某種信號通路實現對鞭毛生長的調控以及它在鞭毛再生中是否還發揮其他未知的功能,這還需要進一步的研究才能證實。
[1] Lee J, Kim MS. The role of GSK3 in glucose homeostasis and the development of insulin resistance[J]. Diabetes Res Clin Pract, 2007,77(Suppl 1):S49
[2] MacDonald BT, Tamai K, He X. Wnt/beta-catenin signaling: components, mechanisms, and diseases[J]. Dev Cell, 2009,17(1):9
[3] Forde JE, Dale TC. Glycogen synthase kinase 3: a key regulator of cellular fate[J]. Cell Mol Life Sci, 2007,64(15):1930
[4] Rayasam GV, Tulasi VK, Sodhi R, et al. Glycogen synthase kinase 3: more than a namesake[J]. Br J Pharmacol, 2009,156(6):885
[5] Pedersen LB, Rosenbaum JL. Intraflagellar transport (IFT) role in ciliary assembly, resorption and signaling[J]. Curr Top Dev Biol, 2008,85:23
[6] Wilson NF, Lefebvre PA. Regulation of flagellar assembly by glycogen synthase kinase 3 in Chlamydomonas reinhardtii[J]. Eukaryot Cell, 2004,3(5):1307
[7] Cheshire JL, Evans JH, Keller LR. Ca2+signaling in the Chlamydomonas flagellar regeneration system: cellular and molecular responses[J]. J Cell Sci, 1994,107(Pt 9):2491
[8] Oren A. A hundred years ofDunaliellaresearch: 1905-2005[J]. Saline Systems, 2005,1:2
[10]LaPointe NE, Morfini G, Pigino G, et al. The amino terminus of tau inhibits kinesin-dependent axonal transport: implications for filament toxicity[J]. J Neurosic Res, 2009, 87(2):440

