小鼠細粒棘球蚴感染早期對NK細胞影響的初步研究①
印雙紅 陳小林 徐芳潔 張旭勇 吳向未 侯 雋 陳雪玲
(石河子大學醫學院免疫學教研室,石河子832002)
包蟲病(Hydatid disease)又稱棘球蚴病,是棘球蚴寄生于中間宿主引起的一種嚴重影響人畜健康的寄生蟲疾病。包蟲病在手術治療過程中或者在正常患者體內,由于包囊意外破裂,部分原頭節可能進入組織內,造成再次感染,也給包蟲病的治療帶來很大困難[1]。蟲體之所以能在宿主體內長期生存,有賴于對宿主的免疫逃避功能。目前關于蟲體免疫逃逸的研究主要是Th1/Th2的漂移可能產生的免疫逃避[2]。對于NK細胞(Natural killer cell)在包蟲免疫逃逸中的作用,有臨床研究顯示其NK細胞活性明顯下降,目前實驗研究的資料較少[3]。本文主要探討細粒棘球蚴感染小鼠后,對小鼠NK細胞的影響。
1 材料與方法
1.1 材料
1.1.1 實驗材料 雌性BALB/c小鼠,6~8周,購自新疆醫科大學第一附屬醫院實驗動物中心。
1.1.2 主要試劑和儀器 流式抗體Anti-Mouse CD49b-FITC(DX-5)、Anti-Mouse CD314-PE(NKG2D)購自 eBioscience公司;流式細胞儀(FACS AriaⅢ)購自BD公司;小鼠淋巴細胞分離液購自Solarbio;Yac-1細胞購自上海銳聰科技;酶標儀購自BIO-RAD公司。
1.2 方法
1.2.1 細粒棘球蚴原頭節的制備 從感染細粒棘球蚴病的羊肝上,無菌抽取無鈣化、無感染、完整的單囊型細粒棘球蚴包囊內容物,置于無菌離心管內,原頭節(Protoscole,PSC)自然沉淀,再用含有100 U/ml青霉素和鏈霉素雙抗的無菌PBS(pH7.3)漂洗3次,除去育囊碎片使其自然沉淀,經0.5%伊紅染色5分鐘,在顯微鏡下鑒定具有活性的蟲體數(>90%),用含雙抗的無菌 PBS稀釋制成含有原頭節10 000個/ml的原頭節懸液,備用。
1.2.2 建立細粒棘球蚴感染小鼠動物模型 將60只健康BALB/c小鼠,隨機分成實驗組和對照組。實驗組:腹腔接種濃度為10 000個/ml原頭節,加入100 U/ml青霉素和100 U/ml鏈霉素0.2 ml/只;對照組:腹腔接種PBS加入100 U/ml青霉素和100 U/ml鏈霉素0.2 ml/只,分別在1、3、5、7、9、12 天的時候頸椎脫臼法處死小鼠,無菌摘取脾臟,制備脾細胞懸液。
1.2.3 小鼠脾臟細胞分離 脫頸處死小鼠,無菌摘取小鼠脾臟,用1支5 ml和1支1 ml注射器在含有少許PBS的小平皿中刮出脾細胞。用1 ml注射器抽吸刮出的脾細胞3~5次,使脾細胞盡量分散。向一新離心管加入3 ml的小鼠淋巴細胞分離液,再將約1.5 ml的脾細胞懸液緩慢加入(V分離液∶V脾細胞懸液=2∶1),2 000 r/min離心20分鐘。取出中間的云絮層(淋巴細胞層)用3 ml PBS,1 000 r/min離心5分鐘洗滌2~3次。最后將沉淀細胞懸浮于1 ml 1640液中。細胞計數,配成(2~3)×107ml-1備用。
1.2.4 LDH法檢測NK的殺傷活性 取效應細胞淋巴細胞1×107個/ml和靶細胞Yac-1 cells 1×105個/ml各0.1 ml(E∶T=100∶1)加入細胞培養板中,設3復孔,同時設靶細胞自然釋放孔(0.1 ml靶細胞+0.1 ml 10%FCS-RPMI1640培養液)和最大釋放孔(0.1 ml靶細胞+0.1 ml 1%NP40液),1 000 r/min低速離心2分鐘。置37℃,5%CO2孵育2小時。1 000r/min離心5分鐘。吸取各孔上清0.1 ml加至新96孔板中,37℃,10分鐘。每孔再加入0.1 ml新配制的LDH底物溶液,室溫避光反應10~15分鐘。加入30 μl 1 mol/L檸檬酸終止液終止酶促反應。酶聯監測儀在570 nm波長下讀各孔A值。計算:根據下列公式計算NK細胞活性:NK細胞活性
1.2.5 流式細胞染色及檢測 取1×106個脾細胞,向各管中加入小鼠血清孵育15分鐘,再分別加入 Anti-Mouse CD49b-FITC(DX-5),Anti-Mouse CD314-PE(NKG2D)抗體,4℃下避光孵育30分鐘,進行表面染色;PBS洗滌1次,加入0.5 ml PBS重懸細胞,用FACS AriaⅢ流式細胞儀進行檢測。
1.3 統計學分析 所有數據用SPSS17.0軟件進行統計學分析,多組樣本之間用方差分析,兩組間比較采用兩樣本均數的t參數檢驗或q檢驗。
2 結果
2.1 細粒棘球蚴感染小鼠不同時間,對小鼠NK細胞殺傷活性的影響 乳酸脫氫酶法(LDH)檢測結果顯示:經統計分析小鼠腹腔接種細粒棘球蚴后1、3、5、7、9、12天的NK細胞對Yac-1細胞的裂解率(NK細胞殺傷活性)與對照組比較差異均有統計學意義(P<0.05),其中在小鼠感染后的1、3、5、9 天,P <0.001,見圖1。隨著時間的推移感染組小鼠NK細胞的殺傷活性呈下降的趨勢,經q檢驗分析,各組之間均有統計學意義(圖1);由第1天的最高值(17.7%±0.561%)到第12天下降至(8.10%±0.745%),并且低于對照組(9.25%±0.401%)(如圖2)。
2.2 小鼠細粒棘球蚴感染早期對NK細胞表面激活受體NKG2D表達的影響 流式細胞術(FCM)檢測細粒棘球蚴感染早期小鼠對NK細胞表面激活受體NKG2D的表達,細粒棘球蚴感染早期小鼠后,隨著時間的延長NK細胞的活性受體NKG2D的表達量呈下降的趨勢,第1天最高,且顯著高于對照組(P<0.001);第12天最低,明顯低于對照組(P<0.001)。與對照組比較,感染后 1、3、9、12 天NKG2D的表達量都有統計學差異(P<0.05或P<0.001)(圖3、4)。
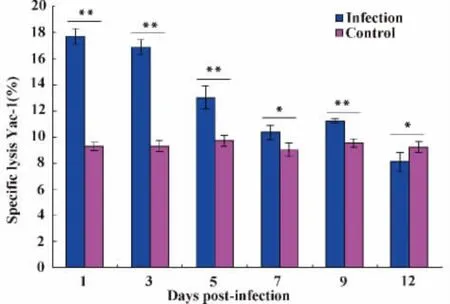
圖1 細粒棘球蚴感染早期小鼠對NK細胞活性的影響Fig.1 The influence of spleen NK cytotoxic activity in early Echinococcus granulosus infected BALB/c mice
2.3 小鼠細粒棘球蚴感染早期對NK細胞數量的影響 通過流式細胞術(FCM)檢測小鼠脾細胞上DX-5的表達情況,了解細粒棘球蚴感染早期小鼠后對NK細胞數量的影響。結果顯示,NK細胞數量在感染后有所升高,感染后第1天最高達到7.76%,但隨著時間的延長NK細胞數量呈下降的趨勢,第5天開始低于感染前,至第12天下降至3.86%最低;經q檢驗發現,與感染前比較,感染后第 1、3、9、12天NK數量差異都有統計學差異(表1、圖5)。
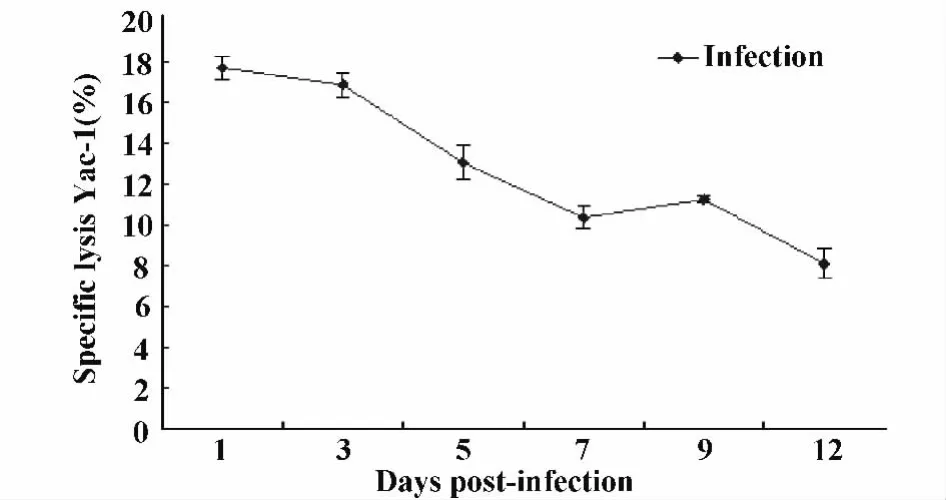
圖2 LDH法檢測細粒棘球蚴感染早期小鼠不同時間NK細胞殺傷活性的變化趨勢Fig.2 Trends of spleen NK cytotoxic activity analyzed by LDH in early stages of infection
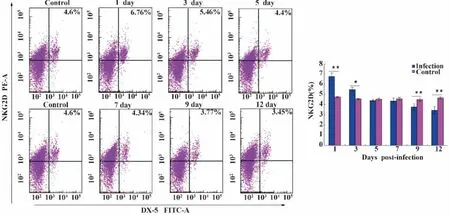
圖3 流式細胞術檢測細粒棘球蚴感染早期小鼠后NKG2D的表達Fig.3 The expression of NKG2D on spleen cells were analyzed by flow cytometry in early stages of infection
2.4 相關性分析 細粒棘球蚴感染小鼠早期,通過對NK細胞的活性及其活性受體NKG2D的表達檢測顯示:隨著感染時間的延遲,NK細胞活性受體NKG2D的表達和NK細胞殺傷活性均呈下降的趨勢。相關性分析結果顯示,細粒棘球蚴感染小鼠早期,NK細胞的殺傷活性與其活性受體NKG2D的表達呈正相關,相關系數r=0.679(圖6)。
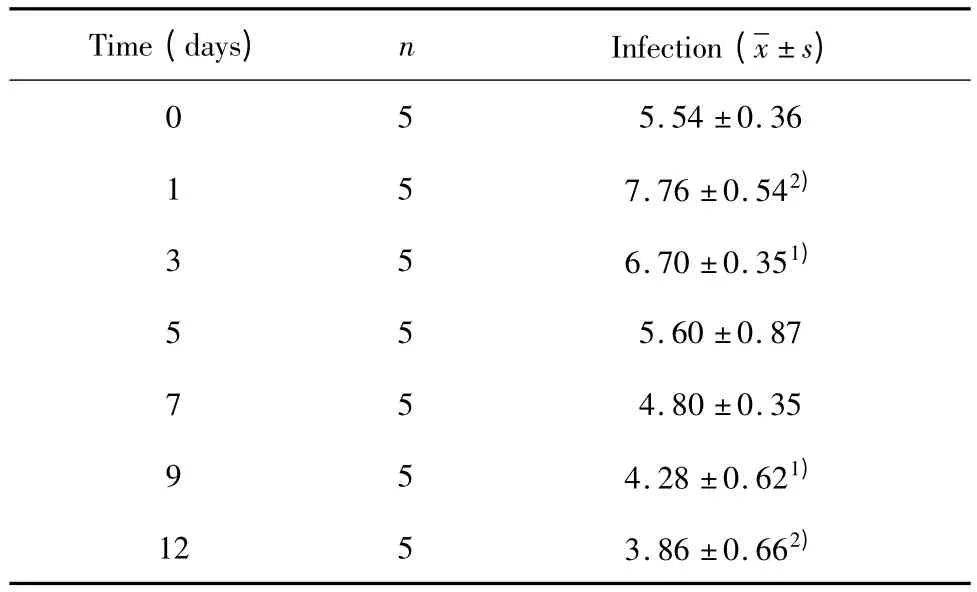
表1 FCM檢測E.g感染早期BALB/c小鼠對NK細胞數量的影響(%)Tab.1 The number of changes of CD4+CD25+T cells were detected by FCM in the early of E.g infection in BALB/c mice(%)
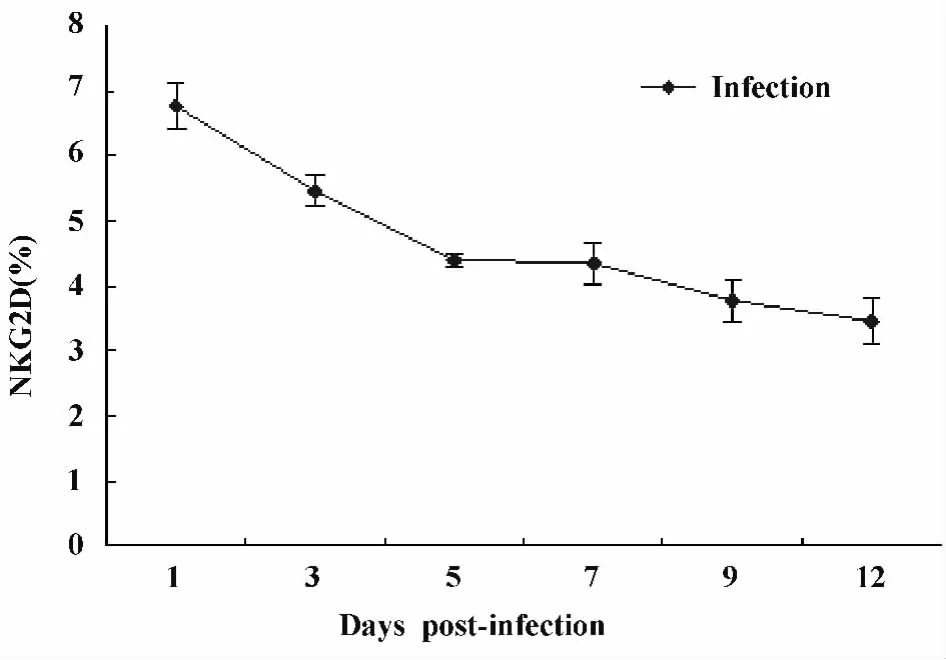
圖4 流式細胞術檢測感染組小鼠NKG2D在不同時期NK細胞表達的變化趨勢Fig.4 Trends of the levels of NKG2D on spleen cells analyzed by flow cytometry in early stages of infection
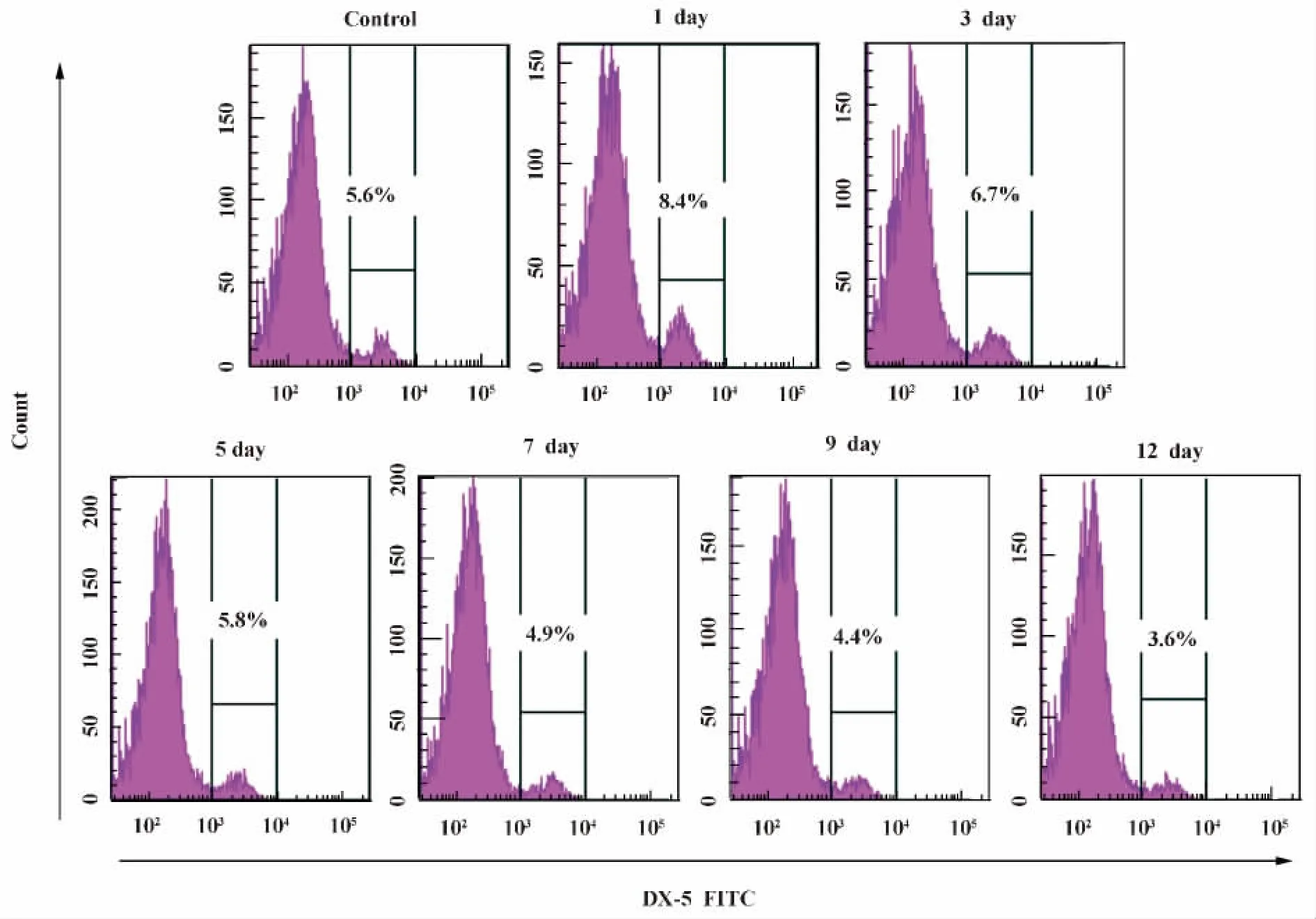
圖5 FCM檢測E.g感染早期BALB/c小鼠NK細胞數量在感染前后的變化Fig.5 Results diagram of the number of NK cells were detected by FCM in the early of E.g infection in BALB/c mice
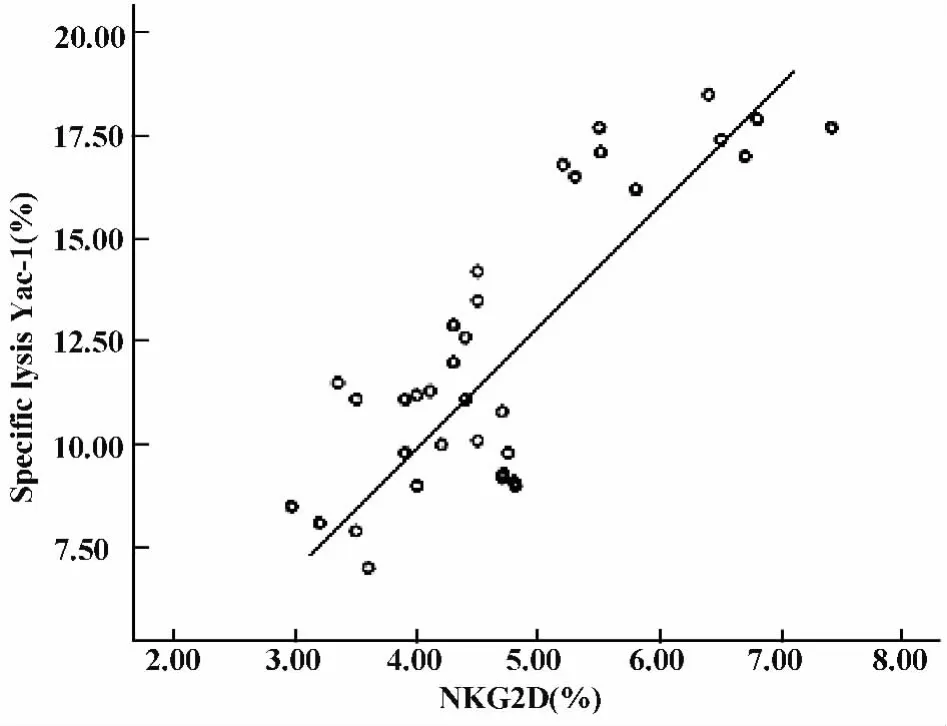
圖6 NK細胞殺傷活性與NK細胞活性受體NKG2D的表達相關性分析相關系數(r=0.679)Fig.6 Correlation between NK cytotoxic activity and receptor expression(r=0.679)
3 討論
細粒棘球蚴感染宿主后能夠在宿主體內長期存活的機理雖未完全清楚,NK細胞作為識別病原入侵的第一道防線,沒有充分發揮天然免疫,應該是發病的重要原因之一[4]。
對于NK細胞方面的研究,現階段主要集中在泡球蚴(AE)臨床患者的外周血中比例下調現象的研究。Nicod[3]研究AE患者外周血單個核細胞時發現,NK細胞活性明顯下降,且NK細胞活性降低與PBMC中NK細胞比例低有關。李富榮[5]也通過檢測患者外周血發現,AE患者的NK細胞比例比正常人的降低,同時張琰等[6]的研究也表明,維吾爾族和漢族包蟲病病例組中NK細胞比例水平均較健康人組顯著降低,提示包蟲感染后,可能會抑制NK細胞的一些免疫功能。本實驗結果表明,在小鼠細粒棘球蚴感染早期中,小鼠NK細胞及其活性受體NKG2D均呈下降的趨勢,感染后第1天最高(顯著高于對照組),第5天降至對照組的水平,至第12天時遠低于對照組。這可能是由于細粒棘球蚴感染后,小鼠NK細胞數量及其活性受體NKG2D應激性增高,但隨著感染時間的延遲,又呈下降趨勢至低于正常水平,而處于抑制狀態,這與人感染泡球蚴后對NK細胞活性的抑制結果相同[7]。
NKG2D屬H型跨膜蛋白,廣泛分布于人NK細胞、DC、巨噬細胞、T細胞,是NK細胞表面的活性受體。在小鼠體內,NKG2D主要分布于NK細胞和部分CD8+T細胞。NKG2D無需抗原呈遞即可直接識別腫瘤細胞表面表達的配體分子,進而激活或協同刺激免疫效應細胞,從而發揮對腫瘤細胞的殺傷作用[8]。隨著活化受體 NKG2D及其配體的發現和研究的深入,發現NK細胞能夠識別靶細胞表面壓力(熱休克、病毒或細菌感染、惡性轉化等)誘導下所表達的配體而啟動活化信號。這種活化可以不受NK細胞抑制性信號的控制,即NKG2D的單獨活化足以刺激NK細胞的活化,并能克服抑制性受體的強勢信號。這種被稱為“壓力誘導(induced-self)”的識別模式使NK細胞能夠及時識別各種危險信號[9-11]。NK細胞的殺傷活性與其表面的活性受體NKG2D的表達量呈正相關[12]。有研究報道:HIV病毒的 Nef和 Vif蛋白能部分下調細胞表面NKG2DLs,而降低NKG2D受體介導的NK細胞對靶細胞(殺傷被感染細胞)的殺傷能力[13,14]。弓形體能提高NKG2D的表達和NK細胞的活性,導致懷孕女性和孕鼠妊娠異常[11]。Nicod[3]研究 AE 患者發現,NK細胞活性明顯下降;此后,又發現AE也能夠通過 MICA/B和 TGF-β的持續表達而抑制了NKG2D的表達,然后改變宿主免疫,利于多房棘球絳蟲的侵入[7]。在細粒棘球蚴感染的研究中我們也得到相似結果:我們通過對小鼠感染細粒棘球蚴早期(感染后1~12天),觀察NK細胞數量,NK細胞的殺傷活性及其表面的活性受體NKG2D的表達量。結果顯示,隨著時間的延遲,NK細胞數量和NK細胞殺傷活性下降,NKG2D表達量也降低,NK細胞殺傷活性下降與NKG2D呈正相關,使得棘球蚴逃避宿主的免疫應答,而能在宿主體內長期生存。
1 Adrian Baz,Gustavo,Sylvia Dematteis et al.Complexity and function of cytokine responses in experimental infection by echinococcus granulosus[J].Immunobiology,2006;3(9)3-8.
2 Jankovic D,Liu Z,Gause W C.Th1-and Th2-cell commitment during infectious disease:asymmetry in divergent pathways[J].Trends in Immunology,2001;22(8):450-457.
3 Nicod L,Bresson-Hadni S,Vuitton D A et al.Specific cellular and humoral immune responses induced by different antigen preparations of Echinococcus multilocularis metacestodes in patients with alveolar echinococcosis[J].Parasite,1994;1(3):261-270.
4 Rigano R,Profumo E,Di Feli C E G et al.In vitro production of cytokines by peripheral blood mononuclear cells from hydatid patients[J].Clin Exp Immunol,1995;99(3):433-439.
5 Li F R,Shi Y E,Shi D Z et al.The significance of lymphocyte variations in alveolar echinococcosis patients[J].Chin J Zoonosis,2003;19(3):91-94.
6 張 琰,溫 浩,林仁勇et al.細粒棘球蚴病患者淋巴細胞及細胞因子變化的初步觀察[J].中國寄生蟲學與寄生蟲病雜志,2007;25(3):209-212.
7 Zhang S,Hüe S,Sène D et al.Expression of major histocompatibility complex class I chain-related molecule A,NKG2D,and transforminggrowth factor-beta in the liver of humans with alveolar echinococcosis:new actors in the tolerance to parasites?[J].J Infect Dis,2008;197(9):1341-1349.
8 臧怡雯,周易明,陳宗祐.NKG2D及其配體在腫瘤免疫中的研究進展[J].復旦學報,2011,38(4):367-371.
9 Raulet D H.Roles of the NKG2D immunoreceptor and its ligands[J].Nat Rev Immunol,2003;3(10):7812790.
10 Watzl C.The NKG2D receptor and its ligands-recognition beyond the“missing self”[J].Microbes and Infection,2003;5(1):31-37.
11 魏海明,鄔 鵬,田志剛.NK細胞識別的新模式:壓力誘導模式[J].中國腫瘤生物治療雜志,2005;12(2):85-88.
12 Xu X,Zhao M,Liu X et al.Toxoplasma gondii infection regulates the balance of activating and inhibitory rece ptorson decidual natural killer cells[J].PLoS One.2013;8(2):e55432.
13 Norman J M,Mashiba M,McNamara L A et al.The antiviral factor APOBEC3G enhances the recognition of HIV-infected primary T cells by natural killer cells[J].Nat Immunol,2011;12(10):975-983.
14 Cerboni C,Neri F,Casartelli N et al.Human immunodeficiency virus 1 nef protein downmodulates the ligands of the activating receptor NKG2D and inhibits natural killer cell-mediated cytotoxicity[J].J Gen Virol,2007;88(Pt 1):242-250.