遠程缺血后適應對大鼠腦缺血再灌注損傷后MIP-1α表達的影響
王榮亮,趙海蘋,羅 玫,張 營,陶 真,閆 峰,羅玉敏
(首都醫科大學宣武醫院,腦血管病研究室,北京 100053)
腦血管病因其高致殘率和高致死率而成為危害人類健康的三大疾病之一。目前,關于腦缺血再灌注損傷機制的研究越來越關注腦組織缺血后的炎癥反應。大量實驗已經證實,腦缺血后級聯的炎癥反應是導致腦細胞損傷的重要原因[1,2],在炎癥反應過程中,多種因素相互作用,共同引起再灌注損傷。通過藥物及外界手段抑制腦缺血再灌注過程中的炎癥反應,減輕腦組織損傷,可能為防治腦缺血疾病提供一條新的有效途徑[3]。然而,對于急性缺血性腦血管病患者,目前除了早期溶栓治療外,幾乎沒有其他有效的治療方法。遠程缺血后適應(RIPostC)是近些年來發展的一種干預措施,它是在重要生命器官發生缺血后,通過對遠程器官重復給予幾次短暫的、非致死性的缺血和再通,可以明顯減輕再灌注損傷。RIPostC可通過實施于非生命重要器官來保護某些對缺氧缺血極其敏感的生命重要器官(比如腦組織),并且可以在缺血事件發生之后進行,因此具有非常重要的臨床應用價值。已有研究表明,遠程缺血后適應對腦損傷有保護作用,而且實施的越早,效果可能越好[4]。
缺血再灌注損傷時促炎細胞因子和趨化因子表達會迅速上調[5-8],其中單核細胞化學趨化蛋白-l(monocyte chemoattractant protein-1,MCP-1)、巨噬細胞炎癥蛋白-1α(macrophage inflammatory protein,MIP-1α)在腦缺血再灌注后炎癥反應的重要作用已引起廣泛關注[5,6]。MIP-1α是屬于CC亞族的一種趨化性細胞因子,主要由單核/巨噬細胞、中性粒細胞、小膠質細胞產生,趨化單核/巨噬細胞、T淋巴細胞和NK細胞等。近來有不少研究表明,MIP-1α在缺血性腦血管病的再灌注損傷中發揮非常重要的作用[9-12]。MCP-1、MIP-lα 與抗體結合后可促進白細胞遷移,應用受體拮抗劑后,可減少腦梗死體積[10]。Terao 等[13]的研究表明,在腦缺血后 MIP-3α顯著增加,腦室注射MIP-3α中和抗體后,可顯著減小缺血后腦組織的損傷。這些研究提示,巨噬細胞炎性蛋白可在腦缺血后增加腦組織的損傷,而抑制其表達可使損傷減少。因此,MIP-1α在腦缺血引發的炎癥反應中起到非常重要的樞紐作用,可以成為治療腦缺血的一個新靶點。
1 材料和方法
1.1 動物分組
SPF級雄性SD大鼠77只,體重(280~310)g,購自北京維通利華實驗動物公司(動物許可證號:SCXK(京)2008-0001)。恒溫條件下飼養,實驗前一晚禁食但不禁水。實驗前隨機分為7組:(1)假手術組(S,n=11);(2)缺血再灌注 8 h組(I8,n=11);(3)缺血后適應8 h組(R8,n=11);(4)缺血再灌注24 h組(I24,n=11);(5)缺血后適應24 h組(R24,n=11);(6)缺血再灌注72 h組(I72,n=11);(7)缺血后適應72 h組(R72,n=11)。
1.2 主要試劑與儀器
小動物呼吸機(Harvard Apparatus 683)、雙極電凝(Devel,ACC100)、顯微鏡(Carl Zeiss)、反饋式溫度調節儀(Harvard Apparatus)、血氣分析儀(Abbott,i-STAT)、有創血壓監測儀(Siemens SC600C)、顯微手術器械、生物安全柜(Labconco Class II Type A2)、PCR儀(MJ Research)、電子天平(Adventurer)、超聲波細胞粉碎機(Scientz-IID)、離心機(Thermo)、酶標儀(Multiskan MK3,Thermo)、MIP-1α 抗體(Santa Cruz Biotechnology,sc-33203)、HRP標記的山羊抗兔抗體(北京中杉金橋生物科技公司)、ECL發光液(Millipore)、NC 膜 (Pall)、化 學 發 光 儀(ChemiScope)、免疫熒光顯微鏡(Nikon digital imaging hero eclipse 80i)、搖床(TS-1/TS-8)。
1.3 動物模型的制備
大鼠稱重后用4%恩氟烷誘導麻醉,應用小動物呼吸機及麻醉機,1% ~2%恩氟烷混合70%N2O和30%O2維持麻醉,術中監測肛溫、血糖、血氣及血壓,各項指標維持在正常范圍。選擇右側大腦中動脈,所應用的線栓(北京沙東生物技術有限公司)頭部直徑為0.38 mm,將其插入頸內動脈,至距頸內動脈和頸外動脈分叉處約1.8 cm~1.9 cm。栓塞2 h后拔出栓子制備缺血2 h再灌注損傷模型,分別于再灌注后8 h、24 h和72 h處死大鼠,斷頭取腦,以備石蠟切片制作以及腦組織蛋白的提取用。假手術組做鈍性分離,插入線栓后立即拔出,腦組織無缺血損傷。
1.4 遠程缺血后適應方法
如之前所述,有研究表明:遠程缺血后適應實施的越早,對腦保護的效果可能越好[4]。我們之前已研究過缺血2 h后給予后適應所起到的神經保護作用[14],為了具體研究其作用機制,我們采取缺血即刻后適應,方法如下:分離大鼠雙側股動脈主干,在大鼠腦缺血即刻夾閉雙側股動脈10 min,放開10 min,如此共進行3個循環。
1.5 石蠟切片的制備
將假手術組(n=4)和實驗組8 h(n=4)、24 h(n=4)和72 h(n=4)分別于再灌注后8 h、24 h和72 h后用10%水合氯醛腹腔麻醉,右心房快速灌注肝素化PBS及4%多聚甲醛進行固定,斷頭取腦,除去嗅球和小腦,置4%多聚甲醛中后固定48 h后放入模具,于視交叉處沿冠狀切片,向前囟方向切2張切片,向小腦方向切3張切片,每片厚約2 mm,石蠟包埋。
1.6 熒光定量RT-PCR檢測
首先進行總RNA提取,冰上分離大鼠皮層,加入含一定量TRIzol的研磨器中,反復研磨勻漿。室溫放置5 min后,每1 mL TRIzol中加入0.2 mL氯仿,劇烈震蕩15 s,室溫放置3 min。12 000 r/min 4℃離心15 min,將上層的水相吸至新的離心管內,加入0.5 mL的異丙醇,室溫放置10 min,于4℃ 以小于12 000 r/min轉速離心10 min。棄去上清液,用1 mL 75% 的乙醇清洗沉淀,于4℃ 以7 500 g轉速離心5 min,用微量移液器盡可能將乙醇吸盡,隨后于室溫放置5~10 min,使殘留乙醇揮發干凈。用DEPC處理的去離子蒸餾水20 μL溶解沉淀,測A260、A280值,計算A260/A280比值,估算樣品中RNA的含量和純度。用DEPC處理的去離子蒸餾水調整樣品終濃度為 1 μg/μL,置于 -80℃ 冰箱保存。
cDNA的合成:將以下成份加入經DEPC處理的200 μL EP 管內。(500 μmol/L 隨機引物 1 μL;10 μm dNTP 2 μL;1 μg/μL 細胞總 RNA 2 μL;用DEPC處理的去離子蒸餾水補至12 μL。65℃變性5 min后即刻冰浴,加入5×first chain緩沖液4 μL、0.1 M DTT 2 μL、40 U/μL RNase 抑制劑 1 μL,混勻。37℃加熱5 min。加10 U/μL逆轉錄酶M-MLV 1 μL,混勻,37℃加熱 50 min。70℃滅活 15 min,反應物保存于-20℃冰箱備用。熒光定量PCR檢測MIP-1α合成的引物:正向 5'-GCGCTCTGGAA CGAAGT-3',反向 5'-GCAAAGGCTGCTGGTCT-3'。
PCR 反應條件:a.反應體系為 25 μL,其中MIP-1α選用2×GC II緩沖液,GAPDH選用10×緩沖液:2 ×GC II緩沖液12.5 μL、10 mM dNTP 2 μL、20 μM 引物:SN 0.5 μL、ASN 0.5 μL、cDNA(1 μg/μL)1 μL、Taq 酶 1.25 μL、加雙蒸水至 25 μL、10 ×緩沖液:10 mM dNTP 2 μL、20 μM 引物:SN 0.5 μL、ASN 0.5 μL、cDNA(1 μg/μL)1 μL、Taq 酶 1.25 μL、加雙蒸水至25 μL。b.擴增反應條件:①預變性:95℃ 5 min。②變性:95℃ 30 s;退火:MIP-1α 55℃ 30 s,GAPDH 54℃ 30 s;延伸:72℃ 1 min。③循環數:最佳退火溫度和反應循環數因擴增的目的基因片段而異。分別于第20、22、24…38、40個循環各取出一管反應產物,取5 μL進行1%瓊脂糖凝膠電泳,對目的帶光密度掃描定量,以光密度值-循環數作曲線,選擇PCR反應達平臺期前的指數增長期循環數確定為半定量PCR的反應循環數。MIP-1α循環數為32,GAPDH循環數為26。④72℃延伸30 s,72℃延伸1 min。⑤4℃保存。瓊脂糖凝膠電泳:制備1%瓊脂糖凝膠,EB染色。凝膠完全凝固后,小心移去梳子,將凝膠放入電泳槽中,加入恰好沒過膠面約1 mm深的足量1×TBE電泳緩沖液。吸取DNA樣品各5 μL與所需加樣緩沖液(loading buffer)混合,用一次性微量移液器,慢慢將混合物加至樣品槽中。蓋上電泳槽并通電,使DNA向陽極移動。100 V穩壓電流電泳20 min左右。切斷電源,從電泳槽上拔下電線,打開槽蓋。在紫外燈下自顯影并照相。應用GEL-PRO analyzer 2.0分析軟件對各目的條帶的光密度值(A)進行分析,計算各目的基因的相對表達水平(相對表達水平=A目的基因/A內對照基因)。
1.7 免疫印跡法檢測
將假手術組(n=4)、缺血再灌注組和缺血后適應組8 h(n=4)、24 h(n=4)、72 h(n=4)分別于再灌注后8 h、24 h和72 h處死大鼠,取梗死側皮層腦組織置于冰上,稱重后加入5倍的裂解液,將樣品用小剪刀剪碎,在冰水浴中用超聲波細胞粉碎機進行勻漿后,冰浴 30 min,12 000 r/min 4℃離心 30 min,取上清液。在酶標儀上用BCA法參照標準蛋白濃度,于560 nm處測定樣本的吸光度值(A值)。根據蛋白定量的標準曲線計算各樣本的蛋白含量。
配制15%分離膠和5%積層膠,取180 μg蛋白樣品溶于相應體積的上樣液中,水浴鍋98℃加熱5 min,蛋白變性后即刻加樣。室溫下40 V電泳1 h,蛋白樣品到達分離膠后將電壓調為80 V,繼續電泳約1.5 h。配制電轉液,冰浴中60 V 30 min電轉。將電轉后的NC膜置于TBST中清洗3次,每次5 min,置入8%脫脂牛奶中4℃封閉過夜。第2天將膜置入一抗中室溫孵育4 h,隨后TBST清洗3次,每次5 min,再置入二抗中室溫孵育1 h。抗體如下稀釋:抗 MIP-1α(1∶200)、抗 actin(1∶2 000)、HRP標記山羊抗兔(1∶2 000)。與二抗反應好后,將膜置于ECL發光液中3 min,放入化學發光儀進行檢測。得到的結果用Quantity one 4.4.0軟件分析蛋白條帶的相對灰度。
1.8 免疫熒光染色
依次進行腦組織切片的二甲苯脫蠟、梯度酒精入水,0.3%的H2O2/甲醇溶液消除內源性過氧化物酶活性,EDTA抗原微波熱修復12 min,小牛血清封閉非特異性抗原,4℃過夜;加1∶200稀釋的MIP-1α抗體,室溫2 h;1×PBS(pH=7.4)漂洗3次,每次3 min;加TRITC山羊抗兔IgG,室溫孵育30 min;1×PBS(pH=7.4)漂洗3次,每次3 min;DAPI封片,熒光顯微鏡下觀察。
1.9 統計學方法
采用SPSS 17.0軟件進行統計分析,所有資料用平均值±標準差(ˉ±s)表示,各數據組間比較使用one-way ANOVA方法,P<0.05有統計學意義。
2 結果
2.1 遠程缺血后適應對大鼠腦缺血 MIP-1α mRNA含量的影響
圖1和圖2分別為熒光定量RT-PCR檢測的大鼠腦缺血核心區和半暗帶區MIP-1α mRNA表達的結果。從圖1中可見,在缺血核心區,單純缺血組MIP-1α mRNA的表達缺血再灌注組高于S組,8 h達高峰,24 h時之后持續下降。缺血后適應組MIP-1α mRNA的表達變化趨勢與缺血再灌注組相同。經統計分析,其中I8組與S組間比較有統計學意義(P<0.05),R8組和R24組與S組相比有統計學意義(P<0.05)。
從圖2中可見,在缺血半暗帶區域,MIP-1α mRNA表達的變化趨勢與缺血核心區相似,其中I8組與S組相比較有統計學意義(P<0.05),而其他組間比較無統計學意義。
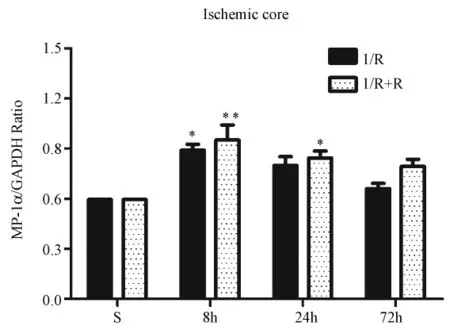
圖1 大鼠腦缺血梗死核心區MIP-1α mRNA表達水平(s)Fig.1 The mRNA level of MIP-1α expression in the cerebral ischemic core(±s)
2.2 遠程缺血后適應對大鼠腦缺血皮層區MIP-1α蛋白含量的影響
圖3為免疫印跡法檢測的大鼠MIP-1α蛋白表達結果和統計圖。與S組相比,隨著缺血再灌注時間延長,I組及R組MIP-1α蛋白的表達均有所增加,其中I24 h和I72 h顯著增加,有統計學意義,P<0.05。與I組相比,R24 h和 R72h組MIP-1α的表達下降,與I 72 h相比,R72 h組MIP-1α的表達下降顯著,接近于 S組,有統計學意義,P<0.05。其余各組間比較無統計學意義。
2.3 免疫熒光結果
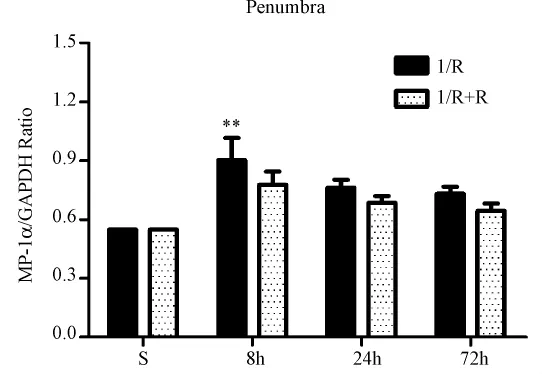
圖2大鼠腦缺血半暗帶區MIP-1α mRNA表達水平ˉ±s)Note:Sham;I/R:MCAO model;I/R+R:MCAO+RIPostC.Fig.2 MIP-1α mRNA level in the cerebral ischemic penumbra±s)
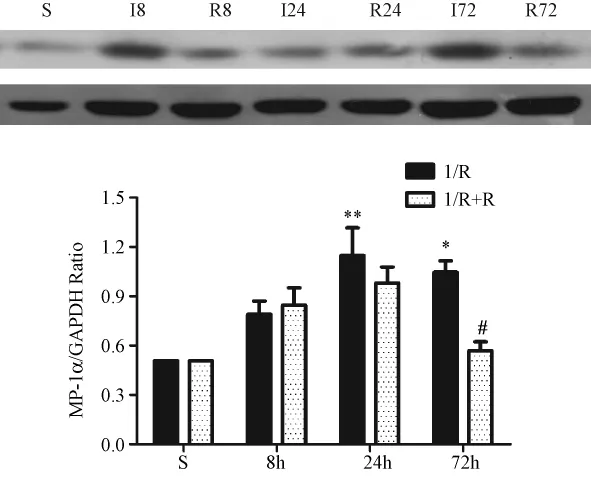
圖3大鼠腦缺血皮層區MIP-1α蛋白的表達水平±s)Fig.3 MIP-1α protein level in the cerebral ischemic cortex
圖4(見文后彩插1)為大鼠腦組織在缺血72 h后皮層區MIP-1α的免疫熒光染色結果圖。缺血再灌注72 h后,I72 h組MIP-1α的表達水平顯著增加;相比較而言,給予遠程缺血后適應干預的R72 h組表達降低,接近sham組水平。免疫熒光的結果與Western blot的結果相符。
3 討論
本文主要是探討遠程缺血后適應對大鼠腦組織MIP-1α mRNA和蛋白水平表達的影響,為遠程缺血后適應的研究提供一定的理論基礎。本研究表明,與S組相比,缺血模型組及遠隔缺血后適應組MIP-1α mRNA均有不同程度地升高,均在缺血再灌注后8 h時達到峰值,有統計學意義。Schmidt-Kastner R 等[7]發現,在大鼠短暫缺血3 h后,MIP-1α mRNA 水平即開始升高。Sieber等[15]和 Nishi等[6]在用小鼠模型研究中發現,MIP-1α mRNA在缺血再灌注后6~12 h顯著增加,12 h達到最高值。這與本研究的缺血再灌注組(I組)結果相符,梗死核心區及缺血半暗帶MIP-1α mRNA的水平均在缺血8 h后達到最高,隨后開始下降。結果表明,遠程缺血后適應不能降低缺血核心區的MIP-1α mRNA表達水平,在缺血半暗帶可一定程度上降低MIP-1α mRNA水平,但無統計學差異。另外,在本研究中,MIP-1α蛋白在缺血再灌注24 h后達到高峰,這與Nishi等[6]的研究結果相符。缺血后各組的MIP-1α蛋白表達均有所增加,與 S組相比,缺血模型組MIP-1α在缺血再灌注24 h和72 h后顯著增加,有統計學差異;值得注意的是,在缺血再灌注72 h組中,相對缺血模型組,遠程缺血后適應組MIP-1α表達水平顯著降低,有統計學差異。以上結果提示MIP-1α參與了大鼠腦缺血再灌注損傷的炎癥反應,而遠程缺血后適應可能通過減輕炎癥反應而發揮腦保護作用,這在再灌注損傷的晚期較為明顯。但由于實驗沒有涉及到72 h后的時間點,無法驗證RIPostC在腦缺血再灌注后更長時間的保護作用,這也是本研究的不足之處。
之前已有研究表明,肢端缺血預處理(limb ischemic preconditioning,LIP)可抑制炎癥因子的表達,減輕腦缺血后炎癥反應,從而對腦組織起到保護作用[16]。本研究采用的是遠程缺血后適應是在缺血后采取的干預,因此,擁有更好的臨床應用前景。進一步研究其作用機制,發揮神經元保護作用而拮抗其致炎效應,可能是今后防治腦缺血的一條新的有效途徑。
[1] Lakhan SE,Kirchgessner A,Hofer M.Inflammatory mechanisms in ischemic stroke:therapeutic approaches[J].J Transl Med,2009,7(1):97.
[2] Amantea D,Nappi G,Bernardi G,et al.Post-ischemic brain damage:pathophysiology and role of inflammatory mediators[J].FEBS J,2009,276(1):13 -26.
[3] Chen B,Liao W Q,Xu N,et al.Adiponectin protects against cerebral ischemia reperfusion injury through anti-inflammatory action[J].Brain Res,2009,1273:129 -137.
[4] Ren C,Yan Z,Wei D.Limb remote ischemic postconditioning protects against focal ischemia in rats[J].Brain Res,2009,1288:88-94.
[5] Wang X,Yue TL,Barone FC,et al.Monocyte chemoattractant protein-1 messenger RNA expression in rat ischemic cortex[J].Stroke,26(4):661-666.
[6] Nishi T,Maier CM,Hayashi T,et al.Superoxide dismutase 1 overexpression reduces MCP-1 and MIP-1α expression after transient focal cerebral ischemia[J].J Cereb Blood Flow Metab,2005,25(10):1312-1324.
[7] Schmidt-Kastner R,Zhang B,Belayev L,et al.DNA microarray analysis of cortical gene expression during early recirculation after focal brain ischemia in rat[J].Mol Brain Res,2002,108(1):81-93.
[8] Berti R,Williams AJ,Moffett JR,et al.Ouantitative real-time RT-PCR analysis of inflammatory gene expression associated with ischemia reperfusion brain injury[J].J Cereb Blood Flow Metab,2002,22(9):1068-1079.
[9] Smits H A,Rijsmus A,van Loon J H,et al.Amyloid-betainduced chemokine production in primary human macrophages and astrocytes[J].J Neuroimmunol,2002,127(1 -2):160 -168.
[10] Minami M,Satoh M.Chemokines and their receptors in the brain:pathophysiological roles in ischemia brain injury[J].Life Sci,2003,74(2 -3):32l-327.
[11] Maurer M,von Stebut E.Macrophage inflammatory protein-1[J].Int J Biochem Cell Biol,2004,36(10):1882 -1886.
[12] 孫叁波,劉朝東.MIP-1α與MMP-9在免疫炎癥反應中作用及其關系研究進展[J].中國免疫學雜志,2008,28(5):474-477.
[13] Terao Y,Ohta H,Oda A,et al.Macrophage inflammatory protein-3alpha plays a key role in the inflammatory cascade in rat focal cerebral ischemia[J].Neurosci Res,2009,64(1):75 -82.
[14] Qi ZF,Luo YM,Liu XR,et al.AKT/GSK3β-dependent autophagy contributes to the neuroprotection of limb remote ischemic postconditioning in the transient cerebral ischemic rat model[J].CNS Neurosci Ther,2012,18(12):965 -973.
[15] SieberMW, ClausRA, WitteOW, etal. Attenuated inflammatory response in aged mice brains following stroke[J].Plos One,2011,6(10):e26288.
[16] 于新迪,王震宇,丁雷,等.大鼠肢端缺血預處理對腦缺血后炎癥反應的影響[J].中國比較醫學雜志,2012,22(9):8-12.

