Lactobacillus casei胞外多糖對BALB/c小鼠腸相關淋巴細胞調控的初步研究①
包 鵬 唐彥君 劉 寧 (東北農業大學食品學院乳品科學教育部重點實驗室,哈爾濱150030)
小腸作為機體消化吸收營養物質的重要器官,同時具有黏膜免疫功能。由小腸的結構特性決定了病原微生物在體內停留時間長,作用面積大,因而極易引起腸道疾病,進而影響機體健康。腸道相關淋巴組織,包括上皮內淋巴細胞、固有層淋巴細胞、派氏集合淋巴結和腸系膜淋巴結,在抵御腸道病原微生物過程中起重要作用,是腸道免疫的重要參與者[1]。這些腸道相關淋巴組織中的免疫細胞或直接作用于入侵病原微生物,或通過釋放各類細胞因子等方式對病原微生物發揮免疫作用[2]。腸道相關淋巴組織中的淋巴細胞主要由T淋巴細胞和B淋巴細胞組成。其中,上皮內淋巴細胞、固有層淋巴細胞及腸系膜淋巴結均含有較高比例的T淋巴細胞,而派氏集合淋巴結則是B淋巴細胞的含量較高[3,4]。其分泌產生的諸多細胞因子在維持腸道免疫平衡及對抗入侵病原中發揮的重要作用。其中的IFN-γ、TNF-α、IL-17 更是參與腸道細胞免疫和黏膜屏障的主要細胞因子。IFN-γ參與由腸組織損傷等引起的免疫調節并具有活化巨噬細胞等免疫能力;TNF-α則擁有直接改變上皮層完整性進而改善腸損傷等生理功能;而IL-17是通過誘導炎癥趨化因子及抑菌蛋白的分泌的方式協助黏膜免疫屏障對抗胃腸道的病原微生物[5,6]。因此,上述部位淋巴細胞的數量及其分泌IFN-γ、TNF-α、IL-17的水平與腸道免疫能力密切相關。近年來研究證實,乳酸菌及其所產生的胞外多糖具有調節機體免疫力的生理功能[7]。其中廣泛應用于發酵食品中的干酪乳桿菌能夠通過調節淋巴細胞數量、調控相關細胞因子分泌等方式改善正常或疾病狀態下的腸道免疫能力[8,9]。但作為發酵食品中天然成分—由干酪乳桿菌分泌的重要免疫活性物質胞外多糖(exopolysaccharide,EPS)對腸道淋巴細胞的調節尚未見報道,對不同腸相關淋巴組織淋巴細胞的調節也未見報道。本研究采用WST-1法和ELISA法分別檢測經干酪乳桿菌EPS處理后BALB/c小鼠小腸四部位腸相關淋巴組織中的淋巴細胞增殖能力及細胞因子TNF-α、IL-17及 IFN-γ 分泌水平,旨在初步探討干酪乳桿菌胞外多糖對不同腸相關淋巴組織淋巴細胞的調控作用。
1 材料與方法
1.1 材料
1.1.1 實驗動物及菌種 BALB/c小鼠,6周齡,雌性,由北京維通利華公司提供(批號:2012-021316)。無特殊病原的環境飼養(SPF級),正常供食供水;干酪乳桿菌(購自于美國的ATCC,編號:ATCC393TM)。
1.1.2 試劑及試劑盒 本實驗所用試劑及試劑盒包括:Percoll原液(Sigma公司),膠原蛋白酶 IV(Sigma公司),RPMI1640培養液,胎牛血清,小鼠TNF-α、IL-17 及 IFN-γ ELISA 檢測試劑盒(ebioscience公司)及WST-1細胞增殖及細胞毒性檢測試劑盒(碧云天生物技術有限公司),其他常規試劑均為分析純。
1.1.3 儀器 酶標儀,電熱恒溫培養箱,CO2恒溫培養箱,無菌超凈工作臺,真空冷凍干燥機,高速冷凍離心機,倒置顯微鏡。
1.2 方法
1.2.1 干酪乳桿菌胞外多糖的提取[10]將干酪乳桿菌按5%體積分數接種于脫脂乳培養基中,32℃培養24小時,后對其依次進行離心、三氯乙酸除蛋白、乙醇沉淀、透析和凍干處理,得到純化的干酪乳桿菌胞外多糖,即EPS。
1.2.2 腸相關淋巴細胞的制備[11,12]頸椎脫位法處死小鼠,取幽門至盲腸的全部小腸,浸泡于預冷的D-Hank's液中,仔細剝離腸系膜,小心剪下派氏集合淋巴結。用含有5%胎牛血清的D-Hank's液反復沖洗腸腔,將沖洗干凈的小腸延縱軸剪開,置于含有EDTA-DTT消化液的離心管中,37℃下180 r/min水平振蕩40分鐘,細胞懸液過400目不銹鋼濾網,離心收集,將細胞重懸于5 ml 40%Percoll液中,小心加在4 ml 70%Percoll液面上,1 000 r/min離心30分鐘,收集交界面處細胞,即為上皮內淋巴細胞(Intraepithelial lymphocytes,IEL);將經 EDTA-DTT消化液消化后的小腸,置于含膠原蛋白酶消化液的離心管中,37℃下180 r/min水平振蕩30分鐘,細胞懸液過400目不銹鋼濾網,離心收集,將細胞重懸于5 ml 40%Percoll液中,小心加在4 ml 70%Percoll液面上,1 000 r/min離心30分鐘,收集交界面處細胞,分離得到固有層淋巴細胞(Lamina propria lymphocytes,LPL);將剝離的腸系膜及收集的派氏集合淋巴結進行研磨,400目不銹鋼網過濾,離心收集,將細胞重懸于5 ml 40%Percoll液中,小心加在4 ml 70%Percoll液面上,1 000 r/min離心30分鐘,收集交界面處細胞,分別得到腸系膜淋巴結淋巴細胞(Mesenteric lymph nodes lymphocytes,MLNL)和派氏集合淋巴結淋巴細胞(Peyer's Patches lymphocytes,PPL)。
1.2.3 細胞增殖實驗 將無菌制備的IEL、LPL、PPL及MLNL調整細胞濃度為2×106ml-1,以100 μl/孔接種于96孔培養板中。實驗組每孔加入100 μl不同濃度的干酪乳桿菌胞外多糖,使終濃度分別為 10、25、50、100 和200 μg/ml,另設等量 RPMI1640培養基為空白對照組。將96孔板置于37℃ 5%CO2培養箱中培養48小時。培養結束后,按照WST-1細胞增殖及細胞毒性檢測試劑盒步驟說明進行操作,分別檢測 IEL、LPL、PPL及 MLNL增殖情況,并計算半數有效劑量(ED50)。
表1 不同濃度EPS對GALT淋巴細胞增殖能力的影響(A450,±s,n=5)Tab.1 Effect of different conentration EPS on GALT lymphocytes proliferation(A450,±s,n=5)
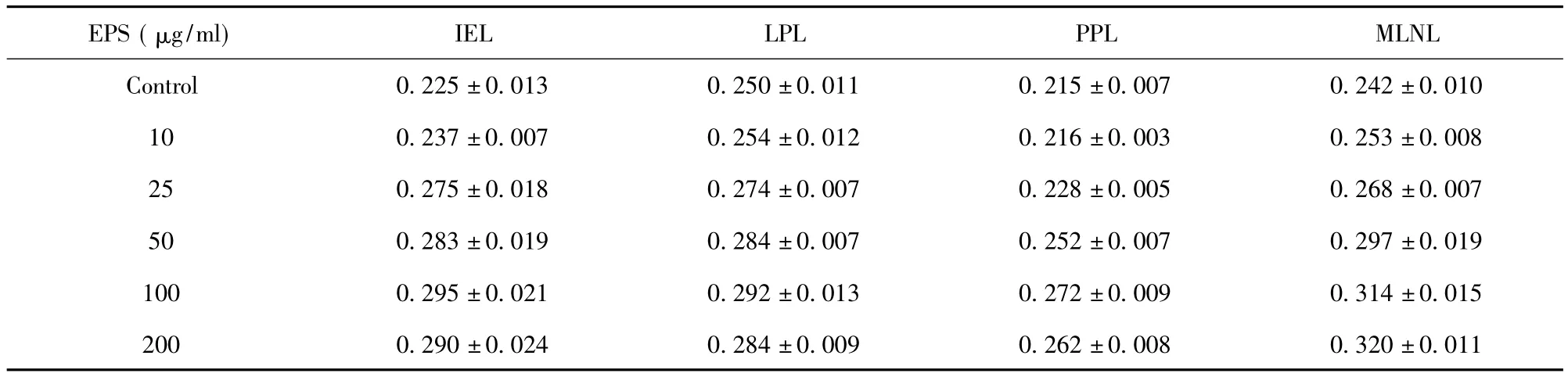
表1 不同濃度EPS對GALT淋巴細胞增殖能力的影響(A450,±s,n=5)Tab.1 Effect of different conentration EPS on GALT lymphocytes proliferation(A450,±s,n=5)
Note:Vs control group,1)P <0.05,2)P <0.01.
EPS(μg/ml)IEL LPL PPL MLNL Control 0.225±0.013 0.250±0.011 0.215±0.00 20±0.011 7 0.242±0.010 10 0.237±0.007 0.254±0.012 0.216±0.003 0.253±0.008 25 0.275±0.018 0.274±0.007 0.228±0.005 0.268±0.007 50 0.283±0.019 0.284±0.007 0.252±0.007 0.297±0.019 100 0.295±0.021 0.292±0.013 0.272±0.009 0.314±0.015 200 0.290±0.024 0.284±0.009 0.262±0.008 0.3
1.2.4 細胞因子的檢測 將無菌制備的IEL、LPL、PPL及 MLNL調整細胞濃度為 2×106ml-1,以100 μl/孔接種于96孔培養板中。實驗組每孔加入100 μl不同濃度的干酪乳桿菌胞外多糖,使終濃度分別為 10、25、50、100 和 200 μg/ml,另設等量 RPMI1640培養基為空白對照組。將96孔板置于37℃5%CO2培養箱中培養48小時。培養結束后,按照小鼠TNF-α、IL-17、IFN-γ檢測試劑盒步驟說明進行操作,分別檢測IEL、LPL、PPL及MLNL上清液中細胞因子 TNF-α、IL-17、IFN-γ 分泌量,并計算 EPS 的半數有效劑量(EP50)。
1.3 統計學分析 每個獨立實驗均重復三次,每次設置五個平行。各組實驗數據用(±s)表示,應用SPSS 17軟件進行統計學處理,以One-way ANOVA方法分析各組數據之間的差異。P<0.05表示差異顯著,P<0.01表示差異極顯著,以Probit回歸分析方法統計分析EPS的半數有效劑量(EP50)。
2 結果
2.1 EPS對小鼠小腸IEL、LPL、PPL及MLNL增殖的影響 EPS對BALB/c小鼠小腸IEL、LPL、PPL及MLNL增殖有一定的促進作用,結果見表1。其對MLNL增殖能力的影響最強,在50~200 μg/ml濃度時與對照組相比均存在顯著差異(P<0.05),且呈劑量依賴性,ED50約為42.85 μg/ml;對于 IEL、LPL及PPL增殖能力在50~200 μg/ml濃度時的影響與對照組相比差異顯著(P<0.05)或極顯著(P<0.01),但并不呈劑量依賴性,而是在100 μg/ml濃度時達到最大值,ED50 分別約為24.75、28.76 和41.25 μg/ml。
2.2 EPS對小鼠IEL、LPL、PPL及MLNL分泌TNF-α調控 如圖1所示,EPS能夠明顯地抑制BALB/c小鼠小腸 IEL、LPL及 PPL分泌細胞因子 TNF-α。在50~200 μg/ml濃度時,IEL、LPL 上清液中 TNF-α的含量與對照組相比有極顯著性的降低(P<0.01),呈劑量依賴性,ED50約為 44.12和50.59 μg/ml;PPL上清液中的細胞因子TNF-α則在50 μg/ml后無法測出,ED50 約為 17.92 μg/ml。但是EPS對MLNL分泌TNF-α并無明顯的抑制作用,且在200 μg/ml時有顯著提高(P<0.01),ED50約為 123.56 μg/ml。
2.3 EPS對小鼠IEL、LPL、PPL及MLNL分泌IL-17調控 如圖2所示,EPS能夠明顯地促進BALB/c小鼠小腸IEL、LPL、PPL及MLNL分泌細胞因子IL-17。IEL上清液中IL-17的含量在濃度25~200 μg/ml時與對照組相比有顯著性(P<0.05)或極顯著性的升高(P<0.01),呈劑量依賴性,ED50約為29.16 μg/ml;LPL、PPL上清液中的細胞因子IL-17則在50 μg/ml時達到最大值,且差異極顯著(P<0.01),ED50約為33.12和27.15 μg/ml;MLNL上清液中的IL-17在200 μg/ml時達到最大值,且差異極顯著(P <0.01),ED50 約為88.86 μg/ml。
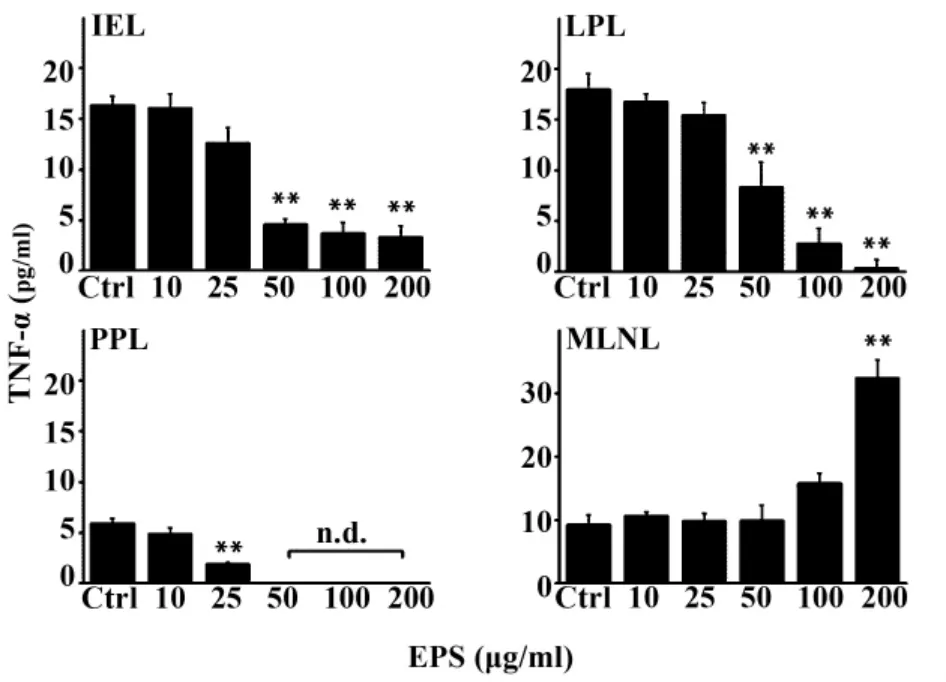
圖1 ELISA法檢測EPS對GALT淋巴細胞分泌TNF-α的影響Fig.1 Effect of EPS on TNF-α induction of GALT lymphocytes by ELISA assay
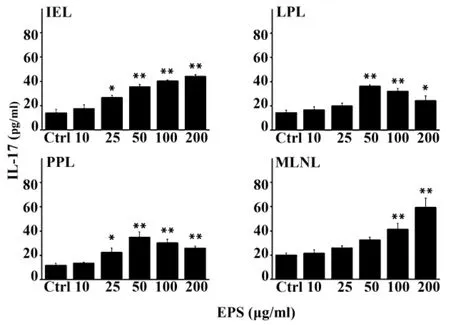
圖2 ELISA法檢測EPS對GALT淋巴細胞分泌IL-17的影響Fig.2 Effect of EPS on IL-17 in duction of GALT lymphocytes by ELISA assay

圖3 ELISA法檢測EPS對GALT淋巴細胞分泌IFN-γ的影響Fig.3 Effect of EPS on IFN-γ induction of GALT lymphocytes by ELISA assay
2.4 EPS對小鼠IEL、LPL、PPL及MLNL分泌IFN-γ調控 如圖 3所示,EPS對 IEL、LPL、PPL及MLNL上清液中IFN-γ含量無明顯影響,與對照組之間的差異不顯著(P>0.05)。
3 討論
早在1988年,Gómez等[13]證明了青春雙歧桿菌所合成的EPS可以促進T淋巴細胞的增殖。隨后,Kitazawa等[14]發現一種德式乳桿菌所分泌的EPS同樣具有促進淋巴細胞增殖的能力。與青春雙歧桿菌和德式乳桿菌一樣,干酪乳桿菌作為一種益生菌被廣泛應用于乳制品生產等食品領域當中。作為食源物質,其產生的EPS對腸道相關淋巴組織中淋巴細胞免疫活性的調控,是干酪乳桿菌EPS對腸道黏膜免疫系統發揮調節作用的關鍵點之一。因為腸相關淋巴組織中的淋巴細胞參與黏膜免疫系統對入侵抗原做出的一系列免疫調節反應,而其較高的免疫活性則能夠保證黏膜免疫調節的快速和準確。腸道淋巴細胞的免疫活性主要體現在增殖能力、分泌各類細胞因子能力和其細胞表面功能分子的表達等方面。本研究利用非常成熟并廣泛應用的Percoll不連續密度梯度分離法嚴格操作分離BALB/c小鼠IEL、LPL、PPL及 MLNL細胞,并加以 EPS處理。WST-1增殖實驗結果表明,干酪乳桿菌EPS可以顯著提高體外培養的IEL、LPL、PPL及MLNL的增殖能力。其中EPS對IEL、LPL和PPL增殖的影響趨勢相似。而MLNL的增殖則呈劑量依賴性,且增殖效果最為明顯。由此可見,干酪乳桿菌EPS能夠不同程度地促進BALB/c小鼠四種主要腸相關淋巴組織中淋巴細胞的增殖,并可能通過此效應初步增強腸道黏膜免疫中由淋巴細胞介導或參與的免疫應答。
已有報道證實,一些多糖類物質具有調控腸道淋巴細胞和脾淋巴等分泌細胞因子的能力[15,16]。本研究在淋巴細胞分泌的諸多細胞因子中選擇了TNF-α、IL-17及 IFN-γ 作為研究對象,以檢測干酪乳桿菌EPS對腸相關淋巴細胞分泌典型細胞因子的調控。IFN-γ主要由活化的Th1型 CD4+T淋巴細胞分泌,γδT淋巴細胞、NK細胞等也可分泌;TNF-α則主要由巨噬細胞分泌,Th1型CD4+T淋巴細胞、γδT淋巴細胞等也是其分泌細胞;IL-17的主要分泌細胞為Th17細胞、γδT淋巴細胞等。本研究結果表明,干酪乳桿菌EPS可以抑制體外培養的IEL、LPL和 PPL分泌 TNF-α,原因可能是干酪乳桿菌EPS直接抑制主要分泌細胞TNF-α或者促進了相關抑制因子的分泌間接地抑制TNF-α水平。但干酪乳桿菌EPS對MLNL中TNF-α的分泌無明顯抑制作用,相反TNF-α的分泌量在高濃度時有顯著提高,這樣的結果可能與MLNL含有不同類型、不同含量的淋巴細胞亞群有關。MLNL中CD4+T淋巴細胞的含量較高,IEL、LPL和PPL中CD4+T淋巴細胞含量較低,而 Th1型 CD4+T淋巴細胞具有分泌TNF-α的能力。因此MLNL中TNF-α水平的增加可能揭示了EPS具有調控Th1型CD4+T淋巴細胞分泌TNF-α的能力,但具體分子學機制仍需進一步確定。與調控TNF-α不同,干酪乳桿菌EPS對四種腸相關淋巴細胞IL-17的分泌呈現促進作用,其中IEL及MLNL最為顯著,且呈劑量依賴。在四種淋巴組織中均含有一定的IL-17分泌細胞,如Th17細胞、γδT淋巴細胞等,因此推斷干酪乳桿菌EPS可能具有調控IL-17主要分泌細胞的能力。
研究結果初步表明,干酪乳桿菌EPS可體外促進腸相關組織中淋巴細胞增殖和調節相關細胞因子TNF-α、IL-17的分泌,初步推斷干酪乳桿菌EPS具有調節腸相關淋巴組織淋巴細胞免疫活性的能力,能夠改善腸黏膜免疫系統。但EPS通過口服途徑到達腸道,以大分子形式接觸腸相關淋巴細胞后,是否仍具有與體外實驗相符的功能仍需進一步證實。
1 Maria Luisa ForcShielli,Allan Walker.The role of gut-associated lymphoid tissues and mucosal defence[J].Br J Nutr,2005;93(1):S41-48.
2 Brigitte Sonier,Christopher Patrick.Intestinal immune regulation as a potential diet-modifiable feature of gut inflammation and autoimmunity[J].Int Rev Immunol,2009;28(6):414-445.
3 Rodney D Newberry,Robin G Lorenz.Organizing a mucosal defense[J].Immunol Rev,2005;206:6-21.
4 Allan McI Mowat.Anatomical basis of tolerance and immunity to intestinal angtigens[J].Nat Rev Immunol,2003;3(4):331-341.
5 Monteleone I,Vavassori P,Biancone L et al.Immunoregulation in gut:success and failures in human disease[J].Gut,2002;50(3):Ⅲ60-Ⅲ64.
6 Christoph Blaschitz,Manuela Raffatellu.Th17 cytokines and the gut mucosal barrier[J].J Clin Immunol,2010;30(2):196-203.
7 Badel S,Bernardi T,Michaud P.New perspectives for Lactobacilli exopolysaccharides[J].Biotechnol Adv,2011;29(1):54-66.
8 Perdigon G,Maldonado Galdeano C,Valdez J C et al.Interaction of lactic acid bacteria with the gut immune system[J].Eur J Clin Nutr,2002;56(4):S21-S26.
9 Monica Carol,Natalia Borruel,Maria Antolin et al.Modulation of apoptosis in intestinal lymphocytes by a probiotic bacter in Crohn's disease[J].J Leukoc Biol,2006;79(5):917-922.
10 Kimmel S A,Robert R F.Development of a growth medium suitable for exopolysaccharide production by Lactobacillus delbrueckii ssp bulgaricus RR[J].Int J Food Microbiol,1998;40(1/2):87-92.11 Aldo Arturo Resendiz-Albor,Rita Esquivel,Ruben Lopez-Revilla et al.Striking phenotypic and functional differences in lamina propria lymphocytes from the large and small intestine of mice [J].Life Sci,2005;76(24):2783-2803.
12 Dina Montufar-Solis,John R Klein.An improved method for isolating intraepithelial lymphocytes(IELs)from the murine small intestine with consistently high purity[J].J Immunol Methods,2006;308(1-2):251-254.
13 Gómez E,Melgar M M,Perez Silva G et al.Exocellular products from Bifidobacteriunm adolescentis as immunomodifiers in the lymphoproliferative responses of mouse splenocytes[J].FEMS Microbiology Letters,1988;56(1):47-52.
14 Kitazawa H,Harata T,Uemura J et al.Phosphate group requirement for mitogenic activation of lymphocytes by an extracellular phosphopolsaccharide from Lactobacillus delbrueckii ssp.Bulgaricus[J].Int J Food Microbiol,1998;40(3):169-175.
15 金麗琴,薛勝霞,呂建新et al.牛膝多糖衍生物對小鼠脾淋巴細胞增殖及誘生IL-2和TNF-α的影響[J].中國生化藥物雜志,2008;29(5):312-314.
16 張皖東,呂 誠,劉振麗et al.人參多糖和豬苓多糖對大鼠腸道黏膜淋巴細胞功能的影響[J].中草藥,2007;38(2):221-224.