IL-2增強肺炎支原體P1C核酸疫苗的肌注免疫效果①
朱翠明 陳蘇芳 余敏君 游曉星 唐雙陽 吳移謀
(南華大學病原生物學研究所,衡陽421001)
肺炎支原體(Mycoplasma pneumoniae,Mp)是兒童社區獲得性肺炎的主要病原體,一年四季都可發病,但大多數發生于夏末秋初,以5~15歲的青少年發病率最高,占兒童肺炎的10% ~30%,流行期間可達30% ~50%[1,2]。Mp 感染多用大環內酯類藥物治療,但近年來耐藥菌株不斷增多,給臨床治療帶來困難[3,4]。因此研制有效的疫苗預防Mp感染十分必要。
對Mp疫苗滅活疫苗、減毒活疫苗和菌體成分疫苗的研究效果均不理想[5]。核酸疫苗在體內表達的抗原具有天然的空間構象,能有效刺激機體產生細胞免疫和體液免疫,是近年來研究熱點。在以往的研究中,我們發現P1蛋白羧基端的第1 125~1 395位氨基酸(P1C蛋白)具有較強的免疫原性,其所誘生的抗體能阻止Mp對細胞的粘附,是研究Mp疫苗的理想候選分子[6]。并構建了P1C核酸疫苗,發現其能誘導小鼠產生一定的免疫應答水平和免疫保護作用[7,8]。
白細胞介素2(Interleukin-2,IL-2)是一種最常用的細胞因子免疫佐劑,能顯著增強疫苗的免疫效果[9],我們實驗室也發現IL-2對梅毒螺旋體、人乳頭瘤病毒和幽門螺桿菌核酸疫苗有良好的佐劑效應[10-12]。本研究將p1c基因和IL-2基因聯合構建在同一真核細胞表達載體上,肌注免疫 BALB/c小鼠,檢測其所誘發的免疫應答水平和免疫保護作用,了解IL-2對P1C核酸疫苗的免疫佐劑效應。
1 材料與方法
1.1 材料
1.1.1 實驗試劑 Mp M129株(ATCC 29342)、pcDNA3.1(+)(縮寫為 pcD)、pcDNA3.1(+)/IL-2(縮寫為 pIL-2)、pcDNA3.1(+)/P1C(縮寫為pP1C)由南華大學病原生物學研究所保存;SP4液體和固體培養基為Oxoid產品;去內毒素質粒大量抽提試劑盒購自Qiagen;HRP標記的羊抗鼠IgG(H+L)購自Santa Cruz;小鼠IFN-γ和IL-4定量檢測試劑盒購自R&D Systems。
1.1.2 實驗動物 BALB/c鼠由武漢大學實驗動物中心提供,南華大學實驗動物中心飼養。
1.2 方法
1.2.1 Mp的培養 將Mp M129菌株轉種至20 ml SP4培養基中,37℃培養5~7天至培養基顏色由紅變黃后棄上清,加入2 ml SP4培養基,收獲燒瓶底部的Mp,其濃度約108~109菌落形成單位[(Colony-Forming unit,CFU)/ml,CFU/ml]。
1.2.2 核酸疫苗的構建 以本研究所保存的pP1C為模板,設計引物,并在其下游引物中引入一個Linker基因:GATCCCCGGGTACCGAGC(編碼Asp-Pro-Arg-Val-Pro-Ser),用上游引物 p1c-F 5'-GGGGATCCATGACGGACTTTGTCAAACC-3'和下游引物 p1c-Linker-R 5'-GATCCCCGGGTACCGAGCCCCATCTAACAGTTCAGC-3'擴增得到 p1c-Linker基因;以 pIL-2質粒為模板,用上游引物Linker-IL-2-F 5'-GCTCGGTACCCGGGGATCTACAGGATGCAACTCC-3'和下游引物IL-2-R 5'-GGAATTCCTAGTTTTCCATACTGAT-3'擴增Linker-IL-2基因;然后以擴增得到的p1c-Linker基因和Linker-IL-2基因為模板,p1c-F和IL-2-R為引物擴增p1c-IL-2基因。將純化的p1c-IL-2基因和pcD質粒用BamHⅠ和EcoRⅠ雙酶切、T4連接酶連接后轉化E.coli XL-1 Blue感受態細胞,涂布于含50 μg/ml氨芐西林的LB平板,37℃過夜培養篩選陽性克隆。并通過PCR、酶切、測序鑒定。用去內毒素質粒抽提試劑盒提取質粒DNA,無菌PBS稀釋至 2 μg/μl備用。
1.2.3 免疫接種 將125只4~6周齡BALB/c雌性小鼠隨機分為5組,每組免疫25只小鼠;在各組小鼠左后腿股四頭肌分別注射50 μl PBS、pcD、pIL-2、pP1C或pP1C-IL-2。分別于第0、14和28天進行3次免疫。
1.2.4 抗感染實驗 小鼠初次免疫后第56天,用乙醚麻醉小鼠,誘導過度通氣,在每只小鼠處于吸氣相時向其鼻孔內滴入50 μl含有2×107CFU的Mp菌液,正常對照組以等量的SP4培養基滴鼻接種。
1.2.5 樣本的收集 在小鼠初次免疫后第56天和Mp 攻擊后第1、3、6、9、12 天,分別摘取眼球放血處死小鼠,將收集的血清和支氣管肺泡灌洗液(BALF)凍存于-80℃備用。肺組織用10%甲醛固定,石蠟包埋,切片后用蘇木蘇和伊紅(H&E)染色,進行肺組織炎癥病理評分(Histopathologic score,HPS)。
1.2.6 ELISA 融合重組蛋白rP1C的制備見文獻[6]。將1 μg純化的rP1C 4℃包被酶標板過夜,次日用含0.05%Tween 20的 PBS洗3次后用0.3%的BSA 4℃封閉過夜。將100 μl 1∶50稀釋的小鼠血清或1∶4稀釋的BALF加入酶標板,37℃孵育1小時后用PBST洗滌4次,再加入1∶1 000稀釋的HRP標記的羊抗小鼠 IgG、IgG1、IgG2a或 IgA,37℃孵育30分鐘后用PBST洗滌4次,在各反應孔中加入顯色劑 TMB與 H2O2各50 μl,37℃避光孵育10分鐘,最后每孔加入50 μl 2 mol/L硫酸終止反應。酶標儀讀取OD450值。根據試劑盒說明書,檢測小鼠血清和BALF中IFN-γ、IL-4的含量,兩種細胞因子試劑盒的最低檢測量為4 pg/ml。
1.2.7 Mp菌落計數 將25 μl系列倍比稀釋的BALF接種至SP4固體培養基,37℃ 95%N2和5%CO2氣體條件下,培養5~7天,低倍鏡下計數Mp菌落數,用log10CFU/ml表示,本實驗最低菌落檢出率數為40 CFU/ml。
1.2.8 肺組織病理評分 Mp感染各組小鼠后,用雙盲法請組織病理學者根據文獻[13]用肺組織病理學評分系統對各組BALB/c鼠肺組織進行炎癥評分。
1.3 統計學分析 運用SPSS16.0軟件,實驗數據以±s表示,均數之間的比較采用單因素ANOVA分析。P<0.05有統計學差異。
2 結果
2.1 真核重組質粒鑒定 pP1C-IL-2重組質粒雙酶切后用瓊脂糖凝膠電泳可見約5.4 kb和1 300 bp的兩個條帶,其大小與線性化的pCD質粒和p1c-IL-2基因片段相符。以pP1C-IL-2為模板,p1c-F和IL-2-R為引物擴增的得到一約1 300 bp的基因片段,與預期結果一致(圖1)。測序鑒定表明獲得陽性重組體。
2.2 P1C特異性抗體和抗體亞類 P1C-IL-2和P1C核酸疫苗免疫后56天所產生血清總IgG、IgG1和IgG2a亞類均較PBS、pcD和pIL-2對照組顯著增高(P<0.001),P1C-IL-2融合疫苗組血清中 IgG、IgG1和IgG2a與P1C單基因疫苗相比,差異有顯著性(P<0.05),且IgG2a較IgG1的增高更顯著。各免疫組BALF中SIgA抗體水平差異無顯著性(P>0.05,圖2)。
2.3 IFN-γ和IL-4水平 P1C-IL-2疫苗組和 P1C疫苗組小鼠支氣管灌洗液中IFN-γ和IL-4水平均較對照組顯著增高,且P1C-IL-2疫苗組小鼠IFN-γ和IL-4水平與P1C免疫組小鼠差異有顯著性(P<0.001 和 P <0.05,圖3)。
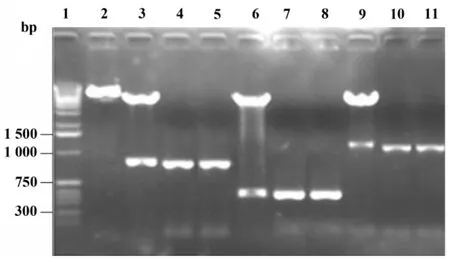
圖1 pP1C-IL-2重組質粒的酶切和PCR鑒定Fig.1 Identification of recombinant plasmid pP1C-IL-2 by endonuclease digestion and PCR
2.4 肺組織病理改變和評分 Mp感染后第1、3、6天,與P1C疫苗組小鼠相比,P1C-IL-2核酸疫苗組小鼠的肺間質炎癥病變區域較擴散,淋巴細胞、漿細胞浸潤增多,HPS明顯增高(P<0.05),而與 PBS、pCD、pIL-2對照組差異無顯著性(P >0.05,圖4)。第9、12天P1C-IL-2核酸疫苗免疫組小鼠的HPS與P1C疫苗免疫組差異無顯著性(P>0.05),且兩組HPS均低于對照組(P<0.05,圖4)。用SP4培養基做對照攻擊的小鼠HPS為0~1分。
2.5 Mp攻擊后各免疫組小鼠Mp菌落計數 用Mp 經呼吸道感染免疫小鼠,1、3、6、9、12 天后 P1CIL-2和P1C疫苗組小鼠BALF中Mp菌落數均低于對照組(P<0.05)。與P1C核酸疫苗組比較,P1C-IL-2融合基因疫苗組小鼠第1、3、6天 BALF中Mp菌落數明顯減少(P<0.05),但第9、12天兩組 Mp菌落數差異無顯著性(圖5)。
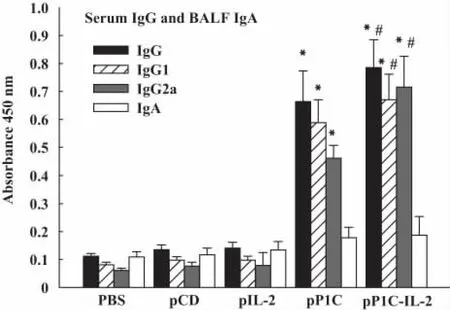
圖2 血清IgG及亞類和支氣管灌洗液IgA檢測(n=5)Fig.2 The levels of total antibody,IgG isotypes and BALF IgA of anti-P1C from immunized mice(n=5)
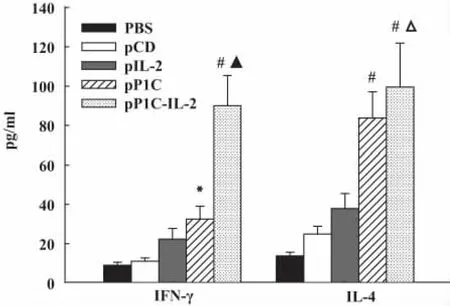
圖3 各免疫組小鼠支氣管灌洗液中IFN-γ和IL-4水平(n=5)Fig.3 ELISA analysis of IFN-γ and IL-4 levels in BALF(n=5)
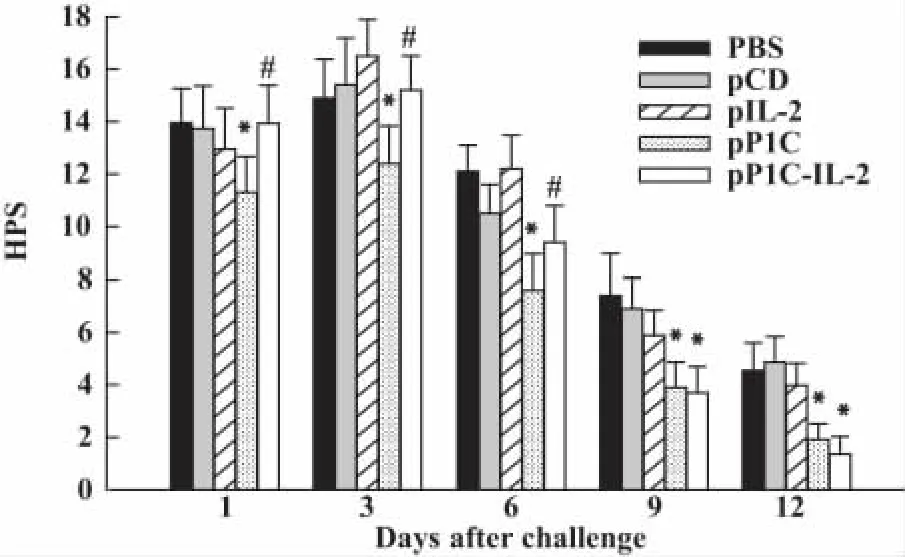
圖4 Mp感染后各組肺組織病理評分(n=4)Fig.4 The HPS in the lung tissues of each group of mice inoculated with M.pneumoniae(n=4)
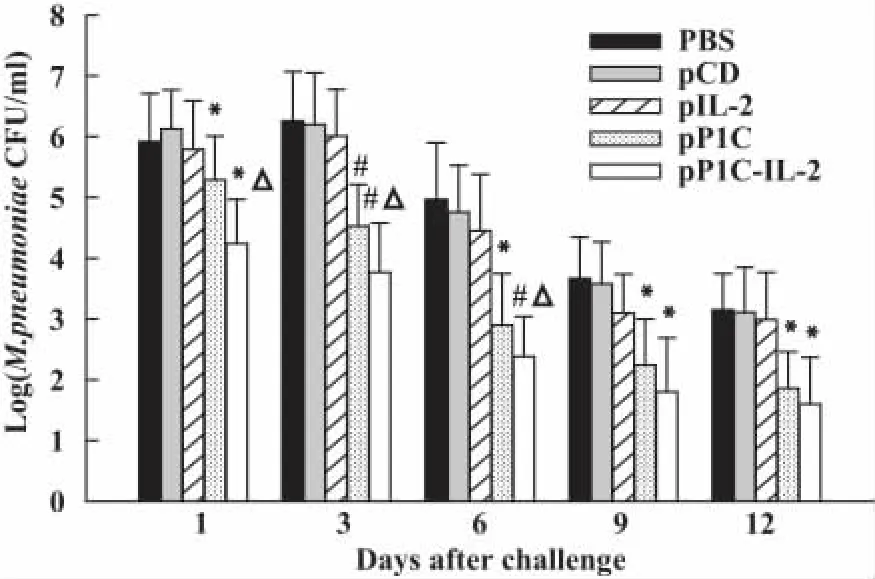
圖5 Mp攻擊后各免疫組小鼠支氣管肺泡灌洗液菌落計數(n=4)Fig.5 BAL fluids colonization by M.pneumoniae after respiratory challenge with M.pneumoniae(n=4)
3 討論
Mp為胞外寄生的病原體,其免疫主要是體液免疫。抗體對控制Mp感染有重要的作用,中和抗體能阻止Mp對呼吸道黏膜上皮細胞的粘附而阻止感染,IgG還能促進吞噬細胞的吞噬作用并阻止Mp向肺泡擴散[14]。實驗結果顯示,IL-2能增強P1C疫苗免疫后的總IgG以及IgG1和IgG2a亞類水平,表明IL-2能促進P1C疫苗誘發的系統體液免疫應答。
SIgA能阻止Mp感染呼吸道黏膜上皮細胞,是黏膜局部抗感染免疫最重要的抗體。P1C-IL-2融合疫苗免疫組和P1C單基因疫苗免疫組小鼠支氣管灌洗液中的SIgA與對照組差異均無顯著性,這表明經肌注免疫后,IL-2不能促進P1C核酸疫苗免疫后黏膜局部SIgA的分泌。
目前越來越多的研究表明,體液抗體對Mp感染的保護作用不完全。Mp可侵入宿主的組織細胞,在細胞內增殖,引起持續性感染[14],導致腦膜腦炎、心肌炎、腎炎、動脈粥樣硬化、冠心病等肺外感染和并發癥。細胞免疫,尤其是CD4+Th1型細胞免疫對清除胞內持續感染的 Mp非常重要[15,16]。CD4+Th1細胞主要通過分泌IFN-γ、IL-2、IL-12等細胞因子發揮細胞免疫效應,其中IFN-γ是一種至關重要的抗Mp感染的細胞因子,呼吸道黏膜局部IFN-γ的缺失可導致Mp的菌落數增高、肺組織炎癥加重[17]。實驗發現 IL-2能促進P1C疫苗免疫后支氣管灌洗液中IFN-γ的水平,顯著增強P1C疫苗誘導的細胞免疫。
為檢測疫苗的免疫保護作用,實驗對各免疫組小鼠感染Mp早期和晚期肺間質炎癥進行檢測,發現在Mp感染1~6天,P1C-IL-2疫苗免疫組小鼠的肺組織病理炎癥較P1C組加重,這可能是由于P1CIL-2疫苗激發的免疫應答過強,導致肺組織出現超敏反應性炎癥[18]。這種超敏反應性炎癥可能與IL-2作為佐劑促進P1C疫苗分泌高水平的IL-4相關。研究表明,IL-4基因敲除小鼠感染Mp后,肺組織中支原體數量少于正常感染小鼠,肺組織炎癥病理損傷減輕。因此IL-4的產生非但不能產生免疫保護,還可引起超敏反應性,加重肺組織炎癥[17]。在感染9天后,疫苗免疫組小鼠的肺組織炎癥較對照組減輕,這可能是由于疫苗激發的免疫保護效應所致。
用Mp攻擊各免疫組小鼠,病原學檢測發現P1C-IL-2雙基因融合疫苗免疫小鼠感染后第1、3、6天支氣管灌洗液中Mp的菌落數較P1C單基因疫苗免疫組小鼠顯著減少,說明IL-2能增強P1C核酸疫苗的抗Mp感染作用。
綜上所述,IL-2雖可顯著增強P1C核酸疫苗的免疫保護作用和免疫應答水平,但在感染早期也誘發了較重的肺組織病理炎癥。在后續研究中,我們將通過改變疫苗接種策略,如改變接種途徑、減少疫苗接種劑量等進一步研究IL-2對P1C核酸疫苗的免疫佐劑作用。
1 Tao L L,Hu B J,He L X et al.Etiology and antimicrobial resistance of community-acquired pneumonia in adult patients in China[J].Chin Med J(Engl),2012;125(17):2967-2972.
2 Kicinski P,Wisniewska-Ligier M,Wozniakowska-Gesicka T.Pneumonia caused by Mycoplasma pneumoniae and Chlamydophila pneumoniae in children-comparative analysis of clinical picture[J].Adv Med Sci,2011;56(1):56-63.
3 Bébéar C,Pereyre S,Peuchant O.Mycoplasma pneumoniae:susceptibility and resistance to antibiotics[J].Future Microbiol,2011;6(4):423-431.
4 Morozumi M,Takahashi T,Ubukata K.Macrolide-resistant Mycoplasma pneumoniae:characteristics of isolates and clinical aspects of community-acquired pneumonia[J].J Infect Chemother,2010;16(2):78-86.
5 Linchevski I,Klement E,Nir-Paz R.Mycoplasma pneumoniae vaccine protective efficacy and adverse reactions--Systematic review and meta-analysis[J].Vaccine,2009;27(18):2437-2446.
6 朱翠明,汪世平,吳移謀et al.肺炎支原體P1蛋白片段免疫學活性及黏附功能的研究[J].中華微生物學和免疫學雜志,2012;32(8):706-710.
7 Zhu C,Wu Y,Chen S et al.Protective immune responses in mice induced by intramuscular and intranasal immunization with an Mycoplasma pneumoniae P1C DNA vaccine[J].Can J Microbiol,2012;58(5):644-652.
8 Zhu C,Wang S,Hu S et al.Protective efficacy of a Mycoplasma pneumoniae P1C DNA vaccine fused with the B subunit of Escherichia coli heat-labile enterotoxin [J].Can J Microbiol,2012;58(6):802-810.
9 Tovey M G,Lallemand C.Adjuvant activity of cytokines[J].Methods Mol Biol,2010;626:287-309.
10 Zhao F,Wu Y,Zhang X et al.Enhanced immune response and protective efficacy of a Treponema pallidum Tp92 DNA vaccine vectored by chitosan nanoparticles and adjuvanted with IL-2 [J].Hum Vaccin,2011;7(10):1083-1089.
11 李 薇,唐雙陽,朱翠明et al.人乳頭瘤病毒16型E5與IL-12聯合基因疫苗的免疫活性[J].微生物學免疫學進展,2011;39(3):6-8.
12 于 文,張 艷,靖吉芳et al.幽門螺桿菌Lpp20-IL2核酸疫苗免疫活性[J].微生物學報,2010;50(4):554-559.
13 Cimolai N,Taylor G P,Mah D et al.Definition and application of a histopathological scoring scheme for an animal model of acute Mycoplasma pneumoniae pulmonary infection [J].Microbiol Immunol,1992;36(5):465-478.
14 Waites K B,Talkington D F.Mycoplasma pneumoniae and Its Role as a human pathogen[J].Clin Microbiol Rev,2004;17(4):697-728.
15 Jones H P,Simecka J W.T lymphocyte responses are critical determinants in the pathogenesis and resistance to mycoplasma respiratory disease[J].Front Biosci,2003;8:d930-d945.
16 Dobbs N A,Odeh A N,Sun X et al.The multifaceted role of T cell-mediated immunity in pathogenesis and resistance to mycoplasma respiratory disease[J].Curr Trends Immunol,2009;10:1-19.
17 Woolard M D,Hodge L M,Jones H P et al.The upper and lower respiratory tracts differ in their requirement of IFN-gamma and IL-4 in controlling respiratory mycoplasma infection and disease[J].J Immunol,2004;172(11):6875-6883.
18 Linchevski I,Klement E,Nir-Paz R.Mycoplasma pneumoniae vaccine protective efficacy and adverse reactions--Systematic review and meta-analysis[J].Vaccine,2009;27(18):2437-2446.