不同類型HBV感染者外周血Treg/Th17細胞的變化及意義
王 萍 胥 冰 張麗君
(陜西中醫學院免疫教研室,咸陽712046)
乙型肝炎是一種由乙型肝炎病毒(Hepatitis B virus,HBV)感染機體后所引起的疾病,嚴重危害我國人民身體健康。乙型肝炎特別是慢性乙型肝炎的發病機制十分復雜,近年來研究證實宿主免疫功能紊亂是其發病的重要原因,但確切機制尚未完全清楚[1]。Treg/Th17細胞是新近發現的具有特異細胞膜表面分子和核轉錄因子的兩類細胞亞群[2,3],國內外研究表明Treg/Th17細胞在自身免疫性疾病、腫瘤及感染性疾病中發揮重要作用[4,5],有研究資料顯示Treg/Th17細胞在HBV感染疾病中也發揮一定作用[6-9],但研究結果并不一致,且大多數研究只針對一種類型HBV感染的Treg或Th17細胞進行分析,缺乏同時對不同類型HBV感染類型Treg/Th17細胞的系統研究。為進一步研究Treg/Th17細胞在不同類型HBV感染中的作用,本研究擬通過對不同類型HBV感染者外周血Treg/Th17細胞、核轉錄因子及相關細胞因子的分析,初步探討Treg/Th17細胞在HBV感染過程中的變化及其臨床意義。
1 資料與方法
1.1 研究對象 入選2011年10月至2012年6月在陜西中醫學院附屬醫院住院和門診治療的不同類型乙型肝炎患者95例,其中急性乙型肝炎(acute hepatitis B,AHB)患者15例、慢性乙型肝炎(chronic hepatitis B,CHB)患者40例、無癥狀攜帶者(asymptomatic HBV carriers,AsC)40例,其中男性59例,女性36例,年齡21~64歲,平均年齡(38.75±16.57)歲。所有病例診斷符合2000年中華醫學會傳染病與寄生蟲學分會、肝病學分會聯合修訂的《病毒性肝炎防治方案》[10],所有病例均排除HAV、HCV、HDV、HEV等其他病毒性疾病、自身免疫性和藥物及酒精性肝炎等,在進行采集樣本前未進行抗病毒治療和免疫調節治療。另外選擇同期健康體檢者30例作為對照組,其中男性17例,女性13例,年齡20~62歲,平均年齡(36.87 ±15.37)歲,兩組研究對象性別、年齡的比較差異均無統計學意義(P<0.05)。本研究得到我院倫理委員會批準并取得所有受試者的知情同意。
1.2 主要儀器和試劑 美國貝克曼公司生產的FACS Calibur流式細胞儀;美國Bio-Rad公司生產的熒光定量PCR擴增儀;芬蘭 Thermo公司生產的DENLEY DRAGON Wellscan MK 3酶標儀;鼠抗人FITC-CD4、Alexa Fluor?647-IL-17、PE-Foxp3、PE 標記IgG同型對照、Alexa Fluor?647標記IgG同型對照購自美國 eBioscience公司;佛波酯、離子霉素(Ionomycin)購自Calbiochem公司;TRIzol液購自美國Invitrogen公司;cDNA第一鏈合成試劑盒購自立陶宛Fermentas公司;SYBR?Premix Ex TaqTMⅡ試劑購自TaKaRa生物科技有限公司;人 TGF-β1、IL-17 ELISA試劑盒購自美國R&D公司。
1.3 方法
1.3.1 Th17細胞檢測 取外周血單個核細胞懸液250 μl,加入 PMA(50 ng/ml)、離子霉素(500 ng/ml)培養2小時后加入BD GolgiPlugTM蛋白轉運抑制劑(1 μl/ml),混勻后37℃、5%CO2條件下孵育4 小時。加入20 μl FITC-CD4抗體,溫和混勻,常溫下避光孵育20分鐘;依次加入2 ml預先準備的預冷(4℃)1×固定液、2 ml預先準備的溫(37℃)1×破膜液,37℃避光孵育30分鐘;加入20 μl Alexa Fluor?647-IL-17抗體,室溫避光孵育20分鐘,洗滌細胞后應用FACS Calibur型流式細胞儀檢測,通過Cellquest軟件進行收集分析數據。
1.3.2 CD4+Foxp3+Treg 細胞檢測 在 250 μl外周血單個核細胞懸液中加入20 μl FITC-CD4抗體常溫下避光孵育20分鐘,加入Foxp3 buffer工作液孵育30分鐘后加入20 μl PE-Foxp3,室溫避光孵育20分鐘,洗滌細胞后上流式細胞儀檢測。
1.3.3 實時定量逆轉錄聚合酶鏈反應(RT-PCR)測定Foxp3/RORγt mRNA的表達 利用TRIzol液提取細胞總RNA,利用Fermentas試劑盒進行cDNA第一鏈合成,實驗操作嚴格按照試劑盒說明書進行。參照 Genbank cDNA序列設計 Foxp3、RORγt及GAPDH引物,具體序列如下:Foxp3 5'-TTCCTTGAACCCCATGCCAC-3',5'-TGAAATGTGGCCTGTCCTGG-3',產物大小 131 bp;RORγt 5'-GAGCCAAGGCTCAGTCATGAGAA-3',5'-GTCCCTCTGCTTCTTGGACAT-3',產物大小289 bp;GAPDH 5'-GAGAAGGCTGGGGCTCATTT-3',5'-AGTGATGGCATGGACTGTGG-3',產物大小231 bp。用20 μl SYBR?Premix Ex TaqTMⅡ反應體系進行PCR擴增,擴增反應條件為:95℃ 30秒預變性,95℃ 5秒、60℃ 30秒40個循環。擴增結束后采用Bio-Rad iQ520 Standard Edition Optical System Software V2.0進行數據分析。
1.3.4 ELISA 檢測血漿 TGF-β1、IL-17 水平 利用ELISA試劑盒檢測TGF-β1、IL-17水平,實驗操作嚴格按照試劑盒說明書進行,每個樣本做3個復孔。
1.4 統計學分析 利用SPSS 16.0軟件進行統計學處理,計量資料采用±s表示,兩組比較采用t檢驗,多組比較采用單因素方差分析,當P值有統計學意義時再進行組間比較,以P<0.05認為差異有統計學意義。
2 結果
2.1 各組患者外周血CD4+Foxp3+Treg/Th17細胞百分率變化 流式細胞檢測結果顯示CHB組患者外周血CD4+Foxp3+Treg/CD4+T細胞百分率為(11.27 ±3.17)%,與正常對照組(8.95 ±2.87)%相比明顯升高,差異有統計學意義(P<0.05);但AHB組、AsC組患者外周血CD4+Foxp3+Treg/CD4+T細胞百分率分別為(9.68±2.98)%、(10.25±2.98)%,與正常對照組相比無統計學意義(P >0.05),見圖1A。與正常對照組(0.94±0.28)%相比,AHB組、CHB組患者外周血中CD4+IL-17+/CD4+T細胞百分率(1.34±0.36)%、(1.26±0.32)%顯著升高,差異有統計學意義(P<0.05);而AsC組患者外周血中CD4+IL-17+/CD4+T細胞百分率為(1.07±0.31)%,與正常對照組相比無統計學意義(P>0.05),結果見圖1B。
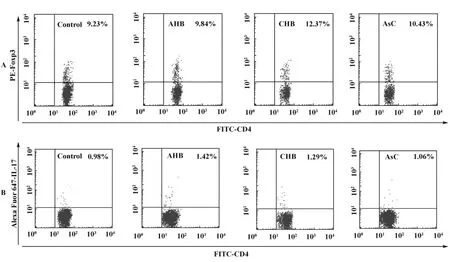
圖1 各組患者外周血CD4+Foxp3+Treg/Th17細胞百分率變化Fig.1 The changes of the percentage of CD4+Foxp3+Treg/Th17 cells in the peripheral blood of different groups
2.2 各組患者Foxp3/RORγt mRNA表達水平比較Foxp3/RORγt是Treg/Th17細胞分化過程中關鍵的轉錄因子,本實驗同時檢測了各組患者外周血Foxp3/RORγt mRNA的表達水平,結果見圖2。與正常對照組(0.42±0.11)相比,CHB組患者外周血Foxp3 mRNA 表達水平(0.56±0.21)明顯升高,差異有統計學意義(P<0.05);但 AHB組(0.46±0.15)、AsC 組(0.48 ±0.17)患者外周血 Foxp3 mRNA表達水平與正常對照組相比無統計學意義(P>0.05)。AHB 組(0.57 ±0.23)、CHB 組(0.51 ±0.16)患者外周血中RORγt mRNA表達水平與正常對照組(0.39±0.12)相比顯著升高,差異有統計學意義(P <0.05);而 AsC 組(0.43 ±0.11)患者外周血中RORγt mRNA表達水平與正常對照組相比無統計學意義(P >0.05)。

圖2 各組患者Foxp3/RORγt mRNA表達水平比較Fig.2 The comparison of the mRNA expression of Foxp3/RORγt in different groups
2.3 各組患者血漿中 TGF-β1、IL-17水平變化CHB組患者外周血TGF-β1水平明顯升高于正常對照組,差異有統計學意義(P<0.05);但AHB組、AsC組患者外周血TGF-β1水平與正常對照組相比無統計學意義(P>0.05),見表2。與正常對照組相比,AHB組、CHB組患者外周血中IL-17水平顯著升高,差異有統計學意義(P<0.05);而AsC組患者外周血中IL-17水平與正常對照組相比無統計學意義(P >0.05),結果見表1。
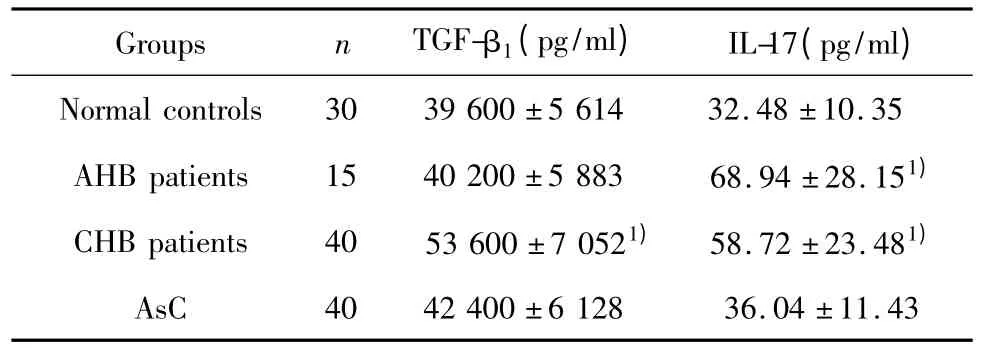
表1 各組患者血漿中TGF-β1、IL-17水平變化Tab.1 Changes of the plasma levels of TGF-β1/IL-17 in different groups
3 討論
隨著對乙型肝炎發病機制研究的不斷深入,目前大多數學者認為乙型肝炎病毒造成的肝臟損傷及轉歸與機體細胞免疫功能及免疫耐受密切相關[1]。CD4+T淋巴細胞是機體免疫應答中的重要部分,在機體免疫調節中發揮關鍵作用,Treg/Th17細胞是新近發現的具有特異細胞膜表面分子和核轉錄因子的兩類CD4+T細胞亞群,Foxp3是Treg細胞的特異性標志,而RORγt是Th17細胞分化過程中關鍵的轉錄激活因子[2,3]。動物實驗和臨床研究均發現在Ⅰ型糖尿病、實驗性自身免疫性腦脊髓炎、多發性硬化癥、銀屑病和重癥肌無力等自身免疫性疾病中Treg細胞數量減少,免疫抑制功能受損,而Th17細胞在類風濕性關節炎、多發性硬化癥、炎性腸病、系統性紅斑狼瘡、原發性膽汁性肝硬化等自身免疫性疾病中數量增多[4,5]。
最近研究發現 Treg/Th17細胞在 HBV、HCV、HIV、巨細胞病毒等感染過程也發揮一定作用[11,12],國內外學者研究發現Treg/Th17細胞在HBV感染疾病中也發揮一定作用[6-9],但研究結果并不完全一致,可能與每個研究的病例選擇、采樣時間、Treg/Th17細胞檢測分選手段不同及流式細胞儀檢測靈敏度等因素有關。為了進一步研究Treg/Th17細胞在HBV發病中的具體作用,我們對不同類型HBV感染者外周血中Treg/Th17細胞、核轉錄因子及相關細胞因子進行了分析。研究證實Foxp3是Treg細胞的特異性標志,因此我們利用CD4+Foxp3+作為檢測Treg細胞的標記;目前對Th17細胞的檢測大多采用CD4+IL-17+標記,本實驗也利用CD4+IL-17+作為檢測Th17細胞的標記。本實驗結果發現在不同類型 HBV感染中,CD4+Foxp3+Treg/Th17細胞數量發生不同變化。在AHB中,主要是Th17細胞明顯增多,其轉錄因子RORγt mRNA及效應分子IL-17的水平也明顯升高,這與國內外的研究結果一致[7,13,14],而 CD4+Foxp3+Treg/細胞、Foxp3 mRNA及TGF-β1水平無明顯變化,但有研究結果顯示AHB患者Treg細胞減少,這可能與采集樣本的時間及流式細胞術標記方法不一致有關[15]。在HIV的研究中發現,病毒感染早期IL-17的水平及Th17細胞數量有所增加,提示Th17細胞可能在病毒感染急性期發揮作用[16]。而在 CHB患者體內 CD4+Foxp3+Treg//Th17細胞數量均升高,但以CD4+Foxp3+Treg細胞升高為主,這與國內外研究結果基本一致[6-8]。AsC患者雖然CD4+Foxp3+Treg細胞雖然與正常對照組相比沒有統計學意義(P>0.05),但數量還是高于正常對照組,而Th17細胞數量與正常對照組相比沒有統計學意義。研究證實在一定的條件特別是在不同細胞因子作用下,Treg細胞、Th17細胞之間可以相互轉化保持機體的免疫平衡狀態,不同類型HBV感染者體內Treg細胞、Th17細胞之間可能互相轉化,進而發揮不同的作用。
綜合目前國內外研究及我們的實驗結果認為在AHB中Th17細胞發揮主導作用,Th17細胞在HBV感染的急性期可能發揮了促進炎癥、引起病理損傷的效應,導致肝臟炎癥和免疫損傷;在CHB中以Treg細胞升高為主,主要發揮免疫抑制作用,病毒無法清除,同時Th17細胞數量也增高,導致一定程度的免疫損傷;在AsC患者體內,Treg細胞在一定程度上增高,發揮了一定的免疫抑制作用,而Th17細胞數量無變化,此時病毒長期存在,但不表現肝細胞損傷。總之,Treg/Th17細胞在不同類型的HBV感染中可能發生轉化,從而發揮不同的作用,但Treg/Th17細胞失衡的原因及其在HBV發病中的具體作用機制尚待進一步深入研究。
1 Liaw Y F,Chu C M.Hepatitis B virus infection[J].Lancet,2009;373(9663):582-592.
2 Gavin M A,Rasmussen J P,Fontenot J D et al.Foxp3-dependent programme of regulatory T-cell differentiation[J].Nature,2007;445(7129):771-775.
3 Crome S Q,Wang A Y,Kang C Y et al.The role of retinoic acid-related orphan receptor variant 2 and IL-17 in the development and function of human CD4+T cells[J].Eur J Immunol,2009;39(6):1480-1493.
4 Shevach E M.Biological functions of regulatory T cells[J].Adv Immunol,2011;112:137-176.
5 Wilke C M,Bishop K,Fox D et al.Deciphering the role of Th17 cells in human disease [J].Trends Immunol,2011;32(12):603-611.
6 Xue-Song L,Cheng-Zhong L,Ying Z et al.Changes of Treg and Th17 cells balance in the development of acute and chronic hepatitis B virus infection[J].BMC Gastroenterol,2012;12:43.
7 Wu W,Li J,Chen F et al.Circulating Th17 cells frequency is associated with the disease progression in HBV infected patients[J].J Gastroenterol Hepatol,2010;25(4):750-757.
8 Stross L,Günther J,Gasteiger G et al.Foxp3+regulatory T cells protect the liver from immune damage and compromise virus control during acute,experimental hepatitis B virus infection[J].Hepatology,2012;56(3):873-883.
9 巫翠萍,覃 西,王華民et al.慢性乙型肝炎患者外周血CD4+CD25+Treg與CD4+和CD8+T淋巴細胞亞群的相關研究[J].中國免疫學雜志,2010;26(3):273-277.
10 中華醫學會傳染病與寄生蟲學會、肝病學分會.病毒性肝炎防治方案[J].中華內科雜志,2001;41(4):62-68.
11 Rouse B T,Sarangi P P,Suvas S.Regulatory T cells in virus infections[J].Immunol Rev,2006;212:272-286.
12 Hartigan-O'Connor D J,Hirao L A,McCune J M et al.Th17 cells and regulatory T cells in elite control over HIV and SIV[J].Curr Opin HIV AIDS,2011;6(3):221-227.
13 Zhang J Y,Zhang Z,Lin F et al.Interleukin-17-producing CD4(+)T cells increase with severity of liver damage in patients with chronic hepatitis B [J].Hepatology,2010;51(1):81-91.
14 朱華芳,王秀麗,張建琴.慢性乙型肝炎患者外周血Th17細胞檢測及意義[J].山東醫藥,2010;50(51):81-82.
15 Xu D,Fu J,Jin L et al.Circulating and liver resident CD4+CD25+regulatory T cells actively influence the antiviral immune response and disease progression in patients with hepatitis B[J].J Immunol,2006;177(1):739-747.
16 Yue F Y,Merchant A,Kovacs C M et al.Virus-specific interleukin-17-producing CD4+T cells are detectable in early human immunodeficiency virus type 1 infection [J].J Virol,2008;82(13):6767-6771.