IL-4、IL-13蛋白表達及抗IL-4、IL-13人源單鏈抗體的篩選①
袁 青 黃 黎 郭夕源 葉迎春 年四季
(瀘州醫學院基礎醫學院,瀘州646000)
白細胞介素(IL)IL-4和IL-13表達于2型輔助性T細胞(Th2)和肥大細胞上,是遺傳性過敏癥和過敏性炎癥疾病如哮喘發病機制中關鍵的細胞因子[1,2]。IL-4和 IL-13都可促進急性炎性過程和呼吸道基本結構的變化,促進其受體在多種類型的細胞上表達[3]。遺傳性過敏癥和過敏性炎癥疾病的一個共同關鍵特征是活化的B淋巴細胞上免疫球蛋白M向免疫球蛋白E種型轉換,而免疫球蛋白M向E轉換在很大程度上是受IL-4/IL-13細胞因子途徑激活的影響[4]。IL-4和IL-13信號通過一共同的途徑:在T細胞表面,通過由IL-4受體 α鏈(IL-4Rα)和共同g鏈之一(用于結合IL-4和IL-13)或IL-13受體α鏈(IL-13Rα)(專一用于IL-13結合)組成的異質二聚體促進IL-4和IL-13的結合。細胞內信號通過酪氨酸激酶介導的信號傳導器和轉錄激活子(STAT6)的磷酸化所啟動,一旦磷酸化,STAT6分子形成二聚體,進入細胞核,激活靶基因轉錄,誘導產生IgE[5-7]。此外,IL-4和IL-13還參與多種免疫調節和促炎活化,對過敏性炎癥及哮喘起著誘導、增強及控制的作用。
基于IL-4和IL-13信號途徑在過敏性炎癥疾病中所發揮的重要作用,制備中和性抗IL-4和IL-13雙特異性抗體,從而封阻它們的生物學活性,對于過敏性炎性疾病的控制具有很大的潛力。本研究從前期構建的天然人源抗體文庫中分別篩選抗IL-4和IL-13單鏈抗體,以用于后期IL-4/IL-13雙特異性抗體的構建。
1 材料與方法
1.1 材料 人外周血取自健康志愿者;mRNA提取試劑盒購自Invitrogen公司;pET的directional TOPO expression kits購自 Invitrogen公司;Oligo dT15和MMLV反轉錄酶購自Promega公司;Ni-NTA親和純化系統購自Invitrogen公司;DNA標準分子量為New England Biolabs公司的100 bp DNA ladder;蛋白Marker為TaKaRa公司的低分子量蛋白Marker;蛋白預染Marker為Invitrogen公司的BenchMarkTMpre-stained protein ladder。大腸桿菌TG1、輔助噬菌體M13K07及pCANTAB-5E噬菌體載體均購自Gene公司。
1.2 方法
1.2.1 IL-4和IL-13基因擴增 從健康志愿者外周血中分離單核細胞,采用mRNA提取試劑盒提取mRNA(Invitrogen,USA)。以mRNA為模板,用Oligo dT15、MMLV 反轉錄酶(promega,USA)反轉錄合成cDNA。從NCBI中下載人IL-4和IL-13基因序列,設計引物。用于擴增IL-4的上游引物IL-4F:5'-CACCTTCCTGCTAGCATGTGCCGGC-3';下游引物 IL-4R:5'-GGAATTCAAGCCCGCCAGGCC-3'。用于擴增IL-13的上游引物IL-13F:5'-CACCTGCCTTGGCGGCTTTGCCTCC-3';下游引物 IL-13R:5'-AGCTGAGACCTTGTGCGGGCA-3'。上游引物 5'端添加了4個堿基CACC用于PCR產物直接連接到pET102/D-TOPO載體上。取合成的 cDNA 2 μl作為模板,進行PCR擴增。PCR擴增程序為94℃ 2分鐘,然后94℃ 30秒,55℃ 30秒,72℃ 30秒,35次循環,最后72℃延伸10分鐘。
1.2.2 IL-4、IL-13的表達純化 取 IL-4、IL-13 PCR產物按照pET Directional TOPO expression kit(Invitrogen,USA)說明書進行連接和轉化入E.coli One Shot-TOPO,提取陽性質粒,測序驗證轉化的DNA序列正確后,將含正確插入序列的pET102/IL-4、pET102/IL-13陽性重組質粒轉化 E.coli BL21,過夜培養后取2 ml接種到含50 μg/ml羧芐青霉素的100 ml LB液體培養基中,37℃,200 r/min培養至A600=0.5左右,加入終濃度為1 mmol/L IPTG于30℃培養5小時后,8 000 r/min離心培養液10分鐘,收集沉淀保存用于SDS-PAGE鑒定和后續純化。
按照購自Invitrogen公司的Ni-NTA親和純化系統中Hybrid(雜交法)純化得到有生物學活性的IL-4和IL-13蛋白,并進行 Western blot鑒定。由于pET102/D-TOPO載體帶有6×His-tag,表達純化的蛋白采用抗組氨酸單克隆抗體(GE Healthcare,來源于小鼠)和馬抗小鼠IgG抗體(Promega,USA)進行鑒定,最后加入底物NBT/BCIP進行顯色。
1.2.3 抗IL-4、IL-13人源單鏈抗體的篩選 前期工作已構建了天然人源性scFv抗體文庫,文庫容量達到了 2.5 ×108,多樣性良好[8]。純化的 IL-4 或IL-33蛋白根據EZ-Link?Sulfo-NHS-LC-Biotinylation試劑盒(Thermo Scientific)進行生物素化。約5×1011TU新鮮制備的scFv抗體文庫噬菌體用封閉液(1×PBS緩沖液中含3%BSA,0.05%Tween 20)于室溫封閉1小時,加入10 μg生物素化蛋白于封閉后的scFv抗體文庫噬菌體中,于37℃緩慢振蕩孵育1小時;按說明書加入鏈霉親和素包被的M-280磁珠(streptavidin-coated Dynabeads M-280,Invitrogen)于混合液中,緩慢室溫振蕩30分鐘捕獲IL-4(IL-13)蛋白-抗IL-4(IL-13)特異性噬菌體復合體。用PBS/Tween 20洗滌磁珠5~10次,然后用0.1 mol/L HCl(pH2.2)使特異性噬菌體解離,感染大腸桿菌TG1后涂2×YTAG(2×YT平板含100 μg/ml氨芐青霉素和2%葡萄糖),從平板上洗下所有菌落用于噬菌體文庫擴增。生物素化的1 μg IL-4或100 ng IL-13用于第2輪和3輪親和篩選。
1.2.4 噬菌體擴增 取40 μl從平板上洗下的抗體文庫菌懸液加入到40 ml 2×YTAG(2×YT平板含100 μg/ml氨芐青霉素和2%葡萄糖)培養基中,于37℃培養至A600=0.2。離心沉淀細菌,用40 ml 2×YTA(2×YT平板含100 μg/ml氨芐青霉素)重懸細菌,加入約6×109TU輔助噬菌體 M13K07,37℃靜止感染15分鐘,然后200 r/min 37℃ 振蕩培養2小時。加入終濃度20 μg/ml卡拉霉素后于32℃振蕩培養過夜。次日用PEG/NaCl溶液(20%PEG,2.5 mol/L NaCl)沉淀噬菌體,用1×PBS重懸噬菌體。
1.2.5 噬菌體 ELISA 包被液(50 mmol/L NaHCO3/Na2CO3,pH9.6)稀釋的 10 μg/ml IL-4 或 IL-13純化蛋白于酶標板內4℃包被過夜。次日封閉液(1×PBS含5% 脫脂奶粉和0.05%Tween-20)37℃封閉酶標孔1小時,洗滌酶標板。加入等倍體積封閉夜室溫封閉30分鐘的噬菌體溶液,37℃孵育1小時。洗滌酶標板后,加入HRP標記抗M13單克隆抗體(Amersham Biosciences)37℃孵育1小時,最后用TMB顯色液顯色,于450 nm處讀取吸光值(A)。
2 結果
2.1 IL-4、IL-13的擴增 從外周血單核細胞mR-NA中成功擴增得到IL-4和IL-13 cDNA片段。IL-4擴增片段為 280 bp,IL-13擴增片段為 252 bp,見圖1。經序列測定及NCBI BLAST比對,所擴增的IL-4和IL-13序列正確。
2.2 IL-4、IL-13的純化及鑒定 pET102/D-TOPO融合表達載體攜帶有氨芐青霉素抗性基因,對于大多數蛋白采用氨芐青霉素作為抗性篩選可對蛋白進行很好的表達。但如果表達量比較低,那么則可以選擇羧芐青霉素。pET102/D-TOPO融合表達載體N端攜帶硫氧還蛋白標簽,C端V5,6×His標簽,有利于增加表達蛋白的可溶性,并有利于目的蛋白的鑒定。表達后,對表達產物進行了SDS-PAGE分析,表達的IL-4目的融合蛋白大小為27 kD,IL-13目的融合蛋白為25 kD左右(包括了兩端連接的標簽,圖2)。表達產物一部分為沒有生物學活性的包涵體,也有一部分蛋白為可溶性蛋白。經用Ni-NTA親和純化系統純化得到有生物學活性的可溶性蛋白并進行Western blot鑒定,證明表達純化的蛋白即為目的蛋白IL-4和IL-13(圖2)。
2.3 抗IL-4、IL-13人源單鏈抗體的篩選 對天然人源scFv抗體文庫分別用IL-4或IL-13生物素化蛋白作為抗原采用免疫磁珠法進行了3輪噬菌體展示篩選后,分別從3輪富集后的抗體文庫中隨機挑取克隆子,進行單個克隆子噬菌體擴增,采用噬菌體ELISA對表達的單個scFv以抗HRP標記的M13單克隆抗體進行檢測,結果顯示:經過3輪富集后,特異性單鏈抗體得到富集,分別有37%左右的 scFv對IL-4顯示陽性,27%左右的scFvs對IL-13顯示陽性(圖3)。
2.4 單鏈抗體的鑒定 挑取分別與IL-4或IL-13結合能力強的4株單鏈抗體,進行了表達、純化和Western blot鑒定,結果顯示表達產物在約32 kD處有靶帶,為表達的單鏈抗體(圖4)。說明從天然的人源抗體文庫中成功地篩選到了抗IL-4和抗IL-13單鏈抗體,但一般從天然抗體文庫中篩選到的單鏈抗體其親和力相對較低,后期我們將根據篩選到的抗IL-4或IL-13單鏈抗體構建突變文庫,以篩選到高親和力單鏈抗體。

圖1 RT-PCR擴增IL-4和IL-13 cDNAFig.1 Amplifaction of the cDNA of IL-4 or IL-13 by RT-PCR
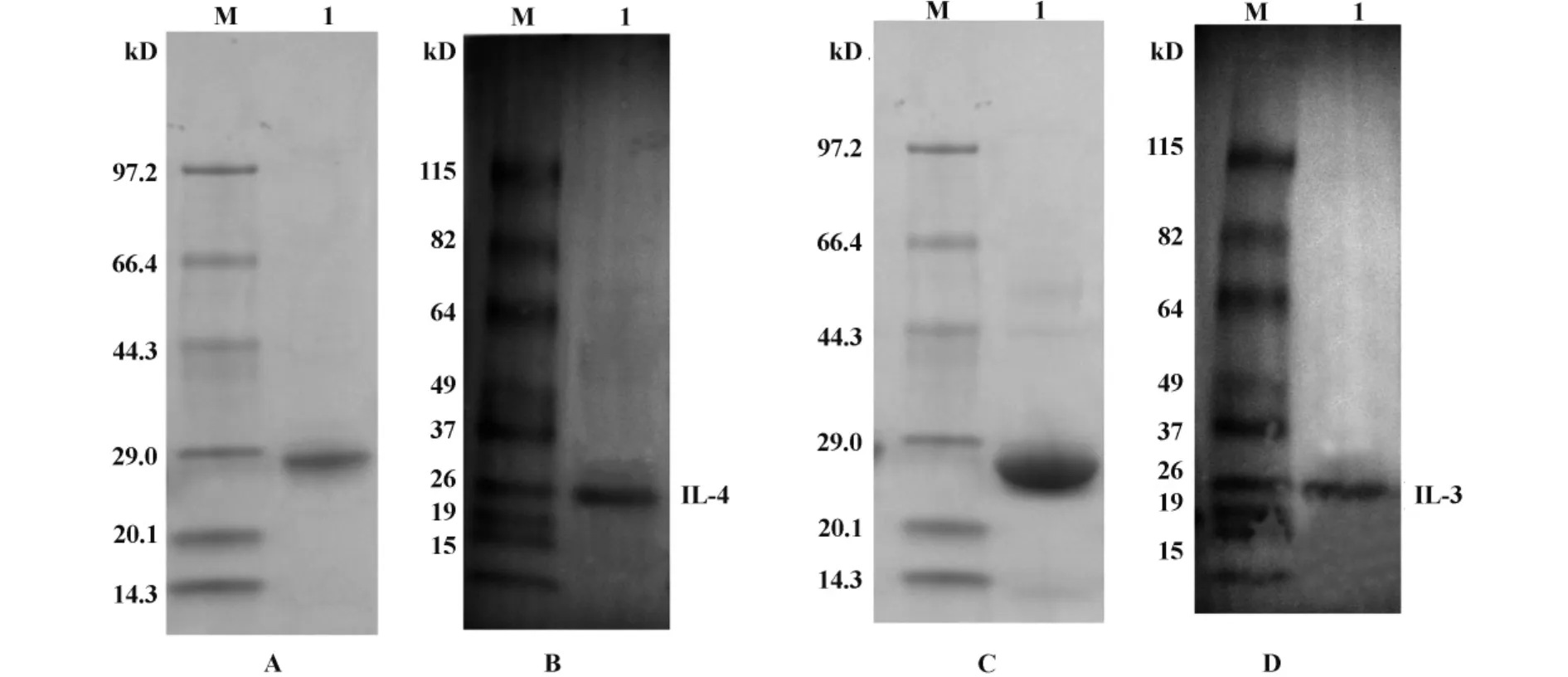
圖2 SDS-PAGE和Western blot鑒定純化的IL-4、IL-13蛋白Fig.2 Purification and identification of IL-4 and IL-13 by Western blot

圖3 ELISA篩選抗IL-4、IL-13單鏈抗體Fig.3 Selection of scFvs against IL-4 or IL-13 by ELISA
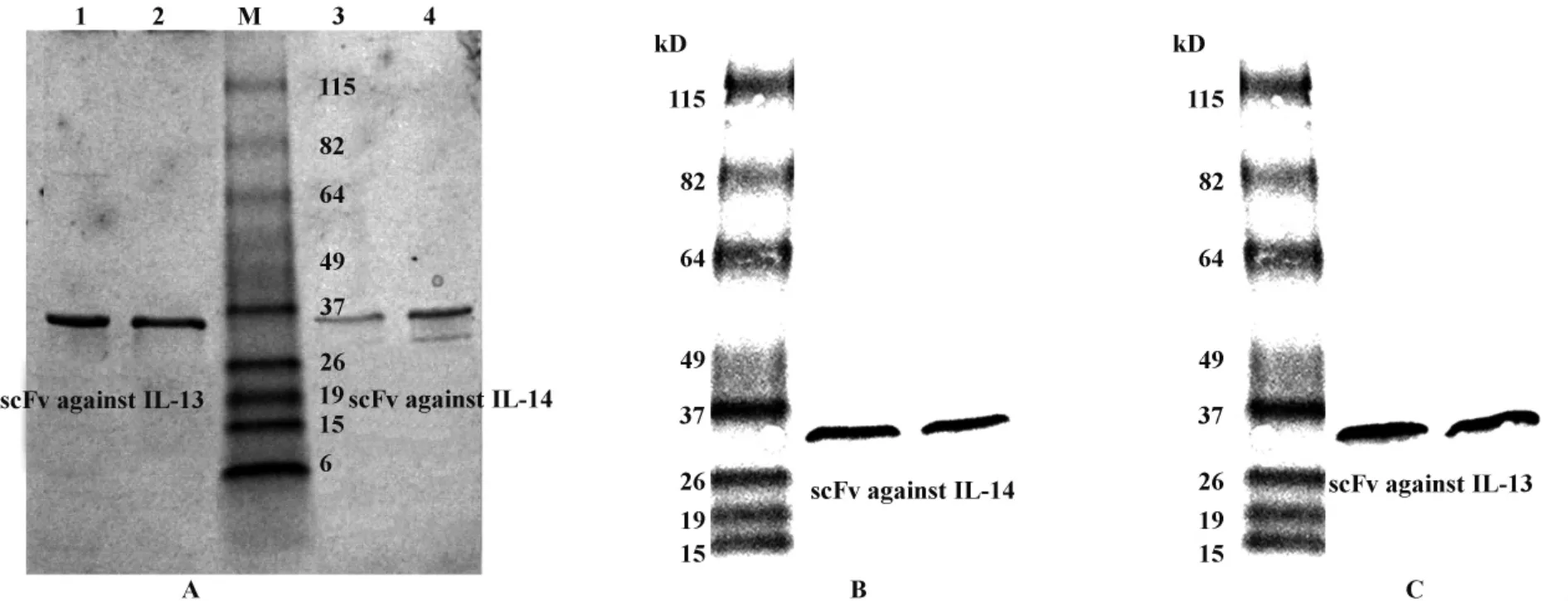
圖4 SDS-PAGE和Western blot鑒定純化的抗IL-4、IL-13單鏈抗體Fig.4 Identification of purified scFvs against IL-4 or IL-13 by SDS-PAGE and Western blot
3 討論
IL-4和IL-13由Th2和肥大細胞產生,通過激活嗜酸性粒細胞、巨噬細胞和樹突狀細胞促進氣道炎癥,增強纖維母細胞的增殖/活化引起氣道重塑;激活B細胞產生IgE;刺激氣道上皮細胞/杯狀細胞產生黏液;激活氣道平滑肌細胞引起氣道高反應性[9],在過敏性炎癥疾病如哮喘中起著重要的作用。靶作用于IL-4和IL-13的生物復合物可為嚴重過敏性炎癥病人提供新的治療手段。小鼠哮喘模型中,單獨敲除或封阻IL-4能抑制過敏性炎癥應答和其他哮喘癥狀[10]。研究發現一種包含人源IL-4R-α鏈胞外蛋白的可溶性IL-4受體片段(Altrakincept),能競爭性地抑制IL-4與受體結合,在早期研究中對人輕度和中度哮喘有一定的效果,但對頑固性哮喘作用不明顯[11]。而又有一些研究者發現用抗IL-13單克隆抗體或可溶性受體可減少肺部炎癥、降低氣道反應性、減少黏液分泌[12]。但單獨阻斷 IL-4或IL-13一種細胞因子的生物學活性,其治療效果并不特別理想。通過深入研究哮喘等過敏性炎癥疾病的致病機理,IL-4/IL-13信號途徑在其致病機制中發揮著關鍵的作用,若同時封阻IL-4和IL-13生物學活性,將會取得更好的治療效果。
本研究中使用的抗體文庫為人源天然抗體文庫,從天然抗體文庫中篩選的單鏈抗體一般親和力較低,所以后期本研究小組將針對篩選的抗IL-4和IL-13單鏈抗體分別構建突變文庫,從而篩選到高親和特異性的抗IL-4和IL-13單鏈抗體,為抗IL-4和IL-13雙特異性的構建打下基礎。
1 Brightling C E,Symon F A,Birring S S et al.TH2 cytokine expression in bronchoalveolar lavage fluid T lymphocytes and bronchial submucosa is a feature of asthma and eosinophilic bronchitis[J].J Allergy Clin Immunol,2002;110:899-905.
2 Robinson D S,Hamid Q,Ying S et al.Predominant TH2-like bronchoalveolar T-lymphocyte population in atopic asthma[J].N Engl J Med,1992;326:298-304.
3 Hershey G K.IL-13 receptors and signaling pathways:an evolving web [J].J Allergy Clin Immunol,2003;111:677-690.
4 Holt P G.Parasites,atopy,and the hygiene hypothesis:resolution of a paradox[J].Lancet,2000;356:1699-1701.
5 Kelly-Welch A E,Hanson E M,Boothby M R et al.Interleukin-4 and interleukin-13 signaling connections maps[J].Science,2003;300:1527-1528.
6 Kabesch M,Schedel M,Carr D et al.IL-4/IL-13 pathway genetics strongly influence serum IgE levels and childhood asthma[J].J Allergy Clin Immunol,2006;117:269-274.
7 Oh C K,Geba G P,Molfino N.Investigational therapeutics targeting the IL-4/IL-13/STAT-6 pathway for the treatment of asthma[J].Eur Respir Rev,2010;115(19):46-54.
8 Qing Y,Huang L,Wang X et al.Construction of human nonimmune library and selection of scFvs against IL-33[J].Appl Biochem Biotechnol,2012;167:498-509.
9 Corry D B,Kheradmand F.Induction and regulation of the IgE response[J].Nature 1999;402:B18-23.
10 Nakajima H,Takatsu K.Role of cytokines in allergic airway inflammat ion [J].Int Arch Allergy Immunol,2007;142:265-273.
11 Borish L C,Nelson H S,Corren J et al.Efficacy of soluble IL-4 receptor for the treatment of adults with asthma[J].J Allergy Clin Immunol,2001;107:963-970.
12 Polte T,Foell J,Werner C.CD137 mediated immunotherapy for allergic asthma[J].J Clin Invest,2006;116:1025-1036.