脈沖射頻及連續射頻對大鼠坐骨神經超微結構的影響觀察
師存偉,敬曉鵬,劉詠梅,冶占福,宋濤
(1.青海大學附屬醫院疼痛科,西寧 810001;2.沈陽市一五七醫院內科,沈陽 110045;3.中國醫科大學附屬第一醫院疼痛科,沈陽 110001)
目前,射頻治療廣泛應用于疼痛治療領域。治 療的疾病主要包括三叉神經痛、枕大神經痛、帶狀皰疹后神經痛、脊神經根性痛以及癌痛等,并取得了明確的臨床效果[1~4]。在疼痛治療中常用的射頻模式包括:脈沖射頻、連續射頻、雙極射頻等,其中連續射頻技術(continuous radiofrequency,CRF)與其他破壞感覺神經傳導通路的方法相似。通過使射頻針尖周圍的靶組織凝固壞死而終止神經信號的傳導[5],在止痛的同時通常會造成相關區域的皮膚感覺減退,而出現麻木或蟻走感。而脈沖射頻(pulsed radiofrequency,PRF)在臨床治療中同樣具有止痛的效果,且不伴有皮膚感覺的減退,但其起效時間較連續射頻慢,同時療效維持時間也有待于深入觀察[6,7]。本研究比較CRF及PRF對大鼠坐骨神經超微結構上的影響,探究PRF的作用機制。
1 材料與方法
1.1 材料
50只雄性Wistar大鼠(青海大學醫學院實驗動物部提供),清潔級,體質量180~220 g。
所有研究動物水、食物供應充足,生長室溫20~26℃,相對濕度55%±15%,無噪音、強光,晝夜節律正常的環境中。50只大鼠隨機分5組,每組10只。
1.2 處理方法
所有大鼠均給予氯胺酮(80 mg/kg)聯合甲苯噻嗪(25 mg/kg)腹腔注射麻醉后,沿右臀部做一斜切口,剝離肌肉,暴露右側坐骨神經(暴露范圍從坐骨切跡至脛、腓神經分叉處)。需接受射頻處理的大鼠射頻針于脛、腓神經分叉前插入坐骨神經,選用美國施樂輝公司生產的PMG-230型射頻儀進行射頻處理。然后依次按如下方式處理大鼠:對照組,僅暴露神經不做任何其他處理;假實驗組,脈沖電極針插入坐骨神經120 s,但電極不通電。PRF-42℃組,按照2 Hz的脈沖射頻頻率,每次持續20 ms,處理時間120 s,溫度設定為42℃;CRF-42℃組,使用連續射頻的方式對坐骨神經進行熱凝,處理時間120 s,溫度設定為42℃;CRF-70℃組,同樣使用連續射頻的方式對坐骨神經進行熱凝,處理時間120 s,溫度設定為70℃。處理結束后,皮膚切口縫合。21 d后處死大鼠,取坐骨神經組織做電子顯微鏡檢查。
1.3 電子顯微鏡檢查
組織標本用2.5%戊二醛固定6 h后,用磷酸鹽緩沖液(pH 7.4)洗滌。再次于1%的四氧化鋨及戊二醛緩沖液(pH 7.4)中固定2 h,梯度乙醇脫水后,使用環氧丙烷洗滌,再以環氧樹脂包埋。用LKB-Nova V型超薄切片機(瑞典)做2 μm半薄切片,將半薄切片用亞甲藍染色,然后用尼康Eclipse600(日本尼康公司)光學顯微鏡進行觀察。對半薄切片進行修整和定位后做60 nm的超薄切片,并用醋酸鈾和檸檬酸鉛染色5 min,然后用JEM 1200EX透射電鏡和Orius SC 1000型數字化相機(日本Jeol有限公司)進行電子顯微鏡觀察和照相。
1.4 數據分析
從每個樣本中隨機選取2張切片,每組10個樣本共20張切片,從每張切片內選出10個髓鞘軸突進行觀察分析并分級。病理分級標準[8]:0級:正常結構;1級:髓鞘結構分層;2級:髓鞘結構斷裂;3級:出現蜂巢樣結構;4級:髓鞘崩解形成髓鞘球。
1.5 統計學處理
采用SPSS 13.0軟件對數據進行分析,行χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠電鏡觀察結果
實驗過程中無大鼠傷口感染、自殘、死亡事件發生。各組大鼠無髓鞘軸突超微結果未見明顯異常。對照組大鼠大部分的髓鞘軸突顯示正常(圖1)。假實驗組中大鼠大部分髓鞘軸突顯示正常,但小部分表現為磷脂脫落(圖2),這可能與研究過程中缺乏灌注有關。PRF-42℃組大鼠未發現存在嚴重變性的髓鞘軸突。大部分軸突僅表現為磷脂脫落,并且可同時觀察到新形成的髓鞘軸突(圖3)。CRF-42℃組大鼠約1/3的髓鞘軸突可以觀察到嚴重的變性(Wallerian變性)。這些變性的軸突可見髓鞘崩脫、形成髓鞘球,細胞骨架成絮狀或消失,線粒體膨脹或消失。損壞的軸突只存在電極作用部位,而遠離該處的組織中髓鞘軸突形態正常。該組同樣觀察到新形成的髓鞘軸突(圖4)。CRF-70℃組大鼠大部分髓鞘軸突可以觀察到嚴重的變性(Wallerian變性),同時可見髓鞘崩脫、形成髓鞘球,細胞骨架成絮狀或消失,線粒體膨脹或消失。該組大鼠所有的髓鞘軸突均遭到不同程度破壞,電鏡下所有的軸突均表現出病理改變(圖5)。
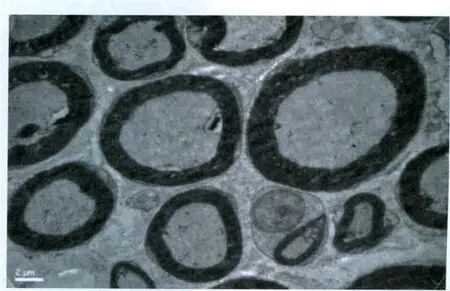
圖1 對照組電鏡下超微結構觀察×6000Fig.1 Observation of ultrastructure under electron microscope inthe control group×6 000
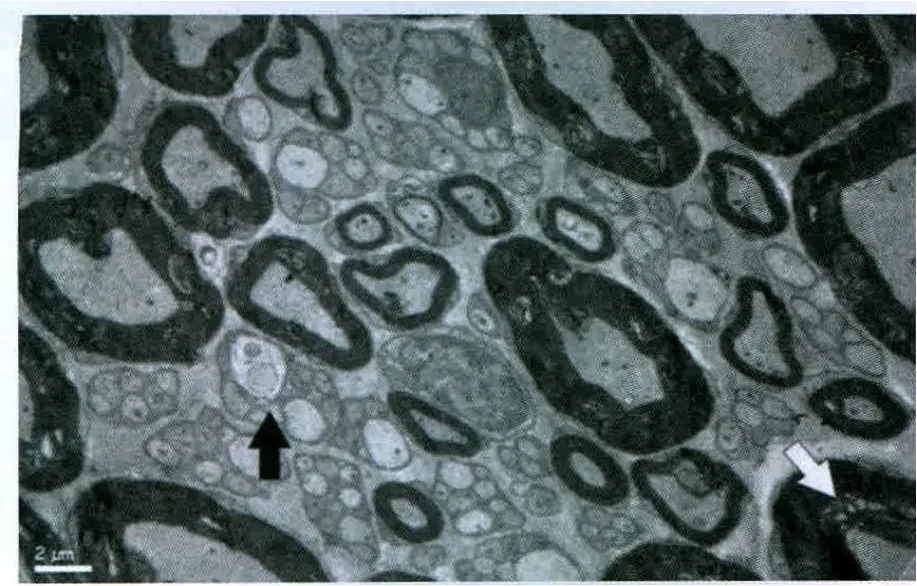
圖2 假實驗組電鏡下超微結構觀察(白色箭頭指示脫落的磷脂,黑色箭頭指示無髓鞘軸突)×6000Fig.2 Observation of ultrastructure under electron microscope inthe sham group (white arrow:loss of the phospholipids,black arrow:unmyelinated axon)×6 000
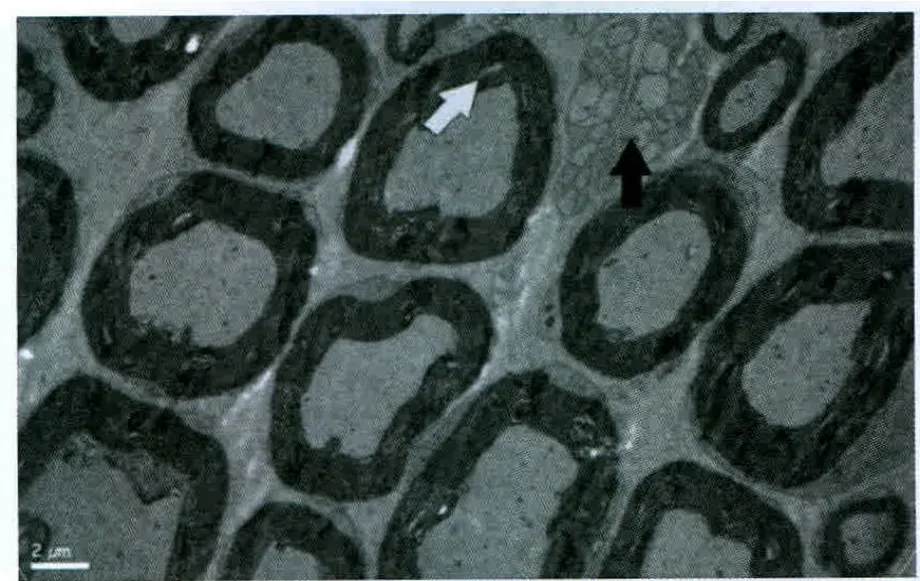
圖3 PRF-42℃組電鏡下超微結構觀察(白色箭頭指示脫落的磷脂,黑色箭頭指示無髓鞘軸突)×6000Fig.3 Observation of ultrastructure under electron microscope inthe PRF-42 ℃ group (white arrow:loss of the phospholipids,black arrow:unmyelinated axon)×6000
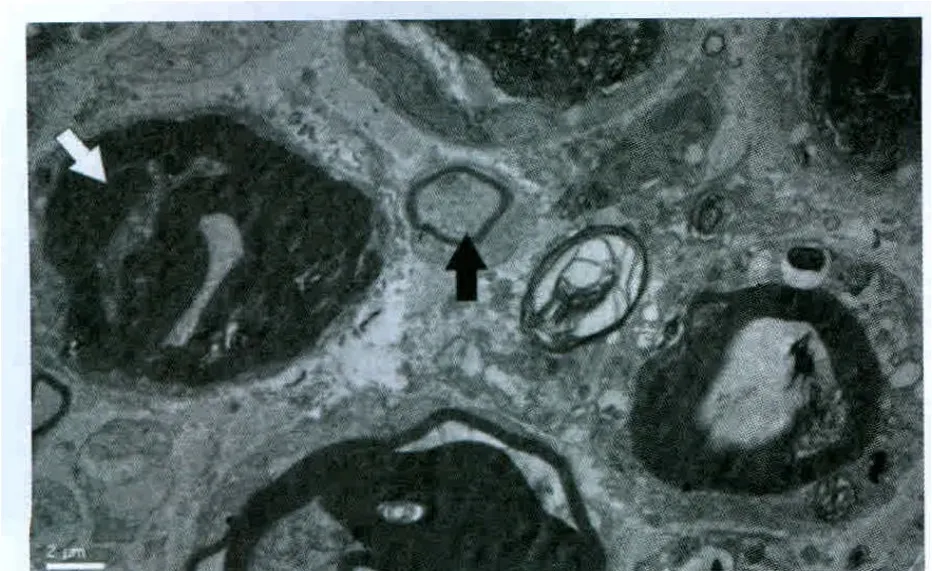
圖4 CRF-42℃組電鏡下超微結構觀察(白色箭頭指示髓鞘球,黑色箭頭指示腫脹的線粒體)×6000Fig.4 Observation of ultrastructure under electron microscope inthe CRF-42 ℃ group(white arrow:ovoid myelin,black arrow:swollen mitochondria)×6000
2.2 各組分級情況比較
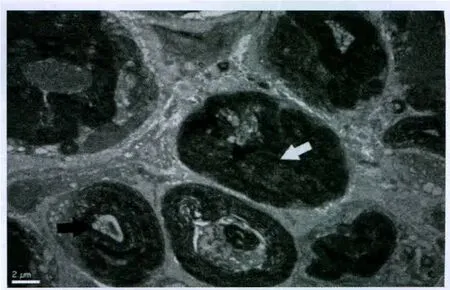
圖5 CRF-70℃組電鏡下超微結構觀察(白色箭頭指示髓鞘球,黑色箭頭指示腫脹的線粒體)×6000Fig.5 Observation of ultrastructure under electron microscope inthe CRF-70 ℃ group (white arrow:ovoid myelin,black arrow:swollen mitochondria)×6000
對照組及假實驗組未觀察到2~4級變性,PRF-42℃組展示較好的分級情況,而CRF-70℃組分級情況最差。所有實驗組與對照組比較分級均有統計學差異(P<0.05)。而且PRF-42℃組、CRF-42℃組、CRF-70℃組3組間兩兩比較差異也有統計學意義(P<0.05),見表1。
3 討論
CRF探針溫度一般設定為60~80℃,這可造成靶組織的凝固性壞死。因此,CRF可以有效破壞選擇區域的神經,造成持續的真皮區域的感覺遲鈍而產生長久的止痛效果。PRF被認為是一種溫和而安全的射頻技術,與CRF比較PRF對周圍組織及神經的損傷較輕[9]。而 Van Zundert等[10]的研究發現,慢性盆腔疼痛、慢性三叉神經疼痛患者行PRF治療后未發現明確不良反應。何云武等[11]分析了24例腰椎間盤突出患者行PRF的治療效果,發現PRF治療與常規治療比較可以顯著降低患者術后1周、1個月及3個月的疼痛評分,制痛效果明顯。
以往認為射頻電流只對小的無髓神經纖維有影響。而Kanpolat等[12]認為CRF的止痛作用是通過破壞有髓神經及無髓神經纖維實現的。本研究發現CRF及PRF均不會造成無髓神經纖維的損害,而CRF-42℃可造成約1/3的髓鞘軸突可以觀察到嚴重的變性,造成軸突的髓鞘崩脫、形成髓鞘球,細胞骨架成絮狀或消失,線粒體膨脹或消失。隨著CRF溫度升高,70℃時大部分髓鞘軸突可以觀察到嚴重變性,并且神經及其周圍組織均有不同程度損害。說明CRF的止痛作用與有髓神經纖維的損害有關。然而脈沖射頻治療疼痛的機制至今尚未完全闡明。國外學者[7]認為PRF止痛的機制可能與其在神經組織間形成的電動勢有關,這可以造成諸如質膜破壞、影響細胞主要功能的分子鏈破壞等細胞結構的改變。本研中PRF-42℃與CRF-42℃神經病變的分級存在明顯差異,前者顯著低于后者,并且超微結構的改變更加輕微。再次說明PRF的止痛作用與熱效應關系不大。而本研究中PRF組僅觀察到有髓神經纖維磷脂的脫落,推測其鎮痛作用可能與此有關。因為髓鞘的脫落可造成神經傳導阻斷,進而發揮止痛作用。而磷脂層的脫落可能與電磁場對細胞膜的作用有關。
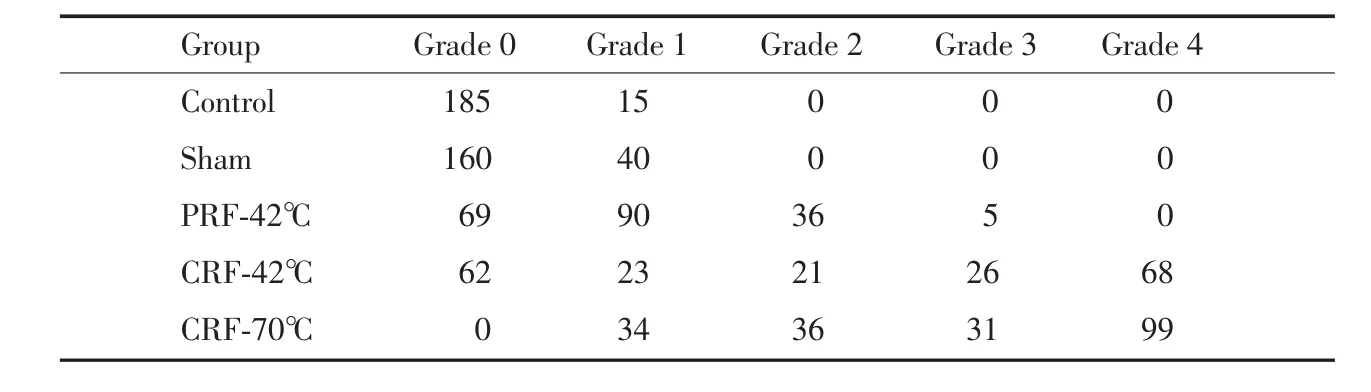
表1 各組超微結構分級情況Tab.1 Grading scores of ultrastructure in different groups
綜上所述,脈沖射頻時的高頻電磁場可能導致可逆性的磷脂脫落;而有髓神經纖維磷脂脫落則可能阻斷神經沖動的傳導,發揮鎮痛效果。PRF的止痛機制可能與熱作用無關。本研究觀察了不同射頻參數對正常神經纖維超微結構的影響,并結合臨床現象進行初步的分析,為后續的研究奠定了基礎。今后可以通過建立不同機制的疼痛模型,研究射頻對病理狀態下的神經纖維超微結構的影響及相關的動物行為學變化。另外在臨床上,以“神經節”和“神經纖維”不同部位為靶點進行的射頻治療具有不同的臨床效果,今后可以對“神經節”及“神經纖維”等不同部位的射頻治療進行比較,深入探討射頻在疼痛治療中的機制。
[1]羅高權,肖芳,楊忠民,等.脈沖射頻不同作用時間對三叉神經痛療效的影響[J].廣東醫學,2011,32(12):1582-1583.
[2]葉坪,陳堅,倪磊.比較不同類型射頻刀頭行半月板成形后患者關節疼痛及屈曲角度的變化[J].中國組織工程研究與臨床康復,2009,13(35):6969-6972.
[3]崔婷,張慧珍,杜茸茸.腰椎間盤射頻熱凝靶點消融術的手術配合體會[J].中國社區醫師(醫學專業),2012,14(28):302.
[4]Ahmed M,Raslan,MD.Percutanious computed tomograthy-guided radiofrequency alation of upper spinal cord pain pathways for cancerrelated pain[J].Neurosurgery,2008,62(3):226-234.
[5]古建軍,張騁,丁永國.經皮穿刺射頻熱凝聯合臭氧消融治療頸椎間盤突出癥[J].寧夏醫學雜志,2012,34(3):256-257.
[6]公維義,蘇建生,陳華.脈沖射頻和射頻熱凝術對臂叢神經損傷的病理學觀察[J].中國康復理論與實踐,2011,17(11):1003-1006.
[7]Sluijter ME,van Kleef M.Characteristics and mode of action of radiofrequency lesions[J].Curr Rev Pain,1998,2(5):143-150.
[8]Chao SC,Lee HT,Kao TH,et al.Percutaneous pulsed radiofrequency in the treatment of cervical and lumbar radicular pain[J].Surg Neurol,2008,70(1):59-65.
[8]Kaptanoglu E,Palaoglu S,Surucu HS,et al.Ultrastructural scoring ofgraded acute spinal cord injury in the rat[J].J Neurosurg,2002,97(1 Suppl):49-56.
[9]李倩燁,陳華梅,李吉艷,等.脈沖射頻術與射頻熱凝術對兔股神經的影響[J].昆明醫科大學學報,2012,9:34-37.
[10]Van Zundert J,Brabant S,Van de Kelft E,et al.Pulsed radiofrequency treatment of the Gasserian ganglion in patients with idiopathic trigeminal neuralgia[J].Pain,2003,104(3):449-452.
[11]何云武,龍慧,鄒聰,等.腰椎背根神經節脈沖射頻術治療腰椎間盤突出癥的療效觀察[J].中南醫學科學雜志,2013,41(1):28-30.
[12]Kanpolat Y,Onol B.Experimental percutaneous approach to the trigeminal ganglion in dogs with histopathological evaluation of radiofrequency lesions[J].Acta Neurochir Suppl(Wien),1980,30(Suppl 1):363-366.

