嗎啡誘導的斑馬魚條件性位置偏愛模型的研究
彭 菊,劉 偉,羅超華,陳小輝,張文清,莫志賢
斑馬魚(Danio rerio,zebrafish),是一種常見的熱帶觀賞魚,因其體側具有像斑馬一樣縱向的暗藍與銀色相間的條紋而得名。其具有體積小,產卵量大,胚胎繁殖迅速且整體透明,易于活體觀察[1]等特點,作為一種新的模式生物越來越多的應用于各種人類疾病模型的建立以及藥物的高通量篩選。與大鼠、小鼠等哺乳動物相比,斑馬魚給藥量少且給藥方式簡單;與果蠅等低等動物相比,斑馬魚基因圖譜與人類有極大的相似;與細胞模型相比,斑馬魚擁有整體生物優勢以及能夠進行靶向給藥的特點[2-3]。利用它的眾多優點,斑馬魚作為一種新型模式生物在行為學上的應用前景也逐漸被研究者所認識,利用斑馬魚進行藥物依賴研究的報道也逐漸出現[1,4]。
目前,國外利用斑馬魚進行藥物依賴的研究主要集中在研究斑馬魚對成癮藥物產生的學習記憶[5]、成癮藥物誘導的位置偏愛[6-8]、成癮藥物戒斷癥狀研究[8-9]、成癮藥物引起的斑馬魚腦內蛋白表達的改變以及相關的行為學變化[9-10]等幾個方面。國內也陸續開始了對斑馬魚藥物依賴機制的研究[4,11]。本研究利用條件性位置偏愛(conditioned place preference,CPP)原理并結合斑馬魚的生物學特性,旨在建立斑馬魚的嗎啡依賴模型,為進一步研究藥物依賴的戒斷提供科學依據。
1 材料與方法
1.1 材料
1.1.1 藥品 鹽酸嗎啡,解放軍總后勤部藥品供應站提供,批號:710303。魚用生理鹽水,自配,NaCl濃度為100 mmol·L-1。Tricaine methanesulfonate(MS222),購自 Sigma公司。
1.1.2 儀器 Noldus EthoVision XT 8.5(荷蘭 Noldus公司提供)。
1.1.3 動物 野生型AB系斑馬魚,由南方醫科大學斑馬魚實驗中心提供,魚齡:4~7個月。養魚系統為北京愛生公司凈水系統,系統溫度控制在28.5℃ ~29.5℃;鹽濃度為0.03% ~0.04%;pH 7.2~7.6;晝夜光照控制14 h光照(8∶30 am~10∶30 pm),10 h黑夜。正常喂食,每天兩次,實驗用魚♀♂各半(50∶50),且在實驗前于獨立安靜的環境中適應性喂養3~5 d。
1.2 方法
1.2.1 CPP箱的制作 參考小鼠CPP箱的制作方法及參考文獻[12],取塑料魚缸,長16 cm,寬9 cm,高9 cm。將魚缸分為等體積的兩個箱,一箱為褐色,一箱為透明,兩箱中間用一個透明的活動擋板隔開。
1.2.2 斑馬魚基線測定 斑馬魚在獨立的CPP箱(抽出擋板)中適應性喂養2d,CPP箱中水位不低于5 cm。于d 3觀察其15 min,以頭部位置為準記錄斑馬魚在兩箱中活動時間。基線測定結果表明大于95%的斑馬魚偏愛于褐色箱體,故以CPP箱的褐色箱體部分作為斑馬魚的偏愛箱,透明箱體部分為非偏愛箱(伴藥箱)。此后斑馬魚基線測定以其在非偏愛箱中的活動時間≥8 min為合格。
1.2.3 CPP模型建立 (1)分組:取基線測定合格的斑馬魚60 條,稱重,隨機分為生理鹽水組,30、40、50、60、90 μg·g-1嗎啡劑量組,每組10條,♀♂各半。(2)觀察:于正式實驗d1測定斑馬魚15 min內于CPP箱透明側(非偏愛箱)的活動時間,并用Noldus EthoVision XT 8.5軟件追蹤斑馬魚在CPP箱中的運動軌跡(5 min)。(3)訓練:于實驗d 2、d 4、d 6將斑馬魚浸入50 mg·L-1的tricaine methanesulfonate溶液中進行麻醉(麻醉以用手能順利撈起斑馬魚但其仍保持正常游動姿勢為度),用微量注射器迅速腹腔注射各濃度嗎啡(空白組注射生理鹽水),再將其放入系統水中30 s,待其麻醉恢復后,放入伴藥箱內40 min,同時用透明擋板隔開,訓練結束后將斑馬魚移至較大的有藍色環境的魚缸中,并清洗CPP箱。d 3、d 5同一時間斑馬魚腹腔注射與嗎啡同體積生理鹽水,將其放入偏愛箱內40 min。(4)觀察:在末次給藥24 h后,即d 7再次測定斑馬魚在非偏愛箱中的活動時間并比較訓練前后各條斑馬魚在伴藥箱活動時間的差值(斑馬魚訓練后在伴藥箱中的活動時間﹣斑馬魚訓練前在伴藥箱中的活動時間),同時分析斑馬魚在非偏愛箱中的運動軌跡及運動總路程。
2 結果
2.1 斑馬魚訓練前后在伴藥箱的活動時間變化 Tab 1顯示,以腹腔注射給藥的方式,各組斑馬魚訓練之前在伴藥箱的活動時間無差異(P>0.05),而腹腔注射嗎啡并進行連續3 次訓練后,40、50、60 μg·g-1嗎啡組斑馬魚在伴藥箱中的活動時間比訓練前均明顯增加(P<0.05),而比較訓練前后時間的差值,40、50 μg·g-1嗎啡組斑馬魚與生理鹽水組比較差異有顯著性(P<0.01),說明腹腔注射40~50 μg·g-1嗎啡并對斑馬魚進行連續3次訓練能夠誘導其CPP的形成。
Tab 1 Change of activity time of zebrafish in non-preferred compartment between pre-and post training by intraperitoneal injection of morphine(ˉ ± s,n=10)
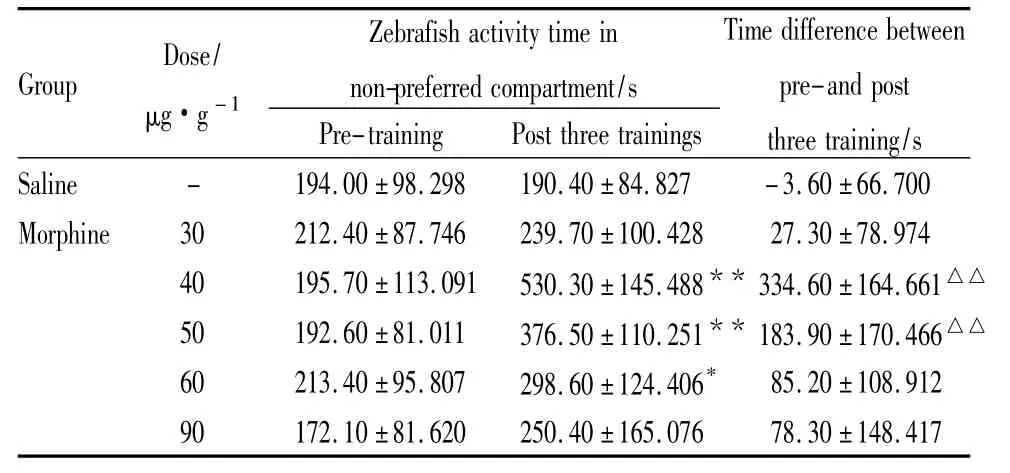
Tab 1 Change of activity time of zebrafish in non-preferred compartment between pre-and post training by intraperitoneal injection of morphine(ˉ ± s,n=10)
*P<0.05,**P<0.01 vs pre-training;△△P<0.01 vs saline
Group Dose/μg·g-1 Zebrafish activity time in non-preferred compartment/s Pre-training Post three trainings Time difference between pre-and post three training/s Saline - 194.00 ±98.298 190.40±84.827 -3.60±66.700 Morphine 30 212.40 ±87.746 239.70 ±100.428 27.30 ±78.974 40 195.70 ±113.091 530.30±145.488** 334.60±164.661△△50 192.60 ±81.011 376.50±110.251** 183.90±170.466△△60 213.40 ±95.807 298.60 ±124.406* 85.20 ±108.912 90 172.10 ±81.620 250.40 ±165.076 78.30 ±148.417
2.2 斑馬魚訓練前后在伴藥箱中的運動總路程變化 利用Noldus EthoVision XT 8.5軟件分析出斑馬魚5 min內在伴藥箱中的運動總路程。由Tab 2可知,各組斑馬魚訓練之前,在伴藥箱中的運動路程無差異,而訓練之后,40、50 μg·g-1嗎啡組斑馬魚在伴藥箱中的總路程明顯延長(P<0.01)。
Tab 2 Change of total movement path of zebrafish innon-preferred compartment within 5min(ˉ±s,n=10)
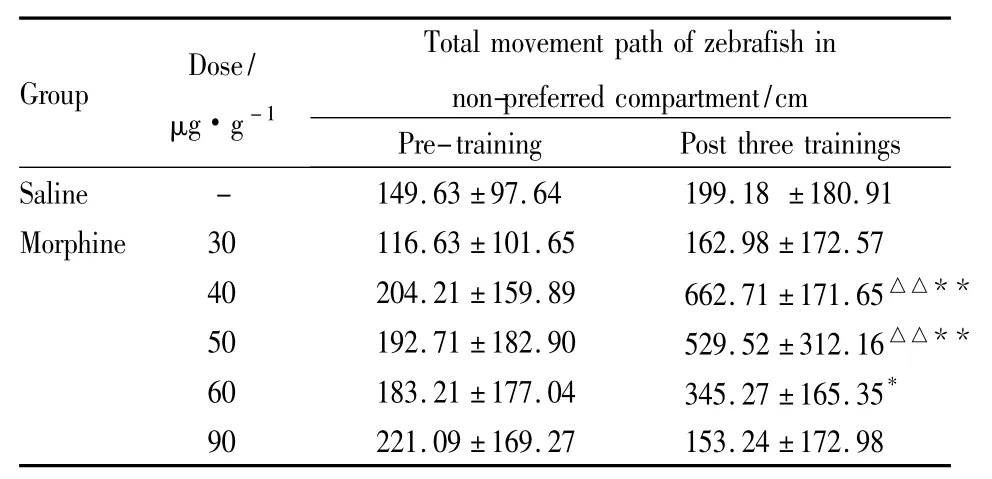
Tab 2 Change of total movement path of zebrafish innon-preferred compartment within 5min(ˉ±s,n=10)
*P<0.05,**P <0.01 vs pre-training;△△P <0.01 vs saline
Group Dose/μg·g-1 Total movement path of zebrafish in non-preferred compartment/cm Pre-training Post three trainings Saline - 149.63 ±97.64 199.18 ±180.91 Morphine 30 116.63 ±101.65 162.98 ±172.57 40 204.21 ±159.89 662.71 ±171.65△△**50 192.71 ±182.90 529.52 ±312.16△△**60 183.21 ±177.04 345.27 ±165.35*90 221.09 ±169.27 153.24 ±172.98
2.3 斑馬魚造模前后在CPP箱的活動軌跡圖 斑馬魚連續3次注射嗎啡后,其在非偏愛箱中的運動軌跡均有增多,而以注射40 μg·g-1的嗎啡斑馬魚的軌跡改變最為明顯,見Fig 1。

Fig 1 Activity route of two zebrafish groups in CPP compartment
3 討論
CPP的形成機制可能與一些經典的條件反射實驗相似,其基本原理是以某種自然獎勵或成癮藥物作為非條件刺激,將其與某個特定的非獎賞中性刺激(如某特定環境)反復相聯系之后,后者便可獲得某種獎賞特性,即這一特定非獎賞中性刺激可以誘發最初與非條件刺激聯系在一起的那種非條件行為效應[13]。CPP實驗是目前國內外評價藥物精神依賴性的經典實驗模型,也是廣泛應用于尋找抗覓藥行為的有效工具。本研究通過對嗎啡誘導的斑馬魚CPP條件的探索,旨在選取建立斑馬魚嗎啡依賴模型的最佳條件。本研究前期采用浸泡給藥的方法,單次訓練和連續3次訓練之后,均無法使其在伴藥箱中的活動時間明顯增強。導致該結果的原因可能是嗎啡藥液的濃度不夠,也可能因為浸泡給藥斑馬魚對藥物的吸收程度過低,或者訓練次數的不足。
通過改進給藥方法,采用腹腔注射給藥的方式,斑馬魚在單次注射嗎啡之后即能產生不同程度的CPP效應,而通過連續3次訓練之后,注射40~60 μg·g-1的嗎啡都能使斑馬魚在伴藥箱中的活動時間延長,但注射90 μg·g-1的嗎啡卻不能引起斑馬魚在伴藥箱中的活動時間延長,說明過高劑量的嗎啡對斑馬魚形成CPP無益。與生理鹽水組相比,僅40、50 μg·g-1的嗎啡能引起斑馬魚訓練前后在伴藥箱的活動時間差值明顯增大,說明誘導斑馬魚形成CPP的最佳嗎啡濃度為 40 ~50 μg·g-1。
斑馬魚經過連續 3 次訓練之后,40、50 μg·g-1嗎啡組在伴藥箱中的運動總路程明顯延長。表明給藥訓練之后,斑馬魚對伴藥箱的偏愛大大增加,無論是在伴藥箱中的活動時間,還是運動總路程,都證明連續3次注射嗎啡的訓練能誘導斑馬魚位置偏愛的形成。而綜合斑馬魚訓練前后在伴藥箱中活動時間和運動總路程的結果,初步探索出采用腹腔注射給予40~50 μg·g-1嗎啡,并經過連續3次訓練,能建立穩定的斑馬魚CPP模型。
斑馬魚連續注射不同劑量的嗎啡,僅 40、50 μg·g-1嗎啡組的斑馬魚在伴藥箱中的活動時間明顯增加,運動總路程明顯延長,說明斑馬魚產生CPP效應的嗎啡劑量范圍較窄。當嗎啡劑量低于40 μg·g-1時,斑馬魚的CPP效應明顯降低,當劑量為30 μg·g-1時,斑馬魚在CPP箱中的活動時間變化差異已無顯著性。因此,在建模過程中嗎啡的濃度選擇非常重要,這也是本模型建立成功的關鍵所在。
在研究中,除了對嗎啡劑量、訓練次數以及給藥方法的控制外,應要求對實驗過程中環境溫度,系統水溫嚴格控制,并盡最大可能避免人為因素的干擾。腹腔注射給藥具有給藥劑量小且劑量準確的優點。斑馬魚腹腔注射的操作應迅速、準確,減小操作對斑馬魚行為的影響,注射時可用一塊帶有凹槽(寬度與斑馬魚體寬接近,凹槽中添加系統水)的瓊脂板對處于淺麻醉狀態的斑馬魚進行固定,可避免其在操作過程中離開水時間過長所造成的傷害。在每次斑馬魚給藥訓練結束之后,應及時用70%的乙醇清洗CPP箱,因斑馬魚對氣味的刺激極其敏感,當使用同一個CPP箱進行多輪或多次實驗時,斑馬魚可能因嗅覺的影響模仿前一條斑馬魚的軌跡來運動,而不是根據其本身在CPP中的天然偏愛進行活動。
斑馬魚因具有生長快速,研究周期短,給藥劑量小且飼養方便等諸多優點,越來越多地應用于各種藥物的高通量篩選。與哺乳動物相比,斑馬魚神經系統相對簡單,但其能極好地控制學習、成癮、抑郁等復雜行為,這種組織與系統間簡單性與復雜性的良好平衡,使得其在研究藥物對其行為影響方面極具優勢[12]。國外研究表明,斑馬魚體內存在與哺乳動物功能相似的阿片受體,而且該受體與嗎啡的成癮性有關[14]。Mathur等[7]研究結果也顯示將斑馬魚暴露于低劑量的嗎啡即能誘導其在嗎啡藥液側活動時間的延長。目前,國內針對藥物依賴的研究主要集中于大、小鼠模型,而單一的模式生物在研究中有很大的局限性,因此,將斑馬魚引入毒癮醫學領域,利用斑馬魚的各項生物學優勢為藥物依賴研究服務,不僅豐富了藥物依賴的模型,而且為將來成癮戒斷藥物的篩選提供更有力的保障。
[1] 孫智慧,賈順姬,孟安明.斑馬魚:在生命科學中暢游[J].生命科學,2006,18(5):431-6.
[1] Sun Z H,Jia S J,Meng A M.Zebrafish:swim in the life science[J].Chin Bull Life Sci,2006,18(5):431 -6.
[2] Lieschke G J,Currie P D.Animal models of human disease:zebrafish swim into view[J].Nat Rev Genet,2007,8(5):353 -67.
[3] 鄒蘇琪,殷 梧,楊昱鵬,等.斑馬魚行為學實驗在神經科學中的應用[J].生物化學與生物物理進展,2009,36(1):5 -12.
[3] Zhou S Q,Yin W,Yang Y P,et al.The ethology application of zebrafish in neuroscience[J].Prog Biochem Biophys,2009,36(1):5-12.
[4] 顏 慧,宮澤輝.利用斑馬魚建立成癮性藥物對運動機能及認知功能影響的評價模型[J].中國藥理學通報,2012,28(8):1173-7.
[4] Yan H,Gong Z H.Zebrafish as a model system for assessing effects of addictive drugs on locomotor activity and cognitive performance[J].Chin Pharmacol Bull,2012,28(8):1173 -7.
[5] Stewart A,Wong K,Cachat J,et al.Zebrafish models to study drug abuse-related phenotypes[J].Rev Neurosci,2011,22(1):95 -105.
[6] Klee E W,Ebbert J O,Schneider H,et al.Zebrafish for the study of the biological effects of nicotine[J].Nicotine Tob Res,2011,13(5):301-12.
[7] Mathur P,Lau B,Guo S.Conditioned place preference behavior in zebrafish[J].Nat Protoc,2011,6(3):338 - 45.
[8] Khor B S,Jamil M F,Adenan M I,et al.Mitragynine attenuates withdrawal syndrome in morphine-withdrawn zebrafish[J].PLoS One,2011,6(12):e28340.
[9] Cachat J,Canavello P,Elegante M,et al.Modeling withdrawal syndrome in zebrafish[J].Brain Res,2010,208(2):371 -6.
[10] Macho S F,Rodriguez R E.Expression of the nociceptin receptor during zebrafish development:influence of morphine and nociceptin[J].Int J Dev Neurosci,2009,27(4):315 - 20.
[11]陳毅飛,翁建霖,張文清,等.甲基苯丙胺誘導的斑馬魚位置偏愛模型研究[J].中華行為醫學與腦科學雜志,2011,20(9):772-4.
[11] Chen Y F,Weng J L,Zhang W Q,et al.The study on methamphetamine-induced conditioned place preference model in zebrafish[J].Chin J Behav Med Brain Sei,2011,20(9):772 -4.
[12] Ninkovic J,Bally-Cuif L.The zebrafish as a model system for assessing the reinforcing properties of drugs of abuse[J].Methods,2006,39(3):262 -74.
[13]鄧慧瓊,周旭輝,張登科,等.條件性位置實驗方法及非傾向性實驗設計在藥物依賴研究中的應用[J].中國藥物依賴性雜志,2006,15(2):8-11.
[13] Deng H Q,Zhou X H,Zhang D K,et al.The applications of conditioned place experimental and non-tendentious experimental design in the study of drug dependence[J].Chin J Drug Depend,2006,15(2):8-11.
[14] de Velasco E M,Law P Y,Rodriguez R E.Mu opioid receptor from the zebrafish exhibits functional characteristics as those of mammalian mu opioid receptor[J].Zebrafish,2009,6(3):259 -68.

