鯉魚主要組織中金屬硫蛋白提取工藝的研究
李 華,許曉曦,* ,呂萍萍,邵欣欣,關朝亮
(1.東北農業大學食品學院,黑龍江哈爾濱150030;2.綏芬河出入境檢驗檢疫局,黑龍江綏芬河157300)
金屬硫蛋白(Metallothionein,簡稱MT)是一類廣泛存在于生物體中的低分子量、富含半胱氨酸的、能被金屬誘導產生的金屬結合蛋白。廣泛存在于生物界,它涉及許多生理和病理學過程,具有重要的生物學功能[1-2]。自從1957年Margashes和Vallee首次發現MT以來,MT成為基礎和應用科學研究的熱點之一,其研究和開發涉及農業、醫藥保健、生物工程、環境保護等各個領域[3]。對于金屬硫蛋白(MT)的研究,國內外主要集中在實驗室提取、純化和檢測以及應用上。在實際生產中,目前主要靠用金屬鎘或鋅等金屬誘導動物肝臟合成,然后經提取、分離純化來制備Cd-MT[4-5]。由于受到誘導和提取方法的限制,分離純化后的金屬硫蛋白中還含有其它的雜蛋白,產率低,且無法實現大批量生產及工業化,大大影響了MT的開發應用。我國是漁業大國,有豐富的魚類資源,因而開發利用魚體內的金屬硫蛋白具有廣闊的前景,目前國內外對于魚類資源批量誘導提取MT進行工業化生產有關研究相對較少。誘導和提取工藝不夠理想是制備Cd-MT產率低的主要原因,目前對Cd-MT的誘導,主要采取動物注射的方法,由于注射的劑量和時間的差異,動物體內的金屬硫蛋白合成不穩定,造成資源浪費。本實驗綜合傳統動物金屬硫蛋白提取方法。以金屬離子溶液養殖模式誘導鯉魚體內金屬硫蛋白的合成,解決了實驗室少量金屬硫蛋白的提取的局限性,有助于工業化大規模提取鯉魚體內的金屬硫蛋白。
1 材料與方法
1.1 材料與儀器
鯉魚(Cyprinus carpioi) 當地市場購買,平均體長(12.4±0.4)cm,平均體重(42.1±0.5)g,鯉魚在經曝氣3d的自來水中暫養14d,然后選取體表無傷,身體健康的個體供實驗所用。研究器官肝、腎、腮、心臟和腦;自來水中未檢出Cd金屬離子,溶氧(DO)大于7mg/L,pH6.8~7.4,實驗期間水溫為 20~25℃,同時保持自然光照;HNO3(濃)、HClO4、三羥甲基氨基甲烷 (簡 稱 Tris)、HCl、CdCl2、CHCl3、無 水 乙 醇(95%)等試劑 均為分析純、硝酸+高氯酸混合酸(4∶1),牛血清白蛋白,HRP-羊抗兔 IgG,兔抗魚 MT多克隆抗體,Ellman’試劑DTNB(Sigma),鎘標準溶液(1.0mg/mL),鎘標準使用液(100.0ng/mL),牛血紅蛋白等。
PE-800型原子吸收分光光度計 美國珀金埃爾默公司;PHS-3C型pH計 上海精密科學儀器有限公司;TGL18M臺式高速冷凍離心機 鹽城市凱特實驗儀器有限公司;可調試恒溫電熱板、可調試電爐
上海特成機械設備有限公司;101C-1B型電熱鼓風干燥箱 金華雷琪實驗器材有限公司;電子分析天平 北京賽多利斯儀器系統有限公司;酶標板(NUNC,F16)、酶標儀 杭州生友生物技術有限公司;勻漿機 南京萊步科技實業有限公司;磁力攪拌器 鄭州南北儀器設備有限公司;電熱恒溫水浴鍋
北京東方精瑞公司。
1.2 實驗方法
1.2.1 Cd-MT的誘導 根據蛋白質的提取理論和傳統生物體金屬硫蛋白的誘導方法[6-10]首先進行鯉魚MT誘導的預實驗,從時效性、提取量、提取條件等方面綜合考慮,確定了以傳統經典方法為主線的鯉魚MT的提取工藝。預實驗結果表明Cd2+(10mg/L),誘導時間為兩周時,鯉魚體內鎘-金屬硫蛋白能穩定達到最大。故確定誘導方法為:選取鯉魚,放入含Cd2+(10mg/L)金屬離子濃度進行批量誘導,誘導時間為2周,期間不喂食,然后取出解剖取實驗器官(肝、腎、腮、心臟和腦),-20℃冷凍。
1.2.2 Cd-MT的提取與分離 在提取工藝中,MT的提取大致可分為勻漿與除雜兩步,近幾十年來,一直采用勻漿離心法提取動物MT,Tris-HCl緩沖溶液性質穩定,與生理體液的相容性好[8],因此Tris-HCl緩沖液常作為提取劑。有些研究中Tris-HCl緩沖液含有0.15mol/L NaCl以促進蛋白溶解,及蛋白酶抑制劑苯甲基磺酰氟(PMSF,0.1、0.2mmol/L)、還原劑二硫蘇糖醇(DTT,1mmol/L)或B2巰基乙醇(10mmol/L),以保護MT的巰基(-SH)不被降解或氧化,被提取的組織與所加緩沖液的質量體積比(g/mL)一般為1/2~1/5[8,11]。但是不同研究者所使用的緩沖液的濃度、pH以及動物組織與緩沖液的質量體積比各不相同,勻漿液的離心轉速、時間以及離心后上清液的加熱處理條件也存在較大差異[12-15]。所以提取的MT含量和純度等都不一樣,這種狀況十分不利于MT對水域重金屬污染的指示作用。
1.2.2.1 勻漿過程中對MT提取的影響 勻漿過程中影響MT提取率的因素包括:Tris-HCl緩沖液濃度、pH、所用組織與緩沖液的質量體積比(m/v),而內臟組織與緩沖液的質量體積比(m/v)對MT提取率的影響最小[11],在實驗中不做考慮。因此,分別稱取約0.2g內臟組織加入一定體積4℃預冷的Tirs-HCl緩沖液進行勻漿,對緩沖液濃度、pH設計單因素實驗優化勻漿條件。所得到的勻漿液均采用相同的除雜步驟進行處理。即:變性除雜蛋白,10000r/min于4℃離心30min,棄沉淀,取上清液,85℃水浴熱變性5min,冰水冷卻,用8層紗布過濾,取清液,靜置約2h、8000r/min于4℃離心10min,棄沉淀,取上清液,得到所要的勻漿液,記下體積V,精確到1mL,每組設5個平行。按照1.2.5節的方法測定疏基含量。
1.2.2.2 除雜過程中對MT提取的影響 除雜過程中,水浴加熱的目的是利用MT的熱穩定性去除勻漿液中的熱不穩定大分子蛋白,而離心僅為獲得上清液的1種手段。該過程雖然不會影響MT提取率,但是水浴加熱時間、離心時間等因素決定著提取液中對MT測定有干擾的雜質(大分子蛋白質、熱敏蛋白以及含-SH的小分子物質)去除程度[11]。因此,依次采用單因素影響實驗對這些因素進行優化,按照1.2.2.1的條件制備內臟勻漿液,在依次控制1次離心時間10~70min、水浴加熱時間5~30min、2次離心時間為10~70min的情況下,對勻漿液進行處理,所得到的上清液按照1.2.5的方法測定琉基含量,每組設5個平行。
1.2.3 酶聯免疫吸附法測定鯉魚MT含量 取鯉魚的肝臟和腎臟為例,以上述方法制備勻漿后,取上清液以酶聯免疫吸附法(ELISA)[16]測定MT含量。以包被液按1∶100稀釋后,加100μL于酶標板的凹孔中,加蓋4℃過夜,以p H7.4 Tris-HCl(內含質量分數0.05%的Tween-20)緩沖液洗滌3次;加入封閉液(1.5%質量分數的牛血清白蛋白)200μL,37℃,1h后洗滌 3次;加入 100μL兔抗魚 MT多克隆抗體(1∶1000 倍)37℃,2h,以緩沖液洗滌3 次,將 HRP-羊抗兔IgG抗體(1∶1000稀釋)100μL加入孔內,37℃,1.5h,以緩沖液洗滌3次,蒸餾水洗滌3次,孔內加入100μL TMB應用液,室溫放置 15min后,再加入50μL 2mol/L H2SO4,5min 后測 A450,并與血紅蛋白/鎘飽和法比較其結果。
1.2.4 鎘含量測定 按文獻方法[17],精密吸取魚標準樣品溶液,用去離子水定量稀釋(使Cd濃度在標準曲線濃度范圍內),搖勻。原子吸收分光光度計上測得吸光度,按肝臟重計算鎘的提取量(mg Cd/g濕肝)。對魚肝用濕法消化后,稀釋,測定肝中鎘含量。

表1 鯉魚不同組織中MT含量(mg/g,n=5)Table 1 The content of MT in carps for different tissues(mg/g,n=5)

表2 ELISA法和鎘-血紅蛋白飽和法測定MT含量(mg/g,n=5)Table 2 Determination of concentration MT with ELISA and Cadmium/hemoglobin saturation method(mg/g,n=5)
1.2.5 巰基含量的測定 Ellman’試劑檢測[18],MT具有疏基(-SH)含量高的特點。稱取一定量鯉魚MT樣品(疏基含量0.1~0.5μmol),配成小于 50μL 溶液。加入 10μL 1.2mol/L HCl和 200μL 0.1mol/L EDTA反應10min脫去金屬。加入200μL Ellman’s試劑(含 5mmol/L DTNB,1mmol/L EDTA,6mol/L 鹽酸胍,0.1mol/L PBS,pH7.3),混勻3min使MT 變性后與DTNB形成黃色絡合物,用0.1mol/L PBS,p H7.3稀釋至4mL在412nm處測紫外吸光度A,同時以50μL提取劑代替樣品提取液,按同樣步驟進行空白實驗得到吸光度A0。以ΔA(A-A0)表征組織中的MT水平。
1.2.6 鯉魚MT氨基酸組成分析 將0.1mg樣品溶于0.5mL蒸餾水中,加0.4mL,5.7mol/L恒沸HCl,抽真空封口,于110℃下分別水解24、48和72h,再經處理上氨基酸分析儀分析。
1.2.7 計算 收率計算:因 1mol MT(分子量9799[19])可結合 7mol Cd2+(原子量 112.4),故鯉魚每克組織中的 MT 含量(μg·g-1)為[20]
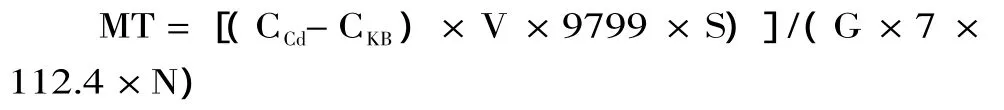
式中:CCd為上清液中 Cd2+的質量濃度,μg·mL-1;CKB為空白樣品最終上清液讀數;S為測定時所取上清液的體積,mL;G為取樣組織的質量,g;V為組織勻漿體積,mL;N為勻漿后的取樣體積,mL。
疏基濃度計算:C=DA/ε,式中 ε=1.23×104(mol/L)-1·cm-1,A 為吸光值,D 為稀釋倍數[18]。
數據處理采用Excel7.0版及SPSS數據分析軟件進行統計分析。實驗數據用平均數±標準差表示,同時采用t-test進行差異性和顯著性檢驗。
2 結果與討論
2.1 鯉魚主要組織中MT分布與含量
鯉魚的肝臟、腎臟、腮、心臟和腦內MT含量分布如表1,其結果表明鯉魚體內能誘導合成大量的MT,并且MT含量在各組織中差異很大,尤其在肝臟和腎臟內含量明顯突出(p<0.05)。因此,與其他組織器官相比,肝臟和腎臟是吸收重金屬鎘最強的組織器官,這與大多研究的結果是一致的。反映了在鎘誘導下,MT合成在肝臟和腎臟旺盛,是絡合和積累鎘的主要器官。因此,對鯉魚體內MT的誘導合成主要以肝腎臟合成量為標準。
2.2 酶聯免疫吸附法與血紅蛋白/鎘飽和法測定鯉魚組織MT含量比較
表2列出ELISA法和血紅蛋白/鎘飽和法測定鯉魚組織中MT含量的結果,ELISA法測定魚體MT比血紅蛋白/鎘飽和法的結果偏低,原因可能是由于兩種方法使用不同的標樣(ELISA法以MT純品為標樣,血紅蛋白/鎘飽和法以標準鎘為標樣,用血紅蛋白去除鎘時有殘留的鎘),結果引起偏差。
2.3 Cd-MT的提取影響因素分析
2.3.1 緩沖液濃度、pH對MT提取效果的影響 勻漿過程中緩沖溶液的1個作用是作為溶劑促進被提取成分的溶出。由圖1實驗結果表明:在其他條件相同的情況下,緩沖液濃度≥0.03mol/L的Tirs-HCl緩沖溶液所得到的吸光度遠小于兩個較低濃度的提取效果。這是因為,隨著Tris-HCl濃度的增高,溶液的離子強度增大,而較高的離子強度可造成蛋白沉淀[6],并在隨后的離心過程中從上清液中去除,從而導致吸光度的降低。因此,為獲得較高MT提取率,Tris-HCl緩沖溶液的濃度選用0.01mol/L或0.02mol/L為宜。

圖1 Tirs-HCl緩沖液濃度對提取液中MT含量的影響Fig.1 Effect of Tirs-HCl buffer concentration on MT content in the extract
緩沖液的另一個作用是為離體蛋白提供相對穩定的pH環境,防止變性,蛋白質在胞內一般處于中性環境,因此采用p H6~8的緩沖溶液可有效防止離體蛋白質變性[21]。據報道,水生生物MT的等電點在p H3.5~6.0之間[2],如果緩沖液的 p H 與目標蛋白的等電點(p I)一致,則蛋白質因溶解度減少會發生聚集[6]。因此,本研究選用遠離pI且能保持蛋白質活性的緩沖溶液pH范圍(7.4~9.0)進行優化。從圖2可知,當緩沖液p H為8.6時,鯉魚MT的測定值最大,說明這種p H最有利于MT的穩定,既能避免等電點附近出現的蛋白沉淀,又可避免較高pH條件下的蛋白變性,由此確定Tris-HCl溶液最佳的pH為8.6。

圖2 Tris-HCl溶液pH對提取液中MT含量的影響Fig.2 Effect of Tirs-HCl buffer pH on MT content in the extract
綜上,鯉魚組織的最佳勻漿條件為:Tris-HCl緩沖溶液濃度為0.01mol/L,p H8.6,內臟組織與緩沖液的質量體積比為 1/2[4]。
2.3.2 水浴、離心時間對MT提取效果的影響
2.3.2.2 一次離心的時間對MT提取效果的影響由圖3可見,控制離心時間為10~20min時,吸光度測定值較高,表明能夠產生干擾的含-SH雜質不能完全被去除;當離心時間為30min時,吸光度顯著降低(p<0.05),說明延長離心時間有利于雜質的沉降去除;繼續延長時間,吸光度趨于平緩,沒有顯著變化(p>0.05)。因此,離心時間以30min為宜。

圖3 一次離心時間對提取液中MT含量的影響Fig.3 Effect of centrifugal time during the first centrifugation on MT content in the extract
2.3.2.3 水浴加熱時間對MT提取效果的影響 MT分子的構象較為堅固,具有較強的耐熱性,可以80℃水中保存30min[22]不變性,而大多數種類的蛋白質在溫度高40~50℃時即開始變性[23]。利用這一特性可去除熱不穩定大分子蛋白,進一步消除提取液中的干擾成分。考慮到溫度低于80℃時,非MT蛋白的變性不夠充分,而溫度太高時,MT中的-SH容易失活[24],本研究選擇85℃水浴對上述離心后的上清液進行處理。由圖4可見,水浴加熱5~15min時,吸光度保持在較高的穩定水平,表明鯉魚MT在此時間內不會失活;當加熱超過15min時,隨著時間延長,吸光度顯著降低(p<0.05),表明部分MT已發生熱變性。從保證加熱期間MT分子的穩定性及有效分離其他蛋白質兩方面考慮,選取最適水浴加熱時間為5min。

圖4 水浴加熱時間對提取液中MT含量的影響Fig.4 Effect of water-curing treatment time on MT content in the extract
2.3.2.4 二次離心時間對MT提取效果的影響 二次離心的目的是實現熱變性絮凝雜蛋白與提取劑的分離。一般在10000r/min時離心10min就能將細胞碎片、線粒體等物質沉降[25]。為提高分離速度,在保持離心為8000r/min的情況下,對離心時間進行優化。由圖5可見,二次離心的時間對吸光度的測定值影響不大,在10~60min內基本穩定。為節省提取時間,二次離心的時間以10min為宜。

圖5 二次離心時間對提取液中MT含量的影響Fig.5 Effect of centrifugal time during the second centrifugation on MT content in the extract
因此,為獲得較高的MT提取率,鯉魚組織的最佳勻漿條件為:Tris-HCl緩沖溶液濃度為0.01mol/L,p H8.6,內臟組織與緩沖液的質量體積比為1/2,第一次離心10000r/min,30min,取上清液,置85℃水浴熱變性5min,進行第二次離心8000r/min,10min。在此條件下鯉魚組織MT的提取率能達到最大,這些結果有助于重金屬生物監測中鯉魚MT的經濟高效提取和共存雜蛋白干擾的有效去除。
2.3 Cd-MT的提取結果
原子吸收分光光度計上測定其鎘濃度,按Cd-MT的分子質量為6500u和每分子Cd-MT含7個鎘原子計算,得到Cd-MT的含量約為4.53mg/g濕肝,再以測得的巰基含量,按412nm外測紫外吸收值,得到Cd-MT的含量約為4.48mg/g濕肝。
2.4 鯉魚氨基酸組成分析
不同生物中誘導的MT性質有所不同。表3~表4為鯉魚 MT 氨基酸組成與鯽魚[19]、海蝶[26]和小沙魚[27]的氨基酸組成的對比。其氨基酸成分分析結果表明:該蛋白中半胱胺酸為29.7%,約占1/3,與鯽魚、海蝶和小沙魚組成相似,然后依次是賴氨酸、絲氨酸等,未發現有芳香族氨基酸。用Ellman′試劑測定疏基的結果與此相同,這和李令媛等[28]研究大鯢MT含Cys約23%~24%結果相似,且都小于哺乳動物MT的Cys含量。張建業等[29]以鋅誘導兔肝MT發現半胱氨酸含量有32%~33.8%,MT-I和MT-II分別結合7個和6個Zn,無Cd和Cu;人胎肝的MT含量較高(1.0~1.3),且可能隨胎齡增長發生某種變化。而郭詳學等[30]從藍藻中誘導純化的類金屬硫蛋白與哺乳動物金屬硫蛋白結構差異很大,這可能只是一種進化上的趨同。

表3 鯉魚MT的氨基酸組成(%)Table 3 Amino acid composition of carp MT(%)

表4 鯉魚與其他魚種氨基酸組成對比(%)Table 4 Amino acid composition of carp and other fish species contrast(%)
3 結論
3.1 本文利用鯉魚作為材料,研究體內各組織MT的含量及批量誘導提取工藝,用于MT生產企業。由實驗結果看出:鯉魚肝、臟、腮、心臟和腦中的MT含量較高,肝臟的含量也反映出肝臟是吸收和積累重金屬的主要器官,也是重金屬污染的最適指示器官,通過與其他魚類MT的氨基酸對比結果看出:鯉魚MT中也不含芳香族氨基酸,氨基酸殘基組成相似,含有大量的半胱氨酸。
3.2 采用血紅蛋白/鎘飽和法測定魚體MT,此方法操作簡便、快速,但此方法有一定的局限性,即:特異性較差因為重金屬結合MT的能力次序為Bi(Ⅲ)、Hg(Ⅱ)、Ag(Ⅰ)、Cu(Ⅱ)>Cd(Ⅱ)>Pb(Ⅱ)>Zn(Ⅱ),即不能用于 Bi、Hg、Cu-MT 樣品的測定,而且還與其它一些小分子量化合物結合,而ELISA法則適用于廣泛的樣品測定[9]。ELISA法可以特異地檢測出動物組織勻漿液中微量的MT,是當前檢測MT最靈敏的方法之一,由于這兩種方法具有不同的特點及實驗上的局限性,工作中應根據具體情況而選擇不同的方法,也可以兩種方法并用,綜合作出評價。
3.3 采用單因素設計優化鯉魚主要組織中MT的提取過程。在勻漿階段,最佳工藝條件為:Tris-HCl緩沖液的濃度0.01mol/L,pH8.6,內臟組織與緩沖液的質量體積比為1/2,在此條件下MT在緩沖液中的溶出量達到最大。除雜階段的最佳工藝條件為:勻漿液在10000r/min、4℃、離心30min,棄沉淀,取上清液,置85℃水浴熱變性5min,再次除雜蛋白,用冰水冷卻,用8層紗布過濾,取清液,靜置約2h、8000r/min于4℃離心10min,棄沉淀,取上清液,得到所要的勻漿液,記下體積V,精確到1mL。該優化結果去除了影響MT測定的雜蛋白,為鯉魚MT應用于企業工業化生產提供了可靠、高效的提取方法。而且該提取方法操作簡單,過程易于控制,將對科學研究和生產企業的生產與深加工具有重要意義。
[1]茹炳根,潘愛華,黃秉乾,等 .金屬硫蛋白[J].生物化學與生物物理進展,1991,18(4):254-257.
[2]劉安玲,朱必鳳,金屬硫蛋白的研究進展[J].韶關學院學報:自然科學版,2001,22(3):86-91.
[3]VALLEE B L.Introduction to metallothionein[J].Methods in Enzymology,1991,20(5):3-7.
[4]潘愛華,茹炳根,李令媛,等.鋅誘導家兔肝臟金屬硫蛋白的純化及鑒定[J].生物化學與生物物理學報,1992,24(6):509-5011.
[5]Comeau R D,McDonald K W,Tolman G L,et al.Gram scalc purification and preparation of rabbit liver zinc metallothionein[J].Prep Biochem,1992,22(1):151-155.
[6]李世崇,陳昭烈.不穩定蛋白質的分離純化[J].藥物生物技術,2002,9(3):175-177.
[7]徐麗霞,彭新君.金屬硫蛋白(MT)的誘導、分離純化與特性研究進展[J].湖南中醫藥導報,2002,8(4):152-154.
[8]孟范平,肖靜.海洋動物金屬硫蛋白的提取與分析技術研究進展[J].中國海洋大學學報,2010,40(6):41-46.
[9]王達,葛剛.金屬硫蛋白(MT)的分離純化與檢測技術[J].江西科學.2004,20(3):22-23.
[10]王瑩,張彬.金屬硫蛋白提取工藝的研究進展[J].養殖與飼料,2007,7(4):63-65.
[11]孟范平,肖靜.菲律賓蛤仔金屬硫蛋白的提取方法優化[J].中國海洋大學學報,2010,40(7):121-125.
[12]Wu SM,Lin H C,Yang W L.The effects of maternal Cd on the metallothionein expression in tilapia (Oreochromis mossambicus)embryos and larvae[J].Aquatic Toxicology,2008,87(4):296-302.
[13]Santiago-Rivas S,Moreda-Pieiro A,Bermrjo-Barrera A,et al.Fraction metallothionein-like proteins in mussels with on line metal detection by high performance liquid chromatography inductively coupled plasma-optical emission spectrometry[J].Talanta,2007,71(4):1380-1586.
[14]Nunez-Nogueira G,Mouneyrac C,Amiard J C,et al.Subcellular distribution of zinc and cadmium in the hepatopancreas and gills of the decapod crustacean Penaeus indicus[J].Marine Biology,2006,150(2):197-211.
[15]Fernandes D,Zanuy S,Bebianno M J,et al.Chemical and biochemical tools to assess pollution exposure in cultured fish[J].Environmental Pollution,2008,152(1):138-146.
[16]Robert J.Cousins,measurement of humen metallothionein by enzyme linked immunosorbent assay[J].Methods in Enzymology,2005(PartB):131-140.
[17]黃波,金泰.金屬硫型的檢測方法的適用性和局限性[J].勞動醫學,1999,16(2):114-115.
[18]Kagi J H,Kojima Y.Chemistry and biochemistry of metallothionein[J].Experientia Supplementum,1987,52:25-61.
[19]REN Hongwei,WANG Wenqing,RU Binggen,et al.Purification and identification of metallothionein from Carassius auratusliver induced by cadmium chloride[J].Progress in Biochemistry and Biophysics,1993,20(4):281-285.
[20]DAI Jianguo,CHEN Jingheng,YANG Sen.Cadmiumsaturation method for determination of mousehepatic metallothionein[J].Acta Universitatis Medicinalis Nanjing,1995,15(3):722-724.
[21]馮小黎,金業濤,蘇志國.分離純化中蛋白質的不穩定性及其對策[J].生物工程進展,2002,20(3):67-71.
[22]田曉麗.硒對金屬硫蛋白的誘導表達及對肝纖維化的防護作用研究[D].北京:中國人民解放軍軍事醫學科學院,2006:115-116.
[23]沈同,王鏡巖,趙邦梯,等.生物化學[M].北京:高等教育出版杜,1990:216.
[24]吳萍,彭新君,何斌,等.家兔肝臟中鋅金屬硫蛋白提取工藝的研究[J].湖南中醫學院學報,2004,24(3):45-51.
[25]譚天偉.生物分離技術[M].北京:化學工業出版社,2007:35-36.
[26]Overnell J,Coombs T L.Purification and properties of plaice metallothionein.a cadmium binding protein from liver of plaice[J].Biochem,1979,183:277.
[27]Joan H,Rosa F.Dogfish metallothionein I purification and characterization and comparison with rat metallothionein[J].Comp Biochem Physiol,1986,83(1):99-102.
[28]李令媛,馬宏寶,安鈺,等.鎘誘導大鯢肝臟與腸金屬硫蛋白的分離純化與鑒定[J].北京大學學報:自然科學版,1996,32(4):534-541.
[29]張建業,胡國良,畢云祥,等.人胎肝金屬硫蛋白的分離純化及其性質的研究[J].山東醫科大學學報,1992,30(1):11-14.
[30]郭祥學,陳正佳,但春濤,等.聚球藻類金屬硫蛋白的純化及部分性能的研究[J].生物化學雜志,1997,13(6):699-703.

