秸稈還田與施肥對稻田土壤微生物生物量及固氮菌群落結構的影響
劉驍蒨,涂仕華,孫錫發,辜運富,張先琴,張小平,*
(1. 四川農業大學資源環境學院微生物系, 成都 611130; 2. 四川省農業科學院土壤肥料研究所,成都 610066)
秸稈還田與施肥對稻田土壤微生物生物量及固氮菌群落結構的影響
劉驍蒨1,涂仕華2,孫錫發2,辜運富1,張先琴1,張小平1,*
(1. 四川農業大學資源環境學院微生物系, 成都 611130; 2. 四川省農業科學院土壤肥料研究所,成都 610066)
利用氯仿熏蒸法和變性梯度凝膠電泳法(PCR-DGGE)研究了秸稈覆蓋還田與施肥對灰棕沖積水稻土0—10cm和10—20cm土層土壤微生物生物量碳、氮和固氮菌群落結構的影響。結果表明:土壤微生物量碳、氮和固氮菌多樣性從0—10cm土層到10—20cm土層均呈現降低趨勢。無秸稈覆蓋處理(對照組)的土壤微生物生物量碳(SMB-C)和微生物生物量氮(SMB-N)量最小。在秸稈覆蓋還田處理中,低氮和無鉀處理的SMB-C和SMB-N都顯著低于全量氮磷鉀肥處理。雖然無磷處理的SMB-N低于全量氮磷鉀處理, 但差異不顯著。說明秸稈覆蓋還田配施充足氮磷鉀肥能顯著提高土壤微生物生物量碳、氮。由DGGE圖譜多樣性指數分析得知,配施充足氮磷鉀肥的處理土壤的固氮菌多樣性最豐富。UPGMA聚類分析顯示,10種不同處理的聚類圖也不同,對照(無秸稈)處理0—10cm和10—20cm的微生物不同于其它處理單獨聚在了一個群里。DGGE條帶測序得知,14個條帶的近緣種大部分為非培養細菌nifH基因片段,主要優勢菌群其歸屬于變形菌門(Proteobacteria)的β-變形菌綱(Betaproteobacteria)。應用PCR-DGGE技術可以解釋灰棕沖積水稻土秸稈覆蓋不同肥料用量固氮菌分子群落結構特點。
秸稈還田;灰棕沖積水稻土;微生物生物量;PCR-DGGE;固氮菌群落結構
我國的秸稈資源十分豐富,據統計全國每年共產生秸稈數量為6.2億t,約占世界的20%—30%[1],農作物秸稈中蘊含有大量的氮、磷、鉀和中、微量元素等礦質養分。農作生產中產生的大量秸稈被焚燒,造成了營養物質流失和嚴重環境污染。秸稈還田作為秸稈利用的一種重要且有效的方式,既可以避免資源浪費和環境污染,同時也可以增加土壤有機質和養分的含量,提高孔隙度,降低土壤容重,還可以提高土壤微生物生物量及增強各種土壤酶的活性[2],從而使作物更好更快地生長,提高作物產量。
土壤微生物是土壤生態系統的重要組成部分,在有機質分解、土壤養分循環和植物養分吸收利用過程中發揮著至關重要的作用[3]。生物多樣性越高的生態系統越穩定的Elton假說,受到大多數學者的認同。Tilman通過直接控制生物多樣性,對147個草地進行了實驗研究。結果表明,草地生態系統的生物多樣性影響著草地短期和長期的生產率及發展[4]。一些研究者指出隨著有機質的施入和化學肥料的減少,土壤微生物生物量和微生物活性都明顯增加[5]。秸稈覆蓋與土壤微生物之間作用是相互促進相互影響的,一方面秸稈覆蓋增加了土壤微生物生物量,提高微生物的活性[6],另一方面土壤微生物生物量及活性的提高也會加快秸稈的腐解[7]。
傳統平板培養分離方法可分離出的微生物種類只占土壤微生物種類總數的0.1%—1%[8]。應用PCR-DGGE技術可以有效地避免在傳統菌落培養分離過程由于微生態生境無法復制而造成的大量微生物多樣性的丟失,能夠更加全面而可靠的反映土壤微生物的組成情況,故其在微生物群落多樣性研究中得到越來越廣泛的應用[9]。固氮細菌是生態系統中一類重要的功能菌群,它在土壤氮素循環發揮著不可取代的作用[10]。目前有關秸稈還田條件下配合化肥使用對土壤微生物量和特殊生理類群微生物群落結果影響的研究還不多,關于秸稈還田下施用不同肥料對四川灰棕沖積水稻土微生物量及固氮菌群落結構的影響的研究更無報道。本研究將應用PCR-DGGE技術研究秸稈還田下不同施肥土壤固氮菌群落結構,并對土壤中的主要固氮菌群進行測序分析,從微生物角度了解秸稈還田土壤生態狀況,為秸稈還田與合理施肥、水分管理、保護土壤微生物等方面的工作提供科學依據。
1 材料與方法
1.1 試驗點及實驗處理
試驗土壤采集于四川省農業科學院土壤肥料研究所于2002年建立在四川省廣漢市西高鎮的試驗基地。該地為亞熱帶濕潤氣候,年均氣溫16.3℃,積溫5980.4℃,降水量為890.8mm,日照時數為1229.2h,無霜期達281d。試驗開始于2004年10月,作物輪作為小麥水稻,一年兩熟。土壤為灰棕沖積水稻土,試驗前的土壤基本理化性質見表1。試驗采取完全隨機區組設計方案,5個處理:N150P60K90(CK,無覆蓋),秸稈覆蓋+N90P60K90(SNL),秸稈覆蓋+N150P60K90(SCK),秸稈覆蓋+N150P60K0(SNP)和秸稈覆蓋+N150P0K90(SNK),3次重復,小區面積為3m×4m。試驗小區四周為20cm高田埂,重復之間有排水溝。各處理肥料用量分別為,氮肥(N,尿素) 90、150 kg/hm2;磷肥(P2O5,磷酸一銨) 0、60 kg/ hm2;鉀肥(K2O,氯化鉀) 0、90 kg/hm2。每季作物收獲后,秸稈全部均勻覆蓋于原試驗小區,連續覆蓋免耕。小麥和水稻施肥時間和比例分別為,氮肥30%作底肥施用,70%作分蘗肥施用;磷肥全部作底肥施用;鉀肥50%作底肥,50%作分蘗肥。

表1 供試土壤基本理化性質
1.2 取樣方法
于2009年7月水稻生長旺盛期,在田間采用“梅花型”布點取樣,取樣深度分別為0—10cm(在處理代碼后加T下標)和10—20cm(在處理代碼后加s下標)。將每一小區內同一取樣點中相同深度土壤混勻,用無菌PET樹脂袋封裝帶回實驗室。立即進行土壤微生物數量分析和DNA的提取。另取一部分放于室內風干,研細過2 mm篩,用于土壤理化性質的分析。其它放在-20℃的冰箱里保存以備后續分析。
1.3 土壤微生物生物量的測定。
土壤微生物生物量土壤微生物生物量碳(MBC)、微生物量氮(MBN)的測定采用氯仿熏蒸法[11]。
1.4 土壤固氮菌群落結構的PCR-DGGE分析和系統發育樹的構建
1.4.1主要儀器和試劑DGGE所用儀器the D-code TM Universal Mutation Detection System (Bio-Rad Co)。采取巢式一步PCR擴增nifH基因,巢式一輪引物為FGPH19和PolR,巢式第二輪引物為AQER和PolF-GC。(引物均由Invitrogen英杰生命技術公司合成),具體引物序列參見文獻[12]。切膠純化試劑盒(TaKaRa,大連寶生物)純化。
1.4.2土壤微生物總DNA提取 采用土壤總DNA提取試劑盒(北京天恩澤基因科技有限公司),稱取0.5g于20℃保存的土樣,按試劑盒提供的操作步驟進行土壤微生物總DNA的提取,在0. 8%的瓊脂糖凝膠中對提取的DNA進行電泳檢測。
1.4.3固氮菌nif-H基因的PCR擴增采用Nested-PCR程序。
第一次PCR 所用引物為固氮菌nif-H基因的引物FGPH 19和Po1R,反應體系為:PCR Master Mix (Tiangen Biotech, Bejing) 25L,每種引物0.5μL (20pmol/μL),0.5μL 10倍稀釋的土壤總DNA提取液,加ddH2O至反應終體積50μL。為減少擴增過程中的非特異性產物,采用Touch-down PCR程序,反應程序:94℃預變性5min,94℃ 1min,65—55℃ 50s (每個循環溫度降低0.5℃,72℃ 1.30min,20個循環,然后在其它條件不變的情況下,在55℃的退火溫度下繼續擴增15個循環,72℃ 7 min,最后于4℃恒定保存。
第二次PCR 第一次PCR產物1∶10稀釋后作為二次PCR反應的模板進行,引物為AQER和PolF-GC,反應的體系為:10×PCR buffer緩沖液5μL, MgCl2(25mmol/μL) 3μL, dNTP(2.5mmol/μL) 1μL, PolF-GC (20pmol/μL) 0.5μL, AQER(20pmol/μL) 0.5μL, Taq DNA聚合酶(5u/μL) (Tiangen Biotech, Bejing)0.5μL,模板DNA1μL,加ddH2O至終體積50μL。反應程序是在第一輪PCR的基礎上,退火溫度變為在前20個循環為63—53℃,接下來的后15個循環的退火溫度為53℃,其它步驟與第一輪PCR反應相同。
1.4.4 PCR產物的變性梯度凝膠電泳(DGGE)分析
取第一次PCR產物15μL進行DGGE分析,變性劑梯度范圍為20%—50%,自配的聚丙烯酰胺凝膠濃度為8% (100%的變性劑為尿素7 mol/L和40%的去離子甲酰胺)。在1×TAE緩沖液中,50V電壓進膠30 min,然后在150V 60℃緩沖液中電泳6h。電泳后采用銀染法進行染色。然后用數碼相機拍照。DGGE指紋圖譜分析借助于Bio-Rad公司的凝膠成像系統(Quantity One Bio-Rad, USA)分析樣品電泳條帶。
在圖像處理過程中,在DGGE電泳圖譜上有一些肉眼可見、但被軟件忽略掉的細小條帶進行手動添加,條帶的密度由該軟件自動算出。
1.4.5 DGGE條帶的切割、克隆與測序
從DGGE凝膠上仔細切下有用的DGGE條帶裝于PCR反應管中,用50μL無菌水反復沖洗3次后,加人20μL無菌水在4℃冰箱過夜。次日12000g離心5 min,收集上清液。以此作為模板進行下一步的PCR擴增,用引物AQER和PolF,進行nif-H基因PCR擴增。PCR反應程序同1.4.3中第一次PCR反應。將上述PCR產物連接到pMD19-T載體(Takara, 大連)上,轉化到E.coliDH5α感受態細胞中,在含有氨芐青霉素的LB培養基上選擇具有氨芐青霉素抗性的白色轉化子。采用T載體通用引物M13F, M13R進行菌落PCR,PCR產物經1%瓊脂糖凝膠電泳檢測是否為陽性克隆。測序工作由北京華大基因科技有限公司完成。
1.4.6 固氮基因nif-H序列分析
所得序列提交到GenBank數據庫中,并用BLAST程序進行同源性比對,獲得與本實驗所得序列相似性最高的序列。將這些相似性較高序列與本實驗獲得的固氮基因nif-H序列一起,使用Clustal X1.83工具進行多序列比對。然后使用MEGA軟件中的Kimura雙參數修正模型進行系統發育樹的構建。
1.5 數據處理
用Quantity One分析軟件分析得到相似性指數;以Shannon-Wiener指數反映固氮菌多樣性,香濃指數計算方法采用Eichner等[13]和Hedrick等[14]的方法;數據處理用Microsoft Excel 2000進行,統計與顯著性檢測利用SPSS11.0軟件進行。
2 結果與分析
2.1 秸稈覆蓋與不同施肥量對土壤微生物生物量碳、氮的影響
農田生態系統中土壤微生物生物量的變化受到多種因素的影響如環境條件、施肥管理等,同時它們能夠靈敏地反映環境因子的變化,故常被用于土壤質量生物學的評價指標之一[15]。本研究中由于覆蓋秸稈和不同的施肥處理,導致土壤微生物利用的碳源數量、方式發生變化,從而使不同處理的土壤微生物生物量碳、氮表現出差異。供試土壤微生物生物量碳的變化范圍介于156.97—229.37mg/kg,微生物生物量氮的變化則介于21.87—35.85mg/kg,最低值均是沒有覆蓋秸稈的對照組的下層(10—20cm)土樣。SCKT與CKT處理的微生物生物量碳、氮差異顯著說明覆蓋秸稈配施定量的氮磷鉀肥能夠使土壤微生物量碳、氮有明顯的提高。處理SCKT的微生物生物量碳、氮明顯高于SNLT,說明秸稈覆蓋還田后只有當氮素充足時微生物才更容易繁殖。SNPT處理的微生物量碳、氮明顯低于SCKT,表明秸稈覆蓋還田配施相同的氮肥磷肥,但不施鉀肥不利于微生物生長。處理SNKT微生物量碳顯著低于處理SCKT,而其微生物量氮雖也較低但卻沒有顯著性差異,說明磷肥對于土壤微生物生物量碳、氮的影響不相同。同時說明磷對于微生物的代謝具有重要的作用[16]。不同處理的下層土壤之間的差異與上層相似,且同一處理的上下層土壤的微生物生物量碳有顯著性差異,而微生物生物量氮均沒有顯著性差異。
土壤微生物生物量碳氮比(SMBC/SMBN)可反映微生物群落結構信息,其顯著的變化表明微生物群落結構變化直接影響微生物量的高低[17]。一般情況下細菌的碳氮比在5∶1左右。Petra Marschnera等[18]認為土壤有機碳的含量和碳氮比能夠顯著影響土壤細菌群落結構的變化。不同處理間土壤微生物群落結構的相似性或多樣性變化主要是由于秸稈還田下不同施肥土壤的微域生境的改變所致,這種改變影響了土壤生境對多種微生物的適宜性。從表2看出,微生物生物量碳氮比的范圍5.52—7.26之間。同一層土樣不同處理的微生物碳氮比并沒有差異,同一處理的上層土壤與下層之間也沒有顯著性差異。說明秸稈還田為微生物提供了充足的碳源,配施適量氮磷鉀肥增加了土壤養分,但是對土壤微生物生物量碳、氮的影響卻不相同,這可能是因為復雜的環境因素對微生物有著多方面的影響。只有微生物碳氮比合適,且具有較高有效利用性,才能促進微生物繁殖,從而增加土壤微生物生物量。
2.2 DGGE圖譜分析
固氮菌被認為是土壤氮素循環中固氮環節不可或缺的重要成員。對固氮菌群落結構和與固氮相關的種群動態研究對于人們了解不同環境下的生態系統過程十分重要。許多研究試圖通過不同的分離技術去研究土壤中具有固氮功能的固氮菌,但是對大多數生態系統來說,細菌中不可培養部分占了總數的絕大多數。通過靶定固氮酶編碼基因nifH的PCR擴增和變性梯度凝膠電泳(DGGE)分析,為深入了解固氮菌種群提供了很好的途徑[22]。
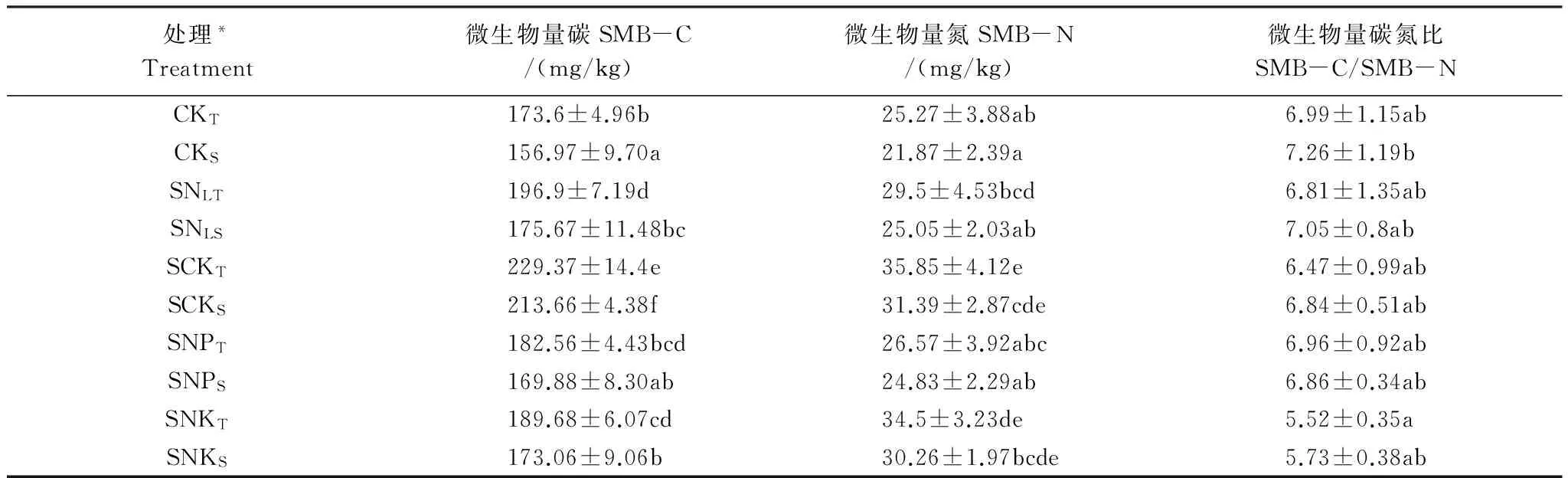
表2 秸稈還田下不同施肥處理的土壤微生物生物量碳氮
*CK為無秸稈覆蓋處理(N10P4K6), SNL為秸稈覆蓋+N6P4K6(低量氮肥),SCK為秸稈覆蓋+N10P4K6,SNP為秸稈覆蓋+N10P4K0,SNK為秸稈覆蓋+N10P0K6,處理代碼的下標T表示0—10cm土層,S表示10—20cm土層;表中數據為平均值±標準差;表中同列相同小寫字母表示P≥0.05水平無顯著性差異

圖1 土壤固氮菌nifH基因的PCR-DGGE圖譜Fig.1 PCR-DGGE profiles of soil microbial nifH genes條帶近緣菌株依次為Closest relatives in turn:1. Azospirillum brasilense strain AWB12 (GQ161239.1,90%); 2. Uncultured soil bacterium clone T01(EU331520.1, 92%); 3. Uncultured bacterium clone KW-B4(HQ335637.1,96%); 4. Uncultured bacterium clone BNnif4 (HQ190124.1, 96%); 5. Uncultured bacterium clone U1C_12(DQ520301.1,97%); 6. Pseudacidovorax sp ptl-2(GQ249664.1, 94%); 7. Azospira oryzae strain(U97115.2,90%); 8. Uncultured bacterium clone(DQ140703.1,88%); 9. Uncultured bacterium clone pPS204 (FJ381614.1,95%); 10. Uncultured Burkholderia sp isolate DGGE(HM565855.1,94%); 11. Uncultured bacterium isolate DGGE (GU097344,95%); 12. Uncultured bacterium clone BNnif22 (HQ190133.1,95%); 13. Uncultured bacterium clone BNnif17 (HQ190131.1, 98%); 14. Ideonella dechloratans (EU542578.1,93%)
土壤中固氮酶編碼基因nifH的擴增片段通過DGGE被分成了許多條帶,不同的條帶代表不同的固氮細菌及基因片段。結果如圖1,從圖中我們可以初步看出:供試土壤在DGGE圖譜中電泳條帶數目、強度和遷移率均存在一定程度的差異,充分顯示了固氮細菌的多樣性。每個泳道中條帶的亮度反映出固氮菌相對生物量的多少,電泳條帶的多少可以直觀地反映樣品中固氮菌群落的遺傳多樣性。從指紋圖譜可以看出每個樣品均可分離到10到18條不等的條帶。條帶數目最少的是CKS處理,條帶數目最多的是SCKT處理,表明配施足夠的氮磷鉀肥+秸稈覆蓋能夠維持土樣營養物質的充足,防止植物與微生物爭氮,更有利于固氮細菌的生長繁殖。圖譜中不同土壤間有一些共同的條帶如條帶1、4,說明供試土壤間存在共同的固氮菌類群,但是這些共有條帶的亮度不相同,說明土壤固氮菌的數量有一定的改變。
2.3 土壤固氮菌多樣性指數
根據電泳圖譜中每個條帶的信息,對不同處理土壤中固氮菌多樣性指數(H)、豐度(S)和均勻度(EH)等指標進行綜合分析,結果如表3所示。結果表明,多樣性指數和豐富度最高的處理是SCKT,其值分別為2.86和18.00;而最低的是CKS,這兩個值僅為2.38和10.33。統計學分析后得知,處理SCKT和CKT多樣性指數及豐富度均有顯著性差異,說明覆蓋秸稈后配施氮磷鉀肥能夠明顯的提高土壤固氮菌的多樣性。處理SCKT的多樣性指數和豐富度明顯大于SNLS說明覆蓋秸稈配施相同量的磷鉀肥,氮肥施用高的土壤固氮菌多樣性指數更大。土壤生境碳氮比需要維持在一定的水平,由于配施秸稈后土壤碳素增加,只有當配施足夠的氮才能防止微生物與植物爭氮,更有利于微生物的生長繁殖[2]。SNPT處理的多樣性指數和豐富度明顯低于SCKT處理,表明秸稈覆蓋后只配施氮磷肥、缺少鉀肥不利于固氮菌的生長。SNKT處理的多樣性指數和豐富度低于SCKT處理但沒有明顯差異,表明磷肥對于固氮菌多樣性指數有一定影響但是并沒有統計學上的意義。從表3可以看出,同一個處理的上下層土壤多樣性指數及豐富度均沒有顯著差異。同一處理的上層或下層土壤固氮菌的均勻度除了處理SCKT和SCKS有差異外,其余上下層處理均沒有顯著差異。不同處理的上層土壤固氮菌的均勻度中處理SCKT只與處理SNPT有顯著性差異,不同處理的下層土壤中處理SCKs與處理SNPs也有顯著性差異,說明鉀肥對于固氮細菌均勻度也有一定的影響。
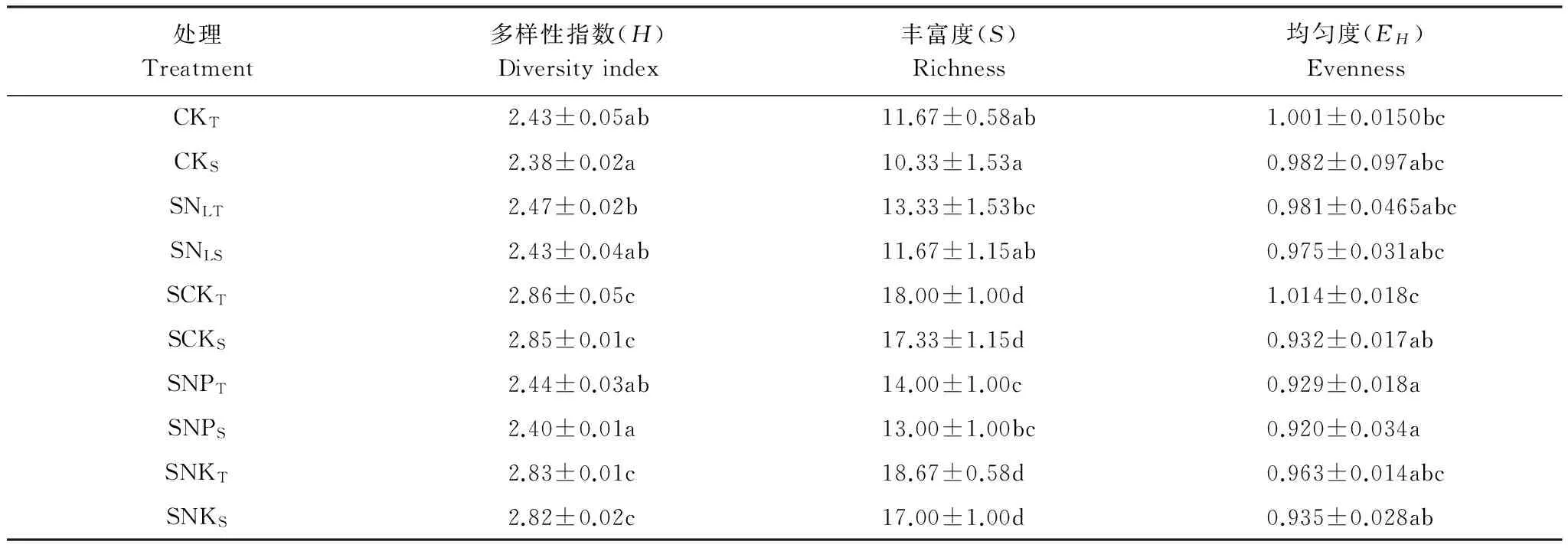
表3 秸稈還田下不同施肥處理土壤固氮基因nifH多樣性指數
2.4 土壤固氮菌群落相似性分析
進一步利用Quantity One軟件(Bio-Rad)對DGGE圖譜的條帶數和亮度進行數字化處理,并依此為據進行聚類分析,得到各處理間的聚類分析結果(圖2) 。10個處理聚類為三大族群, CKT、CKS為一種族群;SNLT、SNLS、SNPT、SNPS為一個族群;SCKT、SCKS、SNKT、SNKS為第三族群。通過DGGE聚類圖可以看出,相同的處理的上下層土壤聚到了一起,不同處理聚在了不同的族群里,說明秸稈覆蓋和不同的施肥方式都導致土壤理化性質差異,從而導致不同處理間的土壤固氮菌群落結構的影響不一致。從圖中可以看出,只施肥而不覆蓋秸稈的處理單獨聚成了一族,說明覆蓋秸稈使土壤固氮菌的群落結構發生了明顯變化。

圖2 DGGE圖譜聚類分析Fig.2 Cluster analysis of DGGE banding patterns
2.5 DGGE條帶測序分析
根據土壤固氮菌DGGE圖譜中出現的優勢和特殊共有條帶進行測序,將所得序列輸入NCBI網站將同源性較高的序列下載,通過Clustal X1.83, Mega Soft等軟件構建系統發育樹。結果如圖3。從系統樹可見該固氮菌群有豐富的菌種組成多樣性,14個條帶的近緣種大部分為非培養細菌nifH基因片段,主要優勢菌群其歸屬于變形菌門(Proteobacteria)的β-變形菌綱(Betaproteobacteria)非培養伯克氏菌屬、假食酸菌屬(Pseudacidovorax)、Azospira屬、Ideonella屬。14個條帶分屬于4個主要的簇,其中第一簇中的band 10、band 11、band 12、band 13與銅礦荒地的非培養伯克氏菌屬固氮細菌HM565855.1 十分相似,band 3與荷蘭Kollumerwaard土壤非培養細菌HQ335637.1十分相似、band 14與Ideonelladechloratans菌株EU542578.1相似性為94%,第二簇中band 2、band 5、band 6 與假食酸菌屬(Pseudacidovorax)菌株聚在一起,band 1、band 4、band 7與Azospira屬菌株聚為第三簇,band 8、band 9與其它序列差異較大單獨成簇,其為未確定歸屬的固氮細菌。
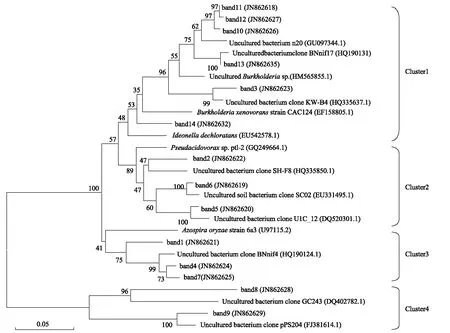
圖3 DGGE切膠條帶的系統發育樹,序列的GenBank登錄號列于括號中,尺長度為5%的核苷酸置換率Fig.3 Phylogenetic tree of sequences from DGGE bands. Numbers in parentheses represent the sequences accession number in GenBank. The scale bar: 5% sequence divergence
3 討論
3.1秸稈還田能有效改善土壤物理性結構,改善各類土壤細菌營養條件與提高細菌活性,有機肥與秸稈還田措施均可以提高不同功能土壤微生物類群的活性,有效的提高了氮肥的利用效率,使農作物產量得到增加[19]。微生物生物量碳、氮被認為是土壤活性養分的儲存庫,是植物生長可利用養分的重要來源[11]。土壤微生物生物量碳、氮是土壤微生物軀體中所固定的碳素和氮素,其含量的多少決定于土壤中微生物的數量,是土壤微生物對碳素、氮素同化與固持作用這種動態過程的綜合反映。Nie Jun[20]等研究表明秸稈覆蓋提高了微生物生物量碳和微生物生物量氮,與只施化肥田塊相比,分別提高了12.66%和15.07%;與對照相比,分別提高了7.76%和31.42%。
本試驗表明秸稈覆蓋還田配施適量氮磷鉀肥土壤微生物生物量碳氮的含量明顯高于對照處理,說明秸稈還田為微生物生長和繁殖提供了大量的碳源和能源,同時施用的氮肥又為微生物的生長提供了較多的氮源,刺激了微生物的生長。在秸稈覆蓋的處理中SCKT、SCKS分別高于SNLT、SNLS,即施氮肥較高的處理具有更高的微生物生物量碳、氮值。秸稈還田后,隨著施氮量的增加,提供給微生物的氮素增多,促進了微生物的繁殖,加快了秸稈腐解。處理SNPT、SNKT的微生物生物量碳氮低于SCKT,處理SNPS、SNKS的微生物生物量碳氮低于SCKS。說明秸稈覆蓋后需同時配施適量氮磷鉀才能更好地為微生物的生長提供更全面的能源物質。秸稈覆蓋下不同施肥配比對表層土壤影響更大,并隨著土層加深而減少。其原因是表層土壤能較好地與外界進行物質與能量交換,進入土壤的有機物質最先聚集于表層,養分條件好,土壤微生物活動旺盛,有利于微生物的繁殖。本試驗同一處理的上下層土壤的微生物生物量碳有顯著性差異,而微生物量氮均沒有顯著性差異。說明本研究中20cm表土層內微生物生物量碳氮均受到秸稈覆蓋及施肥的影響,但是影響的程度和方式卻不相同。
3.2PCR-DGGE技術是從微生物基因多樣性的角度研究土壤微生物群落結構的方法,近年來己經成為國內外研究的熱點[21]。與純培養相比,PCR克隆、RFLP分析等非培養方法被用于研究不同環境下nifH基因的組成和多樣性,更有利于對固氮生物進行完整和深入的探索和研究。采用PCR-DGGE方法對秸稈覆蓋還田下不同施肥處理的土壤微生物nifH基因多樣性及群落結構組成進行研究,從指紋圖譜我們可以看出不同處理土壤固氮微生物群落結構有一定的差異。Juraeva等研究發現,土壤總氮含量能夠影響固氮微生物的分布[22]。Keeling等研究表明,土壤碳氮比例影響著土壤固氮微生物的活性[23]。因此,土壤理化性質的差異可以影響固氮微生物的群落結構。對DGGE圖譜進行聚類分析和多樣性統計表明同層間SCKT、SCKS處理具有最高的多樣性指數及豐富度,而僅CKT、CKS對照組這兩個值最小。結果說明秸稈覆蓋還田配合不同施肥措施改變了土壤的營養狀況,改善土壤的生物學特征,導致土壤固氮微生物多樣性發生變化。Baumann等研究也指出植物殘留物能夠影響微生物的呼吸和微生物群落結構[24]。從樣品DGGE優勢條帶測序結果可以看出,這些條帶中最多的是非培養固氮細菌,其余對應的同源性最高的微生物分別屬于變形菌門(Proteobacteria),β-變形菌綱(Betaproteobacteria)的非培養伯克氏菌屬、假食酸菌屬(Pseudacidovorax)、Azospira屬以及Ideonella屬。說明本實驗土壤中固氮菌遺傳多樣性較為豐富。Bodelier等也證明了像水稻這樣的淹水作物的根際上壤中氧量較低,特別適合于進行生物固氮[25]。本研究運用PCR-DGGE方法得到的這些固氮細菌還未被培養或不可培養,故很難鑒定它們在耕作土壤中的生態功能,要具體了解這些優勢菌群的結構與功能,還需要做更全面細致的研究。
[1] Jiang Y H, Yu Z R, Ma Y L. The effect of stubble return on Agro-ecological system and crop growth. Chinese Journal of Soil Science, 2001, 32(5): 209- 213.
[2] Hong C L, Wei Y Z, Huang J F, Wang R Y, Yang X E. Effects of total crop straw return on soil fertility and field ecological environment. Journal of Zhejiang University: Agriculture and Life Sciences, 2003, 29(6): 627- 633.
[3] Steenwerth K L, Jackson L E, Calderón F J, Stromberg M R, Scow K M. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California. Soil Biology and Biochemistry, 2002, 34(11): 1599- 1611.
[4] David Tilman D, Johannes Knops J, David Wedin D, Reich P, Ritchie M, Siemann E. The influence of functional diversity and composition on ecosystem processes. Science, 1997, 277(5330): 1300- 1302
[5] Clough Y, Kruess A, Tscharntke T. Organic versus conventional arable farming systems: functional grouping helps understand staphylinid response. Agriculture, Ecosystems and Environment, 2007, 118(1/4): 285- 290.
[6] Yu C Y, Liu H, Xing Y D, Manukovskyd N S, Kovalevd V S, Gurevichd Y L. Bioconversion of rice straw into a soil-like substrate. Acta Astronautica 2008, 63(7/10): 1037- 1042.
[7] Bowen R M, Harper S H T. Decomposition of related compounds by fungi isolated from straw wheat straw and in arable soi1. Soil Biology Biochemistry, 1990, 22(3): 393- 399.
[8] Chen H, Tang X S, Lin J, Zhang B S, Ren D M. Community constitute and phylogenetic analysis on soil uncultured microorganism. Acta Microbiologica Sinica, 2002, 42(4): 478- 483.
[9] Kisand V, Wikner J. Limited resolution of 16S rDNA DGGE caused by melting properties and closely related DNA sequences. Journal of Microbiological Methods, 2003, 54(2): 83- 191.
[10] Dixon R, Kahn D. Genetic regulation of biological nitrogen fixation. Nature Reviews Microbiology, 2004, 2(8): 621- 631.
[11] Wu J S, Lin Q M, Huang Q Y, Xiao H A. The Method of Measuring Soil Microbial Biomass and Its Application. Beijing: China Meteorological Press, 2006.
[12] Dlallo M D, Wlllems A, Vloemans N, Cousin S, Vandekerckhove T T, de Lajudie P, Neyra M, Vyverman W, Gillis M, Van der Gucht K. Polymerase chain reaction denaturing gradient gel electrophoresis analysis of the N2-fixing bacterial diversity in soil under Acacia tortilis ssp. raddiana and Balanites aegyptiaca in the dryland part of Senegal. Environmental Microbiology, 2004, 6(4): 400- 415.
[13] Eichner C A, Erb R W, Timmis K N, Wagner-D?bler J. Thermal gradient gel electrophoresis analysis of bioprotection from pollutant shocks in the activated sludge microbial community. Applied and Environmental Microbiology, 1999, 65(1): 102- 109.
[14] Hedrick D B, Peacock A, Stephen J R, Macnaughton S J, Brüggemann J, White D C. Measuring soil microbial community diversity using polar lipid fatty acid and denaturing gradient gel electrophoresis data. Journal of Microbiological Methods, 2000, 41(3): 235- 248.
[15] Lin X G, Hu J L. Scientific connotation and ecological service function of soil microbial diversity. Acta Pedologica Sinica, 2008, 45(5): 892- 900.
[16] Zheng S X, Hu J L, Chen K, Yao J, Yu Z N, Lin X G. Soil microbial activity measured by microcalorimetry in response to long-term fertilization regimes and available phosphorous on heat evolution. Soil Biology and Biochemistry, 2009, 41(10): 2094- 2099.
[17] Lovell R D, Jarvis S C, Bardgett R D. Soil microbial biomass and activity in long-term grassland: effects of management changes. Soil Biology and Biochemistry, 1995, 27(7): 969- 975.
[18] Marschnera P, Kandeler E, Marschner B. Structure and function of the soil microbial community in a long-term fertilizer experiment. Soil Biology and Biochemistry, 2003, 35(3): 453- 461.
[19] Ye W P, Xie X L, Wang K R, Li Z G. Effects of rice straw manuring in different periods on growth and yield of rice. Chinese Journal of Rice Science, 2008, 22(1): 65- 70.
[20] Nie J, Zhou J M, Wang H Y, Chen X Q, Du C W. Effect of long-term rice straw return on soil Glomalin, Carbon and Nitrogen. Pedosphere, 2007, 17(3): 295- 302.
[21] Petra M, Pauline F G, Zed R. Microbial community composition and functioning in the rhizosphere of threeBanksiaspecies in native woodland in Western Australia. Applied Soil Ecology, 2005, 28(3): 191- 201.
[22] Juraeva D, George E, Davranov K, Ruppel S. Detection and quantification of thenifHgene in shoot and root of cucumber plants Canadian Journal of Microbiology, 2006, 52(8): 731- 739.
[23] Keeling A A, Cook J A, Wilcox A. Effects of carbohydrate application on diazotroph populations and nitrogen availability in grass swards established in garden waste compost. Bioresource Technology, 1998, 66(2): 3814- 3822.
[24] Baumann K, Marschner P, Smernik R J, Baldock J A. Residue chemistry and microbial community structure during decomposition of eucalypt, wheat and vetch residues. Soil Biology and Biochemistry, 2009, 41(9): 1966- 1975.
[25] Bodelier P L E. Interaction between oxygen-releasing roots and microbial processes in flooded soils and sediments//de Kroon H, Visser E J W, eds.Root Ecology. Ecology Studies. New York: Springer, 2003, 168: 331- 362.
參考文獻:
[1] 江永紅, 宇振榮, 馬永良. 秸稈還田對農田生態系統及作物生長的影響. 土壤通報, 2001, 32(5): 209- 213.
[2] 洪春來, 魏幼璋, 黃錦法, 王潤屹, 楊肖娥. 秸稈全量直接還田對土壤肥力及農田生態環境的影響研究. 浙江大學學報: 農業與生命科學版, 2003, 29(6): 627- 633.
[8] 陳灝, 唐小樹, 林潔, 張伯生, 任大明. 不經培養的農田土壤微生物種群構成及系統分類的初步研究. 微生物學報, 2002, 42(4): 478- 483.
[11] 吳金水, 林啟美, 黃巧云, 肖和艾. 土壤微生物量測定方法及其應用. 北京: 氣象出版社, 2006: 54- 61.
[15] 林先貴, 胡君利. 土壤微生物多樣性的科學內涵及其生態服務功能. 土壤學報, 2008, 45(5): 892- 900.
[19] 葉文培, 謝小立, 王凱榮, 李志國. 不同時期秸稈還田對水稻生長發育及產量的影響. 中國水稻科學, 2008, 22(1): 65- 70.
Effectofdifferentfertilizercombinationsandstrawreturnonmicrobialbiomassandnitrogen-fixingbacteriacommunityinapaddysoil
LIU Xiaoqian1, TU Shihua2, SUN Xifa2, GU Yunfu1, ZHANG Xianqin1, ZHANG Xiaoping1,*
1CollegeofResourcesandEnvironment,SichuanAgriculturalUniversity,Chengdu611130,China2SoilandFertilizerInstitute,SichuanAcademyofAgriculturalSciences,Chengdu610066,China
Chloroform fumigation and denaturing gradient gel electrophoresis(DGGE) were employed to study the influence of different fertilizer treatments with crop residue return on microbial biomass and nitrogen-fixing bacteria community in a gray brown alluvial paddy soil at soil depth of 0—10 cm and 10—20cm. Results show that soil microbial biomass carbon (SMB-C), microbial biomass nitrogen (SMB-N) and diversity of nitrogen-fixing bacteria decreased with soil depths. The control treatment with straw removal had the lowest amounts of SMB-C and SMB-N. Among the treatments receiving straw return, the quantity of SMB-C and SMB-N in the treatments with low nitrogen rate and omitting was significantly lower than the full rate NPK treatment. Omission of phosphate on the basis of NPK nonsignificantly reduced the SMB-N compared to the NPK treatment. It shows that straw mulching with addition of adequate NPK fertilizers can significantly increase the SMB-C and SMB-N. The diversity indices of DGGE profiles indicate that the treatment with adequate NPK had the most abundant nitrogen-fixing bacterial diversity. According to UPGMA cluster analysis, dendrogram of the 10 treatments were different, and the micro-organisms at the 0—10cm and 10—20cm in the control treatment differed from all the other treatments and stood alone in a separate group. DGGE bands sequencing further revealed that the 14 closely related species were largely uncultured bacterianifHgene fragment with the predominant community falling in the class of Proteobacteria in Betaproteobacteria. Application of PCR-DGGE can well interpret the community structure characteristics of the nitrogen-fixing bacteria molecules in the gray-brown alluvial paddy soil with straw return and different fertilizer treatments.
straw return; gray-brown alluvial paddy soil; microbial biomass; PCR-DGGE; nitrogen-fixing bacteria community
農業部公益性行業(農業)科研專項資助(201003016)
2012- 05- 29;
2012- 10- 26
*通訊作者Corresponding author.E-mail: luwenru@mail.caas.net.cn
10.5846/stxb201205290788
劉驍蒨,涂仕華,孫錫發,辜運富,張先琴,張小平.秸稈還田與施肥對稻田土壤微生物生物量及固氮菌群落結構的影響.生態學報,2013,33(17):5210- 5218.
Liu X Q, Tu S H, Sun X F, Gu Y F, Zhang X Q, Zhang X P.Effect of different fertilizer combinations and straw return on microbial biomass and nitrogen-fixing bacteria community in a paddy soil.Acta Ecologica Sinica,2013,33(17):5210- 5218.

