黃海細紋獅子魚種群特征的年際變化
陳云龍,單秀娟,周志鵬,戴芳群,李忠爐,金顯仕,*
(1. 中國海洋大學水產學院, 青島 266003; 2. 山東省漁業資源與生態環境重點實驗室,中國水產科學研究院黃海水產研究所,青島 266071;3. 廣東海洋大學水產學院, 湛江 524088)
黃海細紋獅子魚種群特征的年際變化
陳云龍1,2,單秀娟2,周志鵬2,戴芳群2,李忠爐3,金顯仕2,*
(1. 中國海洋大學水產學院, 青島 266003; 2. 山東省漁業資源與生態環境重點實驗室,中國水產科學研究院黃海水產研究所,青島 266071;3. 廣東海洋大學水產學院, 湛江 524088)
根據1958—2010年冬季黃海漁業資源底拖網調查獲得的細紋獅子魚(Liparistanakae)生物學數據,對4個不同年代間黃海細紋獅子魚的空間分布、相對資源密度、生長特征和繁殖特性等特征的年際變化進行了分析。結果表明:細紋獅子魚在黃海北部主要分布在遼東半島一側50 m等深線附近,在黃海中南部1958—1959年集中分布在黃海中部,1985年其分布范圍明顯擴大,1993—1994年和1999年其分布區域發生北移,高產區集中在36°N以北,2005年重新擴散至整個黃海中南部,2010年主要分布在石島東南部(35.5—36.5°N,123.5 —124.5°E)和江蘇南部外海(33.5—34.5°N,123—124°E)的兩個區域。出現頻率以1985年最高,達87.5%,相對資源密度以1993—1994年最大,為15.5 kg/h。近10年相對資源密度與海表溫度呈極顯著負相關(Plt;0.01),出現頻率和海表溫度呈負相關關系(P=0.051)。1985年、1999—2001年、2005年和2010年平均體長分別為35.1、33.9、33.8 cm和32.3 cm,呈逐漸減小的趨勢。除1985年外,雄性平均體長均顯著大于雌性(Plt;0.05)。各年份性比均與1∶1無顯著差異,但各體長組間差異較為明顯。伴隨著Ⅲ期所占的比例逐漸上升(6.7%—71.8%),細紋獅子魚性成熟比例(Ⅳ期及以上)逐漸降低(51.1%—23.9%)。
細紋獅子魚;生物學特征;空間分布;黃海
細紋獅子魚屬鮋形目Scorpaeniformes、獅子魚科Liparidae、 獅子魚屬Liparis,大中型底層魚類,廣泛分布于東北太平洋近岸寒溫帶水域,以黃海中南部產量最高,東海北部為其分布南限[1- 3]。細紋獅子魚屬于低值魚類, 國內無專門捕撈,長期作為底拖網的兼捕種,利用不足[3- 4]。在1975—1983年秋季太平洋鯡探捕中,細紋獅子魚占試捕總漁獲量的百分比從1975年的1.69%增至1982年的25.13%[5],現已成為黃海漁業資源優勢種[6],在黃海食物網中占據關鍵地位[7]。目前,黃鮟鱇Lophiuslitulon和細紋獅子魚Liparistanakae已經取代藍點馬鮫Scomberomorusniphonius、星康吉鰻Congemyriaster和帶魚Trichiuruslepturus等魚類,成為黃海生態系統的頂級捕食者[8]。頂級捕食者的波動會通過食物網下行效應(top-down effect)影響其他種類的豐度[9],細紋獅子魚具有季節性變動較大,生長迅速[10],生命周期相對較短,對外界環境變化響應較明顯的特點,因此對其種群進行長期監測是十分有益且必要的。目前對細紋獅子魚種群生物學變化的研究較少[11- 12],國內對其研究主要涉及攝食生態[13- 15]和寄生蟲學[16],對其種群長期動態方面還未見報道。本文以黃海水產研究所自20世紀50年末以來的底拖網調查數據為基準,分析細紋獅子魚資源長期動態,探討外界環境對其種群豐度和生物學特征的影響,以期為黃海漁業生態系統的開發、管理和保護提供基礎資料。
1 材料與方法
1.1 數據來源
數據來源于各年冬季黃海底拖網調查,調查時間為11月—2月初,翌年1月和2月調查數據歸為前一年,共計17個航次,分別為1958、1959、1960、1985、1993、1994、1999、2000、2001、2002、2003、2004、2005、2006、2007、2009和2010年。調查范圍為整個黃海(33°—39°N,121.5°—124.5°E),以37°N作為黃海北部和黃海中南部調查區的分界限。1958—1960年取樣使用雙船(約149.0 kW×2)底拖網,1985年至今采用“北斗”號調查船(1677.8 kW),船舶參數如表1。生物學測定細紋獅子魚樣品共計667 尾,分別為1985年97 尾;2000—2001年61 尾;2005年222 尾;2010年287 尾。生物學測定指標包括體長、體重、性別和性腺成熟度。
細紋獅子魚(12月—2月)取樣海域的年平均海表溫度下載自哥倫比亞大學海洋環境數據庫[http:// iridl. ldeo. columbia.edu],范圍為32.5—36.5°N,121.5—124.5°E,分辨率為1°×1°。
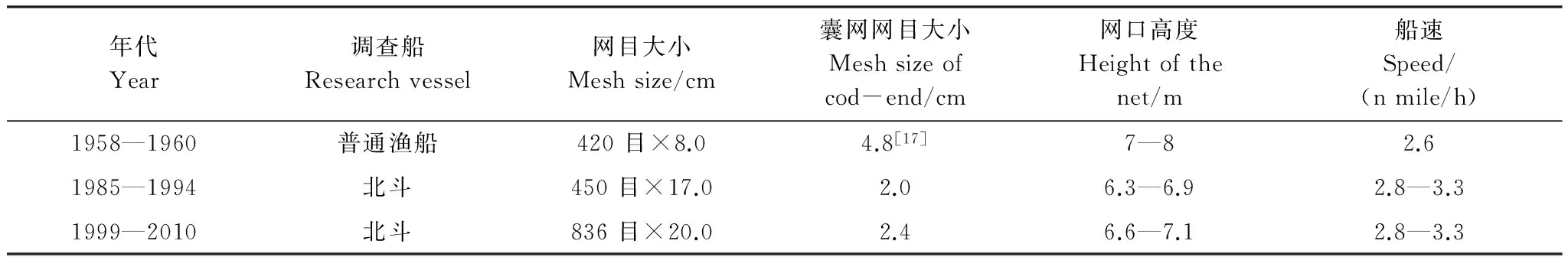
表1 各航次調查船和網具
1.2 數據處理
各站位拖網時間均標準化為1 h,并根據網口面積標準化漁獲數據[18]。相對資源密度以單位時間漁獲量(kg/h)表示, 各年平均相對資源密度以平均單位時間漁獲量(kg/h)表示。
生物學測定中,體長和體重分別精確到1 mm和0.1 g,以2 cm分組計算優勢體長,體長-體重關系用冪指數方程表示:W=aLb。W為體重(g),L為體長(cm),其中a為條件因子,b為異速增長因子[19]。協方差分析(ANCOVA)檢驗性別間體長-體重關系差異性,若無顯著差異,則合并雌、雄及未發育個體以擬合體長體重關系。
性別、性腺成熟度和攝食等級采用目測法,性腺按照Ⅰ—Ⅵ期[20]劃分,并規定Ⅳ期以上(即Ⅳ—Ⅵ期)為性成熟。細紋獅子魚性比與1∶1的差異以20 mm為間隔運用卡方檢驗(χ2檢驗)進行分析,肥滿度公式[19]為C=W/L3×100,L為體長(cm),W采用體重(g)。
數據采用Excel 2007、SPSS 18.0和Surfer 9.0進行統計和處理。
2 結果
2.1 種群空間分布的變化
黃海中南部細紋獅子魚相對資源密度的空間分布及相對資源密度和出現率的年際變化見分別見圖1和表2。在黃海北部,細紋獅子魚主要分布在遼東半島一側50 m等深線附近,中部深水區分布較少,1999年分布區域較1958年相比有所擴大。其中在黃海北部1958年出現頻率為20.8%,相對資源密度最高為31.5 kg/h,1985年在黃海北部僅1個站位出現,為1.2 kg/h,1999年出現頻率為66.7%,相對資源密度最高為37.2 kg/h。
在黃海中南部,1958—1959年相對資源密度集中分布在黃海中部,特別是34°N附近,最高為63.0 kg/h。1958年在近岸區域也有分布,但相對資源密度小于黃海中部,最高為21.0 kg/h。1985年其分布范圍明顯擴大,廣泛分布于黃海海槽區域,出現率為87.5%,相對資源密度相對均勻,在50 m等深線附近稍高。1993—1994年和1999年相比1985年和1958—1959年,細紋獅子魚的分布區域發生北移,高產區集中在36°N以北,出現率為45.8%,相對資源密度最高值出現在1993—1994年間,為160 kg/h,占當年調查的44.1%,1999年36°N 以南相對資源密度明顯較小,并在34°N形成分布南限。2005年其分布重新擴散至整個黃海中南部,出現率為77.3%,相對資源密度多在5—20 kg/h,分布相對均勻。2010年主要分布在50 m以深的水域,且明顯集中在石島東南部(35.5—36.5°N,123.5 —124.5°E)和江蘇南部外海(33.5—34.5°N,123—124°E)的兩個區域,出現率為69.4%,南部分布較為均勻,相對資源密度基本在5—20 kg/h之間,北部幾個站點相對資源密度較高,最高為70 kg/h,而50 m以淺的幾個站點均未分布。如圖1,1958—1959年細紋獅子魚在黃海中南部相對資源密度較低,分布范圍也較小,1985年和1993—1994年其相對資源密度最高,分布范圍遍及黃海中南部,1999年相對資源密度有所下降,而近10年其相對資源密度有回升的趨勢。
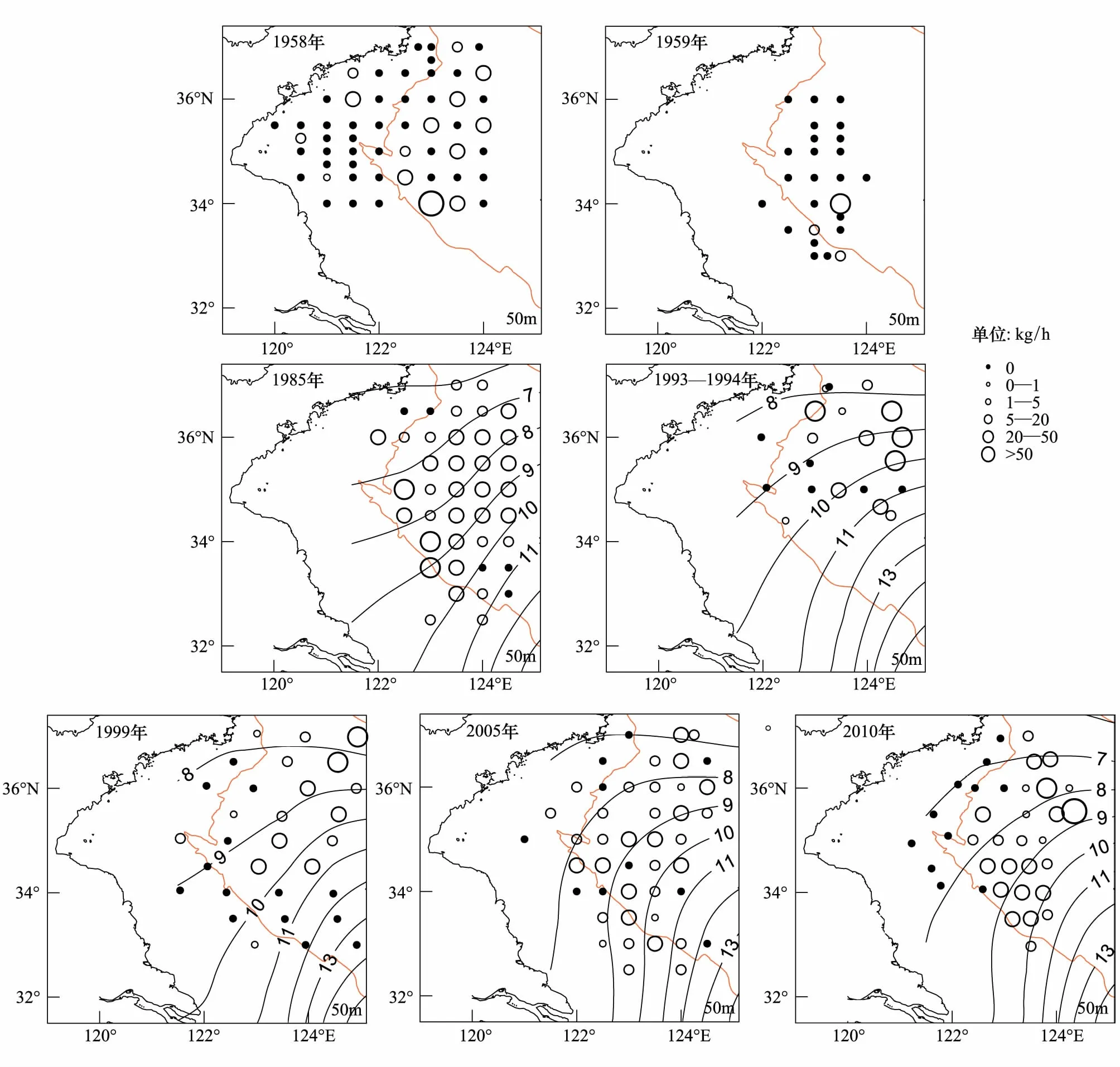
圖1 黃海中南部細紋獅子魚相對資源密度的空間分布Fig.1 Distribution of the relative stock density of L.tanakae in the central and southern Yellow Sea1958和1959年無相應溫度資料
Table2InterannualvarianceinrelativestockdensityandoccurrencefrequencyofL.tanakaeinthecentralandsouthernYellowSea
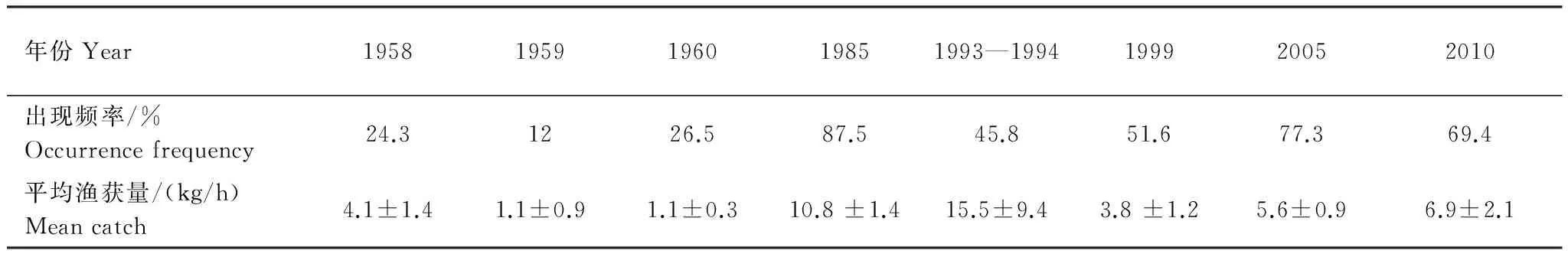
年份Year19581959196019851993—1994199920052010出現頻率/%Occurrencefrequency24.31226.587.545.851.677.369.4平均漁獲量/(kg/h)Meancatch4.1±1.41.1±0.91.1±0.310.8±1.415.5±9.43.8±1.25.6±0.96.9±2.1
海表溫度和細紋獅子魚相對資源密度以及出現頻率的關系如圖2。比較近10年海表溫度與細紋獅子魚相對資源密度發現,兩者存在極顯著的負相關關系(Plt;0.01,r=-0.81):當溫度升高時,細紋獅子魚的相對資源密度下降,如2005—2006年間,平均水溫升高0.73℃,相對資源密度由5.6 kg/h下降至1.9 kg/h。當溫度下降時,相對資源密度往往有上升的趨勢,如2000—2002年水溫下降了0.86℃,相應的相對資源密度上升了2.45 kg/h,而2004—2005年的數據相應為1.06℃,3.14 kg/h。水溫較低的年份如2005和2010年細紋獅子魚出現率均很高,其分布遍及整個黃海中部。海表溫度和細紋獅子魚的出現頻率呈負相關關系,但不顯著(P=0.051,r=-0.60)。
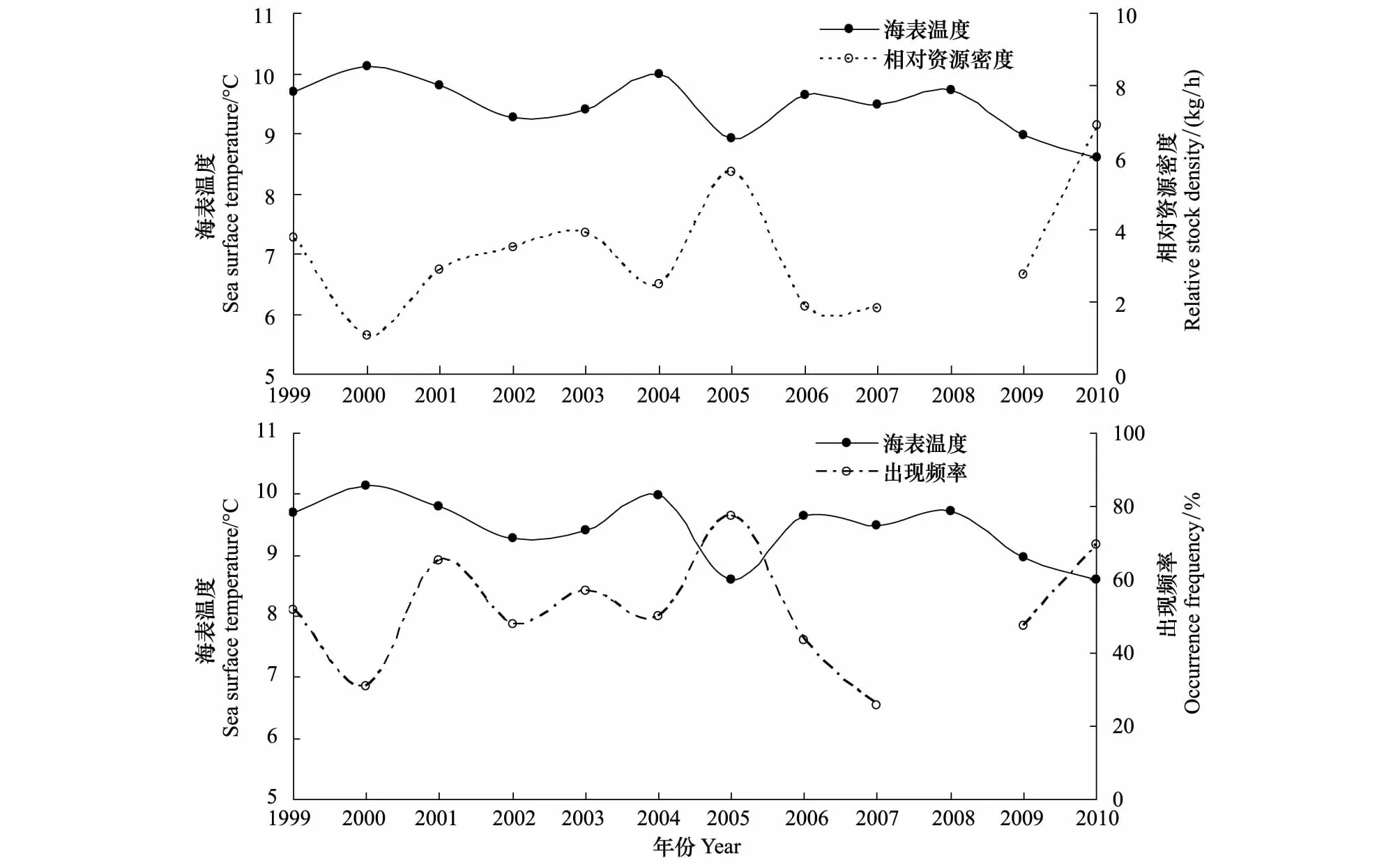
圖2 細紋獅子魚相對資源密度和出現頻率與海表溫度的關系Fig.2 The relative stock density and occurrence frequency of L.tanakae and their relationship with sea surface temperature
2.2 體長分布和體長體重關系
細紋獅子魚各年份的體長頻次如圖3所示。1985年其平均體長為35.1 cm,優勢體長范圍30—42 cm,占69.9%,雌性平均體長為34.6 cm,雄性為34.9 cm;1999—2001細紋獅子魚的平均體長為33.9 cm,優勢體長范圍30—34 cm和36—44 cm,分別占24.3%和37.1%,雌性和雄性平均體長分別為35.7 cm和38.1 cm;2005年平均體長為33.8 cm,優勢體長范圍30—38 cm,約占58.5%,雌性和雄性的平均體長為32.3 cm和35.6 cm;2010年平均體長為32.3 cm,優勢體長范圍26—38 cm,占78.8%,其中雌性平均體長為30.9 cm,雄性為33.6 cm;4個年代的總體平均體長和優勢體長呈下降趨勢。
年際間的t檢驗顯示,2010年平均體長顯著小于其他年份(Plt;0.05),2005年平均體長顯著小于1985年(Plt;0.05),其余年份間均無顯著差異。另外除1985年雌雄間平均體長無差異(Pgt;0.05),其余年份雄性平均體長極顯著大于雌性(Plt;0.01)。
各年代體長體重關系見表3,協方差檢驗顯示1985年和2005年的雌雄個體參數b值差異不顯著(Pgt;0.05),故將其雌雄合并,而2000—2001年和2010年的雌雄間b值差異顯著(Plt;0.05)。b值年際間變化顯示,1985年和剩余年份差異顯著(Plt;0.05),其他3個年份之間無顯著差異(Pgt;0.05)。t檢驗顯示,1985年、2005年以及2010年的雄性個體的b值顯著小于3,群體呈負異速生長;其余b值均與3無顯著差異,為等速生長。
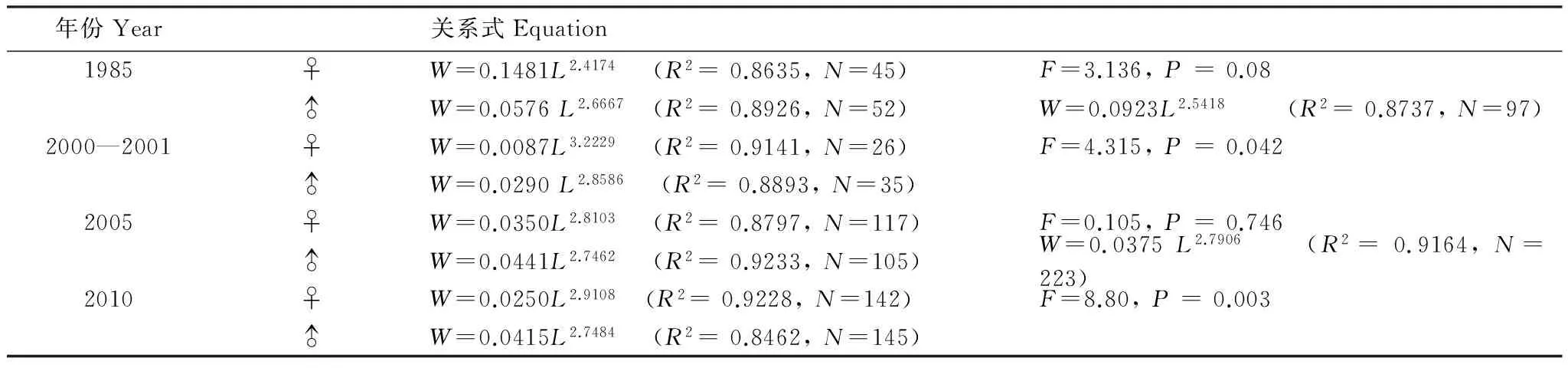
表3 黃海細紋獅子魚體長-體重關系式中各參數
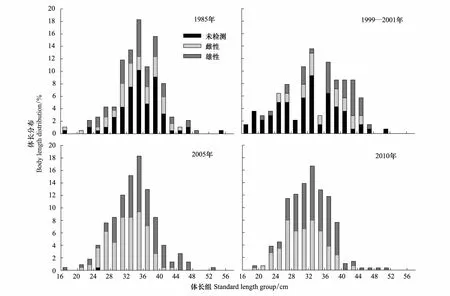
圖3 黃海細紋獅子魚的體長頻次分布Fig.3 Body length distribution of L. tanakae in the Yellow Sea
2.3 性比及性腺成熟度
1985—2010年冬季4個年份的雌雄性比雖稍有變化,但均與1∶1無顯著差異(表4)。各體長組間差異較為明顯,小于20 cm的個體中,1985年和2010年均為雌性,2005和2000—2001年均為雄性。20—30 cm體長組中,2000—2001年和1985年性比1∶1無顯著差異。而2005年雄性居多(Plt;0.05),2010年雌性居多(Plt;0.01)。30—40 cm體長組雌雄個體性比與1∶1無顯著差異。40—50 cm體長組中,各個年份個數雄性居多,其中2005年差異極顯著(Plt;0.01),而大于50 cm的漁獲物中僅存在雄性個體。
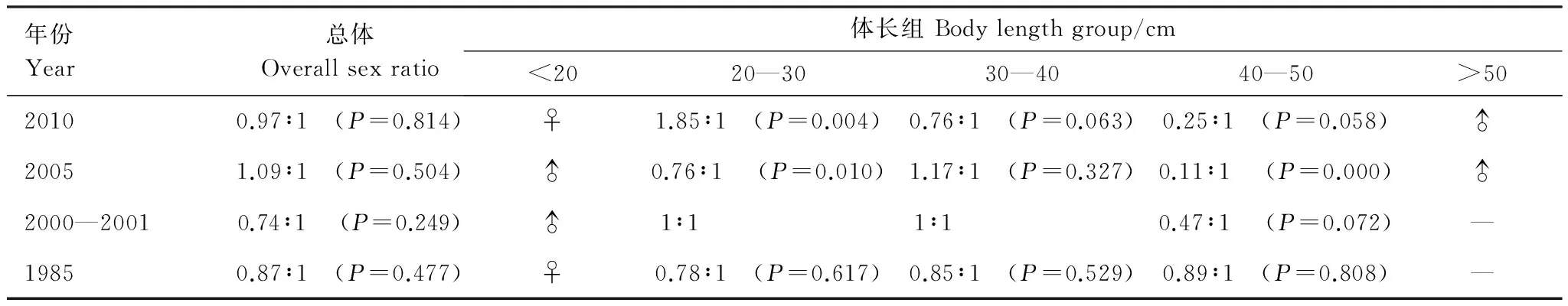
表4 細紋獅子魚體長組性比的年際變化
性腺成熟度各期百分比如圖4所示,1985年Ⅱ期占據比例較高,為42.2%,為所有調查年份最高,而其余年份Ⅱ期所占比例均小于10%。Ⅲ期所占比例隨時間的變化逐漸增加,1985年僅占6.7%,而2010年冬季高達71.8%。性成熟個體(Ⅳ和Ⅴ期)所占比例呈現出下降趨勢,1985年為51.1%,2000—2001年略有上升變為53.8%,2005年為41.8%,2010年最低,僅為23.9%。
2.4 肥滿度的變化
細紋獅子魚的肥滿度為1.81—1.99,雌性肥滿度為1.82—1.96(圖5),而雄性為1.78—1.83。t檢驗顯示,各年份雌雄肥滿度無顯著差異,而2000—2001年的總體肥滿度顯著高于2005年和2010年,其他年份之間均無顯著差異。
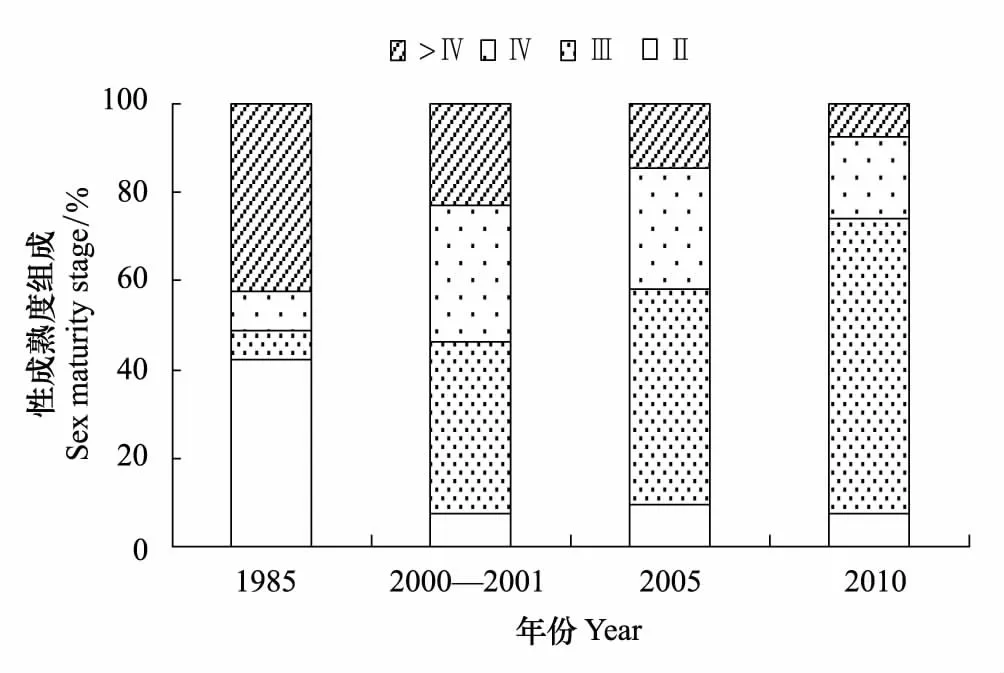
圖4 黃海中南部細紋獅子魚雌性性腺成熟度(Ⅱ—Ⅵ期)各期百分比組成Fig.4 Percentage of sex maturity stage (Ⅱ—Ⅵ) of female L. tanakae in the central and southern Yellow Sea
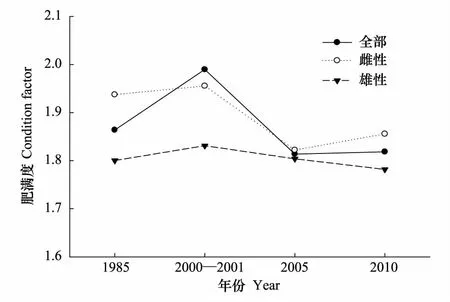
圖5 黃海中南部細紋獅子魚的肥滿度變化 Fig.5 Variations in condition factor of L. tanakae in the central and southern Yellow Sea
3 討論
3.1 細紋獅子魚生物學特征的變化
趙紫晶[5]曾報道1—2月黃海細紋獅子魚的產卵群體平均體長40 cm,優勢體長33—36 cm和44—45 cm,略高于1985年的數據,這可能是與該魚生長快速,體長跨度大有關。本研究中,1985年到2010年平均體長和優勢體長持續減小。過度捕撈常常被認為是影響魚類生物學特征的主要因素[21- 22],由于細紋獅子魚的資源量相對較高,其他資源種類的衰退迫使漁業對象發生轉變,且水產品深加工的發展也提升了該魚的利用率,其近年承受的捕撈壓力增大,使得體長特征開始發生變化,大個體比例顯著減小。在攝食習性上,細紋獅子魚的優勢餌料生物也出現了明顯的更替[13, 15],張波等[14]發現由于鳀魚在漁業資源的比例逐漸降低,細紋獅子魚的餌料中鳀魚比例逐漸減小,而脊腹褐蝦的比例逐漸升高。魚類的生長與餌料的大小有很大的關系,根據“最佳攝食理論”[23],魚類生長過程中總是傾向于捕食大個體的餌料生物,最大限度地獲得能量,以補償捕食所消耗的能量。這種食性的變化可能導致細紋獅子魚捕食耗能增加,而用于生長的能量下降,從而導致生物學特征變化。
繁殖時期,細紋獅子魚所攝能量多用于性腺發育,這個時期的體長生長速度降低,所以異速增長因子b小于3或與3無差異。肥滿度在性成熟時一般較大,可以用來確定產卵期。2000—2001年冬季的肥滿度高于其他年份,與2005年和2010年冬季差異顯著,且性成熟比例同時也較高,說明該年的繁殖期可能早于其他年份。不同體長組的性比變化可能與雌雄異形有關,本研究中1985年各體長組差異較小,起性比均與1∶1無顯著差異。而其他年份,體長大于40 cm組的個體偏向于雄性,這種體長組性比的雌雄差異在鮟鱇魚類中也有存在[24]。性成熟個體所占總個體數比例呈現下降的趨勢,由1985年的51.1%降至2010年的23.9%,一方面可能與過度捕撈導致大個體數量減少有關,本文四個年代的總體平均體長和優勢體長均呈下降趨勢;另一方面,嚴重的過度捕撈使得一些魚類存在產卵期延長的繁殖策略,如帶魚[25],而目前針對細紋獅子魚繁殖的研究較少,其是否也存在這樣的繁殖策略值得進一步研究。
3.2 細紋獅子魚的資源變動
20世紀50年代,由于漁業捕撈力量不足,黃海的其他大型底層魚類在漁業資源中比例較高。細紋獅子魚與很多底層種類存在食物競爭和空間競爭,如張波等[26]發現細紋獅子魚與小黃魚、高眼鰈、大頭鱈、華鰩、鮟鱇、帶魚和龍頭魚等魚類存在一定的食物競爭。而于振海等[27]發現細紋獅子魚與星康吉鰻的時空生態位重疊值最大,這可能使得細紋獅子魚在20世紀50年代的生態位空間競爭激烈,分布范圍受到限制,導致其相對資源量處于較低水平,分布范圍較小。
本研究1985年細紋獅子魚出現率為87.5%,為各個年份最高。這可能是由于漁業資源和海水溫度的共同變化造成的。一方面,20世紀80年代初,隨著黃渤海底層漁業資源的衰退,黃海食物網上層出現生態空缺,細紋獅子魚種間競爭壓力減小,而其食性廣,生長速度快的特性使其能夠迅速填補生態位的空缺。根據黃海中北部鯡魚試捕調查[5],1975年細紋獅子魚出現率為25.8%,1976年升至80.76%,1977—1980出現率在33.33%—55.5%,而1981—1983年出現率高達94.7%—100%。80年代后期,在大型底層魚類銳減的同時,小型中上層魚類成為黃海的優勢種類[28],特別是鳀魚為細紋獅子魚種群的增長提供了較好餌料基礎。另一方面,相對資源密度與海表溫度具有極顯著的負相關關系(Plt;0.01,r=-0.81),出現頻率和海表溫度呈負相關關系(P=0.051,r=-0.60),1985年黃海中南部冬季平均溫度(來源于哥倫比亞大學海洋環境數據庫)遠低于文中其他年份的海表溫度(圖2),為細紋獅子魚這樣的冷水性魚類的出現創造了良好的水溫條件。
水溫對魚類的分布有直接的影響。Henderson等[29- 30]在布里斯托爾灣發現水溫和獅子魚(L.liparis)豐度的長期變化具有一定相關性;Ishida等[31]研究發現當阿拉斯加灣北部海表溫度較低時,大麻哈魚(Oncorhynchusketa)和紅大麻哈魚(Oncorhynchusnerka)在白令海的產量和分布范圍減少,反之,其在白令海豐度較高,分布較廣;Poulard和Blanchard[32]發現溫度上升使得比斯開灣亞熱帶種類分布比例上升,而溫帶種類的產量穩步下降,一些魚類的分布南限北移;在我國,溫度的上升使得黃海冷水團位置北移,使小黃魚的分布向北偏移[33- 34]。本研究中,1993—1994年和1999年相比1985年和1958—1959年,細紋獅子魚的分布區域發生北移。在調查區域內,細紋獅子魚冬季主要分布范圍為7—11℃(圖1),冬季影響黃海的水系主要是黃海暖流水和沿岸水,圖1中可以看到黃海暖流1993—1994年和1999年相比1985年強度要高,影響的范圍更大,相應的7—11℃區域也更偏北,這可能是導致細紋獅子魚這一冷水性魚類分布北移的原因。此外,1985年和2010年冬季的平均海表溫度相近,處于較低水平,而相對資源密度之差高達3.9 kg/h,說明細紋獅子魚還受到其他因素的影響,低選擇性的捕撈可能是原因之一。
[1] 山田梅芳, 時村宗春, 堀川博史, 中坊徹次. 東シナ海·黃海の魚類誌. 東京: 東海大學出版會, 2007: 525- 529.
[2] Chernova N V, Stein D L, Andriashev A P. Family Liparidae Scopoli 1777-snailfishes. California Academy of Sciences, Annotated Checklists of Fishes, 2004, 31: 1- 72.
[3] Zhao C Y. Marine Fishery Resources of China. Hangzhou: Zhejiang Scientific and Technical Press, 1990: 70- 71.
[4] Liu C X, Qin K J. Fauna of Liaoning(Fishes). Shenyang: Liaoning Science and Technology Press, 1987: 409- 414.
[5] Liu X S. Investigation and Division of the Yellow Sea and Bohai Sea Fishery Resources. Beijing: Ocean Press, 1990: 251- 252.
[6] Jin X S, Cheng J S, Qiu S Y, Li P J, Cui Y, Dong Q. Integrated Research and Evaluation on Fisheries Resources in the Yellow Sea and Bohai Sea. Beijing: Ocean Press, 2006: 94- 98.
[7] Wei S, Jiang W M. Study on food web of fishes in the Yellow Sea. Oceanologia et Limnologia Sinica, 1992, 23(2): 182- 192.
[8] Zhang B, Tang Q S, Jin X S. Functional groups of communities and their major species at high trophic level in the Yellow Sea ecosystem. Acta Ecologica Sinica, 2009, 29(3): 1099- 1111.
[9] Scheffer M, Carpenter S, Young B. Cascading effects of overfishing marine systems. Trends in Ecology and Evolution, 2005, 20(11): 579- 581.
[10] Zhou Z P, Jin X S, Shan X J, Li Z L, Dai F Q. Seasonal variations in distribution and biological characteristics of snailfishLiparistanakaein the central and southern Yellow Sea. Acta Ecologica Sinica, 2012, 32(17): 5550- 5561.
[11] 小坂昌也. 仙臺灣産クサウオLiparistanakai(Gilbert et Burke)の生態的地位について. 東海大學紀要海洋學部, 1971, (5): 27- 41.
[12] Kawasaki T, Hashimoto H, Honda H, Otake A. Selection of life histories and its adaptive significance in a snailfishLiparistanakaifrom Sendai Bay. Nippon Suisan Gakkaishi, 1983, 49(3): 367- 377.
[13] Xue Y, Xu B D, Gao T X, Qiu T L, Lin L S. Preliminary study on feeding ecology ofLiparistanakaein North Yellow Sea. Journal of Fishery Sciences of China, 2010, 17(5): 1066- 1074.
[14] Jin X S, Zhang B, Xue Y. The response of the diets of four carnivorous fishes to variations in the Yellow Sea ecosystem. Deep Sea Research Part II: Topical Studies in Oceanography, 2010, 57(11/12): 996- 1000.
[15] Zhang B, Jin X S, Dai F Q. Feeding habits and their variation of seasnail (Liparistanakae) in the Central and Southern Yellow Sea. Journal of Fisheries of China, 2011, 35(8): 1199- 1207.
[16] Li L, Xu Z, Zhang L P. A new species of genusHysterothylaciumWard et Magath, 1917 (Nematoda, Anisakidae) fromLiparistanakae(Scorpaeniformes, Liparidae) from the Yellow Sea, China. Acta Parasitologica, 2007, 52(4): 371- 375.
[17] Li Z L, Jin X S, Shan X J, Dai F Q. Inter-annual changes on body weight-length relationship and relative fatness of small yellow croaker (Larimichthyspolyactis). Journal of Fishery Sciences of China, 2011, 18(3): 602- 610.
[18] Jin X S, Zhao X Y, Meng T X, Cui Y. Living Resources and Environment in the Yellow Sea and Bohai Sea. Beijing: Science Press, 2005: 1- 20.
[19] Zhan B Y. Fisheries Stock Assessment. Beijing: China Agriculture Press, 1995: 20- 21.
[20] Yellow Sea Fishery Research Institute. Investigation Handbook of Marine Fisheries Resources Survey. 2nd ed. Shanghai: Shanghai Scientific and Technical Press, 1981: 38- 39.
[21] Zhang G Z, Li X S, Jin X S, Zhu J C, Dai F Q. Changes of biological characteristics of small yellow croaker (Larimichthyspolyactis) in the Central and Southern Yellow Sea. Acta Ecologica Sinica, 2010, 30(24): 6854- 6861.
[22] Hsieh C, Yamauchi A, Nakazawa T, Wang W F. Fishing effects on age and spatial structures undermine population stability of fishes. Aquatic Sciences, 2010, 72(2): 165- 178.
[23] Gerking S D. Feeding Ecology of Fish. San Diego: Academic Press, 1994: 1- 244.
[24] Zhang X J, Cheng J H, Shen W, Liu Z L. Feeding ecology ofLophiuslitulonin the South of Yellow Sea. Acta Ecologica Sinica, 2010, 30(12): 3117- 3125.
[25] Mi C D. A study on resources, stock structure and variation of reproductive habit of haritail,Trichiurushaumelain East China Sea. Journal of Fishery Sciences of China, 1997, 4(1): 7- 14.
[26] Zhang B, Tang Q S, Jin X S, Xue Y. Feeding competition of the major fish in the East China Sea and the Yellow Sea. Acta Zoologica Sinica, 2005, 51(4): 616- 623.
[27] Yu Z H, Jin X S, Li X S. Analysis of ecological niche for major fish species in the Central and Southern Yellow Sea. Progress in Fishery Sciences, 2010, 31(6): 1- 8.
[28] Jin X S, Tang Q S. Changes in fish species diversity and dominant species composition in the Yellow Sea. Fisheries Research, 1996, 26(3/4): 337- 352.
[29] Henderson P A, Holmes R H A. Population stability over a ten year period in the short lived fishLiparisliparis. Journal of Fish Biology, 1990, 37(4): 605- 615.
[30] Henderson P A, Seaby R M. Population stability of the sea snail at the southern edge of its range. Journal of Fish Biology, 1999, 54(6): 1161- 1176.
[31] Ishida Y, Azumaya T, Fukuwaka M, Davis N. Interannual variability in stock abundance and body size of Pacific salmon in the central Bering Sea. Progress in Oceanography, 2002, 55(1/2): 223- 234.
[32] Poulard J C, Blanchard F. The impact of climate change on the fish community structure of the eastern continental shelf of the Bay of Biscay. ICES Journal of Marine Science, 2005, 62(7): 1436- 1443.
[33] Shan X J, Li Z L, Dai F Q, Jin X S. Seasonal and annual variations in biological characteristics of small yellow croakerLarimichthyspolyactisin the Central and Southern Yellow Sea. Progress in Fishery Sciences, 2011, 32(6): 7- 16.
[34] Lin L S, Cheng J H, Jiang Y Z, Yuan X W, Li J S, Gao T X. Spatial distribution and environmental characteristics of the spawning grounds of small yellow croaker in the Southern Yellow Sea and the East China Sea. Acta Ecologica Sinica, 2008, 28(8): 3485- 3494.
參考文獻:
[3] 趙傳絪. 中國海洋漁業資源. 杭州: 浙江科學技術出版社, 1990: 70- 71.
[4] 劉蟬馨, 秦克靜. 遼寧動物志(魚類). 沈陽: 遼寧科學技術出版社, 1987: 409- 414.
結果顯示,鐵皮石斛勻漿液對三種病原微生物具有不同程度的抑制效果,其中對大腸桿菌的抑制效果最強,對綠色鏈球菌的抑制效果最弱。最小抑菌濃度的測定結果顯示,鐵皮石斛勻漿液對金黃色葡萄球菌、大腸桿菌和綠色鏈球菌的最小抑菌濃度分別是5%、2.5%和10%,其結果與紙圓片抑菌實驗的測定結果一致。這表明服用鐵皮石斛確實有抑制部分病原微生物、強化免疫力的作用,尤其對維持腸道健康有益。
[5] 劉效舜. 黃渤海區漁業資源調查和區劃. 北京: 海洋出版社, 1990: 251- 252.
[6] 金顯仕, 程濟生, 邱盛堯, 李培軍, 崔毅, 董婧. 黃渤海漁業資源綜合研究與評價. 北京: 海洋出版社, 2006: 94- 98.
[7] 韋晟, 姜衛民. 黃海魚類食物網的研究. 海洋與湖沼, 1992, 23(2): 182- 192.
[8] 張波, 唐啟升, 金顯仕. 黃海生態系統高營養層次生物群落功能群及其主要種類. 生態學報, 2009, 29(3): 1099- 1111.
[10] 周志鵬, 金顯仕, 單秀娟, 李忠爐, 戴芳群. 黃海中南部細紋獅子魚的生物學特征及資源分布的季節變化. 生態學報, 2012, 32(17): 5550- 5561.
[13] 薛瑩, 徐賓鐸, 高天翔, 邱天龍, 林龍山. 北黃海細紋獅子魚攝食生態的初步研究. 中國水產科學, 2010, 17(5): 1066- 1074.
[15] 張波, 金顯仕, 戴芳群. 黃海中南部細紋獅子魚的攝食習性及其變化. 水產學報, 2011, 35(8): 1199- 1207.
[17] 李忠爐, 金顯仕, 單秀娟, 戴芳群. 小黃魚體長- 體質量關系和肥滿度的年際變化. 中國水產科學, 2011, 18(3): 602- 610.
[18] 金顯仕, 趙憲勇, 孟田湘, 崔毅. 黃、渤海生物資源與棲息環境. 北京: 科學出版社, 2005: 1- 20.
[19] 詹秉義. 漁業資源評估. 北京: 中國農業出版社, 1995: 20- 21.
[20] 黃海水產研究所. 海洋水產資源調查手冊 (第二版). 上海: 上海科學技術出版社, 1981: 38- 39.
[21] 張國政, 李顯森, 金顯仕, 朱建成, 戴芳群. 黃海中南部小黃魚生物學特征的變化. 生態學報, 2010, 30(24): 6854- 6861.
[24] 張學健, 程家驊, 沈偉, 劉尊雷. 黃海南部黃鮟鱇攝食生態. 生態學報, 2010, 30(12): 3117- 3125.
[25] 宓崇道. 東海帶魚資源狀況、群體結構及繁殖特性變化的研究. 中國水產科學, 1997, 4(1): 7- 14.
[26] 張波, 唐啟升, 金顯仕, 薛瑩. 東海和黃海主要魚類的食物競爭. 動物學報, 2006, 51(4): 616- 623.
[27] 于振海, 金顯仕, 李顯森. 黃海中南部主要魚種的生態位分析. 漁業科學進展, 2011, 31(6): 1- 8.
[33] 單秀娟, 李忠爐, 戴芳群, 金顯仕. 黃海中南部小黃魚種群生物學特征的季節變化和年際變化. 漁業科學進展, 2012, 32(6): 7- 16.
[34] 林龍山, 程家驊, 姜亞洲, 袁興偉, 李建生, 高天翔. 黃海南部和東海小黃魚 (Larimichthyspolyactis) 產卵場分布及其環境特征. 生態學報, 2008, 28(8): 3485- 3494.
InterannualvariationinthepopulationdynamicsofsnailfishLiparistanakaeintheYellowSea
CHEN Yunlong1, 2, SHAN Xiujuan2, ZHOU Zhipeng2, DAI Fangqun2, LI Zhonglu3, JIN Xianshi2,*
1CollegeofFisheries,OceanUniversityofChina,Qingdao266003,China2KeyLaboratoryforFisheryResourcesandEco-environment,ShandongProvince,YellowSeaFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Qingdao266071,China3FacultyofFisheries,GuangdongOceanUniversity,Zhanjiang524088,China
The snailfish,Liparistanakae, is a cold-water, demersal fish that has become one of the top predators in the Yellow Sea ecosystem because of a decline in the abundance of the commercially targeted species in recent years. We evaluated the interannual variation in relative stock density, distribution, biological and reproductive characteristics of snailfish based on fishery data collected by bottom trawl during winter (1958—2010) in the Yellow Sea. In the northern Yellow Sea, the snailfish was primarily distributed around the Liaodong Peninsula near the 50 m isotherm. In other regions of the Yellow Sea, the species was primarily distributed in the central Yellow Sea in 1959, but had expanded its distribution by 1985. Relative to surveys in 1958—1959 and 1985, the distribution of snailfish moved northward by the 1990s from 34°N to 36°N. In 2005, the species was found in all areas of the Yellow sea and in 2010, it was primarily distributed southeast of Shidao (35.5—36.5°N,123.5 —124.5°E) and off southern Jiangsu province. The relative stock density of snailfish was low in the late 1950s (1.1—4.1 kg/h), then increased in the 1980s and 1990s, peaking at 15.5 kg/h in 1993—1994. The density then decreased to 3.8 kg/h in the late 1990s and has recovered only slightly in the last 10 years. We observed a similar trend in occurrence frequency. In the late 1950s, snailfish only accounted for 12.0%—26.5% of the occurrence frequency. However, it peaked at 87.5% in the 1980s. In other years, the occurrence frequency was relatively large (45.8%—77.3%), though most notably in the “cold” years such as 1985, 2005 and 2010. We observed a significant negative correlation between relative stock density and sea surface temperature in the ten most recent years suggesting that this cold-water species responded rapidly to the changing temperature. Similarly, we observed a negative but insignificant correlation between the occurrence frequency and sea surface temperature. The average body length of snailfish was 35.1 cm in 1985, 33.9 cm in 1999—2001, 33.8 cm in 2005 and 32.3 cm in 2010, suggesting a tendency towards miniaturization. The average body length of male individuals was significantly larger than for female individuals in all survey years (except 1985). Thebvalue for males in 1985, 2005 and 2010 were significantly less than 3, consistent with intensely negative-allometric growth of the population whereas the remainingbvalues were not significantly different. We evaluated the sex ratios(♀:♂)within five length groups(lt;20, 20—30, 30—40, 40—50, gt;50 cm). There was no significant difference in the sex ratio during the survey years. However, the ratio did differ within body length groups. Within lt;20 cm group, all fish were female in 1985 and 2010 and male in 2000—2001 and 2005. In the 20—30 cm group, there was no difference in the ratio during four decades, although in 2005, the catch was dominated by female snailfish. In the 30—40 cm group, there was no difference in all survey years. In the 40—50 cm group, males dominated the catch in 2005 whereas the ratio was equal in all other years. Finally, the catch of gt;50 cm fish consisted exclusively of males in all survey years. In 1985, 2000—2001, 2005 and 2010, the proportion of sexually mature fish (at stage IV or beyond stage IV)were 51.1, 53.8, 41.8 and 23.9%, respectively, while for those at stage III the proportions were 6.7, 38.5, 48.7 and 71.8%, respectively. Changes in biological characteristics may be the result of overfishing. In addition, a shrift in feeding habits may also have played an important role as the dominant prey categories of snailfish have changed significantly. In summary, the lack of interspecific competition, rapid growth and varied diet likely explain the variation in abundance of snailfish in the Yellow Sea ecosystem.
Liparistanakae; biological characteristics; distribution; the Yellow Sea
國家國際科技合作專項項目(2013DFA31410); 氣候變化重大基礎研究項目(973- 2013CB956503); 公益性行業(農業)科研專項(200903005); 山東省泰山學者專項基金共同資助
2013- 04- 17;
2013- 07- 15
*通訊作者Corresponding author.E-mail: jin@ysfri.ac.cn
10.5846/stxb201304170731
陳云龍,單秀娟,周志鵬,戴芳群,李忠爐,金顯仕.黃海細紋獅子魚種群特征的年際變化.生態學報,2013,33(19):6227- 6235.
Chen Y L, Shan X J, Zhou Z P, Dai F Q, Li Z L, Jin X S.Interannual variation in the population dynamics of snailfishLiparistanakaein the Yellow Sea.Acta Ecologica Sinica,2013,33(19):6227- 6235.

