興安落葉松針葉解剖結構變化及其光合能力對氣候變化的適應性
季子敬,全先奎,王傳寬
(東北林業大學生態研究中心,哈爾濱 150040)
興安落葉松針葉解剖結構變化及其光合能力對氣候變化的適應性
季子敬,全先奎,王傳寬*
(東北林業大學生態研究中心,哈爾濱 150040)
葉片易受環境因子影響,其形態解剖結構特征不但與葉片的生理功能密切相關,而且反映樹木對環境變化的響應和適應。葉片結構的改變勢必會改變樹木的生理功能。同一樹種長期生長在異質環境條件下,經過自然選擇和適應,會在形態和生理特性等方面產生變異,形成特定的地理種群。另外,母體所經受的環境脅迫也會影響到其子代的生長、發育和生理等特征。因此,了解植物葉片形態結構對環境變化的響應與適應是探索植物對環境變化的響應和適應機制的基礎。興安落葉松(LarixgmeliniiRupr.)是我國北方森林的優勢樹種,主要分布在我國東北地區。為了區分葉片對氣候變化的可塑性和適應性,采用同質園法比較測定了6個不同氣候條件下的興安落葉松種源的32年生樹木的針葉解剖結構和光合生理相關因子,分析了針葉的解剖結構特征、光合能力(Pmax-a)、水分利用效率(WUE)之間的關系及其對氣候變化的適應性。結果表明:表皮細胞厚度、葉肉細胞厚度、傳輸組織厚度、維管束厚度、內皮層厚度以及葉片總厚度均存在顯著的種源間差異(Plt;0.05)。葉肉細胞厚度與Pmax-a、氣孔導度和WUE之間均存在顯著的正相關關系(Plt;0.05)。葉肉細胞厚度、表皮細胞厚度、葉片總厚度以及葉肉細胞厚度和表皮細胞厚度在葉片總厚度中所占比例均與種源地的干燥度指數(即年蒸發量與年降水量之比)呈正線性關系。這些結果說明:不同種源興安落葉松針葉解剖結構因對種源原地氣候條件的長期適應而產生顯著的差異,從而引起其針葉光合作用、水分利用等生理功能發生相應的變化,從而有利于該樹種在氣候變化的情景下得以生存和繁衍。
氣候變化;種源;葉片解剖;光合特性;水分利用效率
葉片在植物進化過程中作為可塑性較大并容易受環境因子影響的器官[1],其結構特征最能體現環境因子的影響或植物對環境的適應。葉片結構的改變勢必會改變樹木的生理功能[2]。例如,韓梅等[3]研究葉片解剖特征沿溫度梯度變化時發現,不同功能型植物葉片各組織厚度對CO2濃度和溫度升高的響應存在明顯的種類差異。光照強度的差異會導致植物葉片的解剖結構發生變化,從而影響植物的生長發育;另外,干旱頻發、水分短缺等也會嚴重影響植物的生長發育,使葉片的表皮細胞變薄,氣孔數量和開度發生變化,以便適應干旱的環境條件[2]。因此,了解植物葉片形態結構對環境變化的響應與適應是探索植物對環境變化的響應適應機制的基礎。
同一樹種長期生長在異質環境條件下,經過自然選擇和適應,會在形態和生理特性等方面產生變異,形成特定的地理種群[4]。葉片解剖結構特征受樹木生理狀況和環境因子的共同限制,并隨著環境條件的變化而呈現一定的變化規律。以往的研究表明,來源于不同自然環境的種群在葉片大小、形狀等方面存在一定差異[5]。在同質園內,來自于高緯度/海拔種源樹木具有較高的比葉重(Leaf Mass per Area, LMA),這可能是一種基因調控下的對種源原地環境適應的表現[6- 10];而LMA的種源差異往往是由葉片結構的改變而引起的,至于有哪些結構特征參數發生何種變化仍不清楚[6,8]。另外,母體所經受的環境脅迫也會影響到其子代的生長、發育和生理等特征[11],但這種母體效應的影響程度和機理還有待深入研究。這些問題的回答,對于認識樹種葉片解剖結構對氣候變化的響應和適應特征具有重要意義。
葉片的解剖結構與植物的光合能力密切相關。通常,葉片厚度的增加會使其光合速率升高[12]。以往對于闊葉植物的研究表明:葉肉細胞增厚,柵欄組織加厚,細胞層次增多,可使葉片光合能力增強[13- 14]。但對于針葉樹葉片結構與光合的關系報道甚少。馬立祥[15]等認為不同地理種群的兩針松(即Pinusdensiflora、Pinussylvestrisvar.sylvestriformisandPinussylvestrisvar.mongolica)的光合能力存在差異,但對于處在不同地理條件下的同一種群針葉的解剖特性是否存在差異、以及這種差異是植物對環境變化的馴化還是遺傳調控下的適應等問題還不太清楚。
興安落葉松(LarixgmeliniiRupr.)是我國北方森林的優勢樹種,主要分布在我國東北地區,但日益加劇的氣候變化可能會改變其現有的分布區。例如,據張新時[16]預測,如果氣溫增加2—4 ℃、年降水量增加20%的條件下,興安落葉松可能北移,取而代之的是溫帶草原和針闊混交林。然而,類似的模型預測尚未考慮樹木的形態、解剖結構、生理功能等對氣候變化的潛在響應和適應機制。為此,本研究采用同質園法比較測定了6個不同氣候條件下的興安落葉松種源的32年生樹木的葉片解剖結構和光合生理相關因子,旨在比較分析不同種源針葉解剖結構變化與其光合生理特征的關系,為預測氣候變化對北方森林生態系統的影響提供理論基礎。
1 研究材料與方法
1.1 實驗地自然概況
本實驗所用的同質種植園位于東北林業大學帽兒山森林生態站(127 ° 30′—34 ′E, 45 ° 20 ′—25 ′N)。在興安落葉松國內的分布范圍內,在以表征能量差異為主的緯度梯度上選取代表性種源6個(表1),于1980年秋采種,1981年育苗,1983年春造林,1997年和2001年間伐兩次,株行距現為4.5 m × 2.5 m。同質園內土壤、地形、氣候條件一致,平均海拔300 m,平均坡度10—15 °,土壤為暗棕壤,年平均降雨量629 mm,年均蒸發量864 mm,年平均溫度3.1 ℃,1月和7月份平均溫分別為-18.5 ℃和22 ℃,無霜期120—140 d(5—9月份)[17]。

表1 興安落葉松種源原地地理氣象條件及生長現狀
表中的a、b、c表示HSD檢驗顯著性差異組別(α=0.05); MAT:mean annual air temperature, MAP:mean annual precipitation, MAE:mean annual evaporation, DBH:diameter at breast height, and LMA:leaf mass area
1.2 光合能力及相關因子的測定
在同質園內,每個種源選取3株標準木,搭建觸及冠層(14 m左右)的腳手架,以便活體測量針葉的光合作用及其相關因子。每株標準木選取冠層上部向陽方的當年生枝新生葉3簇,于2011年8月中旬,選擇無雨天氣于6:30—12:00時段,采用Li- 6400便攜式CO2/H2O紅外分析儀(Li-Cor, NB, USA)活體測定針葉氣體交換過程以及相應的環境因子。測定時采用的葉室環境控制為:溫度25 ℃,流速500 μmol/s,CO2濃度400 μmol CO2/mol。測定前采用飽和光強對葉片進行充分光誘導。在測定光響應曲線時,光量子通量密度梯度為: 2000、1500、1200、800、400、200、150、100、50、0 μmol 光子量·m-2·s-1;測定輸出參數包括凈光合速率(Pn)、蒸騰速率(Tr)、氣孔導度(gs)等。用于光合測定的針葉面積采用掃描圖像處理獲得[18];隨后將葉片在65 ℃下烘至恒重稱重(精度0.0001),獲取其比葉重(LMA,g/m2):
LMA=葉片干重/葉面積
(1)
1.3 葉片解剖方法
在同質園內各種源每株標準木上選取與測定光合能力葉片位置相近、發育程度一致的健康針葉各10簇,用FAA固定液(酒精∶福爾馬林∶冰醋酸=90∶5∶5)固定。樣品經系列酒精脫水后,二甲苯透明、浸蠟、包埋,然后用旋轉式薄片切片機(Rotary Microtome, Leitz, Germany)制片。在每個針葉中部取10個橫向切片,切片厚度為8—10 μm。切片脫蠟后,用番紅-固綠對染,即用1%的番紅水溶液染色12 h, 再用0.5%固綠染色,然后用阿拉伯樹膠封片,用ZEISS Imager A1型光學攝影顯微鏡觀察攝影;之后用Axio Vision Release 4.5 SP1測量葉片橫切面照片的葉片厚度(LD)、上表皮細胞厚度(LUPD)、下表皮細胞厚度(LBPD)、近軸面葉肉細胞厚度(LUCD)、遠軸面葉肉細胞厚度(LBCD)、維管束厚度(LVD)、內皮層厚度(LED)和傳輸組織厚度( LTD);每個測量指標重復測量3次。表皮細胞厚度(LPD)和葉肉細胞厚度(LCD)分別由下式獲得:
LPD=LUPD + LBPD
(2)
LCD=LUCD + LBCD
(3)
1.4 數據分析
光合作用的光響應曲線采用Prado等[19]的非線性擬合方程:
Pn=Pmax-a(1-e-k(PAR-P))
(4)
式中,Pmax-a為單位葉面積最大凈光合速率(μmol CO2·m-2·s-1),k是常數,Pn是實際測定的凈光合速率,PAR是光合有效輻射,P是光補償點。
葉片尺度的水分利用效率(WUE, μmol CO2/mmol H2O )由下式[20]獲得:
WUE=Pn/Tr
(5)
式中,Tr為蒸騰速率。
干燥度指數(AI)由下式[21]獲得:
AI=MAE/MAP
(6)
式中,MAE為平均年蒸發量;MAP為平均年降水量。
數據分析和差異性檢驗采用SPSS 19.0(SPSS Inc., Chicago 2001)統計軟件分析;所有圖采用Sigma Plot 9.0(Systat corporation, USA)繪制。
2 結果
2.1 葉片解剖結構的種源差異
興安落葉松葉片厚度(LD)及各解剖結構特征厚度均存在顯著種源差異(圖1,Plt;0.05)。LD的大小順序為:中央站((392.8±9.8) μm,平均值±標準誤)gt; 根河(383.0±7.5) μmgt; 鶴北(375.3±8.5) μmgt; 三站(373.7±3.7) μmgt; 塔河(362.5±5.3) μmgt; 烏伊嶺(354.3±6.8) μm;來自寒冷干燥地區的種源具有較高的LD。比較葉片各解剖結構特征參數的大小時發現,來自中央站種源的葉片均具有較高的厚度,而來自低緯度烏伊嶺種源葉片則均具有較小的厚度,其它種源因解剖結構特征參數而具有不同的種源差異。

圖1 六個種源興安落葉松的葉片結構特征參數Fig.1 Parameters of leaf anatomy of the six provenancesLD:葉片厚度Leaf thickness,LUPD:上表皮細胞厚度Leaf adaxial epidermis cells thickness,LBPD:下表皮細胞厚度Leaf abaxial epidermis cells thickness,LUCD:近軸面葉肉細胞厚度Leaf adaxial mesophyll cells thickness,LBCD:遠軸面細胞厚度Leaf abaxial mesophyll cells thickness,LED:內皮層厚度Leaf endoderm cells thickness,LTD:傳輸組織厚度Leaf transporting tissue thickness,LVD:維管束厚度Leaf vascular bundle tissue thickness
葉片各解剖結構特征厚度在葉片總厚度中所占的比例差異明顯(圖2),其中葉肉細胞厚度(LCD)所占比例最大,其平均值波動在(38.4%—43.3%)之間;而表皮細胞厚度(LPD)所占比例為最小,其平均值波動范圍為(5.1%—6.1%);維管束厚度(LVD)波動在(16.15%—19.0%)之間;傳輸組織厚度(LTD)波動范圍為(12.95%—18.2%);而內皮層厚度(LED)則在(11.5%—15.3%)之間波動。

圖2 葉片各解剖結構特征參數占葉片總厚度的比例 Fig.2 The proportion of the parameters of leaf anatomy to the total leaf thickness
2.2 葉片解剖結構與生理功能之間的關系
LD、LCD和LTD均與最大凈光合速率(Pmax-a)、氣孔導度(gs)及水分利用效率(WUE)之間存在顯著的正相關關系(圖3;Plt;0.05;LTD與gs除外)。總體而言,中央站和根河種源葉片具有較高的Pmax-a、WUE和gs,而烏伊嶺和塔河種源的各測定生理特征參數值較低。且種源間LCD與各測定生理特征間相關性要高于LD和LTD。種源間Pmax-a、gs及WUE波動范圍分別為(9.60±0.86)—(16.61±0.91) μmol CO2·m-2·s-1,(0.20±0.002)—(0.30±0.009) mmol CO2·m-2·s-1和(2.06±0.08)—(3.83±0.05) μmol CO2·mmol-1H2O。
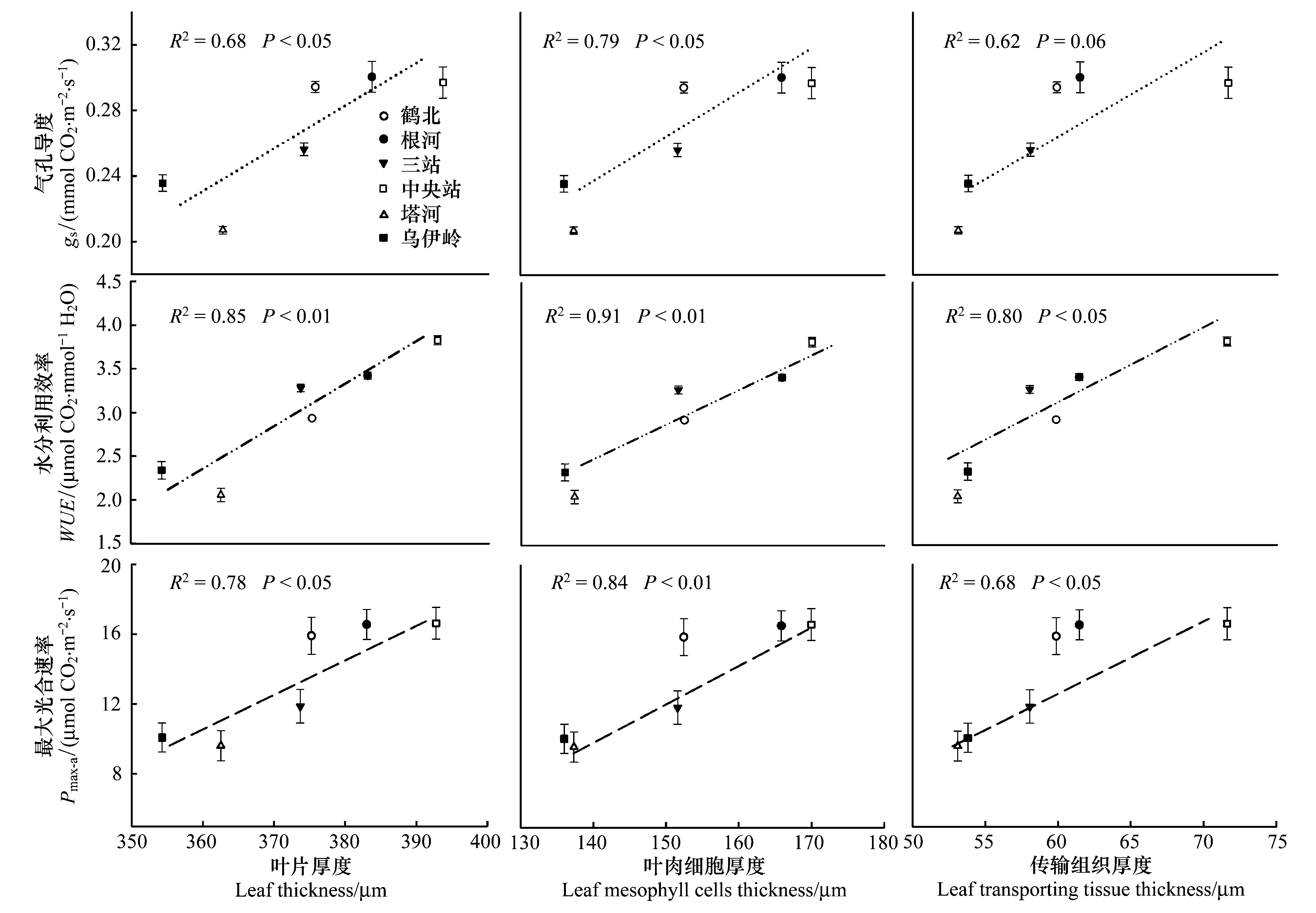
圖3 葉片解剖結構特征參數和最大凈光合速率(Pmax-a)、水分利用效率(WUE)、氣孔導度(gs)之間的關系(n=6)Fig.3 Relationships between parameters of leaf anatomy and Pmax-a、WUE and gs(n=6)
2.3 葉片解剖結構與種源地干燥度指數之間的關系
LD、LCD和LPD均與種源原地干燥度指數(AI)之間呈線性相關,其中AI和LCD之間的相關性最緊密(表1,圖4)。隨著種源原地的干燥程度增加,LD、LCD和LPD均明顯增大,且LCD和LPD在LD中所占比例也隨AI的增加而顯著增大(圖4)。
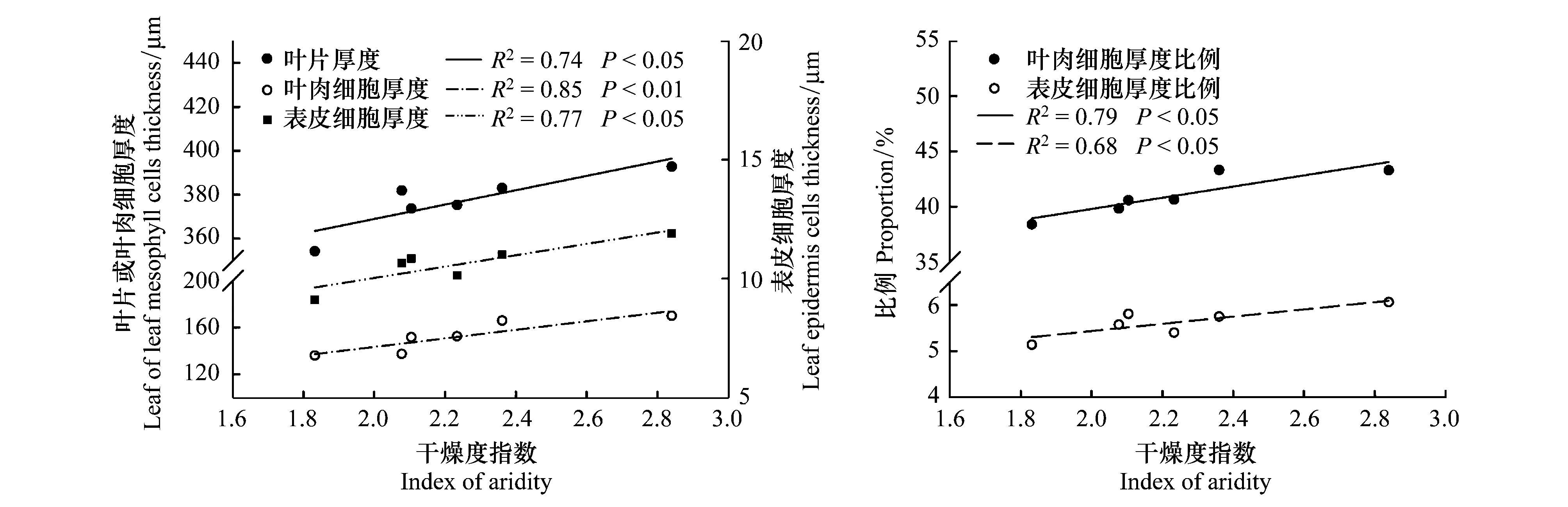
圖4 葉片解剖結構特征參數與種源原地干燥度指數之間的關系(n=6)Fig.4 Relationships between parameters of leaf anatomy and the aridity index at the original sites (n=6)
3 討論
6個種源興安落葉松針葉的解剖結構特征參數差異顯著(圖1),因而導致了針葉總厚度(LD)和LMA的種源間差異(圖1,表1)。在各解剖結構特征參數中,葉肉細胞最為突出,其厚度約占LD的40%左右,且與LD呈現相似的種源間差異。因為6種源興安落葉松已經在環境條件一致的同質園內生長了32a,所以可以認為這種解剖結構上的變化是樹木對種源原地氣候條件長期適應的結果。進一步通過與原地氣候因子進行回歸分析發現,LD、LCD、LPD以及LCD和LPD占LD的比例均與種源原地的干燥度指數(AI)呈線性關系(圖4)。雖然其它解剖特征參數與AI相關沒有達到顯著性水平,但總體趨勢不變,即來自寒冷干燥的種源具有較厚的葉片以及較大的各解剖結構特征參數。楊傳平等[4]對該6個種源興安落葉松的前期研究也發現,其材積、樹高、胸徑等等形態指標也存在顯著的種源間差異。
葉片的形態、解剖結構和生長發育是受遺傳和環境條件(如:地理位置、生境條件和氣候特性等)共同調控的[22- 23],其形態和結構特征的改變能夠反映樹木對環境變化的響應和適應。Glloway[11]對風鈴草(Campanulaamericana)的研究顯示,母體對后代如何適應當地環境條件有暗示作用,即生長在與母體相同環境下的后代植株比其他環境下的后代表現更為出色。劉全宏[24]對太白冷杉(Larixchinensis)的研究報道,隨著年降水量的增加,葉片厚度、傳輸組織、維管束厚度和內皮層厚度呈減小或變薄的趨勢。在干燥條件下,葉片往往通過增加葉片厚度尤其是表皮厚度防止水分的過度蒸發,進而保證植物的正常代謝。Huner[25]等的研究表明,寒冷地區葉片具有較厚的表皮細胞,這正是植物御寒的一種表現。
結構是功能的基礎,葉片結構特征的變化將會影響樹木的光合、呼吸、蒸騰等生理功能。研究結果顯示,Pmax-a和WUE均與LD、LCD和LTD呈顯著的正線性關系(圖3),與Oguchi等[26]的研究結果一致。也有研究報道,來自寒冷高緯度的種源具有較強的光合能力,且與葉片的LMA顯著相關[6- 8,27]。葉片及其葉肉組織增厚,葉綠體含量也相應地升高(數據未顯示),為光合作用提供了更多的場所,進而提高了光合能力;同時,也提高了植物的水分利用效率[28](圖3),從而增強了樹木抵御干旱等環境脅迫的能力。
總之,興安落葉松長期適應當地的環境條件,使得其針葉的形態特征、解剖結構特征和生理功能上產生具有遺傳能力的變異,是其在嚴酷的北方森林生境內得以生存繁衍的生態對策之一。
4 結論
本研究利用同質園實驗有效地區分了興安落葉松針葉解剖結構和光合生理對氣候變化響應的可塑性和適應性。針葉的解剖結構特征參數存在顯著的種源間差異,而且葉肉細胞厚度與針葉的光合能力和水分利用效率之間均存在顯著的正相關關系。葉肉細胞厚度、表皮細胞厚度、葉片總厚度以及葉肉細胞厚度和表皮細胞厚度在葉片總厚度中所占比例均與種源原地的干燥度指數呈正線性關系。這表明興安落葉松長期適應當地的環境條件,在針葉的形態特征、解剖結構特征和生理功能上產生具有遺傳能力的變異,從而有利于該樹種在氣候變化的情景下得以生存和繁衍。
致謝: 感謝黑龍江帽兒山森林生態系統國家野外科學觀測研究站和林木遺傳育種國家重點實驗室(東北林業大學)提供的野外基礎支持。
[1] Wang X L, Wang J. Plant Morphology and Environment. Lanzhou: Lanzhou Publication, 1989, 105- 138.
[2] Li F L, Bao W K. Responses of the morphological and anatomical structure of the plant leaf to environmental change. Chinese Bulletin of Botany, 2005, 22(Supplement): 118- 127.
[3] Han M, Ji C J, Zuo W Y, He J S. Interactive effects of elevated CO2and temperature on the leaf anatomical characteristics of eleven species. Acta Ecologica Sinica, 2006, 26(2): 326- 333.
[4] Yang C P, Jiang J, Tang S S, Li J Y, Wang H R. The provenance test of 21-year oldLarixgmeliniiat Maoershan area. Journal of Northeast Forestry University, 2002, 30(6): 1- 5.
[5] Saxe H, Cannell M G R, Johnsen ?, Ryan M G, Vourlitis G. Tree and forest functioning in response to global warming. New Phytologist, 2001, 149(3): 369- 400.
[6] Cordell S, Goldstein G, Mueller-Dombois D, Webb D, Vitousek P M. Physiological and morphological variation inMetrosiderospolymorpha, a dominant Hawaiian tree species, along an altitudinal gradient: the role of phenotypic plasticity. Oecologia, 1998, 113(2): 188- 196.
[7] Bresson C C, Vitasse Y, Kremer A, Delzon S. To what extent is altitudinal variation of functional traits driven by genetic adaptation in European oak and beech? Tree Physiology, 2011, 31(11): 1164- 1174.
[8] Oleksyn J, Modrzynski J, Tjoelker M G, Reich P B, Karolewski P. Growth and physiology ofPiceaabiespopulations from elevational transects: common garden evidence for altitudinal ecotypes and cold adaptation. Functional Ecology, 1998, 12(4): 573- 590.
[9] Oleksyn J, Tjoelker M G, Reich P B. Adaptation to changing environment in Scots pine populations across a latitudinal gradient. Silva Fennica, 1998, 32(2): 129- 140.
[10] Robson T M, Sánchez-Gómez D, Cano F J, Aranda I. Variation in functional leaf traits among beech provenances during a Spanish summer reflects the differences in their origin. Tree Genetics amp; Genomes, 2012, 8(5): 1111- 1121.
[11] Galloway L F. Parental environmental effects on life history in the herbaceous plantCampanulaamericana. Ecology, 2001, 82(10): 2781- 2789.
[12] Oguchi R, Hikosaka K, Hirose T. Leaf anatomy as a constraint for photosynthetic acclimation: differential responses in leaf anatomy to increasing growth irradiance among three deciduous trees. Plant, Cell and Environment, 2005, 28(7): 916- 927.
[13] Hanba Y T H. Kogami H, Terashima I. The effect of growth irradiance on leaf anatomy and photosynthesis inAcerspecies differing in light demand. Plant, Cell and Environment, 2002, 25(8): 1021- 1030.
[14] Wang X L. The development of plant ecological anatomy. Chinese Bulletin of Botany, 1993, 10, 1- 10.
[15] Ma L X, Wang X W, Mao Z J, Liu L X, Sun T. Variations in photosynthetic capacity and growth characters for 2-needled pine from diverse geographic populations. Bulletin of Botanical Research, 2010, 30(6): 680- 684.
[16] Zhang X S. A vegetation-climate classification system for global change studies in China. Quaternary Sciences, 1993, (2): 157- 169.
[17] Sang Y R, Wang C K, Huo H. Inter-specific and seasonal variations in photosynthetic capacity and water use efficiency of five temperate tree species in northeastern China. Scandinavian Journal of Forest Research, 2011, 26(1): 21- 29.
[18] Xiao Q, Ye W J, Zhu Z, Chen Y, Zheng H L. A simple non-destructive method to measure leaf area using digital camera and Photoshop software. Chinese Journal of Ecology, 2005, 24(6): 711- 714.
[19] Prado C H B A, De Moraes J A P V. Photosynthetic capacity and specific leaf mass in twenty woody species of Cerrado vegetation under field conditions. Photosynthetica, 1997, 33(1): 103- 112.
[20] Wang J L, Yu G R, Fang Q X, Jiang D F, Qi H, Wang Q F. Responses of water use efficiency of nine plant species to light and CO2and it′s modeling. Acta Ecologica Sinica, 2008, 28(2): 525- 533.
[21] Meng M, Ni J, Zhang Z G. Aridity index and its applications in geo-ecological study. Acta Phytoecologica Sinica, 2004, 28(6): 853- 861.
[22] Xu D C, Lü F D, Li B, Jiang Y. Comparison of chlorophyll fluorescence characteristics and leaf characters of pecan in different site conditions. Nonwood Forest Research, 2005, 23(4): 17- 20.
[23] Peng S B, Kriegdr D R, Girma F S. Leaf photosynthetic rate is correlated with biomass and grain production in grain sorghum lines. Photosynthesis Research, 1991, 28(1): 1- 7.
[24] Liu Q H, Wang X A, Tian X H, Xiao Y P. Morphological and anatomical characteristics of leaf ofLarixchinensisand their relationship to environmental factors in Taibaishan Mountain. Acta Botanica Boreali-Occidentalia Sinica, 2001, 21(5): 885- 893.
[25] Huner N P A, Palta J P, Li P H, Carter J V. Anatomical changes in leaves of Puma Rye in response to growth at cold-hardening temperatures. Botanical Gazette, 1981, 142(1): 55- 62.
[26] Oguchi R, Hikosaka K, Hirose T. Does the photosynthetic light-acclimation need change in leaf anatomy? Plant, Cell and Environment, 2003, 26(4): 505- 512.
[27] Scheepens J, Frei E S, St?cklin J. Genotypic and environmental variation in specific leaf area in a widespread Alpine plant after transplantation to different altitudes. Oecologia, 2010, 164(1): 141- 150.
[28] Masle J, Farquhar G D. Effects of soil strength on the relation of water-use efficiency and growth to carbon isotope discrimination in wheat seedlings. Plant Physiology, 1988, 86(1): 32- 38.
參考文獻:
[1] 王勛陵, 王靜. 植物形態結構與環境. 蘭州: 蘭州大學出版社, 1989: 105- 138.
[2] 李芳蘭, 包維楷. 植物葉片形態解剖結構對環境變化的響應與適應. 植物學通報, 2005, 22(增刊): 118- 127.
[3] 韓梅, 吉成均, 左聞韻, 賀金生. CO2濃度和溫度升高對11種植物葉片解剖特征的影響. 生態學報, 2006, 26(2): 326- 333.
[4] 楊傳平, 姜靜, 唐盛松, 李景云, 王會仁. 帽兒山地區21年生興安落葉松種源試驗. 東北林業大學學報, 2002, 30(6): 1- 5.
[14] 王勛陵. 植物生態解剖學研究進展. 植物學通報, 1993, 10: 1- 10.
[15] 馬立祥, 王秀偉, 毛子軍, 劉林馨, 孫濤. 不同地理種群兩針松光合和生長特性的差異. 植物研究, 2010, 30(6): 680- 684.
[16] 張新時. 研究全球變化的植被——氣候分類系統. 第四紀研究, 1993, (2): 157- 169.
[18] 肖強, 葉文景, 朱珠, 陳瑤, 鄭海雷. 利用數碼相機和Photoshop軟件非破壞性測定葉面積的簡便方法. 生態學雜志, 2005, 24(6): 711- 714.
[20] 王建林, 于貴瑞, 房全孝, 姜德鋒, 齊華, 王秋鳳. 不同植物葉片水分利用效率對光和CO2的響應與模擬. 生態學報, 2008, 28(2): 525- 533.
[21] 孟猛, 倪健, 張治國. 地理生態學的干燥度指數及其應用評述. 植物生態學報, 2004, 28(6): 853- 861.
[22] 徐德聰, 呂芳德, 栗彬, 蔣瑤. 不同立地美國山核桃葉綠素熒光特性及葉性狀比較. 經濟林研究, 2005, 23(4): 17- 20.
[24] 劉全宏, 王孝安, 田先華, 肖婭萍. 太白紅杉(Larixchinensis)葉的形態解剖學特征與環境因子的關系. 西北植物學報, 2001, 21(5): 885- 893.
VariationsinleafanatomyofLarixgmeliniireflectadaptationofitsphotosyntheticcapacitytoclimatechanges
JI Zijing, QUAN Xiankui, WANG Chuankuan*
CenterforEcologicalResearch,NortheastForestryUniversity,Harbin150040,China
Leaf anatomy, being susceptible to environmental factors, is closely related to physiological functions of the leaf, and also reflects responses and adaptation of the tree to environmental changes. Changes in leaf anatomical structure are bound to change the physiological functions of trees. The same species growing in heterogeneous environment for a long time through natural selection and adaptation will result in variations in morphological and physiological characteristics, forming distinctive geographic populations. In addition, Matrix subjected to environmental stress will affect its offspring growth, developmental and physiological characteristics. Therefore, to understand how the morphological structure of leaves respond and adapt to environmental changes is essential for exploring the response and adaptation mechanism of plants to environmental changes. Dahurian larch (LarixgmeliniiRupr.) is a dominant tree species in boreal forest in China, mainly distributed in northeast China, but going further climate changes may change its existing distribution. There are few studies to distinguish short-term responses of leaf anatomy and physiology from their potential long-term adaptation to climate changes in field. In this study, we conducted a common garden experiment that included six provenances of Dahurian larch with different climate and site conditions with three replicate trees each provenance. The trees were 32 years old, seeded in 1980, and transplanted in 1983 at identical site and climate conditions. We measured leaf anatomical parameters using paraffin section method (i.e., total leaf thickness, leaf adaxial epidermis cells thickness, leaf abaxial epidermis cells thickness, leaf adaxial mesophyll cells thickness, leaf abaxial mesophyll cells thickness, leaf vascular bundle tissue thickness, leaf endoderm cells thickness, leaf transporting tissue thickness, leaf epidermis cells thickness, leaf mesophyll cells thickness, and photosynthetic physiology (i.e., photosynthetic capacity [Pmax-a], stomatal conductance [gs], water use efficiency [WUE]) in order to address the question of whether leaf anatomical structure adapts to climate changes and consequently results in physiological adaptation. The results showed that the thickness of epidermis cells, mesophyll cells, transmission tissue cells, vascular cells and endothelial cells, and the total thickness of the needles differed significantly among the provenances (Plt;0.05). There was a significant difference in the proportion of thickness of each anatomical part. The thickness of mesophyll cell accounted for the largest proportion, with an average proportion ranging from 38.4% to 43.3%. The thickness of mesophyll cells was positively correlated (Plt;0.05) withPmax-a,gs, andWUE. The thickness of mesophyll cells and epidermal cells, the total thickness of the needles, and the proportions of thickness of mesophyll cells or epidermal cells in the total thickness of the needle were all positively correlated with the aridity index (the ratio of mean annual evaporation to mean annual precipitation) at the origins of the provenances. These results suggest that needles of the Dahurian larch trees from different provenances alter their anatomical structures significantly due to adaptation to local climate conditions, and accordingly change their physiological functions such as photosynthesis and water use efficiency.
climate change; provenance; leaf anatomy; photosynthetic characteristics; water use efficiency
國家“十二五”科技支撐項目(2011BAD37B01);教育部長江學者和創新團隊發展計劃(IRT1054);國家林業局重點項目(2006—77);中央高校基本科研業務費專項資金資助項目(DL10BA19)
2013- 01- 15;
2013- 07- 22
*通訊作者Corresponding author.E-mail: wangck-cf@nefu.edu.cn
10.5846/stxb201301150103
季子敬,全先奎,王傳寬.興安落葉松針葉解剖結構變化及其光合能力對氣候變化的適應性.生態學報,2013,33(21):6967- 6974.
Ji Z J, Quan X K, Wang C K.Variations in leaf anatomy ofLarixgmeliniireflect adaptation of its photosynthetic capacity to climate changes.Acta Ecologica Sinica,2013,33(21):6967- 6974.

