茉莉酸對棉花單寧含量和抗蟲相關酶活性的誘導效應
楊世勇,王蒙蒙,謝建春
(1.安徽師范大學生命科學學院,蕪湖 241000;2.安徽師范大學生物環境與生態安全省級重點實驗室,蕪湖 241000;3.安徽師范大學環境科學與工程學院,蕪湖 241000)
誘導抗性是植物界存在的普遍現象,能通過對昆蟲取食、產卵偏好、繁殖力、發育歷期、免疫力、解毒力、被捕食和被寄生比率以及生活史其它特征的影響,間接調控害蟲的種群密度和種群增長[1-7]。茉莉酸(jasmonic acid,JA)是一種具有多種生理功能的植物激素,除調節植物的基礎發育外,還在植物的傷反應、臭氧和紫外線暴露、病原菌侵染、昆蟲取食和水分脅迫反應中起信號傳遞的作用,誘導植物直接和間接防御反應的發生[8-9]。JA 及其功能類似物茉莉酸甲酯 (methyl jasmonate,MeJA)處理后,番茄[1]、甘藍[2,10]、擬南芥[3]、枸杞[5-6]、豌豆[11]、落葉松[12]、玉米[13-14]、水稻[15]、花生[16]等植物葉片或根部防御相關酶活性增強、防御性次生代謝物含量或揮發性有機物釋放量增加,對害蟲的抗性提高,但在棉花中相關研究并不多[7,17-18],對棉花抗蟲性誘導的生化機理、濃度依賴性和持久性尚未見報道。本研究以棉花幼苗為試材,以不同濃度茉莉酸為誘導子,從棉花幼苗多酚氧化酶 (Polyphenol oxidase,PPO)、過氧化物酶 (Peroxidase,POD)、過氧化氫酶(Catalase,CAT)和苯丙氨酸解氨酶(Phenylalanine ammonia-lyase,PAL)活性以及棉葉丹寧和胰蛋白酶抑制素(Proteinase inhibitors,PIs)含量的誘導入手,探討茉莉酸誘導棉花幼苗抗蟲性的濃度依賴性和持久性,為農業害蟲的防治和生物安全農藥的研發提供理論與實驗依據。
1 材料與方法
1.1 材料培養與茉莉酸處理
供試棉花(Gossypium hirsutum L.)種子皖棉28F1購自蕪湖市城南某種子公司,由安徽省農業科學研究院研制。將顆粒飽滿的種子于室內催芽,待種子露白后播于盛滿黃壤土∶草木灰∶砂子重量比1∶1∶1的塑料花盆(底面半徑r=9 cm;盆高H=15 cm)中于大棚內育苗。棚內光照約為自然光照的85%。育苗期間根據情況適時澆水,無施肥。待幼苗長出2片真葉后,間苗至每盆4株。幼苗長至5—6片真葉時(出苗后45d左右)用于實驗。實驗設4個處理(包括對照),每處理重復4次。
茉莉酸(≥95%,Sigma-Aldrich)用無水乙醇和蒸餾水稀釋成濃度為0.01、0.1和1.0 mmol/L的溶液。以無水乙醇 +蒸餾水為對照,用手持式噴霧器向棉株均勻噴施,直到葉面有液滴落下為止。為減少茉莉酸因蒸發損失,噴施后用透明塑料袋將整株套住,8h后移除塑料袋,并分別于噴施茉莉酸后1、7、14d采集棉花葉片進行生化分析。植物樣從每盆的4株植物上采取并混合。
1.2 測定方法
1.2.1 棉葉單寧含量的測定
棉葉單寧含量采用香草醛法進行測定[19]。取0.2 g棉葉剪碎后浸入25 mL甲醇中提取2 h,再取上清液和4% 的香草醛-甲醇溶液各2.0 mL,與1.0 mL鹽酸混合后于 30℃水浴中保溫20 min。室溫下用 PG-1810APC(普析通用,北京)分光光度計測定510 nm下的吸光度值。以不同濃度單寧酸為標樣繪制單寧濃度與吸光度的標準曲線并計算單寧含量。單寧含量用mg/g鮮重表示。
1.2.2 PIs含量的測定
PIs根據Stout等的方法進行測定[20]。準確稱取0.2 g棉花葉片,用4 mL含有7% 的PVP、1.67 mmol/L苯硫脲、0.3 mol/L KCl和0.4 mmol/L抗壞血酸的 Tris-HCl緩沖液 (50 mmol/L,pH值7.8)研磨成勻漿。再將勻漿在13000 r/min,4°C下離心10 min,上清液用于測定棉胰凝乳蛋白酶含量。測定時,先在含有0.0015 mg胰凝乳蛋白酶的HCl溶液(1.0 mmol/L)中加入等量提取液混合反應10 min,再取100 μL混合液與2.9 mL含有0.5 mmol/L BTEE(N-苯甲酰-L-酪氨酸乙酯)的甲醇-磷酸緩沖液 (pH值 8.0)混勻,于256 nm下測定10 min內吸光度的變化值。用BTEE和胰凝乳蛋白酶作對照。單位時間內吸光度值變化0.01代表生成一個單位PIs(單位U),PIs含量用U/g鮮重表示。
1.2.3 PAL、PPO、POD 和 CAT 活性的測定
酶液提取:于冰浴中將0.2 g棉花葉片用1.25 mL含有體積分數7%PVPP的磷酸緩沖液 (0.1 mol/L,pH值7.4)研磨成勻漿,再向勻漿中加入0.4 mL體積分數10%的Trition X-100,混勻后在10000 g,4℃ 下離心10 min。上清液直接用于PPO、POD、CAT和PAL活性測定。酶活性測定溫度為25℃。
PAL活性參照鄒志燕和王振中的方法進行測定[21]。在2.80 mL含有L-苯丙氨酸 (20 mmol/L)的硼酸緩沖液 (0.2 mol/L,pH值8.8)中加入20 μL酶提取液,混勻后于290 nm處測定2 min內吸光度值的變化。OD290每增加0.01個單位相當于生成了1 μg/mL肉桂酸,PAL活性用μg·g-1鮮重·min-1表示。
PPO活性以鄰苯二酚為底物,參照Tan等的方法進行測定[22]。在2.90 mL含有鄰苯二酚 (0.02 mol/L)的磷酸緩沖液 (0.2 mol/L,pH值7.4)中加入100 μL酶提取液,混勻后于420 nm處測定2 min內吸光度值的變化。以每分鐘吸光度值變化0.01表示1個酶活力單位,PPO活性用U·g-1鮮重·min-1表示。
POD活性以愈創木酚為底物,參照Kumari等的方法進行測定[23]。在2.99 mL含有0.2% 愈創木酚和0.3%H2O2的磷酸緩沖液 (0.05 mol/L,pH值7.4)中加入10 μL酶提取液,混勻后于470 nm處測定3 min內吸光度值的變化。以每分鐘吸光度值變化0.1表示1個酶活力單位,POD活性用U·g-1鮮重·min-1表示。
CAT活性參照Kumari等的方法進行測定[23]。在含有0.3%H2O2的磷酸緩沖液 (0.05 mol/L,pH值7.0)中加入20 μL酶提取液,混勻后于240 nm處測定2 min內吸光度值的變化。以每分鐘吸光度值變化0.1表示1個酶活力單位,CAT活性用U·g-1鮮重·min-1表示。
1.3 數據處理與分析
以酶活性和單寧含量為自變量,以茉莉酸濃度和時間為固定因子,采用單變量多因素方差分析對數據進行處理,并進行Tukey HSD多重比較(SPSS 15.0,P=0.05)。濃度和處理后時間對酶活性和單寧含量的影響用一維方差分析(One-way analysis of variance)進行檢驗,并進行Tukey HSD多重比較 (P=0.05)。
2 結果與分析
2.1 茉莉酸處理對棉花單寧含量的影響
由表1可知,茉莉酸濃度和處理后時間以及濃度和時間的交互作用對棉葉單寧含量影響極顯著(P<0.001)。不同濃度茉莉酸誘導效果的多重比較表明:0.1 mmol/L和1.0 mmol/L茉莉酸處理組棉葉單寧含量均明顯高于對照 (P <0.001);0.1 mmol/L茉莉酸的誘導效果明顯優于0.01 mmol/L(P <0.001),但和1.0 mmol/L 的差異不顯著 (P=0.057)。
處理后不同時間單寧含量的多重比較表明:處理后第14天棉葉單寧含量明顯高于第1天和第7天(P<0.001),但第1天和第7天棉葉單寧含量差異不明顯 (P=0.106)。

表1 茉莉酸及茉莉酸處理后時間對棉單寧含量影響的主效應檢驗Table 1 Main effects of JA treatment and time after JA treatment on tannin contents of cotton leaves
濃度與處理后天數對棉葉單寧含量影響的多重比較表明(圖1):茉莉酸處理后1天,各處理組棉葉單寧含量均明顯高于對照,但以0.1 mmol/L茉莉酸處理組單寧含量最高,且與0.01 mmol/L和1.0 mmol/L兩處理組存在組間 (P=0.002)差異。處理后7天,0.1 mmol/L茉莉酸處理組棉葉單寧含量仍明顯高于對照和0.01與 1.0 mmol/L處理組 (P 值分別為 < 0.001,0.002和0.001)。處理后 14d,1.0 mmol/L 茉莉酸處理組棉葉單寧含量明顯高于對照 (P=0.042);0.1和1.0 mmol/L處理組單寧含量明顯高于0.01 mmol/L處理組 (P=0.007 和 0.006)。
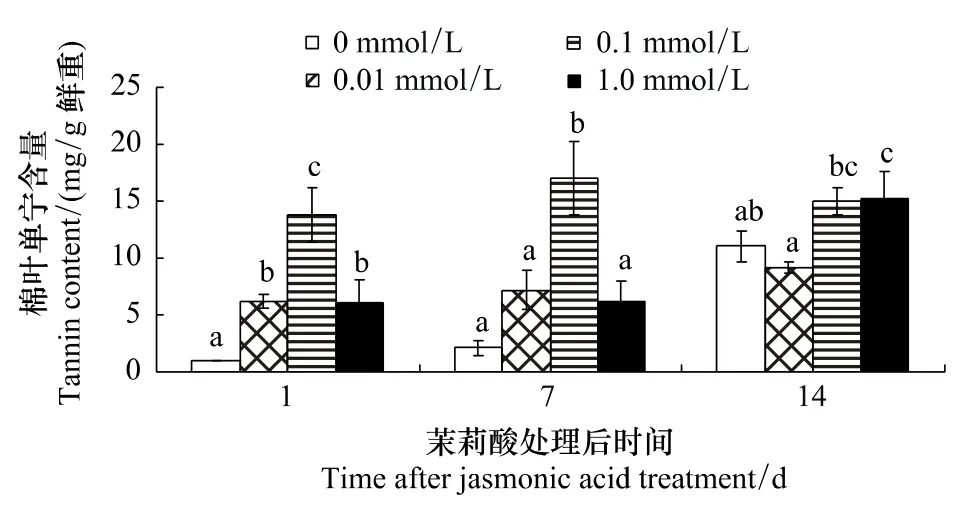
圖1 茉莉酸處理對棉葉單寧含量的影響Fig.1 Effects of JA treatment on tannin content in cotton leaves
2.2 茉莉酸處理對PIs含量的影響
由表2可知,JA濃度和處理后時間對棉葉PIs含量影響極顯著(P<0.001)。不同濃度茉莉酸誘導效果的多重比較表明:0.01 mmol/L和0.1 mmol/L茉莉酸處理組棉葉的 PIs含量明顯高于對照 (P=0.027和0.000),但 0.1 mmol/L 茉莉酸的誘導效果明顯高于 0.01 mmol/L 和 1.0 mmol/L(P=0.046 和 0.002);0.01 mmol/L和1.0 mmol/L茉莉酸的誘導效果差異不明顯 (P=0.6)。
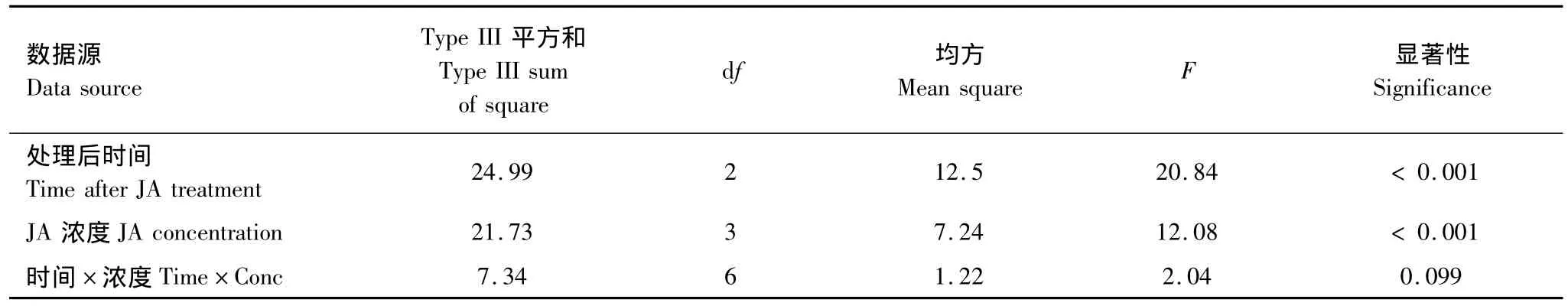
表2 茉莉酸及茉莉酸處理后時間對棉葉PIs含量影響的主效應檢驗Table 2 Main effects of JA treatment and time after JA treatment on PIs contents of cotton leaves
處理后不同時間PIs含量的多重比較表明:處理后第7天棉葉PIs含量明顯高于第1天(P=0.038)和第14天(P <0.001),但處理后第1天的PIs含量卻明顯高于第14天(P=0.002)。
濃度與處理后天數對棉葉PIs含量影響的多重比較表明 (圖2):處理后1d,0.1 mmol/L茉莉酸處理組棉葉PIs含量明顯高于對照 (P=0.049),但和其它兩處理組間的差異并不顯著。處理后第7天,0.01 mmol/L和0.1 mmol/L茉莉酸處理組棉葉內PIs明顯高于對照 (P=0.032和 0.035)。處理后第 14天,除 0.1 mmol/L茉莉酸處理組和對照組有顯著差異外 (P<0.03),其它各組間的差異不顯著。
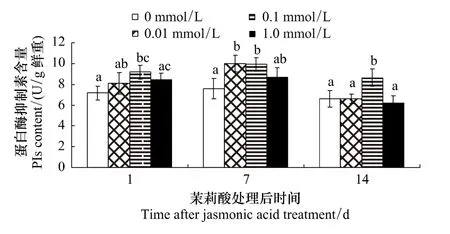
圖2 茉莉酸處理對棉葉PIs含量的影響Fig.2 Effects of JA treatment on PIs content in cotton leaves
2.3 茉莉酸處理對棉葉PPO活性的影響
由表3可知,JA濃度和處理后時間以及濃度和時間的交互作用對棉葉PPO活性的影響明顯。不同濃度茉莉酸誘導效果的多重比較表明:茉莉酸處理組棉葉PPO活性明顯高于對照 (P <0.004);0.1 mmol/L茉莉酸的誘導效果明顯高于 0.01 mmol/L和1.0 mmol/L(P=0.001),但0.01 mmol/L和1.0 mmol/L組無組間差異。
處理后不同時間PPO活性的多重比較表明:處理后第7天棉葉PPO活性明顯高于第14天 (P=0.012),但和第1天差異不明顯 (P=0.52)。
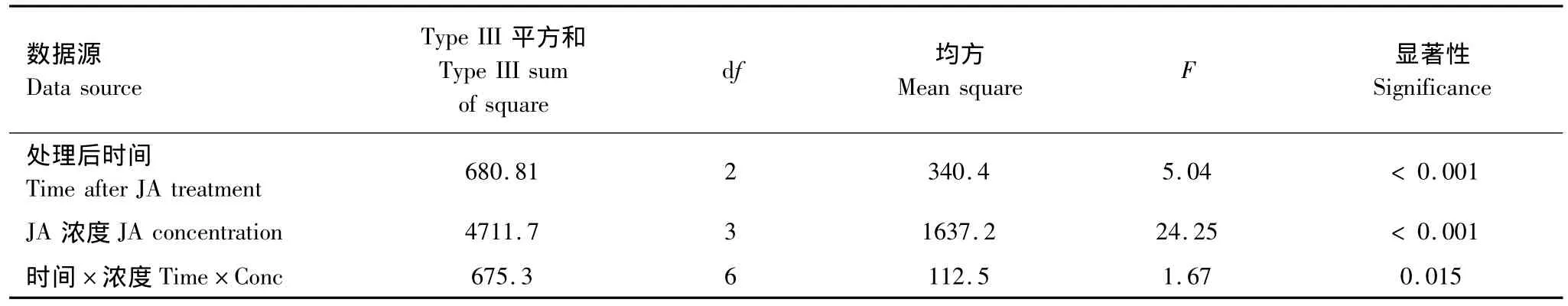
表3 茉莉酸及茉莉酸處理后時間對棉葉PPO活性影響的主效應檢驗Table 3 Main effects of JA treatment and time after JA treatment on PPOs activities of cotton leaves
濃度與處理后天數對棉葉PPO活性影響的多重比較表明(圖3):3種濃度茉莉酸處理均提高了棉葉的PPO活性,但各濃度的誘導效應不同 (P <0.05)。處理后1d和7d,0.1 mmol/L和 1.0 mmol/L 處理組棉葉PPO活性均明顯高于對照組 (處理后第1天,P=0.002 和 0.038;處理后第7天,P=0.006 和 0.04,但組間差異不明顯)。處理后14d,0.1 mmol/L組棉葉PPO活性明顯高于對照和1.0 mmol/L組 (P=0.006和0.009),其它各處理組間差異不明顯。
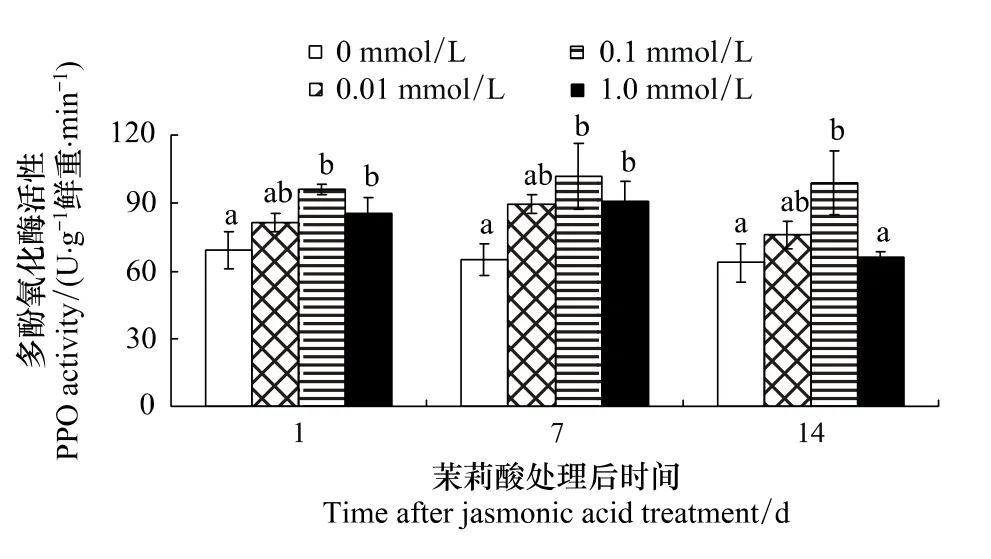
圖3 茉莉酸處理對棉葉PPO活性的影響Fig.3 Effects of JA treatment on PPO activity of cotton leaves
2.4 茉莉酸處理對棉葉PAL活性的影響
由表4可知,JA濃度和處理后時間對棉葉PAL活性的影響明顯(P <0.001)。不同濃度茉莉酸誘導效果的多重比較表明:0.1 mmol/L和1.0 mmol/L茉莉酸處理組棉葉的PAL活性明顯高于對照 (P <0.001),但0.01 mmol/L茉莉酸處理組較對照組差異不明顯(P=0.132);0.1 mmol/L茉莉酸處理組棉葉的 PAL活性明顯高于0.01 mmol/L組 (P <0.001),但較1.0 mmol/L JA處理組差異不顯著 (P=0.057)。
處理后不同時間PAL活性的多重比較表明:處理后第7天和第14天棉葉的PAL活性均明顯高于第1天 (P=0.000和0.006),但第7天和14天棉葉的PAL活性差異不明顯 (P=0.106)。
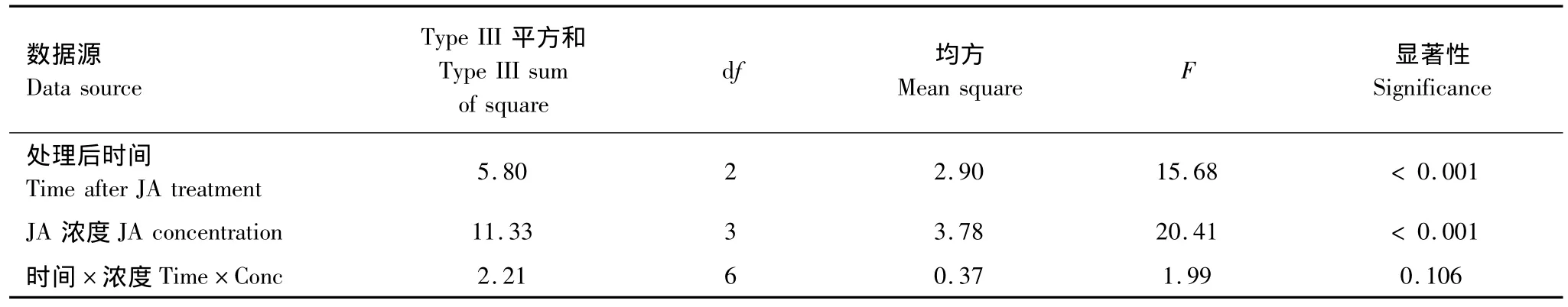
表4 茉莉酸及茉莉酸處理后時間對棉葉PAL活性影響的主效應檢驗Table 4 Main effects of JA treatment and time after JA treatment on PAL activities of cotton leaves
濃度與處理后天數對棉葉PAL活性影響的多重比較表明(圖4):處理后1d各組間PAL活性均無明顯差異。處理后7d,0.1和1.0 mmol/L組PAL活性均明顯高于對照 (P=0.003和0.007),但組間差異不明顯(P=0.86)。處理后 14d,0.1 mmol/L 組棉葉 PAL活性明顯高于對照組和0.01 mmol/L組 (P <0.05),但較1.0 mmol/L茉莉酸處理組差異不明顯。
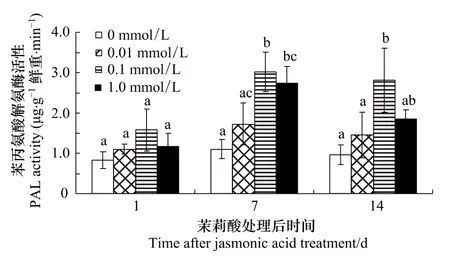
圖4 茉莉酸處理對棉葉PAL活性的影響Fig.4 Effects of JA treatment on PAL activities of cotton leaves
2.5 茉莉酸處理對棉葉POD活性的影響
由表5可知,JA濃度和處理后時間以及濃度和時間的交互作用對棉葉POD活性的影響極顯著 (P<0.001)。不同濃度茉莉酸誘導效果的多重比較表明:0.1 mmol/L和1.0 mmol/L茉莉酸處理組棉葉的POD活性均明顯高于對照(P <0.001);0.1 mmol/L茉莉酸的誘導效果明顯高于0.01 mmol/L和1.0 mmol/L(P <0.001),而1.0 mmol/L茉莉酸的誘導效果明顯優于 0.01 mmol/L(P=0.041)。
處理后不同時間POD活性的多重比較表明:處理后第7天和第14天棉葉的POD均明顯低于第1天(P=0.001和0.000),但第7天和14天棉葉的POD活性差異不明顯。
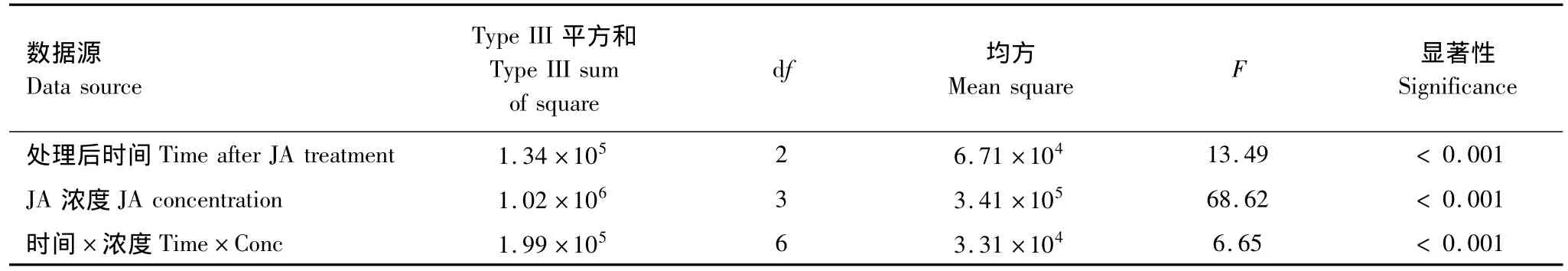
表5 茉莉酸及茉莉酸處理后時間對棉葉POD活性影響的主效應檢驗Table 5 Main effects of JA treatment and time after JA treatment on POD activities of cotton leaves
濃度與處理后天數對棉葉POD活性影響的多重比較表明 (圖5):處理后第1天,0.1 mmol/L和1.0 mmol/L組棉葉POD活性顯著高于對照 (P <0.001),且存在組間差異 (P <0.01)。處理后第7天和14天,0.1 mmol/L組棉葉POD活性均明顯高于其它各組 (P <0.01)。
2.6 茉莉酸處理對棉葉CAT活性的影響
由表6可知,JA濃度以及濃度和時間的交互作用對棉葉CAT活性的影響明顯(P <0.05)。不同濃度茉莉酸誘導效果的多重比較表明:0.1 mmol/L茉莉酸的誘導效果明顯高于1.0 mmol/L(P=0.005)。雖然0.1 mmol/L和0.01 mmol/L處理的組間差異不明顯,但0.1 mmol/L茉莉酸處理組的 CAT活性卻較0.01 mmol/L茉莉酸處理組高。處理后不同時間CAT活性的多重比較表明各處理組間CAT活性均無明顯差異。
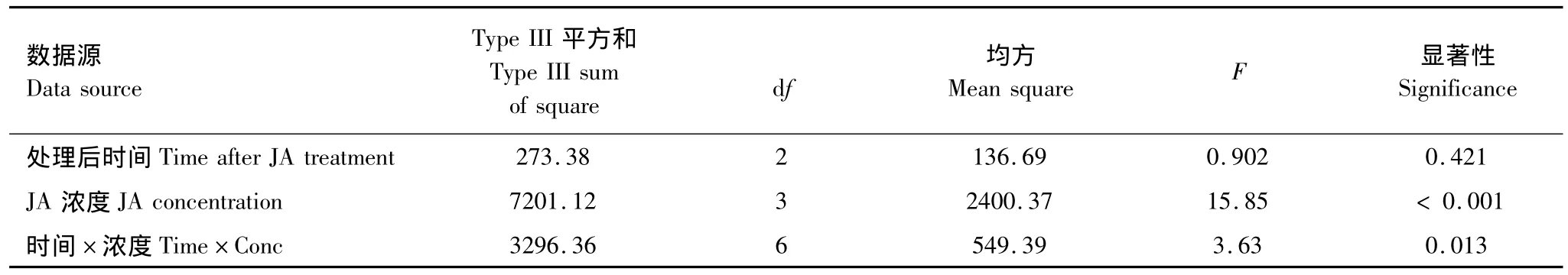
表6 茉莉酸及茉莉酸處理后時間對棉葉CAT活性影響的主效應檢驗Table 6 Main effects of JA treatment and time after JA treatment on CAT activities of cotton leaves
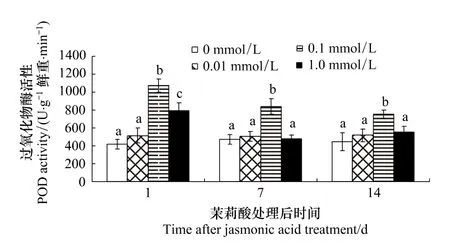
圖5 茉莉酸對棉葉POD活性的影響Fig.5 Effects of JA treatment on POD activities of cotton leaves
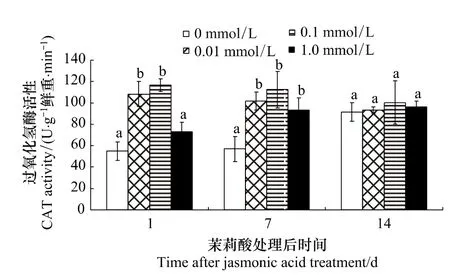
圖6 茉莉酸對棉葉CAT活性的影響Fig.6 Effects of JA treatment on CAT activities of cotton leaves
濃度與處理后天數對棉葉CAT活性影響的多重比較表明(圖6):0.01 mmol/L和0.1 mmol/L茉莉酸對棉葉過氧化氫酶活性有明顯影響 (P <0.05)。處理后1d和7d,0.01 mmol/L和0.1 mmol/L茉莉酸處理組棉葉CAT活性均明顯高于對照(處理后第1天,P=0.008和0.004;處理后第7天,P=0.017和0.005,但組間差異不明顯(圖6)。處理后14d,各組棉葉CAT活性均無明顯差異。
3 討論
茉莉酸是一種具有多種功能的植物生長調節物,能通過防御相關基因的增強表達和抗蟲相關化合物的增量合成提高植物的抗蟲性。植物抗性誘導的效率取決于誘導因子施用的時機和濃度,誘導抗性只有發生在食草昆蟲生長和發育的關鍵期時才能發揮最大效率。本研究表明,茉莉酸在誘導棉花幼苗抗蟲相關次生代謝物含量和相關酶活性方面存在濃度依賴性和滯后性。棉花單寧、PIs、PPO、POD、PAL和CAT等對JA處理的敏感性和滯后期各不相同。
3.1 茉莉酸對棉花單寧的誘導
單寧又稱植物多酚,能與昆蟲的唾液蛋白和消化酶結合,引起昆蟲消化酶失活,干擾昆蟲對植物蛋白的消化吸收[24]。外源茉莉酸或茉莉酸甲酯對植物單寧含量有一定的誘導作用,但存在濃度依賴性和滯后性。馮遠嬌等研究外源茉莉酸對玉米(Zea mays)幼苗化學防御的系統誘導時發現,0.1 mmol/L茉莉酸處理后48 h玉米葉片總酚含量明顯高于對照,而其它濃度如0.01,0.05和0.2 mmol/L對玉米幼苗總酚的誘導不明顯,在48 h以前甚至抑制玉米幼苗的酚酸合成[14]。用更低濃度的 MeJA誘導玉米幼苗異羥肟酸 (hydroxamic acid)和酚酸時發現,1 μL/L和2 μL/L(約0.005 mmol/L和 0.01 mmol/L)的MeJA 處理后 48 h,處理組幼苗葉內酚酸含量明顯高于對照[25],但10 mmol/L JA對玉米葉片總酚的誘導只局限在處理后 3—6 h[13]。Moreira等研究發現,用5 mmol/L MeJA處理海岸松 (Pinus pinaster)幼苗后60d,針葉的總酚含量升高不明顯[26]。本研究沒有采用低于0.01 mmol/L和高于1.0 mmol/L的JA對棉花幼苗進行處理,也沒有測定24 h以內JA的快速誘導效應,但不排除更低或更高濃度JA對棉花幼苗單寧含量的誘導。實驗所采用的3種濃度的茉莉酸均能在14d內誘導棉花幼苗葉片單寧含量升高。如果采樣時間延長,可能也會發現更長的誘導滯后期。
茉莉酸及功能類似物誘導植物抗性的濃度依賴性和滯后期表明,茉莉酸、茉莉酮和茉莉酸甲酯都能誘導落葉松單寧含量明顯升高,且以0.1 mmol/L茉莉酸的誘導效果最好,滯后期為10—20d[12]。宮玉艷等對枸杞的研究表明,0.1 mmol/L茉莉酸處理5d后,枸杞葉片單寧酸含量增幅最大[6]。海岸松經40 mmol/L MeJA處理后2周,針葉內總酚含量比對照植物高1.9倍[27]。本研究發現0.1和1.0 mmol/L茉莉酸在誘導棉葉單寧含量上等效,JA處理后第14天單寧含量最高,在誘導最佳濃度和滯后期方面分別與枸杞[6]、落葉松[12]和玉米[14]、海岸松[27]等相似。
3.2 茉莉酸對棉葉PIs和 PPO的誘導
PPO是與植物抗蟲性密切相關的抗營養蛋白,其催化酚氧化所生成的醌極易攻擊并烷基化某些必需氨基酸如半胱氨酸、賴氨酸、組氨酸和甲氨酸,引起昆蟲營養失調,抑制幼蟲生長和發育[28]。PIs亦稱抗消化蛋白酶,能通過抑制昆蟲中腸消化酶活性而影響昆蟲對植物營養的獲取、吸收、發育,甚至引起幼蟲死亡[29]。前人研究發現,番茄幼苗經1.5 mmol/L茉莉酸甲酯處理后4d,葉片PPO和PIs活性明顯升高[22]。1—2年生油松經0.1 mmol/L茉莉酸甲酯(濃度根據原文計算而得)處理48 h后,球果的PPO活性與PIs含量均明顯高于對照[30]。本研究發現,棉花幼苗經0.01、0.1和1.0 mmol/L 3種濃度 JA處理后,PIs含量和 PPO活性均不同程度升高,說明外源JA能通過誘導棉花抗營養酶和抗消化酶活性而提高棉花幼苗的抗蟲性。另有研究發現,0.1、0.5、1.0 和 5.0 mmol/L 茉莉酸甲酯也能誘導番茄葉片 PIs含量上升,持久期可達 2 周[31]。木豆(Cajanus cajan)經 0.1 mmol/L茉莉酸甲酯處理后 24 h,葉片的 PIs活性明顯升高[32]。輻射松 (Pinus radiata)幼苗經4.5 mmol/L茉莉酸甲酸處理后4d,針葉的 PPO活性比對照高2.3倍,但當 MeJA濃度高于4.5 mmol/L時,卻對幼苗有毒[33]。本研究發現,0.1 mmol/L茉莉酸的誘導效果最佳,誘導的滯后期可達2周,但以JA處理后第7天棉葉的PIs含量和PPO活性最高,并沒有觀察到JA對棉花幼苗的植物毒性。就誘導的最佳濃度而言,與李新崗等對輻射松[30]和 Lomate和 Hivarel[33]對木豆的研究相同;就誘導的滯后期而言,與Fujimoto等[31]對番茄的研究類似。雖然也有研究表明茉莉酸甲酯在誘導番茄 PIs含量上效果不明顯[34],但本研究所使用的3種濃度均在一定程度上誘導了棉花幼苗PIs含量的升高。
3.3 茉莉酸對棉葉PAL的誘導
茉莉酸處理能提高葉片的PAL活性[21,35]。豌豆幼苗經JA處理后葉片PAL活性明顯上升[35]。水稻幼苗經0.1 mmol/L茉莉酸處理后PAL活性升高,抗稻瘟性也隨之增強,持久期可長達15d[21]。本研究表明,0.1和1.0 mmol/L茉莉酸在誘導棉花幼苗PAL活性方面等效(經方差分析差異不顯著),誘導的滯后期可達1—2周,結果與鄒志燕和王振中[21]對水稻的研究基本相同。此外,有研究表明0.1 mmol/L的茉莉酸甲酯能誘導石蒜 (Lycoris radiata)PAL基因的表達[36]。由于PAL是酚類物質合成的關鍵酶和限速酶[37],JA處理后棉花幼苗PAL活性上升,說明茉莉酸激活或直接參與了棉花幼苗的苯丙烷代謝途徑,在提高棉花幼苗防御性次生代謝物含量方面起重要作用。
3.4 茉莉酸對棉葉抗氧化酶POD和CAT的誘導
POD參與酚的氧化,生成對病原菌毒性較高的醌類化合物,并參與木質素的合成,增厚細胞壁以抵御病菌的入侵和擴散。CAT能將逆境條件下(包括昆蟲取食)植物葉綠體和線粒體產生的過量H2O2分解,減輕活性氧成分對植物細胞膜的傷害。前人研究表明,250 μmol/L茉莉酸甲酯可誘導水稻保護酶系POD和CAT活性升高[15]。25、100和250 μmol/L茉莉酸處理提高了7日齡花生幼苗 (Arachis hypogaea L.)根和葉片的POD和CAT活性[23]。茉莉酸處理枸杞幼苗后7d枸杞葉POD活性升高,但0.01 mmol/L茉莉酸的誘導效果最佳[6]。本研究JA對棉花POD和CAT的誘導效應表明,0.1 mmol/L莉酸處理明顯提高了棉葉的 POD和CAT活性,誘導效應可持續1—14d,誘導的滯后期與宮玉艷對枸杞和Kumari等對花生的研究基本相同[6,23]。也有研究表明,感染晚疫病的馬鈴薯(Solanum tuberosum)幼苗經10-4mmol/L茉莉酸處理后,葉片POD活性升高而CAT活性下降[38]。Makissimov等認為:外源茉莉酸處理后,馬鈴薯葉片可溶性POD活性升高,與晚疫菌(Phytophthora infestans)菌絲體的親和力增加,起抑制病原菌擴散的作用;CAT活性的下降則削弱JA誘導的馬鈴薯抗病性,因為CAT催化分解H2O2[38]。本研究中,棉花幼苗經外源JA處理后葉片CAT活性上升,與Makissimov等[38]的報道相反,產生差異的原因可能是二者研究的系統、采用的JA濃度和處理后采樣時間不同。Makissimov等的研究對象是被晚疫菌感染的馬鈴薯植株,而本實驗的對象是健康的棉花植株。另外,茉莉酸除可以誘導植株抗病、抗蟲性外,還能誘導植株產生H2O2[35,38],而過氧化氧酶在清除多余H2O2、保持細胞的氧化還原穩態中起重要作用。據此推測,本研究中所觀察到的CAT活性升高,可能是所使用的茉莉酸誘導了棉花葉片的氧猝發。處理后第14天時CAT活性與對照相比無明顯差異,可能是JA誘導的氧猝發隨處理時間延長逐漸減弱的緣故。
棉葉中豐富的單寧和棉酚能抑制或減輕綠盲蝽 (Apolygus lucorum)的危害[39]、抑制棉鈴蟲化蛹[40],甚至直接起毒殺作用[11]。PPO明顯抑制棉鈴蟲的增重和取食[41]。PIs也在番茄和馬鈴薯的抗棉鈴蟲中起重要作用[34,42]。雖然本研究沒有直接關注JA誘導棉花對棉鈴蟲等害蟲的影響,但茉莉酸及其功能類似物的誘導抗蟲性表明:2.0 mmol/L茉莉酸處理的 Bt棉葉大大降低了草地貪夜蛾 (Spodoptera frugiperda)的相對生長率[7]。4齡棉鈴蟲取食MeJA處理過的番茄 (Tainan ASVEG No.6)葉后,死亡率高達100%[34],外源茉莉酸處理的枸杞苗木和水稻幼苗使枸杞蚜和稻褐飛虱若蟲的發育歷期延長[5,43]。本研究發現,棉花幼苗經茉莉酸處理后,單寧和抗消化酶含量上升、抗營養酶和抗氧化酶活性升高。因此,根據前人和本實驗的結果推測,茉莉酸處理能提高棉花幼苗的抗蟲性。另外,由于植物對茉莉酸誘導存在濃度依賴性、發育階段特異性和物種專一性[30,44-45],開展茉莉酸的誘導抗性實驗時除應該多設濃度梯度外,還應關注研究對象的發育階段。未來應進一步采用分析化學的方法對茉莉酸誘導產生的抗蟲性次生代謝物進行定性和定量分析,從棉花誘導防御對棉鈴蟲等害蟲的取食行為、產卵偏好、生態免疫和解毒功能、從可誘導揮發物對棉鈴蟲捕食性/寄生性天敵的影響等多個營養級層面進行綜合研究,揭示茉莉酸誘導普通棉抗蟲性的生理、生態和生化機制。
[1] Boughton A J,Hoover K,Felton G W.Impact of chemical elicitor applications on greenhouse tomato plants and population growth of the green peach aphid,Myzuc persicae.Entomologia Experimentalis et Applicata,2006,120(3):175-188.
[2] Bruinsma M,van Dam N M,van Loon J J A,Dicke M.Jasmonic acid-induced changes in Brassica oleracea affect oviposition preference of two specialist herbivores.Journal of Chemical Ecology,2007,33(4):655-668.
[3] Abe H,Shimoda T,Ohnishi J,Kugimiya S,Narusaka M,Seo S,Narusake Y,Tsuda S,Kobayashi M.Jasmonate-dependent plant defense restricts thrips performance and preference.BMC Plant Biology,2009,9:27,doi:10.1186/1471-2229-9-97.
[4] Guan X M,Liu X X,Lu Z Q,Zhao Z W,Zhang Q W,Xia J Y.Influence of tannic acid and Cry1Ac toxin of Bacillus thuringiensis on larval growth,growth and development of Helicoverpa armigera.Entomologia Experimentalis et Applicata,2009,132(1):50-58.
[5] Gong Y Y,Duan L Q,Wang A Q,Cui R J,Qiang Y S.Effects of exogenous jasmonic acid-induced resistance to wolfberry on the development and fecundity of the wolfberry aphid aphis sp.Acta Entomologia Sinica,2010,53(6):670-674.
[6] Gong Y Y,Duan L Q,Wang A Q.Induced effects of jasmonic acid on the contents of biochemical substances and enzyme activity in wolfberry leaves.Plant Protection,2010,36(2):61-65.
[7] Mészáros A,Beuzelin J M,Stout M J,Bommireddy P L,Riggio M R,Leonard B R.Jasmonic acid-induced resistance to the fall armyworm,Spodoptera frugiperda,in conventional and transgenic cottons expressing Bacillus thuringiensis insecticidal proteins.Entomologia Experimentalis et Applicata,2011,140(3):226-237.
[8] Stratmann J W.Long distance run in the wound response-jasmonic acid is pulling head.Trends in Plant Science,2003,8(6):247-250.
[9] Koo A J K,Gao X L,Jones A D,Howe G A.A rapid wound signal activates the systemic synthesis of bioactive jasmonates in Arabidopsis.The Plant Journal,2009,59(6):974-986.
[10] Bruinsma M,Posthumus M A,Mumm R,Mueller M J,van Loon J J,Dicke M.Jasmonic acid-induced volatiles of Brassica oleracea attract parasitoids:effects of time and dose,and comparison with induction by herbivores.Journal of Experimental Botany,2009,60(9):2575-2587.
[11] Koussevitzky S,Ne'eman E,Harel E.Import of polyphenol oxidase by chloroplasts is enhanced by methyl jasmonate.Planta,2004,219(3):412-419.
[12] Meng Z J,Zhou Y Q,Yang S C,Jin H,Hu X.Effects of exogenous jasmonates on tannin content in needles of two larch species.Scientia Silvae Sinicae,2010,46(3):96-104.
[13] Feng Y J,Wang J W,Luo S M.Timing and concentration effects on the defense response of Zea mays seedlings after application of jasmonic acid to leaves.Chinese Journal of Plant Ecology,2009,33(4):812-823.
[14] Feng Y J,Wang J W,Luo S M.Timing-and concentration effect of belowground treatment with jasmonic acid on maize seedlings chemical defense response.Chinese Journal of Applied Ecology,2009,20(8):1883-1890.
[15] Wu G Z,Zeng R S.The influence of protective enzymes Perpendicular Gaozhou wild rice(Oryza rufipogon)treated with exterior signal compounds salicylates and jasmonates.Acta Agricultural Boreali-Occidentalis Sinica,2007,16(3):82-84.
[16] War A R,Paulraj M G,War M Y,Ignacimuthu S.Jasmonic acid-mediated-induced resistance in groundnut(Arachis hypogaea L.)against Helicoverpa armigera(Hübner)(Lepidoptera:Noctuidae).Journal of Plant Growth Regulation,2011,30(4):512-523.
[17] Omer A D,Granett J,Karban R,Villa E M.Chemically induced resistance against multiple pests in cotton.International Journal of Pest Management,2001,47(1):49-54.
[18] Opitz S,Kunert G,Gershenzon J.Increased terpenoid accumulation in cotton(Gossypium hirsutum)foliage is a general wound response.Journal of Chemical Ecology,2008,34(4):508-522.
[19] Lin F M,W D,Lu Y H,Zhang Y J,Wang M,Wu K M.The relationship between the main secondary metabolites and the resistance of cotton to Apolygus lucroum.Acta Phytophylacica Sinica,2011,39(3):202-208.
[20] Stout M J,Workman K V,Bostock R M,Duffey S S.Stimulation and attenuation of induced resistance by elicitors and inhibitors of chemical induction in tomato(Lycopersicon esculentum)foliage.Entomologia Experimentalis et Applicata,1998,86(3):267-279.
[21] Zhou Z Y,Wang Z Z.Effects of jasmonic acid on induced resistance of rice seedlings to Magnaporthe Grisea.Acta Phytopathologica Sinica,2006,36(5):432-438.
[22] Tan C W,Lou J C,Yadav J,Ravuiwasa K T,Hwang S Y.Methyl jasmonate induced responses in four plant species and its effects on Spodoptera litura Fab.Performance.Journal of Asia-Pacific Entomology,2011,14(3):263-269.
[23] Kumari G J,Reddy A M,Naik S T,Kumar S G,Prasnathi J,Sriranganayakulu G,Reddy P C,Sudhakar C.Jasmonic acid induced changes in protein pattern,antioxidative enzyme activities and peroxidase isozymes in peanut seedlings.Biologia Plantarum,2004,50(2):219-226.
[24] Barbehenn R V,Jaros A,Lee G,Mozola C,Weir Q,Salminen J P.Hydrolyzable tannin as“quantitative defense”:limited impact against Lymantria dispar caterpillars on hybrid poplar.Journal of Insect Physiology,2009,55(4):297-304.
[25] Wang J W,Xu T,Zhang LW,Zhong Z M,Luo S M.Effects of methyl jasmonate on hydroxamic acid and phenolic acid content in maize and its allelopathic activity to Echinochloa crusgalli(L.).Allelopathy Journal,2007,19(1):161-17.
[26] Moreira X,Sampedro L,Zas R.Defensive responses of Pinus pinaster seedlings to exogenous application of methyl jasmonate:concentration effect and systemic response.Environmental and Experimental Botany,2009,67(1):94-100.
[27] Moreira X,Zas R,Sampedro L.Quantitative comparison of chemical,biological and mechanical induction of secondary compounds in Pinus pinaster seedlings.Trees,2012,26(2):677-683.
[28] Duffey S S,Stout M J.Antinutritive and toxic components of plant defense against insects.Archives of Insect Biochemistry and Physiology,1996,32(1):3-37.
[29] Gatehouse A M R,Norton E,Davison G M,Babbé S M,Newell C A,Gatehouse J A.Digestive proteolytic activity in larvae of tomato moth,Lacanobia oleraceae;effects of plant protease inhibitors in vitro and in vivo.Journal of Insect Physiology,1999,45(6):545-558.
[30] Li X G,Liu H X,Hou H B,Gao W H.Response of Chinese pine cones to induction of exogenous methyl jasmonate and Gravitarmata margarotna larvae.Scientia Silivae Sinicae,2007,43(3):66-72.
[31] Fujimoto T,Tomitaka Y,Abe H,Tsuda S,Futai K,Mizukubo T.Expression of profile of jasmonic acid-induced genes and the induced resistance against the root-know nematode(Meloidogyne incognita)in tomato plants(Solanum lycopersicum)after foliar treatment with methyl jasmonate.Journal of Plant Physiology,2011,168(10):1084-1097.
[32] Lomate P R,Hivrale V K.Wound and methyl jasmonate induced pigeon pea defensive proteinase inhibitor has potency to inhibit insect digestive proteinases.Plant Physiology and Biochemistry,2012,57(2):193-199.
[33] Gould N,Reglinski,Northcott G L,Spiers M,Taylor J T.Physiological and biochemical responses in Pinus radiata seedlings associated with methyl jasmonate-induced resistance to Diplodia pinea.Physiological and Molecular Plant Pathology,2009,74(2):121-128.
[34] Tan C W,Chiang S Y,Ravuiwas K T,Yadav J,Hwang S Y.Jasmonate-induced defenses in tomato against Helicoverpa armigera depend in part on nutrient availability,but artificial induction via methyl jasmonate does not.Arthrod-Plant Interactions,2012,doi:10.1007/s11829-012-9206-3.
[35] Liu Y,Pan Q H,Yang H R,Liu Y Y,Huang W D.Relationship between H2O2and jasmonic acid in pea leaf wounding response.Russian Journal of Plant Physiology,2008,55(6):765-775.
[36] Jiang Y M,Xia N,Li X D,Shen W B,Liang L J,Wang C Y,Wang R,Peng F,Xia B.Molecular cloning and characterization of a phenylalanine ammonia-lyase gene(LrPAL)from Lycoris radiata.Molecular Biology Reports,2011,38(3):1935-1940.
[37] Ritter H,Schulz G E.Structural basis for the entrance into the phenylpropanoid metabolism catalyzed by phenylalanine ammonia lyase.Plant Cell,2004,16(12):3426-3436.
[38] Maksimov I V,Sorokan A V,Chereoanova E A,Surina O B,Troshina N B,Yarullina L G.Effects of salicylic and jasmonic acids on the components of pro/antioxidant system in potato plants infected with late blight.Russian Journal of Plant Physiology,2011,58(2):299-306.
[39] Lin F M,Wu D,Lu Y H,Zhang Y J,Wang M,Wu K M.The relationship between the main secondary metabolites and the resistance of cotton to Apolygus lucroum.Acta Phytophylacica Sinica,2011,39(3):202-208.
[40] Guan X M,Liu X X,Lu Z Q,Zhao Z W,Zhang Q W,Xia J Y.Influence of tannic acid and Cry1Ac toxin of Bacillus thuringiensis on larval growth,growth and development of Helicoverpa armigera.Entomologia Experimentalis et Applicata,2009,132(1):50-58.
[41] Bhonwong A,Stout M J,Attajarusit J,Tantasawat P.Defensive role of tomato polyphenol oxidases against cotton bollworm(Helicoverpa armigera)and beet armyworm(Spodoptera exigua).Journal of Chemical Ecology,2009,35(1):28-38.
[42] Dunse K M,Stevens J A,Lay F T,Gaspar Y M,Health R L,Anderson M A.Coexpression of potato type I and II proteinase inhibitors gives cotton plants protection against insect damage in the field.Proceedings of the National Academy of Sciences of the United States of America,2010,107(34):15011-15015.
[43] Senthil-Nathan S,Kalaivani K,Choi M Y,Paik C H.Effects of jasmonic acid-induced resistance in rice on the plant brownhopper,Nilaparvata lugens St?l(Homoptera:Delphacidae).Pesticide Biochemistry and Physiology,2009,95(2):77-84.
[44] Matthes M C,Pickett J A,Napier J A.Natural variation in responsiveness of Arabidopsis thaliana to methyl jasmonate is developmentally regulated.Planta,2008,228(6):1021-1028.
[45] Cooper W R,Rieske L K.Differential responses in American(Castanea dentate Marshall)and Chinese(C.mollissima Blume)chestnut(Falalles:Fagceae)to foliar application of jasmonic acid.Chemoecology,2008,18(2):121-127.
參考文獻:
[5] 宮玉艷,段立清,王愛清,崔瑞娟,錢遠松.外源茉莉酸誘導枸杞對枸杞蚜生長發育和繁殖的影響.昆蟲學報,2010,53(6):670-674.
[6] 宮玉艷,段立清,王愛清.茉莉酸誘導對枸杞葉生化物質及酶活性的影響.植物保護,2010,36(2):61-65.
[12] 孟昭軍,周永泉,嚴善春,金虎,胡曉.外源茉莉酸類化合物對2種落葉松針葉內單寧含量的影響.林業科學,2010,46(3):96-104.
[13] 馮遠嬌,王建武,駱世明.葉片涂施茉莉酸對玉米幼苗防御反應的時間和濃度效應.植物生態學報,2009,33(4):812-823.
[14] 馮遠嬌,王建武,駱世明.外源茉莉酸處理地下部對玉米化學防御反應影響的時間和濃度效應.應用生態學報,2009,20(8):1883-1890.
[15] 吳國昭,曾任森.外源水楊酸甲酯和茉莉酸甲酯處理對挺立型普通野生水稻保護酶活性的影響.西北農業學報,2007,16(3):82-84.
[21] 鄒志燕,王振中.茉莉酸誘導水稻幼苗對稻瘟病抗性作用研究.植物病理學報,2006,36(5):432-438.
[30] 李新崗,劉慧霞,候慧波,高文海.油松球果對外源茉莉酸甲酯和蟲害誘導的生化反應.林業科學,2007,43(3):66-72.
[39] 林鳳敏,吳敵,陸晏輝,張永軍,王沫,吳孔明.棉花主要抗蟲次生物質及其對綠盲蝽抗性的關系.植物保護學報,2011,39(3):202-208.

