溫度、鹽度及其互作效應對吉富羅非魚血清IGF-I與生長的影響
強 俊,楊 弘,王 輝,徐 跑,*,何 杰
(1.中國水產科學研究院淡水漁業研究中心農業部淡水漁業和種質資源利用重點實驗室,無錫 214081;2.南京農業大學無錫漁業學院,無錫 214081;3.廣東海洋大學水產學院,湛江 524025)
當環境條件改變時,魚體可以通過自身調節機制來維持機體平衡。溫度和鹽度波動對魚類的生長與激素調控有重要影響[1-2]。在等滲環境中,離子轉運所消耗的能量最少,儲存的能量可能主要用于魚體生長[3-4]。然而,也有些學者持相反觀點。Imsland等[5]報道,在鹽度為15,離子調節所需能量較低時可能更有助于促進大菱鲆(Scophthalmus maximu)的生長。
神經內分泌因子對魚類的生長和能量代謝起調控作用[6]。生長激素(GH)、胰島素樣生長因子(IGF-I)和胰島素作為3個重要的神經內分泌因子,在代謝與促進生長方面發揮著重要作用[7]。GH含量可以直接影響肝臟中IGF-I的分泌。同時,這些激素的產生與分泌受許多外源因子(如:飼料中的營養成分、溫度、鹽度、光照與季節變化等)直接或間接調控[8-12]。增加溫度可以提高大菱鲆[10]和大馬哈魚(Oncorhynchus tshawytscha)[6]血漿 IGF-I的水平;而鹽度對大菱鲆血漿 IGF-I水平無明顯影響[10]。Mingarro 等[13]也發現,在溫度較為適宜的季節,金頭鯛(Sparus aurata)血液IGF-I水平較高,魚體生長速度也較快。同時,IGF-I與魚類的攝食率、能量代謝、發育、繁殖以及海水中的滲透壓調節密切相關[13]。2011年全球羅非魚產量達到300多萬噸,中國羅非魚產量占全球產量的一半。羅非魚已成為中國南方地區主要養殖的淡水品種之一。關于鹽度調節羅非魚IGF-I方面的研究較少,僅見Fiess等[1]的報道。Fiess等[1]發現,水溫為28℃,在海水或2倍海水中,莫桑比克羅非魚(Oreochromis mossambicus)血漿IGF-I水平高于淡水環境中的。然而,溫度與鹽度對IGF-I的互作效應以及生長、飼料效率和血清IGF-I之間的關系尚未發現。
本試驗采用中心復合試驗設計和響應曲面分析法,利用此設計與分析方法不僅可以減少試驗次數,降低試驗隨機誤差,而且可以有效的擬合各因素與響應值之間的關系。本研究的主要目的:(1)研究溫度、鹽度及其互作效應對吉富羅非魚血清IGF-I與生長的影響;(2)研究溫度與鹽度的二次效應對血清IGF-I與生長的影響,并建立相關曲面模型;(3)分析特定生長率(SGR)、飼料效率(FE)與血清IGF-I之間的關系。本研究旨在利用最優鹽度與溫度組合優化羅非魚的苗種培育以及分析血清IGF-I在鹽度馴化過程中的調控作用。
1 材料與方法
1.1 材料
試驗魚采自中國水產科學研究院淡水漁業研究中心宜興基地自繁的第16代“吉富”品系尼羅羅非魚幼魚,選擇無病無傷,活力強的個體作為試驗用魚。試驗前在室內水泥池(水溫(27±0.3)℃,pH值7.4±0.2,鹽度為0)中暫養10 d,自然光周期。暫養期間使用循環水并且連續充氣,每天7:00、11:00和16:00各投喂膨化飼料1次(粗蛋白質為32.0%、脂肪8.0%),投喂量為體重的8%。
1.2 試驗設計與分組
正式試驗前先進行羅非魚幼魚的預試驗,通過單因子試驗確定幼魚可以正常攝食與生長的溫度和鹽度范圍。試驗采用中心復合試驗設計,本試驗的響應值為特定生長率、飼料效率和血清IGF-I,因子為溫度(18—37℃)和鹽度(0—18),分別以T和S表示,每個因子的試驗水平編碼分別為-a、-1、0、1、a(表1),試驗采用2因素5水平,共計13次試驗,試驗的次序隨機,中心組合重復5次,每個試驗組合重復3次。具體的溫度和鹽度組合見表1。
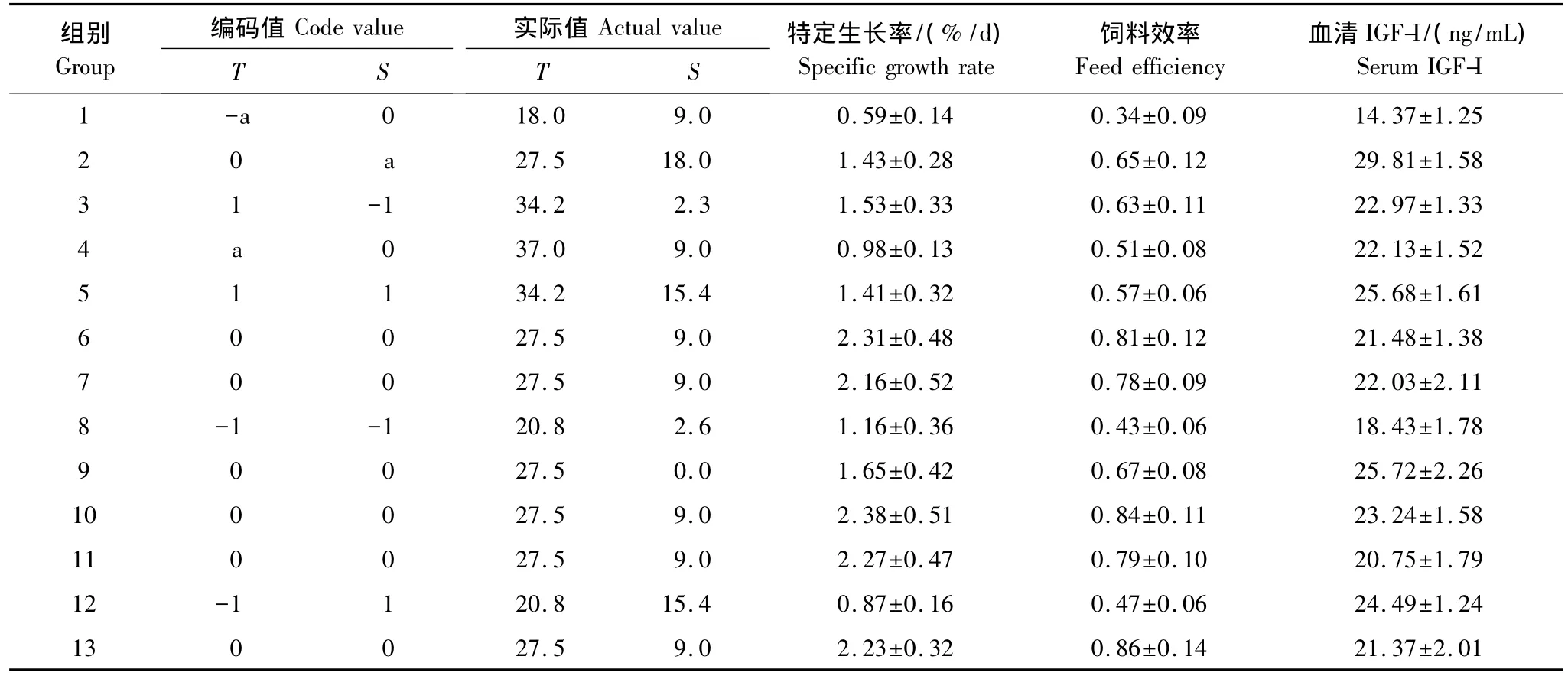
表1 溫度與鹽度的試驗設計組合和結果Table 1 Experimental design of temperature and salinity and results(Mean±SD)
1.3 試驗魚的馴化
試驗魚先進行溫度馴化,馴化在450L的塑料桶中進行,用電子恒溫棒(量程為20—38℃)和冰袋控溫,溫差為±0.5℃。溫度馴化采用漸進方式,每天溫度升降幅不超過2℃。馴化至相應的試驗溫度后開始進行相應的鹽度馴化,用海水晶進行鹽度調節,鹽度測定使用日本ATAGO S-10E鹽度計。鹽度調節也采用漸進方式,每天鹽度升幅不超過2。馴化至相應的設置后,在此設置下飼養7d。
1.4 試驗方法
試驗在39個450 L的塑料桶中進行,每個塑料桶添加曝氣3 d后的自來水400 L。調節至相應的溫度與鹽度組合,試驗開始前對幼魚的體重和體長進行測量。試驗用魚體重為(27.64±2.79)g,體長為(9.43±0.46)cm,每個試驗組合共放置60尾魚,每個平行組各20尾魚。各組初始體重和體長沒有顯著差異(ANOVA,P>0.05)。正常投喂1.1中的膨化飼料,每次定量投喂(保證桶底無飼料殘留),日投喂量為體重的4%—8%,試驗周期共計56 d。試驗期間連續充氣,采用虹吸法清除桶底糞便,日換水量1/3,保持換水前后溫差不超過±0.5,溶氧保持在5 mg/L以上,pH值7.6±0.2,氨氮和亞硝酸鹽分別不高于0.01 mg/L,自然光周期。
1.5 響應指標測定
試驗結束前24 h停飼,次日對每個試驗組合的全部試驗用魚進行體重測量。
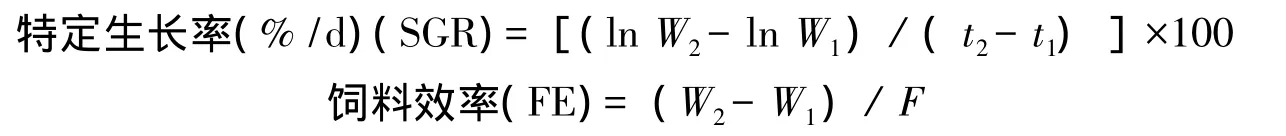
式中,W1、W2為起始時間t1、終末時間t2時的體重(g)、F為總投餌量(g)。試驗結束后,每個養殖桶隨機選取5尾魚,用200 mg/L的MS-222作快速深度麻醉,尾靜脈采血。血樣于4℃冰箱中靜置2 h,在4℃,3500 g離心10 min制備血清,上清液移置-80℃冰箱中保存備用。血清IGF-I的測定采用放射免疫分析方法,試劑盒購自上海朗頓生物科技有限公司。
1.6 數據處理
數據測定結果用平均值±標準差(Mean±SD)表示。通過最小二乘法擬合因子與響應值之間的二次多項回歸方程為:
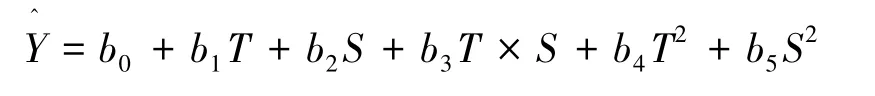
采用STATISTICA 8.0軟件進行試驗設計與結果處理,對溫度、鹽度與響應值進行的二次多項回歸擬合。顯著水平為0.05,極顯著水平為0.01。
2 結果
2.1 溫度、鹽度及其互作效應對吉富羅非魚幼魚血清IGF-I的影響
溫度(T)與鹽度(S)對羅非魚幼魚血清IGF-I的測定結果見表1,對數據采用最小二乘法進行回歸擬合,回歸方程系數顯著性檢驗結果列于表2。模型P=0.0002﹤0.01,表明所建立的回歸模型極顯著;失擬項P=0.2701﹥0.05,表明擬合的模型有效。T和S的一次與二次效應對血清IGF-I有極顯著影響(P﹤0.01)(表2),T×S對血清IGF-I無顯著影響(P﹥0.05)。回歸系數顯示,T效應較S明顯。T和S與血清IGF-I之間的實際二次回歸方程(1):
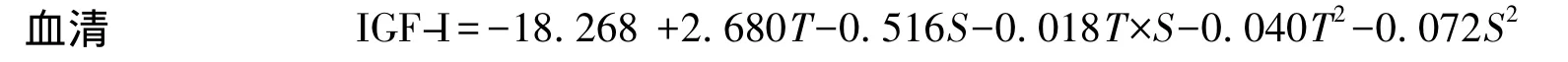
該方程的決定系數R2=0.949,說明該模型能解釋94.9%響應值的變化,僅有總變異的5.1%不能用此模型解釋,該模型擬合程度良好。
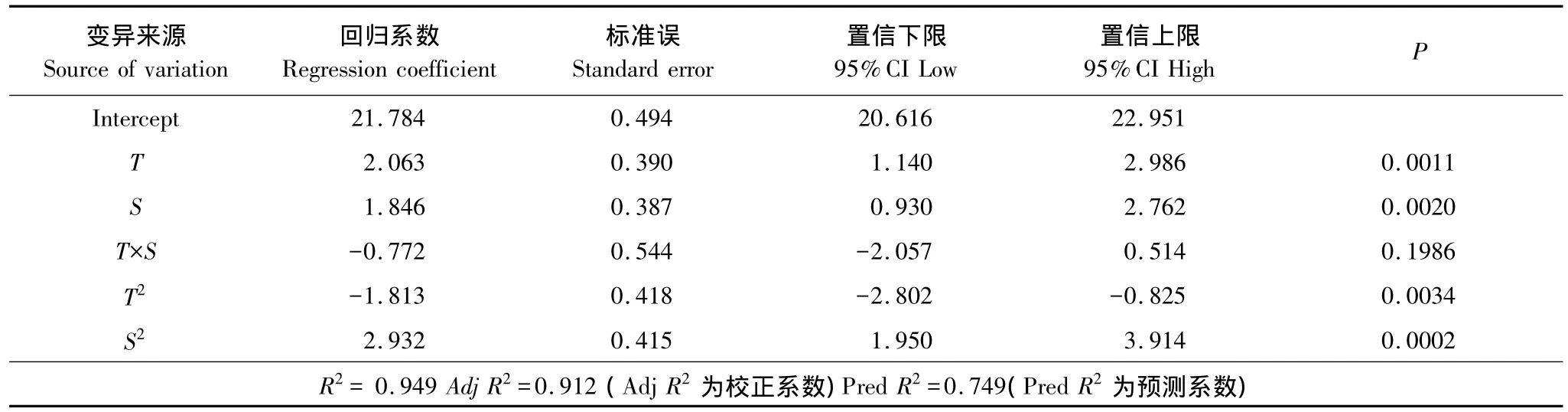
表2 回歸方程系數顯著性檢驗Table 2 Test of significance for regression coefficient
溫度、鹽度及其交互作用與血清IGF-I的響應曲面及其等高線圖見圖1。通過該組動態圖可評價試驗因素對幼魚生長的兩兩交互作用。本試驗條件下,鹽度為9,溫度為18—30℃時,隨著溫度升高,血清IGF-I水平呈上升趨勢。溫度對血清IGF-I水平有極顯著影響(P﹤0.01),溫度高于30℃時,血清IGF-I水平明顯下降;溫度為27.5℃,鹽度為0—7.5時,血清IGF-I水平逐漸下降,鹽度高于7.5時,血清IGF-I水平顯著上升。水溫為18—37℃時,血清IGF-I水平在鹽度為0—18范圍內均呈先下降后上升的變化趨勢。
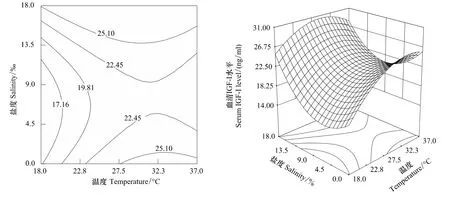
圖1 溫度、鹽度及其交互作用對吉富羅非魚幼魚血清IGF-I水平影響的響應面和等高線Fig.1 Response surface plot and its contour plot of the effect of temperature and salinity and their mutual interactions on serum IGF-I levels of GIFT tilapia juvenile
2.2 溫度、鹽度及其互作效應對吉富羅非魚幼魚特定生長率(SGR)的影響
溫度(T)與鹽度(S)對羅非魚幼魚特定生長率(SGR)的測定結果見表1,對數據采用最小二乘法進行回歸擬合,回歸方程系數顯著性檢驗結果列于表3。模型P﹤0.01,表明所建立的回歸模型極顯著;失擬項P=0.4844﹥0.05,表明擬合的模型有效。T的一次、二次效應與S的二次效應對SGR有極顯著影響(P﹤0.01)(表3),S的一次效應對SGR有顯著影響(P﹤0.05);T×S對SGR無顯著影響(P﹥0.05)。回歸系數顯示,T效應較S明顯。T和S與SGR之間的實際二次回歸方程(2):
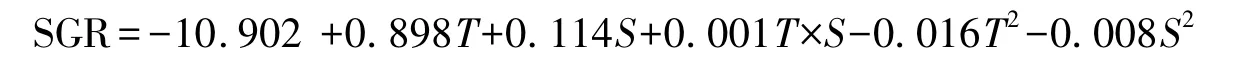
該方程的決定系數R2=0.986,說明該模型能解釋98.6%響應值的變化,僅有總變異的1.4%不能用此模型解釋,該模型擬合程度良好。
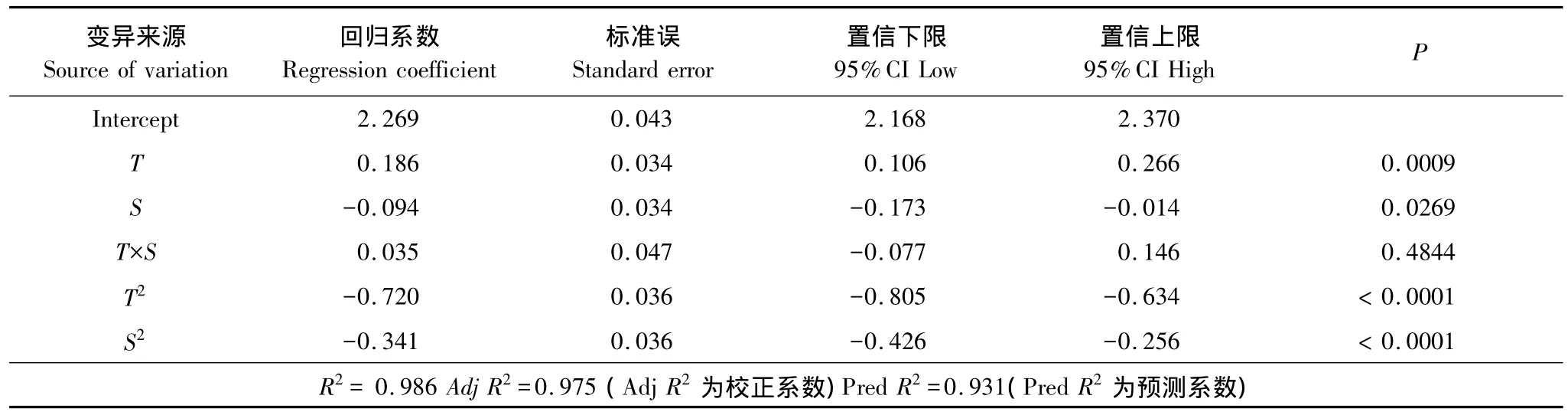
表3 回歸方程系數顯著性檢驗Table 3 Test of significance for regression coefficient
溫度、鹽度及其交互作用的響應曲面圖及其等高線圖見圖2。本試驗條件下,隨著溫度升高,SGR呈先上升后下降的變化趨勢。鹽度為9時,幼魚在水溫為28.4℃環境下生長較快。當鹽度為0—18時,SGR隨鹽度上升呈先上升后下降的變化。水溫為27.5℃,鹽度為9時,幼魚的SGR顯著高于淡水與鹽度18環境中的。水溫為18℃—37℃時,SGR在鹽度為0—18范圍內均呈先上升后下降的變化趨勢,溫度與鹽度之間無互作效應。
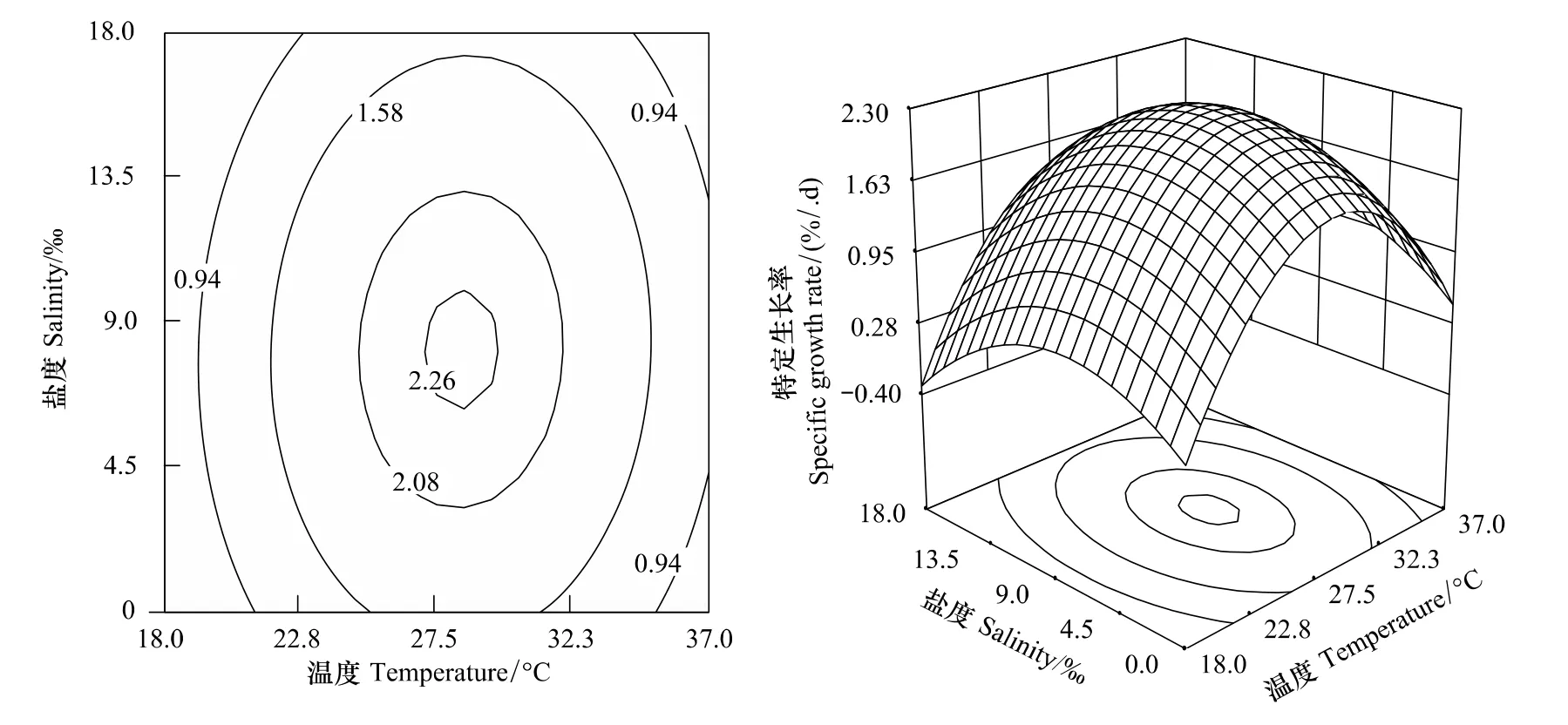
圖2 溫度、鹽度及其交互作用對吉富羅非魚幼魚特定生長率影響的響應面和等高線Fig.2 Response surface plot and its contour plot of the effect of temperature and salinity and their mutual interactions on specific growth rate of GIFT tilapia juvenile
2.3 溫度、鹽度及其互作效應對吉富羅非魚幼魚飼料效率(FE)的影響
溫度(T)與鹽度(S)對羅非魚幼魚飼料效率(FE)的測定結果見表1,對數據采用最小二乘法進行回歸擬合,回歸方程系數顯著性檢驗結果列于表4。模型P﹤0.01,表明所建立的回歸模型極顯著;失擬項P=0.8297﹥0.05,表明擬合的模型有效。T的一次、二次效應與S的二次效應對FE有極顯著影響(P﹤0.01)(表4),S的一次效應對FE無顯著影響(P﹥0.05)。回歸系數顯示,T效應較S明顯。T和S與FE之間的實際二次回歸方程(3):
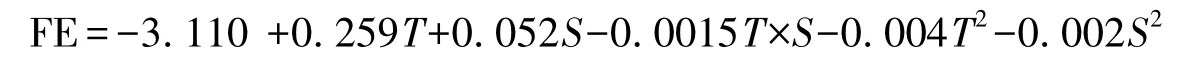
該方程的決定系數R2=0.984,說明該模型能解釋98.4%響應值的變化,僅有總變異的1.6%,不能用此模型解釋,該模型擬合程度良好。
溫度、鹽度及其交互作用與FE的響應曲面及其等高線圖見圖3。本試驗條件下,鹽度為9,溫度為18—29℃時,隨著溫度升高,FE呈上升趨勢。溫度對FE有極顯著影響(P﹤0.01),溫度高于29℃時,FE明顯下降;溫度為27.5℃,鹽度為0—9時,FE逐漸升高,鹽度高于9時,FE開始下降;鹽度為0—18時,FE在0.73—0.82之間,鹽度對FE無顯著影響(P﹥0.05)。溫度與鹽度分別為28.7℃和8.6時,FE較高,為0.82,其可靠性為0.927。水溫為18—37℃時,FE在鹽度為0—18范圍內均呈先上升后下降的變化趨勢,溫度與鹽度之間無互作效應。
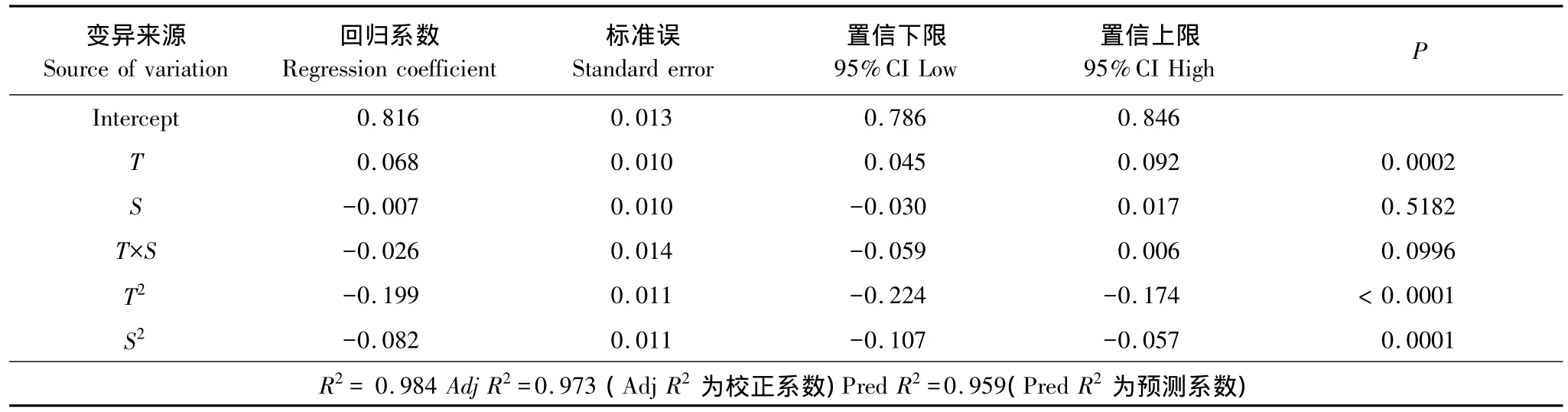
表4 回歸方程系數顯著性檢驗Table 4 Test of significance for regression coefficient
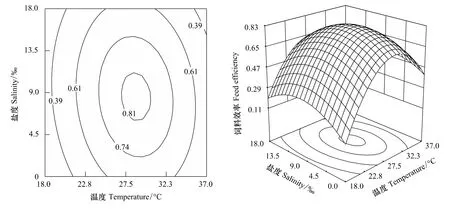
圖3 溫度、鹽度及其交互作用對吉富羅非魚幼魚飼料效率影響的響應面和等高線Fig.3 Response surface plot and its contour plot of the effect of temperature and salinity and their mutual interactions on feed efficiency of GIFT tilapia juvenile
2.4 血清IGF-I與特定生長率的關系
本試驗條件下,羅非魚幼魚血清IGF-I與特定生長率之間的模型為血清IGF-I=-8.657SGR2+28.276 SGR+2.392(P﹤0.05),R2=0.496。血清IGF-I水平與特定生長率具有相關性。
2.5 血清IGF-I與飼料效率的關系
本試驗條件下,羅非魚幼魚血清IGF-I與飼料效率之間的模型為血清IGF-I=-119.47FE2+154.59 FE-24.334(P﹤0.05),R2=0.698。血清IGF-I水平與飼料效率具有相關性。
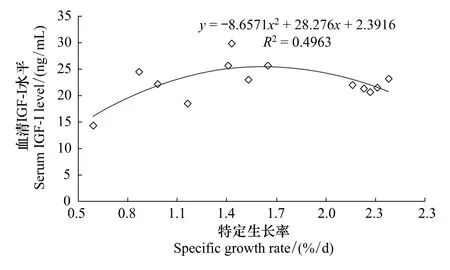
圖4 吉富羅非魚幼魚血清IGF-I與特定生長率的關系Fig.4 Relationship between serum IGF-I and SGR of GIFT tilapia juvenile
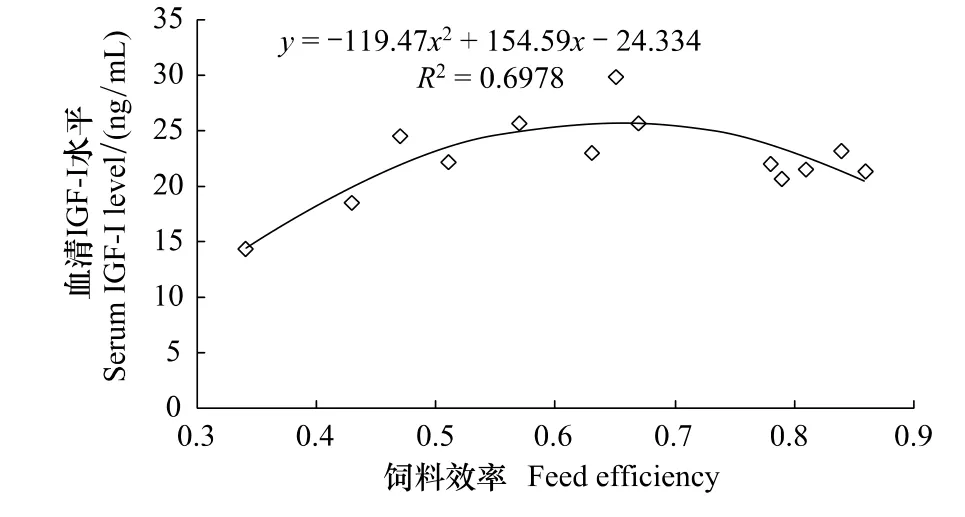
圖5 吉富羅非魚幼魚血清IGF-I與飼料效率的關系Fig.5 Relationship between serum IGF-I and FE of GIFT tilapia juvenile
3 討論
3.1 吉富羅非魚血清IGF-I在不同水溫下的變化及其與生長和飼料效率的關系
吉富羅非魚血清IGF-I與飼養水溫密切相關。在其它魚類上也見到相關報道[10,14],較高溫度有助于提高魚體自身的代謝水平,從而增加血漿中循環IGF-I[10]。同時,血清IGF-I與特定生長率相關,相關系數為0.496,P ﹤0.05。在莫桑比克羅非魚[15]、大菱鮃[10]和銀鮭魚(Oncorhynchus kisutch)[16]的研究中也發現類似報道。Uchida等[15]報道,血漿IGF-I水平可用作莫桑比克羅非魚生長速度的考察指標,IGF-I水平與特定生長率呈正相關,相關系數r=0.74(P﹤0.01);Imsland等[10]研究發現,大菱鮃的特定生長率與IGF-I水平呈正相關,相關系數r=0.53(P﹤0.01);Pierce等[16]研究發現,銀鮭魚的特定生長率與IGF-I水平呈正相關,相關系數r2=0.623(P﹤0.0001)。血清IGF-I可以直接調控魚類生長。然而,本試驗中的IGF-I與特定生長率的曲線關系,可能是因為血清IGF-I參與魚體的能量代謝有關。羅非魚的飼料效率與血清IGF-I水平同樣也有相關性,相關系數為0.698,P﹤0.05。這在以往的銀鮭魚[16]的研究中也發現類似結論,而在大菱鲆[10]的研究中未發現此相關性。IGF-I作為一種促細胞分裂素,通過與IGF-I受體(IGF-IR)的結合,能促進鳥氨酸脫氫酶的活性及細胞內DNA、RNA和蛋白質的生物合成,最終引起細胞的增殖與分化,有助于蛋白質的合成和結締組織及骨髓的產生,從而促進生長[17]。通過以上分析可以發現,水溫可能通過影響血清IGF-I水平來改變生長速度與飼料利用。
3.2 鹽度對吉富羅非魚血清IGF-I的影響
鹽度對吉富羅非魚血清IGF-I有顯著影響。在鹽度為0—18時,血清IGF-I水平呈先下降后上升的變化趨勢。而飼料效率與特定生長率在鹽度較低時(7—9)較高,低鹽環境下可以促進羅非魚的生長與飼料效率。這與血清IGF-I水平在鹽度為0—18條件下的變化趨勢相反,鹽度低于7或高于9時可以刺激血清IGF-I水平上升。Fiess等[1]在莫桑比克羅非魚的研究中也發現類似結論。Shepherd等[18]研究發現,虹鱒(Oncorhynchus myskiss)血漿IGF-I水平隨鹽度(0—20)上升而上升。Sakamo和Hirano[19]研究也發現,將虹鱒從淡水中轉移到鹽度為25的環境中時,鹽度可以引起鰓和腎臟中IGF-I表達的增加,而肝臟中的表達水平無顯著變化。魚體可能通過GH來誘導滲透壓調節器官中IGF-I的表達,從而提高鹽度的耐受性[20]。可見,GH/IGF-I軸在魚類的鹽度馴化中發揮著重要作用。IGF-I與滲透壓調節相聯系,血清IGF-I水平升高有助于維持魚體自身的平衡。Duan等[21]研究發現,GH/IGF-I軸在魚類新陳代謝方面發揮著重要作用。因而,本試驗中血清IGF-I水平的上升可能歸因為,環境溫度與鹽度的增加提高了魚體的能量需求。關于激素與細胞內滲透調節物質變化的關系還有待進一步研究。同時,魚類的營養狀況與其它代謝影響因素也可能影響IGF-I分泌,IGF-I受體的表達與血液中IGF-I結合蛋白的數量對IGF-I的功能也有明顯影響[22-23]。
3.3 溫度與鹽度對吉富羅非魚生長與飼料效率的影響
溫度和鹽度對吉富羅非魚生長有顯著影響。溫度為28—30℃,鹽度為7—9時,羅非魚的生長速度較快。可能由于此水環境下提高了羅非魚的攝食與飼料效率。溫度與羅非魚生長和飼料效率的關系已見一些報道[3,24]。溫度高于33℃時,較高的溫度可能對魚體產生了生理應激,代謝產生的能量主要用于維持機體的衡態,或增加了腸胃的排空速率,從而導致生長與飼料效率的下降[25]。Azaza等[25]研究也發現,水溫為30℃時,尼羅羅非魚的生長速率高于水溫為34℃時的。鹽度為18時,羅非魚的生長與飼料效率低于鹽度較低時的。不同的魚類,鹽度對其的影響有較大差異,如,平鯛(Cichlasoma urophthalmus)[26]在鹽度較高(30)時,生長與飼料效率較高;而金頭鯛[27]與大菱鲆[28]在鹽度為14—28時,生長與飼料效率較高。鹽度對魚類的生長與飼料效率的影響可能與其自身的滲透壓平衡調節有關[10]。通常,在等滲點附近,魚類的代謝水平較高。Sparks等[29]和王輝等[30]研究也發現,羅非魚在低鹽環境中的日常代謝率顯著高于海水中的。在魚類中,滲透壓調節所需的能量占代謝能中的比例較大,往往需要消耗總能量的20%以上甚至高于50%[31]。因此,當羅非魚遠離等滲點時,能量代謝受到抑制,同時,滲透調節又消耗了大量能量,用于生長的能量將減少。鹽度為7—9時可能更接近于羅非魚的等滲點。此時,調節滲透壓平衡所需的能量較少,更多能量用于生長需求[32-33]。
3.4 溫度與鹽度互作效應對吉富羅非魚生長、飼料效率及血清IGF-I的影響
本試驗中,在溫度與鹽度對吉富羅非魚特定生長率、飼料效率和血清IGF-I的研究中未發現互作效應,這與強俊等[34]的結論有所不同。強俊等[34]認為,溫度與鹽度對羅非魚的特定生長率有互作效應。Watanabe等[35]也研究發現,不同鹽度下,溫度對紅羅非魚生長和攝食的影響不同,鹽度為0時,飼料消耗與生長在溫度為27℃較高;而鹽度為18和36時,飼料消耗與生長在溫度為32℃時最高。可能是由于試驗所選取的試驗用魚規格不同。本試驗中,羅非魚的初始體重為27.64 g,高于強俊等[34]的試驗中所采用的6.29 g和Watanabe等[35]的0.56—1.2 g。隨著魚體規格的增加,羅非魚對鹽度的適應能力可能有所提高。同時,本試驗中發現,溫度對羅非魚生長、飼料效率和IGF-I的影響較鹽度明顯。因此,本試驗未發現互作效應的原因可能來自兩個方面:(1)羅非魚屬于亞熱帶魚類,溫度的主效應影響較強,主效應可能對互作效應有屏蔽作用;(2)在鹽度0—18時,鹽度對本試驗中吉富羅非魚幼魚的飼料效率沒有顯著影響,羅非魚對鹽度的耐受性可能隨著生長發育而提高。
本試驗中,利用響應曲面方法首次發現,溫度與鹽度的二次效應對特定生長率、飼料效率和血清IGF-I有極顯著影響。這在實際生產中有較高的應用價值。采用Montgomey[36]的方法,對特定生長率和飼料效率進行優化。溫度和鹽度分別為28.5℃和8.4時,特定生長率和飼料效率分別為2.29%/d和0.82,其可靠性達0.937。建議按照此組合安排羅非魚生產,提高羅非魚的養殖效益。同時,應該注意的是其它環境因子(如:酸堿度、溶氧、光照等)和營養狀況,可能對羅非魚的鹽度馴化與代謝水平存在影響,需要進一步研究。
[1] Fiess J C,KunkelPatterson A,Mathias L,Riley L G,Yancey P H,Hirano T,Grau E G.Effects of environmental salinity and temperature on osmoregulatory ability,organic osmolytes,and plasma hormone profiles in the Mozambique tilapia(Oreochromis mossambicus).Comparative Biochemistry and Physiology,2007,146(2):252-264.
[2] Sun Y,Zhang B,Guo X W,Wang J,Tang Q S.Effects of temperature on energy budget of Sparus macrocephalus.Acta Ecologica Sinica,2001,21(2):186-190.
[3] Likongwe J S,Stecko T D,Stauffer Jr J R,Carline R F.Combined effects of water temperature and salinity on growth and feed utilization of juvenile Nile tilapia Oreochromis niloticus(Linneaus).Aquaculture,1996,146(1/2):37-46.
[4] Morgan J D,Iwama G K.Effects of salinity on growth,metabolism,and ion regulation in juvenile rainbow and steelhead trout(Oncorhynchus mykiss)and fall chinook salmon(Oncorhynchus tshawytscha).Canadian Journal of Fisheries and Aquatic Sciences,1991,48(11):2083-2094.
[5] Imsland A K,Gunnarsson S,Foss A,Stefansson S O.Gill Na+,K+-ATPase activity,plasma chloride and osmolality in juvenile turbot(Scophthalmus maximus)reared at different temperatures and salinities.Aquaculture,2003,218(1/4):671-683.
[6] Beckman B R,Shimizu M,Gadberry B A,Parkins P J,Cooper K A.The effect of temperature change on the relations among plasma IGF-I,41-kDa IGFBP,and growth rate in postsmolt coho salmon.Aquaculture,2004,241(1/4):601-619.
[7] Planas J V,Méndez E,Ba?os N,Capilla E,Navarro I,Gutiérrez J.Insulin and IGF-1 receptors in trout adipose tissue are physiologically regulated by circulating hormone levels.The Journal of Experimental Biology,2000,203(Pt 7):1153-1159.
[8] Cameron C,Moccia R,Azevedo P A,Leatherland J F.Effect of diet and ration on the relationship between plasma GH and IGF-1 concentrations in Arctic charr,Salvelinus alpinus(L.).Aquaculture Research,2007,38(8):877-886.
[9] Jiang J F,Zhang D,Qiu L,Lin H,Jiang S.Research on assessing effects of diets of mud carp(Cirrhinus molitorella)using IGF-I mRNA expression level.South China Fisheries Science,2010,6(2):66-72.
[10] Imsland A K,Bj?rnsson B T,Gunnarsson S,Foss A,Stefansson S O.Temperature and salinity effects on plasma insulin-like growth factor-I concentrations and growth in juvenile turbot(Scophthalmus maximus).Aquaculture,2007,271(1/4):546-552.
[11] Taylor J F,Porter M J R,Bromage N R,Migaud H.Relationships between environmental changes,maturity,growth rate and plasma insulin-like growth factor-i(IGF-I)in female rainbow trout.General and Comparative Endocrinology,2008,155(2):257-270.
[12] Cruz E M V,Brown C L.Influence of the photoperiod on growth rate and insulin-like growth factor-I gene expression in Nile tilapia Oreochromis niloticus.Journal of Fish Biology,2009,75(1):130-141.
[13] Mingarro M,Vega-Rubin de Celis S,Astola A,Pendon C,Valdivia M M,Perez-Sanchez J.Endocrine mediators of seasonal growth in gilthead sea bream(Sparus aurata):the growth hormone and somatolactin paradigm.General and Comparative Endocrinology,2002,128(2):102-111.
[14] Gabillard J C,Weil C,Rescan P Y,Navarro I,Gutiérrez J,Le Bail P Y.Effects of environmental temperature on IGF1,IGF2,and IGF type I receptor expression in rainbow trout(Oncorhynchus myskiss).General and Comparative Endocrinology,2003,133(2):233-242.
[15] Uchida K,Kajimura S,Riley L G,Hirano T,Aida K,Grau E G.Effects of fasting on growth hormone/insulin-like growth factor-I axis in the tilapia,Oreochromis mossambicus.Comparative Biochemistry and Physiology,2003,134(2):429-439.
[16] Pierce A L,Beckman B R,Schearer K D,Larsen D A,Dickhoff W W.Effects of ration on somatotropic hormones and growth in coho salmon.Comparative Biochemistry and Physiology,2001,128(2):255-264.
[17] Tsai I P,Madsen S S,Stephen D M.A howard bern endocrine control of cartilage growth in coho salmon:GH influence in vivo on the response to IGF-I in vitro.Zoological Science,1994,11:299-303.
[18] Shepherd B S,Drennon K,Johnson J,Nichols J W,Playle R C,Singer T D,Vijayan M M.Salinity acclimation affects the somatotropic axis in rainbow trout.American Journal of Physiology,2005,288(5):R1385-R1395.
[19] Sakamoto T,Hirano T.Expression of insulin-like growth factor I gene in osmoregulatory organs during seawater adaptation of the salmonid fish:possible mode of osmoregulatory action of growth hormone.Proceedings of the National Academy of Sciences,1993,90(5):1912-1916.
[20] McCormick S D.Endocrine control of osmoregulation in teleost fish.American Zoologist,2001,41(4):781-794.
[21] Duan C.Nutritional and developmental regulation of insulin-like growth factors in fish.Journal of Nutrition 1998,128(2):306-314.
[22] Dickhoff W W,Beckman B R,Larsen D A,Duan C,Moriyama S.The role of growth in endocrine regulation of salmon smoltification.Fish Physiology and Biochemistry,1997,17(1/6):231-236.
[23] Reinecke M,Bj?rnsson B Th,Dickhoff W W,McCormick S D,Navarro I,Power D M,Gutiérrez J.Growth hormone and insulin-like growth factors in fish:where we are and where to go.General and Comparative Endocrinology,2005,142(1/2):20-24.
[24] Musuka C G,Likongwe J S,Kang′ombe J,Jere W W L,Mtethiwa A H.The Effect of Dietary Protein and Water Temperatures on Performance of T.rendalli Juveniles Reared in Indoor Tanks.Pakistan Journal of Nutrition,2009,8(10):1526-1531.
[25] Azaza M S,Dhraief M N,Kra?em M M.Effects of water temperature on growth and sex ratio of juvenile Nile Tilapia Oreochromis niloticus(Linneaus)reared in geothermal waters in southern Tunisia.Journal of Thermal Biology,2007,192:132-145.
[26] Martinez-Palacios C A,Rossb L G,Rosado-Vallado M.The effects of salinity on the survival and growth of juvenile Cichlasoma urophthalmus.Aquaculture,1990,91(1/6):65-75.
[27] Conides A J,Parpoura A R,Fotis G.Study on the effects of salinity on the fry of the euryhaline species gilthead sea bream(Sparus aurata L.1758).Journal of Aquaculture in the Tropics,1997,12(4):297-303.
[28] Imsland A K,Foss A,Gunnarsson S,Berntssen M,FitzGerald R,Wendelaar Bonga S E,Van Ham E,N?vdal G,Stefansson S O.The interaction of temperature and salinity on growth and food conversion in juvenile turbot(Scophthalmus maximus).Aquaculture,2001,198(3/4):353-367.
[29] Sparks R T,Shepherd B S,Ron B,Richman N H,Riley L G,Iwama G K,Hirano T,Grau E G.Combined effect of temperature and salinity on energy metabolism of gift Nile tilapia(Oreochromis niloticus)juveniles.Journal of Fishery Sciences of China,2003,136(1):657-665.
[30] Wang H,Qiang J,Wang H Z,Xu P,Li R W.Combined effect of temperature and salinity on energy metabolism of GIFT Nile tilapia(Oreochromis niloticus)juveniles.Journal of Fishery Sciences of China,2012,19(1):51-61.
[31] Boef G,Payan P.How should salinity influence fish growth?Comparative Biochemistry and Physiology,2001,130(4):411-423.
[32] Wang H Z,Wang H,Qiang J,Xu P,Li R W.Combined effect of temperature and salinity on the Na+-K+-ATPase activity from the gill of GIFT tilapia juveniles(Oreochromis niloticus).Acta Ecologica Sinica,2012,32(3):898-906.
[33] Li Z M,Liu Z G,Yao R,Luo C J,Yan J F.Effect of temperature and salinity on the survival and growth of Meretrix lyrata juveniles.Acta Ecologica Sinica,2010,30(13):3406-3413.
[34] Qiang J,Ren H T,Xu P,He J,Li R W.Synergistic effects of water temperature and salinity on the growth and liver antioxidant enzyme activities of juvenile.Chinese Journal of Applied Ecology,2012,23(1):255-263.
[35] Watanabe W O,Ernst D H,Chasar M P,Wicklund R I,Olla B L.The effects of temperature and salinity on growth and feed utilization of juvenile,sex-reversed male Florida red tilapia cultured in a recirculating system.Aquaculture,1993,112(4):309-320.
[36] Montgomery D C.Design and Analysis of Experiments.6th ed.New York:John Wiley& Sons,2005:405-444.
參考文獻:
[2] 孫耀,張波,郭學武,王俊,唐啟升.溫度對黑鯛(Sparus macrocephalus)能量收支的影響.生態學報,2001,21(2):186-190.
[9] 姜巨峰,張殿昌,邱麗華,林黑著,江世貴.用IGF-ImRNA表達量評價鯪飼料配方效果的研究.南方水產,2010,6(2):66-72.
[30] 王輝,強俊,王海貞,徐跑,李瑞偉.溫度與鹽度對吉富品系尼羅羅非魚幼魚能量代謝的聯合效應.中國水產科學,2012,19(1):51-61.
[32] 王海貞,王輝,強俊,徐跑,李瑞偉.溫度和鹽度對吉富品系尼羅羅非魚幼魚鰓Na+-K+-ATPase活力的聯合效應.生態學報,2012,32(3):898-906.
[33] 栗志民,劉志剛,姚茹,駱城金,顏俊飛.溫度和鹽度對皺肋文蛤幼貝存活與生長的影響.生態學報,2010,30(13):3406-3413.
[34] 強俊,任洪濤,徐跑,何杰,李瑞偉.溫度與鹽度對吉富品系尼羅羅非魚幼魚生長和肝臟抗氧化酶活力的協同影響.應用生態學報,2012,23(1):255-263.

