回歸·整合·拓展——例談高三復習中關于教材使用的思考
馬娟娟
(江蘇省宜興市第一中學 江蘇 宜興 214206)
教材是教學、復習、備考的依托。 在新課程背景下,高三化學復習對教材的使用應持怎樣的策略才能將教材的作用發揮到極致? 下面以“工業生產中除雜質鐵”為例,結合教材內容、習題以及高考試題加以闡釋。
一、回歸教材 明確目標
蘇教版第一次提及處理廢水中的Fe2+是在《化學1》(2009 年6 月版)76 頁。 只有如下簡單文字:“為除去廢水中的Fe2+,常先將廢水中的Fe2+氧化成Fe3+,再調節溶液的pH 使Fe3+轉化為紅褐色的Fe(OH)3沉淀析出。 ”
對以上教學內容,該向學生提出怎樣的學習要求?
例1.(蘇教版教材86 頁第9 題)化學實驗室產生的廢液中含有大量會污染環境的物質, 為了保護環境,化學實驗室產生的廢液必須經處理后才能排放。 某化學實驗室產生的廢液中含有Fe3+、Cu2+、Ag+三種金屬離子,實驗室設計了下列方案對廢液進行處理, 以回收金屬,保護環境。
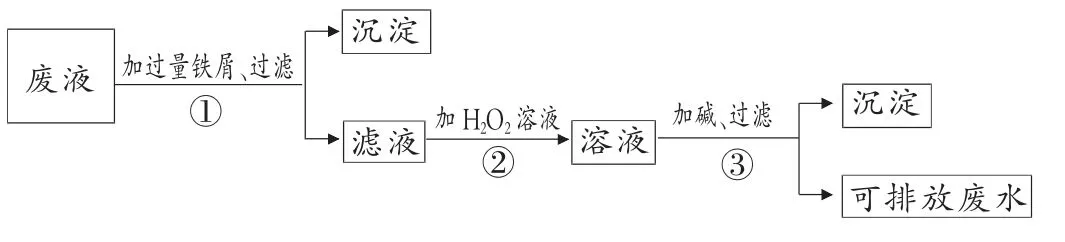
(1)廢液經操作①得到的沉淀中含有的金屬單質是__________。
(2)在操作②中觀察到的實驗現象是_______。
(3)操作③中發生反應的離子方程式為_______。試題簡評:試題以書本中鐵的知識為載體,考查了廢水中除去Fe2+的原理和不活潑金屬的制取原理以及氧化還原反應的知識。 較好地體現了課標和教材在《化學1》對該部分內容的雙基要求,給學生明確了學習目標。
答案:(1)Fe、Cu、Ag (2)溶液由淺綠色變為棕黃色(3)Fe3++3OH-=Fe(OH)3↓
后來在《化學反應原理》(2009 年7 月版)92 頁,較詳細地敘述了除雜的過程:“在無機化合物的制備和提純、廢水處理等領域中,常利用生成沉淀來達到分離或除去某些離子的目的。 例如,除去硫酸銅溶液中混有的少量鐵離子, 可向溶液中加入氫氧化銅或堿式碳酸銅,調節溶液的pH 至3~4, 鐵離子就會全部轉化為氫氧化鐵沉淀除去。 ”

雖然氫氧化銅也難溶于水,但氫氧化鐵的溶解度比氫氧化銅小得多,當溶液的pH 超過5 時,銅離子才開始轉化為氫氧化銅沉淀。 因此,我們可以通過控制溶液的pH,達到除去鐵離子而讓銅離子保留在溶液中的目的。
教學思考:教材編寫的依據是課程標準,必修與選修的教材對內容要求的深度和廣度都不同,必修教材只是讓學生明白這一除雜的方法,而選修教材中則通過KSP對pH 的具體計算提出了要求, 符合學生的認知特點和循序漸進的原則。 教學中教師要重視教材,回歸教材,并依據課程標準給學生提出明確的學習目標,將雙基落到實處。
二、整合教材 歸納提高
重視教材,絕不是把課本當“圣經”,教學時不必拘泥于教材,要善于進行歸納總結,將教材進行整合,創造性地使用教材,這就是本次課改提倡的“不是教教材,而是用教材教”的真正意圖。
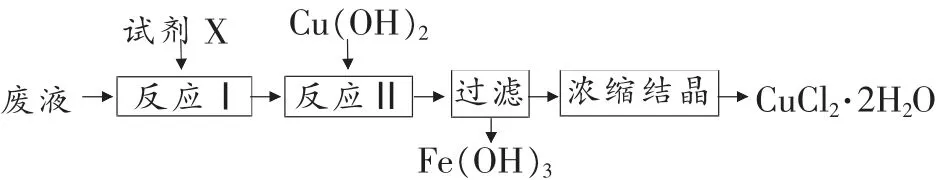
例2 (南京市2012-2013 學年高三年級學情調研卷
改編) 從生產印刷電路板(生產原理:2FeCl3+Cu=2FeCl2+CuCl2)的廢液中提取CuCl2·2H2O 晶體。 實驗流程如下:
室溫下,相關物質的溶度積常數如下表:

?
(1) 上述流程中試劑X 可以選用_______(填化學式)。 反應Ⅱ調節溶液的pH 為4.0, 此時溶液中的c(Fe3+)=_______。
(2)如何證明反應Ⅱ中沉淀已完全?_______。
(3)沉淀過濾后,用蒸餾水洗滌,檢驗沉淀是否洗滌干凈的方法_______。
(4)“濃縮結晶”須在低溫下進行,其原因是_______。
試題簡評:試題仍以書本中鐵的知識為載體,不僅考查了廢水中除去Fe2+、Fe3+的原理和氧化還原反應的知識,同時考查了KSP計算和沉淀洗滌、結晶、Fe3+的檢驗等實驗的相關知識。
答案:(1)Cl2或H2O24.0×10-8mol·L-1(2)靜置,取上層清液少量于試管中,滴加KSCN 溶液,若沒有出現血紅色,說明沉淀已完全。 (3)取最后一次洗滌液少許于試管中,滴入硝酸酸化的硝酸銀溶液,若無白色沉淀生成,則沉淀洗滌干凈。 (4)抑制CuCl2水解
教學思考:雖然在《化學1》和《化學反應原理》有關“工業生產中除雜質鐵”中,并未涉及Fe3+的檢驗、沉淀洗滌、結晶等實驗知識,但是這些都是《化學1》中重要的知識點。 因此,教學時不能局限于教材,要通過歸納總結,不斷地對教材進行加工和重新組合,提升學生運用知識解決問題的能力。
三、拓展教材 凸顯能力
教師充分利用教材提供的資源,挖掘教材蘊含的培養學生思維、能力等方面的因素,對教材的內容進行拓展、延伸。 顯然,這樣不是“照搬教材”,而是“活用教材”。 很多時候,在一些典型素材上,只要再挖掘得深一點、聯系得廣一些,教材的價值就更豐富。 真是“材不在多,用透則靈。 ”
例3.(2010 年福建卷24 題)硫酸鋅可作為食品鋅強化劑的原料。 工業上常用菱鋅礦生產硫酸鋅,菱鋅礦的主要成分是ZnCO3, 并含少量的Fe2O3、FeCO3MgO、CaO等,生產工藝流程示意如下:
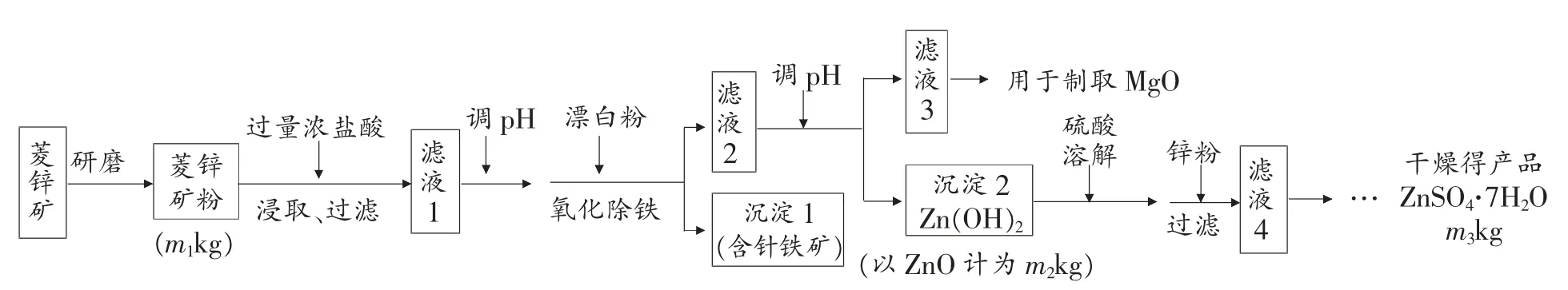
(1)將菱鋅礦研磨成粉的目的是______________。
(2)完成“氧化除鐵”步驟中反應的離子方程式:

(3) 針鐵礦(Goethite)是以德國詩人歌德(Goethe)名字命名的,組成元素是Fe、O 和H,化學式量為89,化學式是_______。
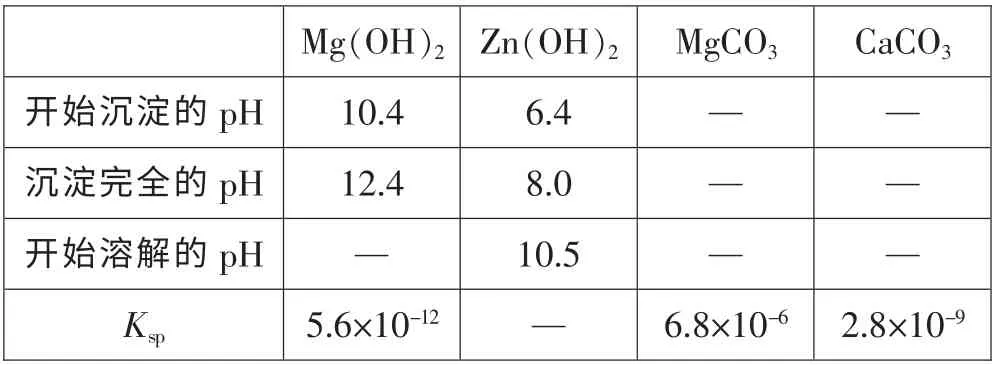
(4) 根據下表數據,調節“濾液2”的pH 時,理論上可選用的最大區間為_______。
?
(5) 工業上從“濾液3”制取MgO 過程中,合適的反應物是_________(選填序號)。
a. 大理石粉 b. 石灰乳 c. 純堿溶液 d. 燒堿溶液
(6) “濾液4”之后的操作依次為_________、_________________________、過濾,洗滌,干燥。
(7) 分析圖中數據,菱鋅礦粉中ZnCO3的質量分數不低于_________________________。
試題簡評:試題在傳統“工業生產除雜質鐵”的基礎上,超越了教材的信息,考查了鎂、鈣等雜質的處理,同時考查了鋅離子沉淀的pH 的選擇范圍。 乍一看是覺得無從入手,細細品味后卻似曾相識。
答案:(1) 增大反應物接觸面積或增大反應速率或使反應更充分;(2)22 Fe(OH)2+11ClO-+11H2O=22 Fe (OH)3+11Cl-;(3)FeO(OH);(4)8.0<pH<10.4;(5)b 或d;(6)蒸發濃縮 冷卻結晶;(7)125m2/81m1
教學思考:在新課程背景下,能力考查成為高考的重點,高考化學試題依據課程標準,遵循考試說明,超越了教材素材。 “拓展教材”不是增加教材的知識點,增加學生學習的難度,而是通過分析、類比的方法,找出拓展知識與教材知識之間的聯系與區別,實現知識的遷移運用,從而凸顯學生的能力。
綜上所述,教材不是教師教和學生學的“枷鎖”,而是“跳板”。教師在高三復習過程中,不能脫離教材,要依據課程標準的理念,認真解讀教材,把握教材內涵,回歸教材,對教材有效地重新整合與適度地拓展延伸。
[1] 祁學俊,朱懷義.尊重與豐富 拓展與超越——例談高三復習中對教材的應用[J].中學化學教學參考,2010,(1~2):55-57
[2] 王祖浩.普通高中課程標準實驗教科書·化學1[M].南京:江蘇教育出版社,2009:76,86
[3] 王祖浩. 普通高中課程標準實驗教科書·化學反應原理[M].南京:江蘇教育出版社,2009:92

