涉及病歷記錄及生物標本研究的倫理審查問題*
汪秀琴
(南京醫科大學第一附屬醫院科技處,江蘇 南京 210029,xiuqinw@126.com)
涉及病歷記錄及生物標本研究的倫理審查問題*
汪秀琴
(南京醫科大學第一附屬醫院科技處,江蘇 南京 210029,xiuqinw@126.com)
介紹了針對涉及病歷記錄及生物標本研究的倫理審查的不同方式,并對相關定義進行了說明,對是否屬于涉及人的研究進行了分析。在此基礎上提出,為了合理地保護受試者的權益,同時又不給研究者和倫理委員會自身增加不必要的負擔,根據國際上的相關做法,可以基于研究的風險大小,對涉及病歷記錄或生物標本的研究,采取免除倫理審查與快速審查不同的倫理審查與管理方式。
生物標本研究;病歷記錄研究;倫理審查;倫理委員會;審查方式
1 不同的倫理審查方式
隨著涉及人體研究倫理審查不斷與國際接軌,涉及病歷記錄以及生物標本的研究已經進入倫理委員會的審查范圍。國家衛生和計劃生育委員會2013年9月頒布的《涉及人的生物醫學研究倫理審查辦法(征求意見稿)》的第三條“本辦法所稱涉及人的生物醫學研究和相關技術應包括以下活動”已經增加了“采用流行病學、社會學、管理學等方法收集、記錄、引用、報告或儲存有關人的樣本、醫療記錄、行為、思想、意見等科學研究資料的活動。”相對于創新藥物臨床試驗等干預性研究來說,大多數的涉及患者生物樣本或醫療記錄的研究風險相對較小,如何對此類研究進行恰當的倫理審查與管理,既合理地保護受試者的權益,又不給研究者和倫理委員會自身增加不必要的負擔,本文參考國際上相關做法,結合我國實際,建議采用以下不同的審查與管理方式。
倫理委員會的主要任務是確保受試者的權益與安全的保護,同時,倫理委員會也承擔著促進研究健康發展的職責。合理的倫理審查應該既滿足受試者保護的要求,同時也應減少對研究者的不必要的負擔,提高工作效率。目前,國際上對當前的人體研究受試者保護的效率與效果存在批評,[1-5]有人認為倫理審查關注文字工作(paper work),沒有注重實質性保護,倫理審查給研究的開展造成了耽擱與負擔,目前的倫理審查模式沒能適應科學技術快速發展及日益復雜化的趨勢。美國健康與人類服務部正在著手對受試者保護聯邦法規進行修改,[6]法規修改有兩個主要任務,一是提高受試者保護體系的效率,減少對研究開展的負擔與耽擱;二是加強法規對受試者的保護作用。因此,我們在發展過程中應注意避免重蹈覆轍。
倫理審查是基于風險的管理,對于風險大的研究,管理的強度就大。比如,風險高的研究,需要倫理委員會全體會議進行審查,對研究的跟蹤審查的頻率就短,比如每3個月提交研究進展報告給倫理委員會;而對于風險小的研究,管理的強度就小,比如對于涉及最小風險的研究,可以由1~2名委員進行快速審查,無需倫理委員會全體會議審查,跟蹤審查的頻率也長,比如1年提交1次研究進展報告;還有一些幾乎沒有風險的研究,則可以免除倫理審查。這樣做的目的是在達到保護受試者效果的前提下,減少研究者的負擔,也減輕倫理委員會自身的工作壓力。根據研究風險的不同,美國OHRP對涉及人的研究的倫理審查進行分類管理,規定有些研究無需提交倫理委員會審查,即可以免除審查(Exemption),有些研究可以進行快速審查(Expedited Review),有些研究則需要會議審查(Board Meeting Review)。參考美國的做法對于涉及病歷記錄以及生物標本的研究,可以根據研究的風險等級,采取不同的倫理審查與管理方式。
2 相關定義
為了對涉及人的生物樣本或醫療記錄的研究進行恰當的倫理審查與管理,需要對此類研究進行明確定義與分類,根據國際慣例,倫理審查的范圍應該是涉及人體受試者的研究包括對于識別身份的人體材料和數據進行的研究。參考美國45CFR46法規,[7]筆者對有關名詞定義如下。①研究:是指系統性的調查,包括研究開發、測試以及評價,目的在于發展可普遍化知識。本定義具有三個要素:一是“系統性的調查”,即不是偶然或隨機的觀察;二是“發現或促進發展的目的”,指是有目的的事件,無計劃、無目的的單純數據采集不屬于研究,當然,無計劃、無目的方式采集的數據將來也可能被用于研究;三是“可普遍化知識”,這是進行推廣應用的基礎,系統地分析很多案例,旨在發現支持同一理論的共同因素或原則。因此,凡是滿足該定義的活動就是研究,不管這些活動是否獲得項目經費的支持。②人體受試者:是指研究者針對活的個體開展研究,以獲得通過對個體進行干預或互動而獲得的數據,或者可識別身份的私人信息。這些活的個體就是人體受試者。死亡的個體不是人體受試者,但是如果死者的信息揭示了其活著的親屬的信息,后者就可能是人體受試者;從個體身上獲得的與其本人無關的信息,這些個體也不是“人體受試者”。③私人信息(Private Information):包括個人預期在不被觀察或記錄情況下發生的行為信息,以及個人因特定目的而提供、且合理預期不被公開的信息。比如,通過竊聽或秘密記錄的信息就是私人信息;醫療記錄、學習記錄、貸款申請就屬于因特定目的而提供,合理預期不被公開的信息。在涉及人的研究中涉及的私人信息,一般都是可識別身份的私人信息。
3 是否屬于涉及人的研究
借鑒美國的規定,“涉及人體受試者的研究”是指同時滿足“涉及人體受試者”以及“研究”這兩個定義的活動,這樣的活動才需要提交倫理委員會。[7]確定一項活動是否為涉及人體受試者的研究,需要回答兩個問題:①該活動是否涉及“研究”?注冊藥物臨床試驗、醫療器械臨床試驗以及根據科研主管部門下達課題批文開展的研究,甚至研究者自主開展的課題研究,毫無疑問都屬于“研究”的范疇。這些活動都是針對某個科學問題,事先設計一個研究方案,規定相應的納入、排除標準,實施研究干預,排除可能影響研究結果的混雜因素,最后進行數據統計分析,得出研究結論,可以進行推廣應用。這樣的活動,就滿足研究定義中“系統性的調查”“發現或促進發展的目的”“可普遍化知識”這三個要素。然而,有一些政府公益項目與示范項目,雖然也有政府部門的批文,也是根據一定的方案去執行,但是其目的是為了推廣某項新技術,其結果并不在于得出“可普遍化知識”,因此就不屬于“研究”活動。②該活動是否涉及人體受試者?“人體受試者”也有兩個要素,第一個是通過“干預或互動”來收集數據,干預(Intervention)包括以研究為目的,旨在采集數據的身體操作,以及對受試者本人或其環境的操縱或處理。身體操作如靜脈穿刺、采集尿液或者體液標本。操縱或處理受試者或其環境,如給藥、將受試者暴露在陽光下、禁止他們看電視等。互動(Interaction)包括研究者和受試者之間的交流或人際聯系。互動可以是面對面的,如面談調查,或通過電話、信件、互聯網或其他媒體進行,如電話訪談。第二個是獲得可識別身份的私人信息。對這個問題的回答,關注研究者“獲得”的到底是什么非常重要。如果研究者沒有通過與受試者互動或干預而獲取數據,或獲得的不是可識別身份的私人信息,那么該研究活動就不涉及人體受試者。針對上述問題①和②的回答,只要有一個回答是“否”,就無需提交倫理委員會審查,只有兩個問題的回答都為“是”,才需提交倫理委員會審查。涉及人的生物樣本或醫療記錄的研究同樣如此,如果不能同時滿足上述“涉及人體受試者”以及“研究”這兩個定義,那么就不屬于涉及人體受試者的研究,就無需提交倫理委員會審查。
4 免除倫理審查
對于涉及人的生物樣本或醫療記錄的研究,我們可以借鑒美國45 CFR 46.101(b)(4)以及相關文件[8]的規定,對以下研究可以免除倫理審查,即對于現有的數據、文件、記錄、病理標本或診斷標本的收集或研究,如果這些資源是可公開獲得的(Publicly Available),或者研究者是以無法識別受試者的方式記錄信息(直接聯系或通過標識符聯系到受試者)。免除審查的標準涉及以下幾個問題:①“現有的”,也就是說,是否可以免除審查取決于在研究者提交倫理審查的時候,這些病歷記錄、組織標本是否就已經存在了。②可公開獲得的(publicly available),比如來自發表的文章、公開的報告中的數據與信息。③研究者以無法聯系受試者的方式記錄信息。這個要素關注的是研究者如何“記錄”數據或信息的?如果研究者從現有記錄或標本中獲得了可識別受試者身份的私人信息或標本,并且記錄了這些可識別信息,或者記錄了病例編號或生物樣本編碼,這樣就不能免除倫理審查,因為通過連接編碼就能確認出受試者的身份。而如果研究者只記錄比如性別、診斷、治療方法與效果等信息,沒有記錄任何可識別受試者身份的信息,比如姓名、電話、社保號等,也沒有記錄信息或標本編碼,無法將信息與受試者聯系起來,就滿足免除倫理審查的要求。具體決策程序見圖1。
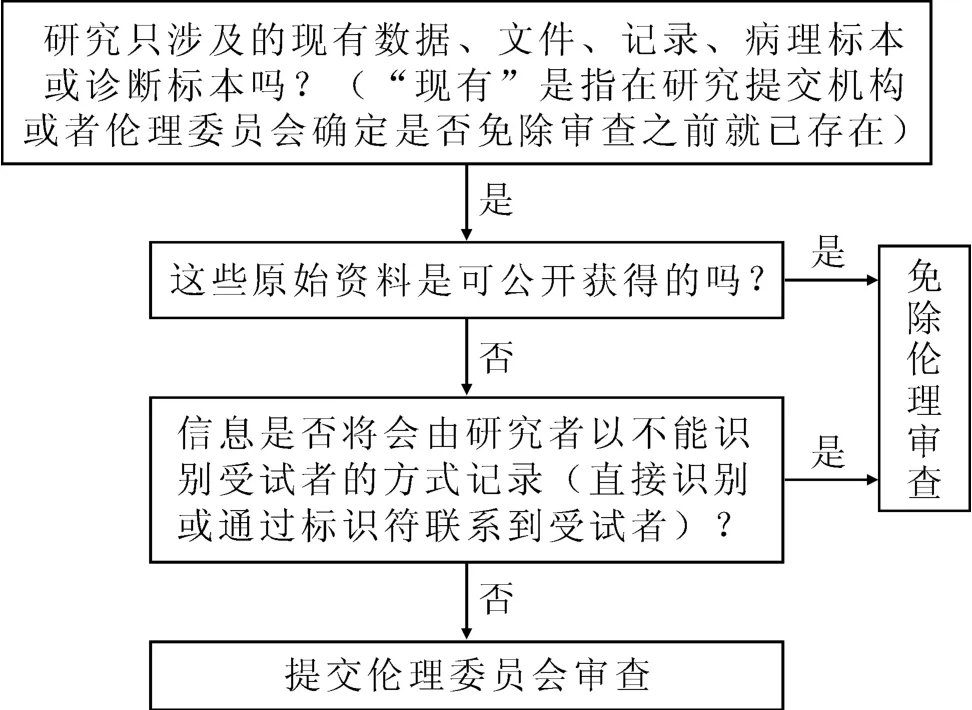
圖1 涉及人的生物樣本或醫療記錄研究是否適用免除審查
對于免除倫理審查的研究,研究者無需提交研究方案給倫理委員會審查,但是,在研究實施過程中,保護受試者的責任是不可推卸的。
5 快速審查
對于需要提交倫理審查的涉及人的生物樣本或醫療記錄的研究,借鑒美國45 CFR 46.110及其關于加快審查的研究分類,[9-10]如果是涉及既往采集材料如數據、文件、記錄或標本等的研究,可以適用快速審查。當然,前提條件是研究對人體受試者的風險不大于最小風險。對于大于最小風險的涉及人的生物樣本或醫療記錄的研究,或者此類研究涉及弱勢群體或敏感問題,那么就不適用于快速審查,而應該采取會議審查的方式。
綜上,任何涉及人的研究都必須提交倫理委員會審查以確保受試者的安全與權益的保護。倫理審查應該關注實質性的保護,應該針對研究風險的等級采用不同的審查方式與管理措施,關鍵是能達到使受試者得到切實保護的效果,同時減少對研究者不必要的負擔。基于此,對于風險較小的涉及人的病歷記錄以及生物標本的研究,可以根據研究的具體情況,采取免除倫理審查、快速審查和會議審查的不同方式。
[1]George Silberman,Katherine L Kahn.Burdens on Research Imposed by Institutional Review Boards:The State of the Evidence and Its Implications for Regulatory Reform[J].Milbank Q,2011,89(4):599-627.
[2]Timothy M,Straight.Clinical research regulation:challenges to the institutional review board system[J].Clinics in Dermatology,2009,27(4):375 -383.
[3]Shalala D.Protecting Research Subjects--What Must Be Done[J].N Engl J Med,2000,343(11):808-810.
[4]Greater oversight urged after human research scandal[EB/OL].http://www.ipsnews.net/2011/ 12/us-greater-oversight-urged-for-human-researchin-wake-of-scandal,2014-02-16.
[5]Human Subjects Research Protections Enhancing Protections for Research Subjects and Reducing Burden,Delay,and Ambiguity for Investigators[EB/OL].http://www.gpo.gov/fdsys/pkg/FR-2011-07-26/pdf/2011-18792.pdf,2014-02-16.
[6]Ezekiel Emanuel J,Menikoff Jerry.Reforming the Regulations Governing Research with Human Subjects[J].N Engl J Med,2011,365(12):1145-1150.
[7]USOHRP.Guidance on Research Involving Coded Private Information or Biological Specimens[Z].U S,2008.
[8]US OHRP.Human Subject Regulations Decision Charts[EB/OL].http://www.hhs.gov/ohrp/policy/checklists/decisioncharts.html,2014-03-10.
[9]USOHRP.Categories of Research thatmay be Reviewed by the Institutional Review Board(IRB)through an Expedited Review[EB/OL].http:// www.hhs.gov/ohrp/policy/expedited98.html,2014-03-10.
[10]汪秀琴,熊寧寧,劉沈林,等.臨床試驗機構倫理委員會操作規程[M].北京:科學出版社,2006:37-42.
Ethical Review of Research Involving M edical Records or Biospecimens
WANG Xiuqin
(Department of Science and Technology,the First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China,E-mail:xiuqinw@126.com)
In this paper,differentmodes and related concepts of ethical review of research involving medical records or biospecimens has been covered and if it is belongs to study involving human was also discussed.In accordance with the international practice,this paper proposed to apply exemption of review or expedited review to research involvingmedical records or biospecimens based on risk of the specific research,with the purpose of protecting human subjects properly,meanwhile lessen the burden for researchers and IRBs themselves.
Research Involving Biospecimens;Research Involving Medical Records;Ethical Review;Ethics Committee;Review Methods
R-052
A
1001-8565(2014)05-0614-03
2014-03-28〕
2014-05-09
〔編 輯 李恩昌〕
科技部“重大新藥創制”科技重大專項(2011ZX09302-003-02);江蘇高校優勢學科建設工程資助項目

