紅曲霉固態發酵產糖化酶及酸性蛋白酶條件的優化
王秋辰,王昌祿,陳勉華,王玉榮,李貞景
(食品營養與安全教育部重點實驗室,天津科技大學食品工程與生物技術學院,天津 300457)
紅曲霉固態發酵產糖化酶及酸性蛋白酶條件的優化
王秋辰,王昌祿,陳勉華,王玉榮,李貞景
(食品營養與安全教育部重點實驗室,天津科技大學食品工程與生物技術學院,天津 300457)
從8株紅曲霉中篩選出紅曲霉MQ7作為高產糖化酶和酸性蛋白酶的供試菌株,采用固態發酵方法測定在不同發酵溫度、底物料液比、大米和麩皮比例條件下的產酶情況.利用正交實驗優化固態發酵產酶過程,確定該菌株產酶最佳發酵條件為:發酵溫度30℃,底物料液比(g∶mL)20∶25,大米麩皮比例(g∶g)17∶3.在此條件下,糖化酶活力達1,641.69U/g,酸性蛋白酶活力達151.09U/g.同時研究了NaCl含量對紅曲霉酶活力的抑制作用,當NaCl質量分數達到18.92%時,紅曲霉MQ7產糖化酶活力下降64.8%,酸性蛋白酶活力下降85.6%.
紅曲霉;面醬;糖化酶;酸性蛋白酶;發酵條件
紅曲是以大米為原料,經紅曲霉(Monascus)發酵制成的一種紫紅色米曲,一直以來被認為具有食用和藥用雙重功效.紅曲中的紅曲色素[1]作為天然、優良的復合型食用色素,可以提供性能穩定、安全性高和品種多樣的天然色素.部分紅曲霉可代謝產生較高的糖化酶、酸性蛋白酶、酯化酶等酶類,在我國釀造微生物行業中占有重要地位,也可用于豆腐、魚蝦等高蛋白食品[2].紅曲中還含有多種藥理活性物質,如Monacolin K能夠治療高膽固醇血癥[3];麥角固醇可防止嬰兒佝僂病,對促進孕婦和老年人鈣、磷的吸收也有明顯的生理作用[4];γ–氨基丁酸是穩定的降血壓活性物質,對低腎素高血壓患者有很好的降血壓效果[5].
面醬是以小麥面粉為主要原料釀制的醬類[6].面醬發酵過程的實質是原料中的淀粉、蛋白質等物質在一定條件下,利用曲霉類微生物分泌的淀粉酶分解為糊精、麥芽糖及葡萄糖.該糖化作用在制曲階段已經開始進行,在醬醅發酵期間更進一步加強.同時,面粉中的少量蛋白質也經曲霉所分泌的蛋白酶的作用將其分解成為各種氨基酸,而使面醬又稍有鮮味,成為具有特殊滋味的產品.
目前,面醬釀造制曲多用米曲霉AS3.042,所產酶系單一,面醬的色、香、味不足.采用多菌種制曲與發酵,可以彌補米曲霉菌種[7]所產生的酶系不全的缺陷,使面醬中各種酶類的比例更趨合理.將紅曲應用于面醬發酵中,利用其糖化酶和酸性蛋白酶活力較高的特點,可優化面醬生產過程中的酶系組成;同時,紅曲霉代謝產生的紅色素能夠彌補面醬色澤偏褐色的缺點;此外,紅曲具有的諸多保健功能對提高面醬出品率、產品質量及附加值具有重要意義.本文對實驗室保藏的部分紅曲霉進行研究,篩選高產糖化酶和酸性蛋白酶紅曲霉,研究紅曲霉固態發酵條件對紅曲產酶的影響,以期為紅曲應用于面醬生產奠定基礎,為改善面醬產品質量提供更多的參考.
1 材料與方法
1.1 材料
1.1.1 菌株與培養基
紅曲霉MQ1、MQ2、MQ3、MQ4、MQ7、MQ8、MQ9、MQ11,天津科技大學食品生物技術實驗室保藏菌種.
斜面培養基(g/L):葡萄糖60,蛋白胨20,硝酸鈉10,硫酸鎂5,磷酸二氫鉀10,瓊脂粉30,121℃滅菌20min.
種子液培養基(g/L):葡萄糖60,蛋白胨20,硝酸鈉10,硫酸鎂5,磷酸二氫鉀10,121℃滅菌20min.
初始發酵培養基:將大米與蒸餾水以1(g)∶1(mL)的比例浸泡過夜,分裝入250mL三角瓶中,每瓶20g原料,20mL蒸餾水,121℃滅菌20min.
1.1.2 試劑與儀器
福林酚試劑,北京索萊寶科技有限公司;麩皮、大米,市售;硫酸鎂、硝酸鈉、冰乙酸、乙酸鈉、乳酸、乳酸鈉、磷酸二氫鉀,分析純,天津市化學試劑一廠.
電子天平,美國雙杰(兄弟)集團有限公司;微電腦控制光照培養箱,珠江廣東省醫療器械廠;迴轉式恒溫調速搖瓶柜,上海欣蕊自動化設備有限公司;電熱鼓風干燥箱,天津市天宇實驗儀器有限公司;電熱恒溫水浴鍋,上海森信實驗儀器有限公司;立式壓力蒸汽滅菌鍋,KAGOSHIMA SEISAKUSHO公司;紫外可見分光光度計,美國安捷倫科技有限公司.
1.2 酶活檢測
糖化酶活力測定采用斐林試劑滴定法,參照GB 8276—2006[8],糖化酶活力單位定義:1g酶粉在40℃、pH 4.6的條件下,1h水解可溶性淀粉產生1mg葡萄糖,即為1個糖化酶活力單位,以U/g表示.
酸性蛋白酶活力測定采用福林酚方法,參照GB/T 23527—2009[9],酸性蛋白酶活力單位定義:1g酶粉在40℃、pH 3.0條件下,1min水解酪蛋白產生1,μg酪氨酸,即為1個酸性蛋白酶活力單位,以U/g表示.
1.3 高產糖化酶和酸性蛋白酶菌種的篩選
將紅曲霉MQ1、MQ2、MQ3、MQ4、MQ7、MQ8、MQ9、MQ11菌種分別接種到新鮮的斜面培養基,30℃培養6~8d后,在紅曲霉菌種斜面中加入5mL已滅菌的種子液培養基,制成孢子懸浮液,接種到裝有100mL種子液培養基的250mL三角瓶中,30℃,180r/min培養24h,得到種子液,調整孢子數為2×106mL-1.將各菌株種子液分別加入已滅菌的初始發酵培養基中,接種量5mL,均勻加入,在30℃恒溫培養箱中培養,從第6天開始每隔24h檢測糖化酶及酸性蛋白酶活力.
1.4 固態發酵條件優化
利用單因素實驗,研究紅曲霉不同發酵溫度、底物料液比(大米和麩皮總質量與蒸餾水體積間的比例)、大米麩皮質量比對糖化酶和酸性蛋白酶活力的影響,并在單因素實驗基礎上,通過L9(34)正交實驗優化固態發酵條件.
1.5 NaCl質量分數對糖化酶和酸性蛋白酶活力的影響
將測定糖化酶和酸性蛋白酶活力所用的乙酸–乙酸鈉緩沖液和乳酸–乳酸鈉緩沖液換成質量分數分別為8.02%、10.15%、12.28%、14.47%、16.67%、18.92%的NaCl溶液,制備樣品稀釋液,比較NaCl質量分數對紅曲霉酶活力的影響.
2 結果與討論
2.1 高產糖化酶及酸性蛋白酶菌種的篩選
按照1.3所述方法篩選高產糖化酶及酸性蛋白酶的紅曲霉菌株,結果見圖1.將各菌株的最大酶活力進行比較,按糖化酶活力排序為MQ7>MQ9>MQ2>MQ1>MQ11>MQ3>MQ8>MQ4,按酸性蛋白酶活力排序為MQ7>MQ9>MQ8>MQ1>MQ11>MQ4>MQ3>MQ2,其中MQ7產糖化酶和酸性蛋白酶活力均最高,因此選擇MQ7作進一步研究.
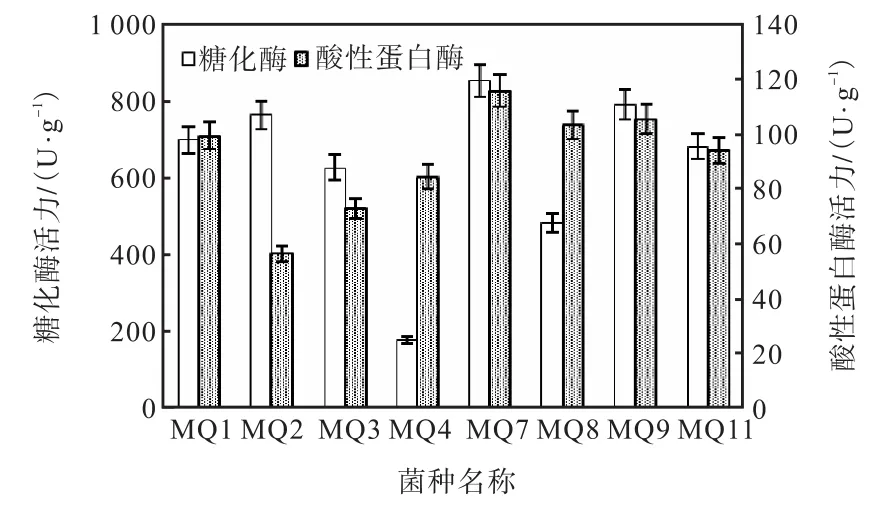
圖1 不同菌株的糖化酶和酸性蛋白酶最大活力對比Fig. 1 Contrast of maximum activities of glucoamylase and acid protease of different strains
2.2 固態發酵條件的優化
2.2.1 發酵溫度對MQ7菌株產酶的影響
在底物料液比20∶20,大米麩皮比例19∶1的條件下發酵7d,研究不同發酵溫度對MQ7菌株產酶活力的影響,結果見圖2.
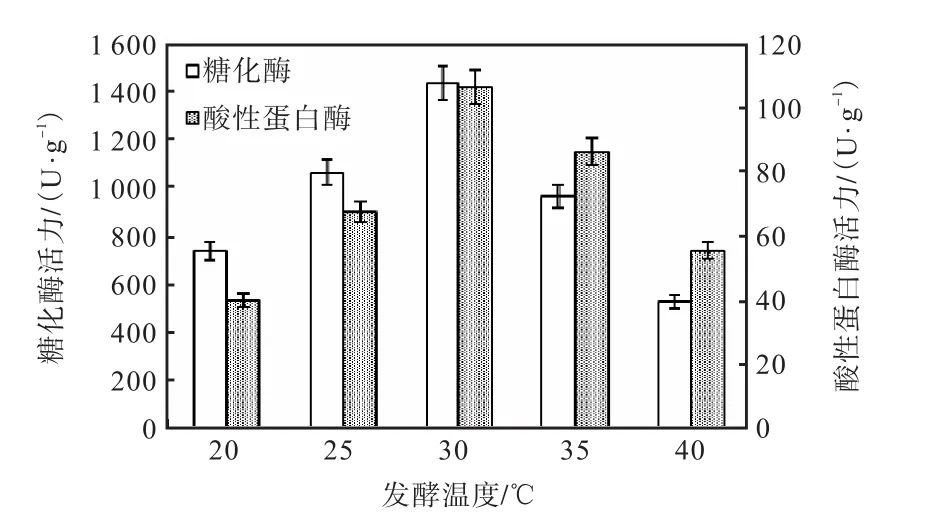
圖2 發酵溫度對MQ7產糖化酶和酸性蛋白酶活力的影響Fig. 2 Effect of fermentation temperature on glucoamylase and acid protease activities of Monascus MQ7
由圖2可見:發酵溫度對紅曲霉MQ7產酶活力有較大影響,在20~30℃范圍內,隨著溫度的升高酶活力逐漸增大,在30℃時MQ7菌株代謝產生的糖化酶和酸性蛋白酶活力最高,分別達到1,432.6U/g和106.6U/g;高于30℃時,酶活逐漸降低,達到40℃時,酶活下降顯著.這是因為溫度過高會抑制酶系充分發揮作用[10],降低產酶活性,并且過高的溫度使得水分蒸發過快,造成紅曲霉在生長過程中逐漸缺水.綜上所述,選擇25、30、35℃作為正交實驗的因素水平.
2.2.2 底物料液比對MQ7菌株產酶的影響
在發酵溫度30℃,大米麩皮比例19∶1條件下發酵7d,研究不同底物料液比對MQ7菌株產酶活力的影響,結果見圖3.
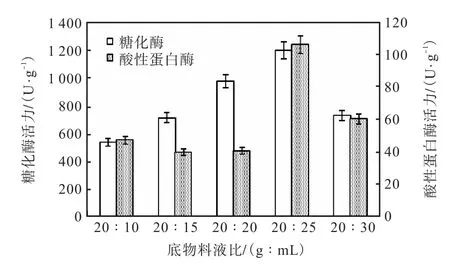
圖3 底物料液比對MQ7產糖化酶和酸性蛋白酶活力的影響Fig. 3Effect of substrate solid-liquid ratio on glucoamylase and acid protease activities of Monascus MQ7
由圖3可見:糖化酶產酶量隨著底物料液比的變化呈現先增后減的趨勢.當底物料液比為20∶25時,紅曲霉MQ7產糖化酶和酸性蛋白酶活力最高,分別達到1,198.3U/g和106.1U/g,相比底物料液比20∶20和20∶30有明顯增長.合理料液比可以使培養基有較好的疏松性[11],增加空氣傳遞,使菌體代謝產生的酶更好地傳輸,提高產物產量.水分含量過低,培養基中后期表面會逐漸干燥,喪失疏松性;水分含量過高,物料黏結,都不利于通風和菌體生長.綜上所述,確定底物料液比20∶20、20∶25、20∶30作為正交實驗的因素水平.
2.2.3 大米麩皮比例對MQ7菌株產酶的影響
在發酵溫度30℃,底物料液比20∶25條件下發酵7d,研究不同大米麩皮比例對MQ7菌株產酶活力的影響,結果見圖4.
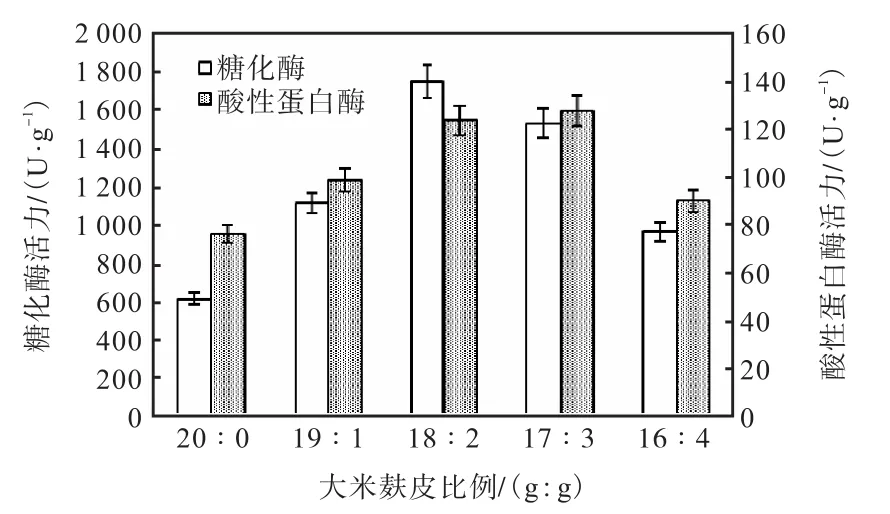
圖4 大米麩皮比例對MQ7產糖化酶和酸性蛋白酶活力的影響Fig. 4Effect of proportion to rice to bran on glucoamylase and acid protease activities of Monascus MQ7
由圖4可見:當大米麩皮比例為18∶2時,紅曲霉MQ7產糖化酶活力最高,達到1,754.4U/g,在大米麩皮比例為17∶3時,紅曲霉MQ7產酸性蛋白酶活力最高,達到127.8U/g.麩皮中含有較多的淀粉、蛋白質、維生素、礦物質等,同時麩皮還能夠保證培養基的疏松程度[12].糖化酶和酸性蛋白酶活力隨大米與麩皮比例的減小而先增高后降低,這可能與大米和麩皮中組分含量不同,導致營養成分利用難易程度不同有關.綜上所述,選擇19∶1、18∶2、17∶3作為正交實驗的因素水平.
2.2.4 正交實驗
在單因素實驗的基礎上,選擇影響產酶活力的發酵溫度(A)、底物料液比(B)、大米麩皮比例(C)3個因素進行L9(34)正交實驗,以糖化酶和酸性蛋白酶活力為指標進行結果分析,考察各因素的影響程度.正交實驗的因素與水平見表1,實驗結果見表2.
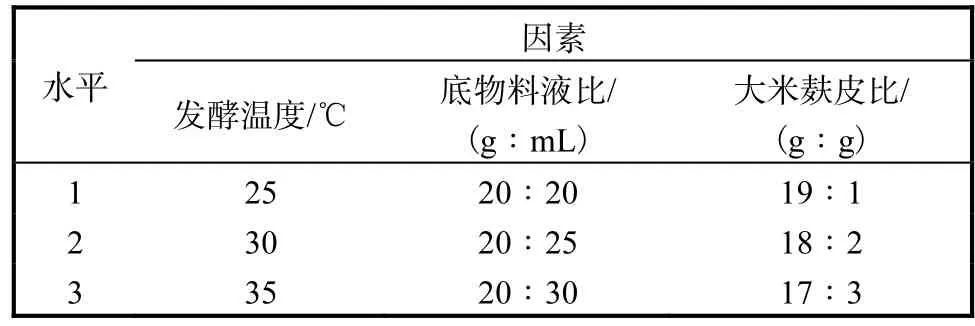
表1 發酵條件優化正交實驗因素與水平Tab. 1Factors and levels of orthogonal experiments for optimization of fermentation
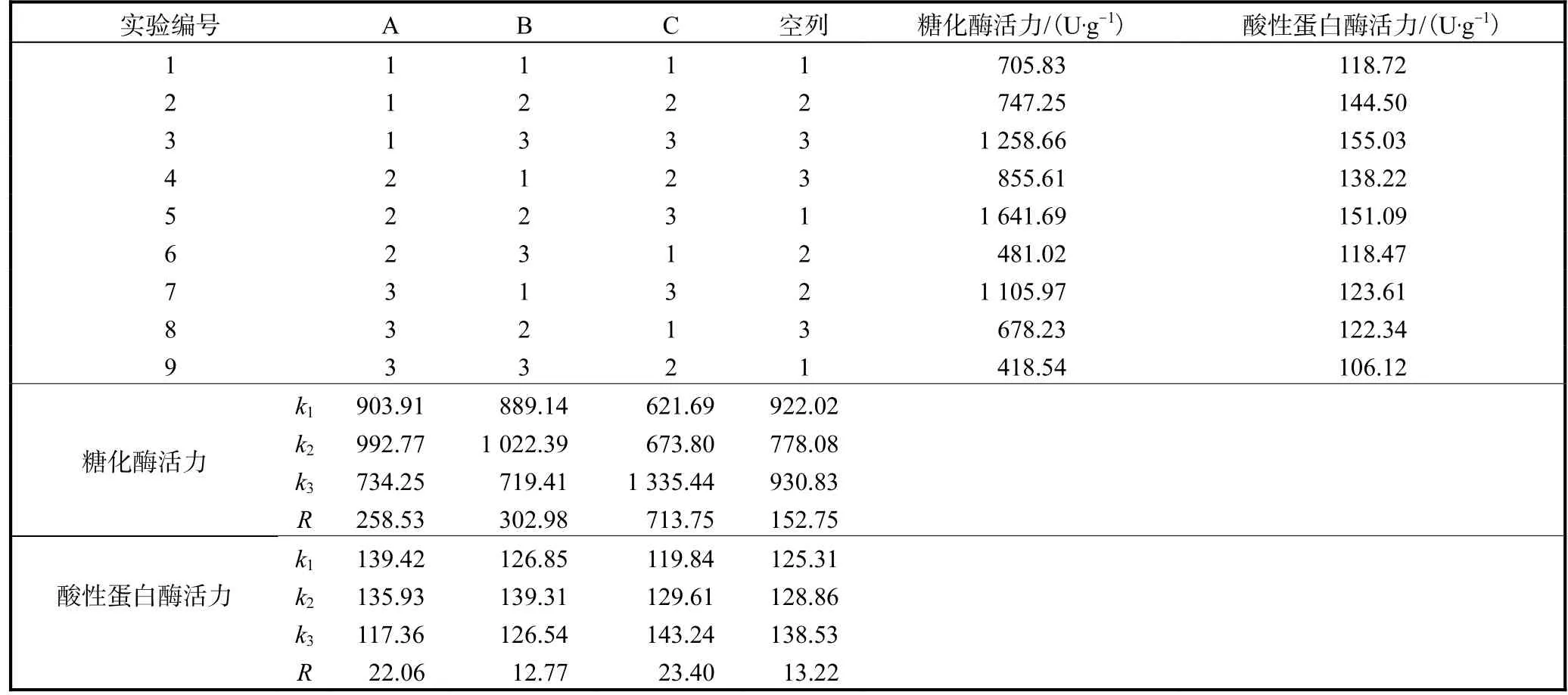
表2 發酵條件優化正交實驗結果Tab. 2 Result of orthogonal experiments for optimization of fermentation
由表2可知,各因素對糖化酶活力影響程度為C>B>A,根據糖化酶活力確定的最優組合為A2B2C3.各因素對酸性蛋白酶活力的影響程度為C>A>B,根據酸性蛋白酶活力確定最優組合為A1B2C3.
通過綜合平衡法[13]確定紅曲霉MQ7固態發酵最佳條件為A2B2C3,即發酵溫度30℃,底物料液比20∶25,大米麩皮比例17∶3.
對表2結果進行方差分析,其結果見表3、表4.
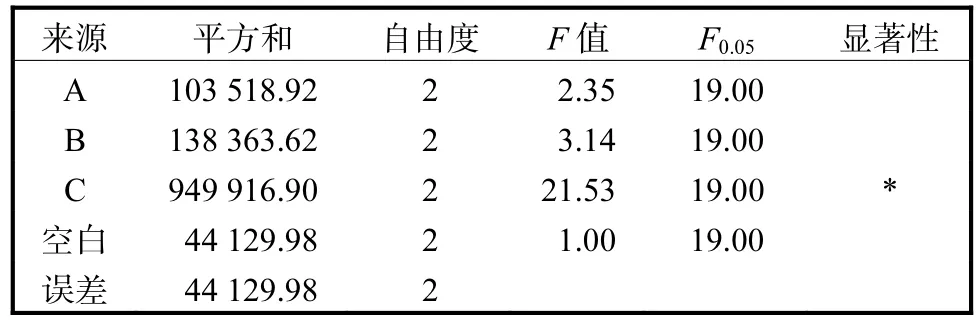
表3 MQ7菌株糖化酶發酵條件優化方差分析Tab. 3 Variance analysis of orthogonal experiments for optimization of glucoamylase
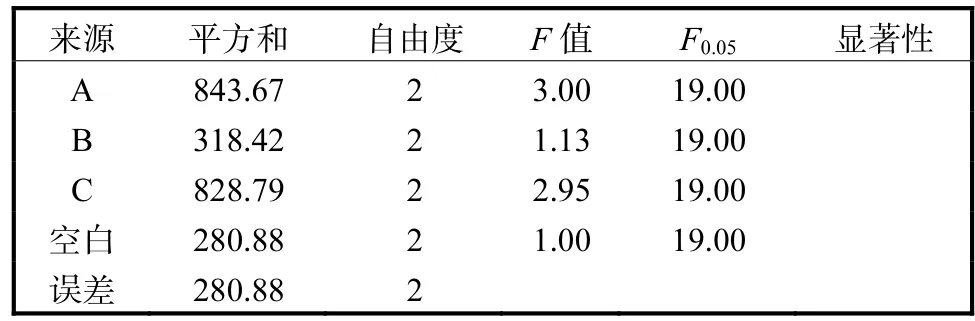
表4 MQ7菌株酸性蛋白酶發酵條件優化方差分析Tab. 4Variance analysis of orthogonal experiments for optimization of protease
由表3可知,在95%的置信區間內,大米麩皮比例對糖化酶活力有顯著影響.
由表4可知,在95%置信區間內,3個因素對酸性蛋白酶活力的影響不顯著,但均對酸性蛋白酶活力有一定影響.
2.2.5 結果驗證
MQ7菌株產酸性蛋白酶的最佳組合A1B2C3并未出現在正交表中,所以在此最佳組合條件下進行3次重復性實驗.結果表明,MQ7菌株產酸性蛋白酶活力分別為155.11、155.32、156.42U/g,平均值為155.62U/g,與實驗組合A2B2C3得到的MQ7菌株代謝產生酸性蛋白酶酶活151.09U/g相差僅3.0%,而實驗組合A2B2C3為MQ7菌株產糖化酶的最優組合,酶活力為1,641.69U/g,因此,選取A2B2C3為正交實驗的最優組合.
2.3 NaCl質量分數對糖化酶和酸性蛋白酶活力的影響
不同質量分數NaCl溶液代替緩沖液對紅曲霉MQ7酶活力的影響見圖5.
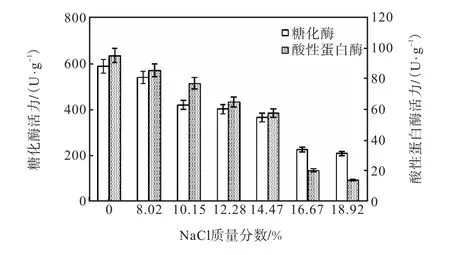
圖5 NaCl質量分數對MQ7產糖化酶和酸性蛋白酶活力的影響Fig. 5 Effect of different concentrations of brine on glucoamylase and protease activities of Monascus MQ7
由圖5可見:隨著NaCl質量分數增加,糖化酶及酸性蛋白酶的酶活均有一定程度的降低.不同NaCl質量分數對酶活降低程度不同,總體來說,NaCl質量分數越高,對酶的抑制作用越大.當NaCl質量分數達到18.92%時,糖化酶活力下降64.8%,酸性蛋白酶活力下降85.6%.糖化酶和蛋白酶活力是鑒定面醬發酵中菌種好壞的重要指標[14],由于面醬發酵中的NaCl主要起著調節口感和防腐作用,因此實際生產中一般控制NaCl質量分數在10%左右,在盡量保證較大酶活力的同時,保證面醬風味,防止腐敗.
3 結 論
本實驗從8株紅曲霉中篩選出高產糖化酶及酸性蛋白酶的MQ7為供試菌株.通過單因素及正交實驗研究紅曲霉MQ7固態發酵過程,確定最佳產糖化酶和酸性蛋白酶培養條件為:發酵溫度30℃,底物料液比(g∶mL)20∶25,大米麩皮比例(g∶g)17∶3.利用NaCl溶液代替緩沖液提取粗酶液,隨NaCl質量分數升高,對酶活力的抑制作用越來越大,在面醬實際生產中考慮口感等因素應控制NaCl質量分數為10%左右.
[1] Pattanagul P,Pinthong R,Phianmongkhol A,et al. Mevinolin,citrinin and pigments of adlay angkak fermented by Monascus sp. [J]. International Journal of Food Microbiology,2008,126(1):20–23.
[2] 王金字,董文賓,楊春紅,等. 紅曲色素的研究及應用新進展[J]. 食品科技,2010,35(1):245–248.
[3] Panda B P,Javed S,Ali M. Optimization of fermentation parameters for higher lovastatin production in red mold rice through co-culture of Monascus purureus and Monascus ruber[J]. Food and Bioprocess Technology,2008,3(3):373–378.
[4] Wang Tianqi,Li Hanxiang,Wang Manyi,et al. Integrative Extraction of Ergostero,(1→3)-α-D-Glucan and Chitosan from Penicillium chrysogenum Mycelia[J]. Chinese Journal of Chemical Engineering,2007,15(5):725–729.
[5] 王啟軍,張東亮,林萍,等. 紅曲在調味品中的應用[J].中國調味品,2008(1):75–78.
[6] 楊煜燦. 醬及醬產品種類探析[J]. 商品與質量:學術觀察,2012(2):291.
[7] 付雯,李冬生,黃紅霞,等. 甜面醬雙菌種制曲工藝條件的研究[J]. 中國調味品,2010,35(10):85–90.
[8] 中華人民共和國國家質量監督檢驗檢疫總局,中國國家標準化管理委員會. GB 8276—2006 食品添加劑·糖化酶制劑[S]. 北京:中國標準出版社,2007.
[9] 中華人民共和國國家質量監督檢驗檢疫總局,中國國家標準化管理委員會. GB/T 23527—2009 蛋白酶制劑[S]. 北京:中國標準出版社,2009.
[10] 李金紅,欒建文. 改進后熟工藝提高醬油風味[J]. 中國釀造,2002(2):28–29.
[11] 戴超,冷云偉. 影響固態發酵的因素及控制策略[J].江蘇調味副食品,2008,25(5):34–35.
[12] 安艷霞,李水蓮,王亞平. 小麥麩皮的功能成分及加工利用現狀[J]. 糧食流通技術,2011(2):41–43.
[13] 陳魁. 應用概率統計[M]. 北京:清華大學出版社,2011:267–270.
[14] 郭繼平,馬鶯. 紫外誘變選育米曲霉高產蛋白酶菌株[J]. 微生物學通報,2007,34(2):246–250.
責任編輯:常濤
Optimization of Fermentation Conditions of Glucoamylase and Acid Protease Production with Monascus in Solid-state Fermentation
WANG Qiuchen,WANG Changlu,CHEN Mianhua,WANG Yurong,LI Zhenjing
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Monascus MQ7 strain was obtained from eight Monascus strains as the highly glucuoamylase and acid protease producing strain. The solid-state fermentation conditions for the glucoamylase and acid protease production with Monascus MQ7 were studied. Based on single factor tests,in different fermentation temperature,substrate solid-liquid ratio,proportion of rice and bran,the glucoamylase and acid protease production conditions were optimized with L9(34)orthogonal test. The results are as follows:the fermentation temperature is 30℃,substrate solid-liquid ratio(g∶mL)20∶25,and the proportion of rice to bran(g∶g)17∶3. Under the above conditions,the glucoamylase activity reached 1,641.69U/g,and the highest acid protease activity reached 151.09U/g. The inhibition of NaCl on enzyme activity was also verified. When the NaCl mass fraction reached 18.92%,Monascus MQ7glucoamylase activity decreased 64.8%,and acid protease activity decreased 85.6%.
Monascus;flour paste;glucoamylase;acid protease;fermentation condition
TS264
A
1672-6510(2014)04-0021-05
10.13364/j.issn.1672-6510.2014.04.005
2013–12–23;
2014–02–27
國家自然科學基金資助項目(31171729)
王秋辰(1988—),女,天津人,碩士研究生;通信作者:王昌祿,教授,clw123@tust.edu.cn.

