烏司他丁對黑火藥煙霧所致吸入性肺損傷大鼠的保護作用以及對IL-1β、TNF-α基因表達的抑制作用
劉一凡,王正冠,唐紅衛,吳小利,謝尹晶,張洪瑞,李登清,王成彬
吸入性肺損傷是指因吸入熱力或化學性刺激物而引起的呼吸道以至肺實質的損害,往往也是導致嚴重全身性病變的重要原因。黑火藥被廣泛應用于軍事和民用方面,如戰爭、演習或煙花爆竹的燃放等,在爆炸、燃燒過程中所釋放的有毒氣體及粉塵顆粒會引發急性吸入性肺損傷,造成肺組織充血、水腫及炎性細胞浸潤等[1-2]。體外研究表明,黑火藥煙霧會導致支氣管上皮細胞炎性細胞因子IL-6、IL-8表達增加,活性氧相對含量增高[3],而其體內損傷機制尚未明確。烏司他丁(ulinastatin,UTI)作為一種蛋白酶抑制劑,目前在臨床上主要用于胰腺炎的治療。研究發現,除對多種蛋白酶、脂水解酶等有抑制作用外,UTI還具有清除氧自由基、抑制炎癥介質的過度釋放等功能[4-6]。動物實驗表明UTI對脂多糖、燒傷及缺血再灌注導致的肺損傷具有保護作用[7-9],但是否能減輕煙霧吸入所致的肺損傷尚未見報道。本研究通過建立黑火藥煙霧所致肺損傷大鼠模型,探討UTI對煙霧吸入性肺損傷的保護作用及其可能機制。
1 材料與方法
1.1 實驗動物 健康成年雄性Wistar大鼠30只,體重210~230g,由解放軍總醫院實驗動物中心提供,合格證號SCXK(京)2012-0001。大鼠于清潔房中飼養,溫度21~24℃,濕度50%~60%,晝夜12h節律,自由進食、飲水。
1.2 主要藥物及試劑 烏司他丁(規格:10萬單位;批號:031301103;廣東天普生化醫藥公司);硝酸鉀、碳粉、硫黃粉(純度99.9%,200目,北京西四化工原料公司);丙二醛(malondialdehyde,MDA)及髓過氧化物酶(myeloperoxidase,MPO)試劑盒(南京建成生物工程研究所);TransScript All-in-One First-Strand cDNA Synthesis SuperMix試劑盒(北京TransGen公司)。實驗所用引物由上海生物工程技術服務有限公司合成。
1.3 實驗分組及動物模型制備 30只Wistar大鼠隨機分為正常對照組(C組)、吸入性肺損傷組(I組)、烏司他丁高劑量組(UH組)、烏司他丁中劑量組(UM組)、烏司他丁低劑量組(UL組),每組6只。C組大鼠暴露于動物煙熏箱的空氣中8min,I組、UH組、UM組、UL組置于動物煙熏箱,在10g火藥產生的煙霧中暴露8min,制作黑火藥煙霧吸入性肺損傷模型[1]。UH組、UM組、UL組分別按100000、50000、20000U/(kg.d)計算出UTI用量,稀釋至3ml,于煙霧吸入后10min經腹腔注射,C組、I組注入3ml 0.9% NaCl注射液。所有大鼠均于煙霧暴露后40h經腹腔注射4%水合氯醛(1ml/kg)麻醉,暴露分離腹主動脈,取動脈血1ml,處死并取材。
1.4 觀察指標
1.4.1 動脈血氣分析 麻醉大鼠并取腹主動脈血1ml,于30min內采用羅氏Cobasb血氣分析儀進行動脈血氣分析。
1.4.2 肺濕/干重比(W/D) 處死大鼠后取右肺前葉及中葉,拭干表面血液后稱濕重并記錄,然后放入60℃烘箱烘烤48h至恒重并記錄干重,計算W/D值。
1.4.3 支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)細胞計數及蛋白含量測定 處死大鼠后,打開胸腔,分離主支氣管,夾閉右主支氣管,在主支氣管切開處置入自制灌洗針并結扎固定,用4℃生理鹽水2.5ml行左肺灌洗,重復3次,記錄回收量。BALF經1500r/min離心10min,收集上清液,BCA法測定總蛋白含量,取沉淀重懸于1ml生理鹽水并進行細胞計數。
1.4.4 血清、肺組織MPO活性及肺組織MDA含量測定 取肺組織100mg,置于液氮中研磨后以1:9比例加入生理鹽水,制成10%的肺組織勻漿,采用MPO及MDA試劑盒測定肺組織MPO活性及MDA含量,具體操作嚴格按照試劑盒說明書進行。大鼠麻醉后取腹主動脈血5ml,3000r/min離心5min,測血清MPO活性,具體操作按照MPO試劑盒說明書進行。
1.4.5肺組織Toll樣受體4(toll-like receptor 4,TLR-4)、白細胞介素-1β(interleukin-1β,IL-1β)、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)mRNA表達水平檢測 采用Trizol試劑盒提取肺組織總RNA。取2μl RNA樣本,加入不含RNA酶的雙蒸水198μl,置于核酸分析儀中測定純度和濃度,取A260/A280值在1.8~2.0的RNA,采用TransScript All-in-One First-Strand cDNA Synthesis SuperMix試劑盒進行反轉錄,合成cDNA,實驗所用引物序列見表1。PCR采用20μl反應體系,包括上游引物(10μmol/L)0.5μl,下游引物(10μmol/L)0.5μl,2×TransStart Green qPCRSuperMix 10μl,模板2μl,雙蒸水7μl。擴增條件:94℃ 180s;94℃ 30s,58℃ 30s,72℃60s,共45個循環;95℃ 30s,58℃ 30s,72℃ 30s。擴增完成后從50℃升溫繪制熔解曲線驗證擴增產物的特異性。
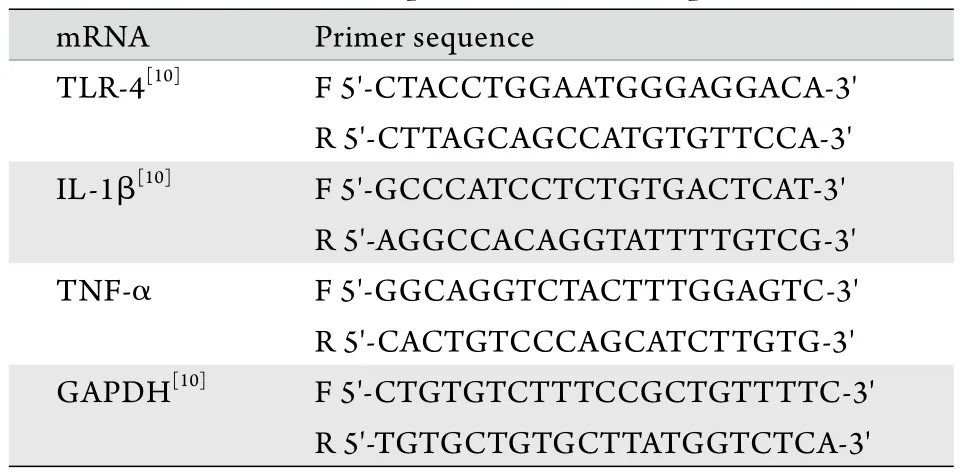
表1 PCR引物序列Tab. 1Primer sequence for PCR amplification
1.4.6 肺組織病理學檢查 觀察肺組織大體病理改變,取右肺后葉浸入4%中性緩沖甲醛溶液中固定24h,石蠟包埋,4μm連續切片,常規HE染色后光鏡下觀察。
1.5 統計學處理 采用SPSS 17.0軟件進行統計分析。符合正態分布及方差齊性的計量資料以±sx表示,多組間比較采用單因素方差分析(One-way ANOVA),進一步兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 動脈血氣分析結果 與C組比較,在暴露于黑火藥煙霧40h后,I組PaO2明顯降低,PaCO2明顯升高(P<0.05)。給予不同劑量UTI處理后,UH、UM、UL組PaO2均高于I組(P<0.05),UM與UL組PaCO2水平低于I組(P<0.05),3組PaO2、PaCO2與C組比較差異均無統計學意義(P>0.05,表2)。
2.2 肺W/D及BALF白細胞計數、蛋白含量測定結果 I組肺W/D顯著高于C組和使用UTI治療的三組(P<0.05),而C組與使用UTI治療的3組相比差異無統計學意義(P>0.05)。I組大鼠BALF白細胞計數顯著高于其余4組(P<0.05),BALF蛋白含量明顯高于C組及UM組、UL組(P<0.05),與UH組比較差異無統計學意義(P>0.05,表2)。
2.3 MPO活性及MDA含量測定結果 UH組血清、肺組織MPO活性及肺組織MDA含量均低于I組(P<0.05),且與C組比較差異無統計學意義(P>0.05)。UM、UL組血清MPO活性顯著低于I組(P<0.05,表3)。
表2 煙霧吸入后40h各組PaCO2、PaO2、W/D及BALF中白細胞計數和蛋白含量比較(±sx,n=6)Tab. 2Arterial blood gas analysis, WBC count and protein contents in BALF of 5groups at 40h post smog inhalation (±sx, n=6)
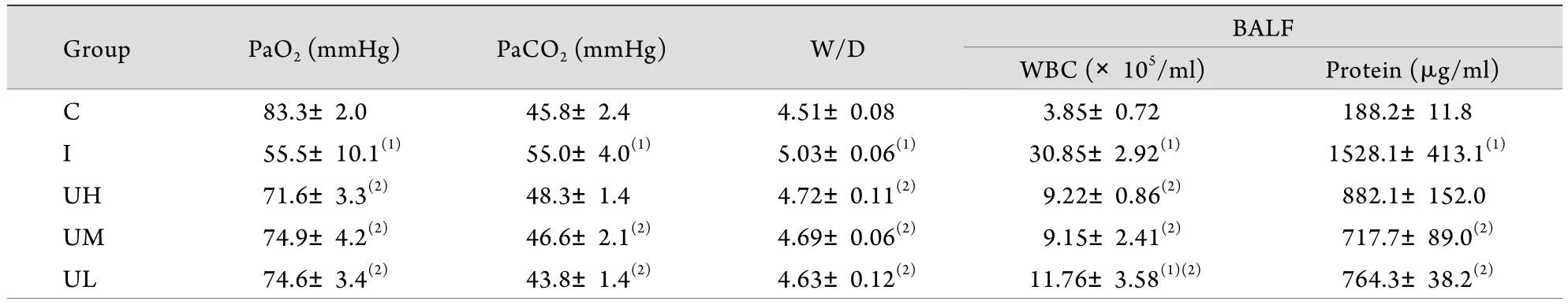
表2 煙霧吸入后40h各組PaCO2、PaO2、W/D及BALF中白細胞計數和蛋白含量比較(±sx,n=6)Tab. 2Arterial blood gas analysis, WBC count and protein contents in BALF of 5groups at 40h post smog inhalation (±sx, n=6)
(1)P<0.05compared with group C; (2)P<0.05compared with group I
Group PaO2 (mmHg) PaCO2 (mmHg) W/D BALF WBC (×105/ml) Protein (μg/ml)C 83.3±2.0 45.8±2.4 4.51±0.08 3.85±0.72 188.2±11.8I 55.5±10.1(1) 55.0±4.0(1) 5.03±0.06(1) 30.85±2.92(1) 1528.1±413.1(1)UH 71.6±3.3(2) 48.3±1.4 4.72±0.11(2) 9.22±0.86(2) 882.1±152.0UM 74.9±4.2(2) 46.6±2.1(2) 4.69±0.06(2) 9.15±2.41(2) 717.7±89.0(2)UL 74.6±3.4(2) 43.8±1.4(2) 4.63±0.12(2) 11.76±3.58(1)(2) 764.3±38.2(2)
2.4 肺組織TLR-4、IL-1β、TNF-α mRNA表達水平
各組之間TLR-4mRNA表達差異均無統計學意義(P>0.05,圖1)。UH組IL-1β、TNF-α mRNA表達均低于I組(P<0.05),且與C組比較差異無統計學意義(P>0.05);UM、UL組IL-1βmRNA表達顯著低于I組(P<0.05),而TNF-α mRNA表達與I組比較差異無統計學意義(P>0.05,圖1)。
2.5 病理學檢查結果 大體觀察見C組大鼠肺組織呈肉粉色,質地柔軟、彈性好。I組大鼠肺表面可見片狀出血壞死灶,彈性較差。UH、UM、UL組肺表面觀無明顯差異,整體呈肉紅色,彈性尚可,UL組偶見點狀出血梗死灶。光鏡下可見C組大鼠肺泡結構完整、清晰,肺泡腔干凈,肺泡間隔均勻一致,間質無炎細胞浸潤;煙霧吸入后40h的I組大鼠肺泡腔增大,肺泡間隔增厚,腔內可見滲出,肺泡間質可見炎細胞浸潤;UH組、UM組肺泡間質炎性浸潤均較I組明顯減輕,肺泡腔內未見滲出,UL組肺泡腔內滲出情況及炎細胞浸潤現象也較I組減輕(圖2)。
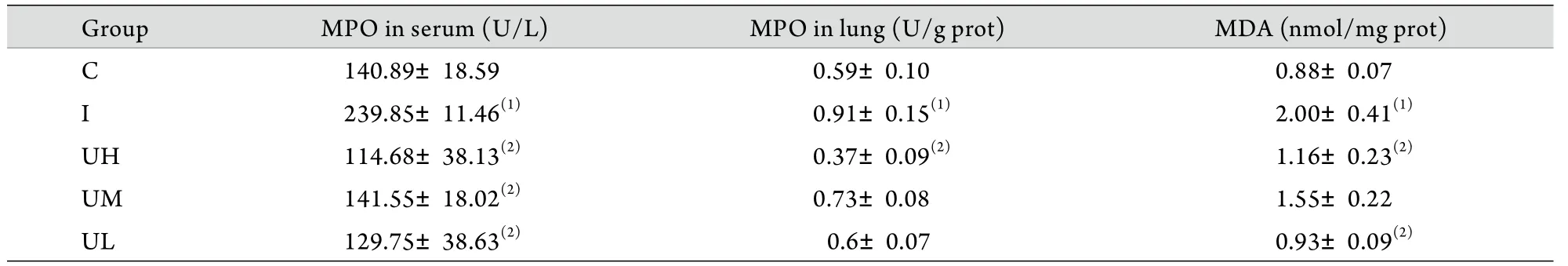
表3 煙霧吸入后40h各組血清、肺組織MPO活性及肺組織MDA含量比較(x±sx,n=6)Tab. 3MPO activity in serum and lung tissue and MDA concentration in lung tissue at 40h post smog inhalation (x±sx, n=6)
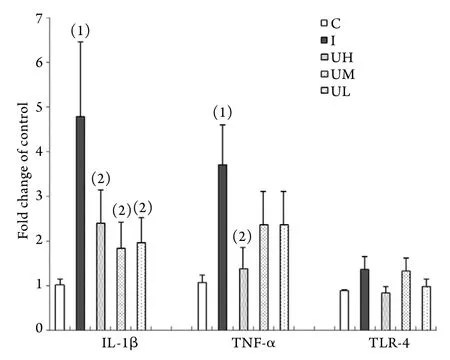
圖1 煙霧吸入后40h各組TLR-4、IL-1β、TNF-α mRNA表達水平比較(n=6)Fig. 1Expression levels of TLR-4, IL-1β and TNF-α mRNA in 5groups at 40h post smog inhalation (n=6)
3 討 論
研究認為,吸入性肺損傷發生的主要原因為當機體吸入熱力物質、有毒氣體或刺激性粉塵后,導致單核巨噬細胞及中性粒細胞等的活化和積聚,釋放MPO、氧自由基及多種炎性細胞因子等,同時,因中性粒細胞與肺組織內的血管內皮細胞發生黏附而阻塞肺組織內微血管,加重局部組織缺血缺氧,使血管內皮通透性增加,進一步加速肺組織水腫的發生,最終加重肺部炎癥反應[11-12]。
目前,以地塞米松為代表的糖皮質激素類藥物在抗炎治療中應用較為廣泛,該類藥物具有較強的免疫抑制作用,能廣泛調節機體內多種炎性介質的表達,但因其會產生藥物依賴、激素抵抗等一系列不良反應,故一直不能作為臨床治療的最佳選擇。UTI是一種由肝臟分泌的具有廣譜蛋白酶抑制作用的糖蛋白,屬于內源性抑炎介質。在由細菌內毒素所致的急性肺損傷大鼠模型中,UTI能有效抑制TNF-α水平和MPO活性的升高,減輕肺泡間隔炎性細胞的浸潤、水腫、出血等,也可通過降低IL-18等炎性因子及NF-κB的表達,減輕肺部炎性反應[13-14]。
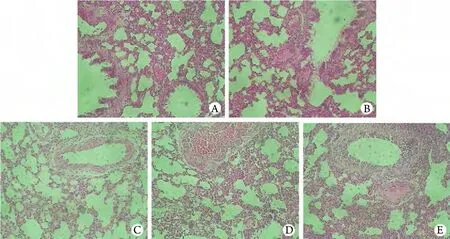
圖2 肺組織病理學觀察(HE ×100)Fig. 2Histopathological observation of the lung tissues (HE ×100)
本研究使用自制的發煙裝置建立了黑火藥煙霧所致大鼠吸入性肺損傷模型,使用高、中、低3個劑量的UTI進行干預。血氣分析結果表明UTI可顯著改善吸入性肺損傷大鼠的PaO2,使之恢復正常水平,同時有效降低了UM組、UL組的PaCO2水平(P<0.05)。UH組PaCO2水平略低于I組,但差異無統計學意義(P>0.05),考慮與大鼠數量有限或血氣測定時點差異有關。肺組織W/D以及BALF中蛋白含量是衡量肺內微血管通透性的主要指標,本研究結果顯示,與I組相比,UTI能有效降低W/D值,同時減少蛋白滲出(P<0.05),與Qiu等[11]的研究結果一致。UH組BALF中蛋白含量雖與I組相比差異無統計學意義,但數值仍低于后者,考慮可能是在收集BALF時因操作不當使標本混入了溶血后的血液,從而導致所測定的蛋白水平假性增高。
MPO活性是組織中性粒細胞浸潤的主要標志。本研究結果顯示高劑量UTI能顯著降低血清及肺組織MPO的活性(P<0.05),且與BALF中白細胞計數的變化趨勢一致,提示UTI能有效抑制中性粒細胞的滲出以及MPO的釋放,減輕肺組織損傷,從而起到保護作用。與UH組相比,UM、UL組肺組織MPO活性下降不明顯(P>0.05),考慮與UTI劑量有關。MDA是脂質過氧化反應的最終產物,其含量可反映組織中自由基的多少及脂質過氧化程度。I組MDA含量增加表明黑火藥煙霧吸入可破壞肺組織的細胞膜結構,而UH組肺組織MDA含量與I組相比顯著下降(P<0.05),表明高劑量UTI具有抗氧化作用。
TLR-4是目前研究較為廣泛的病原微生物模式識別受體,本研究結果顯示TLR-4mRNA表達在各組之間差異無統計學意義(P>0.05),提示在黑火藥煙霧吸入引起的無菌性炎癥中,TLR-4相關炎性通路可能未被激活。TNF-α是感染、燒傷等炎癥反應中最主要的促炎性細胞因子,主要由巨噬細胞產生,可通過誘導IL-1β等其他細胞因子和炎癥介質進一步啟動炎癥反應的發生。本研究結果顯示,高劑量UTI可顯著抑制TNF-α及IL-1β mRNA的表達(P<0.05),而中、低劑量UTI則僅可減少IL-1β mRNA的表達(P<0.05),提示高劑量UTL對煙霧吸入引起的肺損傷可發揮有效的保護作用。上述結果與病理觀察變化趨勢一致。
綜述所述,本研究結果顯示UTI可通過抗炎、抗氧化對黑火藥煙霧所致大鼠肺損傷發揮保護作用,且高劑量UTI可通過有效抑制IL-1β、TNF-α mRNA的表達起到更為顯著的保護效果。
[1]Liu YF, Tang HW, Wu XL, et al. Establishment and evaluation of a rat model of inhalation lung injury caused by black gunpowder smog[J]. Med J Chin PLA, 2013, 38(8): 60-65. [劉一凡, 唐紅衛, 吳小利, 等. 黑火藥煙霧致吸入性肺損傷大鼠模型的建立與評價[J]. 解放軍醫學雜志, 2013, 38(8): 60-65.]
[2]Zhou Y, Lan XM, Wang CB. Study on the secretion of IL-8and IL-6by bronchial epithelial cells (BEAS-2B) injured by black powder smoke and the curative effect of puerarin[J]. Med J Chin PLA, 2012, 37(3): 260-262.[周瑩, 蘭曉梅, 王成彬. 葛根素對火藥煙霧致支氣管上皮細胞損傷的防護效應[J]. 解放軍醫學雜志, 2012, 37(3): 260-262.]
[3]Zhou Y, Wang CB, Lan XM. Puerarin inhibits gene expression of IL-8and IL-6in BEAS-2B cells injured by black powder smoke[J]. Pharm J Chin PLA, 2012, 28(1): 10-14. [周瑩, 王成彬, 蘭曉梅. 葛根素對黑火藥煙霧誘導支氣管上皮細胞IL-8和IL-6基因表達的抑制作用[J]. 解放軍藥學學報, 2012,28(1): 10-14.]
[4]Sato Y, Ishikawa S, Otaki A, et al. Induction of acute-phase reactive substances during open-heard surgery and efficacy of ulinastatin in inhibiting cytokines and postoperative organ injury[J]. Jpn J Thorac Cardiovasc Surg, 2000, 48(7): 428-434.
[5]Li N, You SY, Wang CL, et al. The effects of ulinastatin on sp-a in lung injury induced by severe acute pancreatitis in rats[J].Tianjin Med J, 2013, 41(3): 241-243.[李楠, 尤勝義, 王春立,等. 烏司他丁對大鼠重癥急性胰腺炎肺損傷中SP-A的影響[J]. 天津醫藥, 2013, 41(3): 241-243.]
[6]Wang XH, Hu JH, Shen YZ. Protective effects of Xingnaojing combined with ulinastatin on brain injury in severe acute pancreatitis of rats[J]. Tianjin Med J, 2013, 41(4):349-352.[王小紅, 胡江鴻, 沈云志. 醒腦靜聯合烏司他丁對重癥急性胰腺炎大鼠腦損傷的保護作用[J]. 天津醫藥, 2013, 41(4):349-352.]
[7]Inoue K, Takano H, Shimada A, et al. Urinary trypsin inhibitor protects against systemic inflammation induced by lipopolysaccharide[J]. Mol Pharmacol, 2005, 67(3): 673-680.
[8]Gao C, Liu Y, Ma L, et al. Protective effects of ulinastatin on pulmonary damage in rats following scald injury[J]. Burns, 2012,38(7): 1027-1034.
[9]Xu M, Wen XH, Chen SP, et al. Addition of ulinastatin to preservation solution promotes protection against ischemiareperfusion injury in rabbit lung[J]. Chin Med J (Engl), 2011,124(14): 2179-2183.
[10]Yao L, Kan EM, Lu J, et al. Toll-like receptor 4mediates microglial activation and production of inflammatory mediators in neonatal rat brain following hypoxia: role of TLR4in hypoxic microglia[J]. J Neuroinflammation, 2013, 10: 23.
[11]Qiu X, Wang J, Li H, et al. The therapeutic efficacy of ulinastatin for rats with smoking inhalation injury[J].Intimmunopharmacol, 2012, 14(3): 289-295.
[12]Hu Q, Chai JK, Yang HM. Research progression of lung injury after burn-blast combined injury[J]. Med J Chin PLA, 2013,38(5): 428-432.[胡泉, 柴家科, 楊紅明. 燒沖復合傷肺損傷的研究進展[J]. 解放軍醫學雜志, 2013, 38(5): 428-432.]
[13]Ito K, Mizutani A, Kira S, et al. Effect of ulinastatin, a human urinary trypsin inhibitor, on the oleic acid-induced acute lung injury in rats via the inhibition of activated leukocytes[J]. Injury,2005, 36(3): 387-394.
[14]Xu P, Fang Y, Yu WR, et al. Protective effects of ulinastatin on lung injury from severe burns in rats[J]. J Shanghai Jiaotong Univ (Med Sci), 2009, 29(1): 51-53.[徐鵬, 方勇, 俞為榮, 等.烏司他丁對Ⅲ度燙傷大鼠肺組織的保護作用[J]. 上海交通大學學報(醫學版), 2009, 29(1): 51-53.]

