響應面法優(yōu)化紫山藥花青苷提取工藝及 其抗氧化活性
劉水英,李新生,2,*,黨 婭,2,米 桂,趙 璇,王 昕,韓 豪,楊智勇
(1.陜西理工學院生物科學與工程學院,陜西 漢中 723000;2.陜西省資源生物重點實驗室,陜西省黑色有機食品工程技術(shù)研 究中心,陜西 漢中 723000)
響應面法優(yōu)化紫山藥花青苷提取工藝及 其抗氧化活性
劉水英1,李新生1,2,*,黨 婭1,2,米 桂1,趙 璇1,王 昕1,韓 豪1,楊智勇1
(1.陜西理工學院生物科學與工程學院,陜西 漢中 723000;2.陜西省資源生物重點實驗室,陜西省黑色有機食品工程技術(shù)研 究中心,陜西 漢中 723000)
以紫山藥為實驗材料,以酸性乙醇為提取溶劑,通過Box-Behnken響應面法及Design-Expert 8.0.6分析軟件建立二次多項式數(shù)學模型,優(yōu)化紫山藥花青苷的提取工藝。同時,對紫山藥花青苷清除·OH和O2-·的能力進行分析研究。結(jié)果表明,5 種單因素對花青苷得率影響大小的順序為鹽酸質(zhì)量分數(shù)>提取時間>乙醇體積分數(shù)>液料比>提取溫度,紫山藥花青苷最佳提取工藝參數(shù)為提取溫度80 ℃、提取時間3.5 h、液料比25∶1(mL/g)、乙醇體積分數(shù)70%、鹽酸質(zhì)量分數(shù)18?。在上述最佳條件下,紫山藥花青苷平均得率達到4.966 mg/g,相對標準偏差為0.29%,與數(shù)學模型理論得率的相對誤差小于1.0%。抗氧化實 驗結(jié)果表明,紫山藥花青苷對·OH及O2-·具有較好的清除能力,其抗氧化能力強于VC。
紫山藥;花青苷;響應面法;提取工藝;抗氧化活性
紫山藥(Dioscorea alata)是薯蕷科(Dioscoreae)山藥屬(Dioscorea L.)一年生或多年生蔓生植物,也稱“紫人參”,又名紫薯蕷、紫蒔藥、紫淮山、紫參薯、腳板薯[1]。其塊根質(zhì)脆有黏性,富含淀粉、黏質(zhì)多糖、蛋白質(zhì)、氨基酸、維生素、礦物質(zhì)、膽堿、薯蕷皂(去氫表雄酮)、花青苷等多種營養(yǎng)和功能成分[2-4]。《本草綱目》記載其具有補脾胃、益肺腎、消渴,可治氣虛衰弱、慢性泄瀉、遺精帶下、虛勞咳嗽等病癥,對虛弱、慢性腸胃炎、糖尿病等也有一定的療效[5],長期服用可以抗病、強身,具有藥食兩用的價值[6-9]。國外、國內(nèi)對紫山藥花青苷研究相對較少[10-11],對紫山藥花青苷清除·OH及O2-·的研究也未見相關(guān)報道。我國只在紫山藥引種、品種改良、種植、營養(yǎng)成分等方面有少量研究和報道[12-16],在清除自由基研究方面,倪勤學等[17]僅對紫山藥色素提取液清除DPPH自由基進行了研究。因此,本研究在查閱已有文獻報道及實驗研究的基礎(chǔ)上,采用響應面法對紫山藥花青苷提取工藝進行優(yōu)化,并對紫山藥花青苷的抗氧化清除·OH及O2-·能力進行研究,旨在為我國紫山藥資源的開發(fā)及紫山藥花青苷的進一步研究和綜合利用提供一定的理論參考與實驗指導。
1 材料與方法
1.1 材料與試劑
紫山藥由湖南省長沙地泰農(nóng)業(yè)開發(fā)有限公司提供,經(jīng)陜西理工學院生物科學與工程學院植物學教研室鑒定為薯蕷科山藥屬紫山藥新鮮塊根。
牽牛花素-3-葡萄糖苷標準品(純度≥98%) 美國Sigma公司;95%乙醇(分析純) 天津市富宇精細化工有限公司;鹽酸、蘋果酸、酒石酸、檸檬酸、硫酸亞鐵、水楊酸、過氧化氫、Tris-HAC-EDTA緩沖液、鄰苯三酚等(均為分析純) 國藥集團化學試劑有限公司;VC 上海博湖生物科技有限公司;實驗用水為超純水(電阻率為18.2 MΩ·cm,25 ℃)。
1.2 儀器與設(shè)備
UV-2550型紫外-可見分光光度計、AUW220D型十萬分之一電子天平 日本島津儀器公司;KQ-100DA型數(shù)控超聲波清洗器 昆山市超聲儀器有限公司;LC-800型低速臺式離心機 科大創(chuàng)新股份有限公司;RE-52A型旋轉(zhuǎn)蒸發(fā)儀 上海亞榮生化儀器廠;愛特爾DZF-6050型真空干燥箱 深圳市愛特爾電子科技有限公司;DZF6050型真空干燥箱 上海一恒科學儀器有限公司;HH-S4型數(shù)顯恒溫水浴鍋 北京長風儀器儀表有限公司;PHS-3C型精密酸度計 上海大普儀器有限公司;摩爾細胞型1810B超純水儀、萬能粉碎機 天津市泰斯特儀器有限公司。
1.3 方法
1.3.1 紫山藥提取工藝流程
新鮮的紫山藥洗凈、帶皮切片(厚2~3 mm)、45 ℃恒溫真空干燥、粉碎、過80目篩,得紫山藥干粉(含水量<5%)。下一步提取花青苷(考察溫度、時間、液料比、提取溶劑、超聲頻率等因素的影響),3 500 r/min離心5 min,定容,得紫山藥花青苷提取液,稀釋、定容得待測液。
1.3.2 最佳提取溶劑選擇和紫山藥花青苷光譜特性
稱取5.0 g紫山藥干粉于圓底燒瓶中,以V(5?酸)∶V(70%乙醇)=15∶85[18]的酸性乙醇溶液(蘋果酸-乙醇溶液、酒石酸-乙醇溶液、鹽酸-乙醇溶液、檸檬酸-乙醇溶液)為提取溶劑。按液料比(提取溶劑的體積與提取溶質(zhì)的質(zhì)量之比)為20∶1(mL/g)各加入50 mL上述提取溶劑、混勻,于45 ℃恒溫水浴中超聲浸提2 h,3 500 r/min離心,再用相應的提取溶劑定容于50 mL棕色容量瓶,每種溶劑平行實驗3 次。計算紫山藥花青苷的平均得率,確定最佳提取溶劑。
對紫山藥色素提取的稀釋液按波長間隔為2 nm在190~1 000 nm波長范圍內(nèi)進行波長全掃描。
1.3.3 花青苷標準曲線的繪制
準確稱取牽牛花素-3-葡萄糖苷標準品2.03 mg,用酸性乙醇V(5?鹽酸)∶V(70%乙醇)=15∶85超聲溶解并定容于50 mL棕色容量瓶中,即得到質(zhì)量濃度為40.6 μg/mL牽牛花素-3-葡萄糖苷對照母液。分別移取對照母液0.0、0.5、1.0、1.5、2.0、3.0、5.0 mL于50 mL棕色容量瓶中并用酸性乙醇定容。得到質(zhì)量濃度分別為0、0.406、0.812、1.218、1.624、2.436、4.060 μg/mL的系列花青苷標準溶液,在190~1000 nm波長范圍內(nèi)對標準溶液進行掃描,找出標準品的最大吸收波長λmax,以λmax每種質(zhì)量濃度對應的的吸光度A為縱坐標,相應的標準品質(zhì)量濃度為橫坐標繪制牽牛花素-3-葡 萄糖苷標準曲線。用線性最小二乘法擬合得到花青苷標準曲線的線性回歸方程。
1.3.4 紫山藥花青苷的測定及得率的計算
取紫山藥花青苷提取液2.0 mL定容于10 mL棕色容量瓶中,得到紫山藥花青苷提取稀釋液。在與花青苷標準品牽牛花素-3-葡萄糖苷相同的條件下,以提取所用的溶劑為空白對照,測定出紫山藥花青苷提取稀釋液的吸光度A0,根據(jù)標準曲線的回歸方程得到紫山藥中花青苷的質(zhì)量濃度。紫山藥花青苷得率(ω)計算見公式(1):

式中:ω為紫山藥花青苷的得率/(μg/g);ρ為紫山藥花青苷的質(zhì)量濃度/(μg/mL);n為稀釋倍數(shù),n=25;V為紫山藥花青苷稀釋液的體積/mL;m為紫山藥干粉質(zhì)量/g。
1.3.5 單因素試驗
稱取一定質(zhì)量的紫山藥干粉,依據(jù)1.3.2節(jié)的實驗結(jié)果選擇V(5?鹽酸)∶V(70%乙醇)=15∶85的酸性乙醇作為提取溶劑,以紫山藥花青苷得率作為評價花青苷提取的標準,分別考察提取溫度(40、50、60、70、80、90 ℃)、提取時間(1.0、1.5、2.0、2.5、3.0、3.5 h)、液料比(10∶1、15∶1、20∶1、25∶1、30∶1)、乙醇體積分數(shù)(40%、50%、60%、70%、80%)、鹽酸質(zhì)量分數(shù)(5?、8?、10?、12?、15?、18?、20?)、超聲頻率(20、40、60、80、100、120 Hz)對紫山藥花青苷得率的影響。
1.3.6 響應面法優(yōu)化提取工藝
根據(jù)Box-Behnken試驗設(shè)計原理,在單因素試驗的基礎(chǔ)上采用五因素三水平的響應面分析方法進一步試驗。選擇溫度、時間、液料比、乙醇體積分數(shù)、鹽酸質(zhì)量分數(shù)為自變量,依次用X1、X2、X3、X4、X5表示,并以-1、0、1分別代表各自的低、中、高水平,以花青苷得率Y(mg/g)為響應值,確定這5 個自變量對紫山藥花青苷得率影響的顯著性和提取的最佳工藝條件組合。因素及水平編碼表見表1。

表1 因素及水平編碼表Table 1 Coded levels for factors used in Box-Behnken design
1.3.7 紫山藥花青苷抗氧化活性實驗
將紫山藥花青苷最佳提取工藝條件下得到的花青苷提取液作為抗氧化活性實驗的樣品。清除·OH能力的測定[19-20]采用Fenton反應法,清除O2-·能力的測定[21-22]采用鄰苯三酚氧化法。
1.3.7.1 ·OH清除能力
取5.0 mL 10 mmol/L硫酸亞鐵溶液、5.0 mL 10 mmol/L水楊酸-乙醇和5.0 mL提取液于50 mL錐形瓶中,然后加入5.0 mL 9 mmol/L的過氧化氫,在38 ℃恒溫水浴中反應40 min。以超純水為空白參比,對照品以抗壞血酸代替樣品,平行做3 組實驗。在520 nm波長處測定反應液的吸光度,重復測3 次取平均值。·OH清除率按公式(2)計算:

式中:A0、A1分別為空白對照與樣品的平均吸光度。
1.3.7.2 O2-·清除能力
分別向10 mL石英比色管中加入0.5 mL蒸餾水,4.5 mL pH值為8.2的50 mmol/L Tris-HAC-EDTA緩沖液,混勻后于20 ℃條件下恒溫30 min。再往其中加入10 μL同溫度的45 mmol/L鄰苯三酚溶液,做空白對照時則以蒸餾水代替鄰苯三酚,混勻后迅速在325 nm波長處測定混合溶液的吸光度。測定樣品時將第一步的蒸餾水換為不同質(zhì)量濃度的樣品溶液以測定加入樣品后鄰苯三酚的自氧化能力,同時做樣品溶液的空白對照,扣除樣品溶液本身的干擾。
2 結(jié)果與分析
2.1 最佳提取溶劑

圖1 不同提取溶劑對花青苷得率的影響Fig.1 Influence of different extraction solvents on anthocyanins yield
不同提取溶劑對紫山藥花青苷提取的效果見圖1,可以看出在提取紫山藥花青苷的4 種溶劑中,鹽酸-乙醇作為溶劑時花青苷的得率最高;酒石酸-乙醇的提取效果次之。因此,選擇鹽酸-乙醇作為紫山藥花青苷提取的最佳溶劑。可能原因是鹽酸-乙醇溶液的極性與紫山藥花青苷的最為接近,且鹽酸為強電解質(zhì),電離出的H+可與花青苷結(jié)合形成更為穩(wěn)定的烊鹽而利于紫山藥中花青苷的溶出。
2.2 最大吸收波長的選擇

圖2 紫山藥花青苷紫外-可見光掃描圖Fig.2 Ultraviolet-visible spectrum of purple yam anthocyanins
對紫山藥花青苷提取液在190~1 000 nm波長范圍內(nèi)進行波長全掃描,以波長為橫坐標,吸光度A為縱坐標作圖。由圖2可知,紫山藥色素提取液在530 nm波長處出現(xiàn)特征吸收峰。由于花青苷的光譜學特性是其在可見光區(qū)的最大吸收波長為465~560 nm[23]。說明紫山藥花青苷提取液具有花青苷的特征,屬于花青苷類物質(zhì)。
2.3 花青苷標準曲線
利用紫外-可見分光光度計,以酸性乙醇V(5?鹽酸)∶V(70%乙醇)=15∶85為空白參比,對牽牛花素-3-葡萄糖苷標準品進行全掃描,獲得牽牛花素-3-葡萄糖苷掃描光譜圖。由圖3可見,花青苷測定的最大吸收波長λmax(圖3中1對應的波長)為530 nm。在最大波長處以花青苷標準溶液各質(zhì)量濃度對應的吸光度為縱坐標,質(zhì)量濃度為橫坐標作圖繪制紫山藥花青苷標準品牽牛花素-3-葡萄糖苷的標準曲線,其線性回歸方程為:Y=0.1678X-0.000 6(R2=0.999 8),式中:X為牽牛花素-3-葡萄糖苷的質(zhì)量濃度/(μg/mL);Y為λmax處標準品各質(zhì)量濃度對應的吸光度。

圖3 牽牛花素-3-葡萄糖苷標準品紫外-可見光譜掃描圖Fig.3 Ultraviolet-visible spectrum of petunidin-3-glucoside standard
2.4 單因素試驗
2.4.1 提取溫度對紫山藥花青苷提取的影響

圖4 提取溫度對提取效果的影響Fig.4 Influence of temperature on the extraction efficiency of anthocyanins
由圖4可知,當其他條件相同時,在一定的溫度范圍內(nèi),紫山藥花青苷得率隨著提取溫度的升高而升高。當提取溫度達到80 ℃時,紫山藥花青苷的得率達到最大。溫度再繼續(xù)升高時花青苷得率反而呈現(xiàn)下降趨勢。可能是由于紫山藥花青苷的熱穩(wěn)定性差。當?shù)陀?0 ℃時,隨著溫度的升高紫山藥花青苷的溶出率逐漸增大,升高溫度有利于紫山藥中花青苷的溶出;但高于80 ℃之后,紫山藥花青苷的分解速率明顯增大導致花青苷得率降低[24-27]。綜合考慮,提取溫度選擇80 ℃最佳。實驗測得的最佳提取溫度80 ℃高于曾哲靈[6]、倪勤學[17]、傅婧[28]等的研究,可能原因是在該提取實驗條件下紫山藥花青苷與提取試劑形成了耐高溫的穩(wěn)定結(jié)構(gòu)。
2.4.2 提取時間對紫山藥花青苷提取的影響
提取時間是影響花青苷得率的一個重要因素。由圖5可知,提取時間在1~3 h內(nèi),紫山藥花青苷得率隨時間的延長而呈現(xiàn)明顯增加的趨勢。3 h以后花青苷得率隨著時間的延長而呈下降趨勢。可能是由于紫山藥花青苷的穩(wěn)定性差,時間太長花青苷部分分解。因此,選擇3 h作為最佳提取時間。

圖5 提取時間對提取效果的影響Fig.5 Influence of extraction time on the extraction efficiency of anthocyanins
2.4.3 液料比對紫山藥花青苷提取的影響

圖6 液料比對提取效果的影響Fig.6 Influence of liquid/material ratio on the extraction efficiency of anthocyanins
液料比是決定紫山藥中花青苷濃度高低的因素之一,也是實際生產(chǎn)中必須考慮的重要因素。由圖6可知,在一定范圍內(nèi),花青苷得率液料比的升高而增加。當液料比為20∶1時,紫山藥花青苷的得率最大。之后隨著液料比的增大花青苷得率基本趨于不變。20∶1的液料比既有利于紫山藥中花青苷的提取又利于實際生產(chǎn)中的節(jié)能減排,因此,在5 個梯度的液料比中20∶1是最佳液料比。
2.4.4 乙醇體積分數(shù)對紫山藥花青苷提取的影響

圖7 乙醇體積分數(shù)對提取效果的影響Fig.7 Influence of ethanol concentration on the extraction efficiency of anthocyanins
由圖7可以看出,當乙醇體積分數(shù)在40%~60%之間,隨著乙醇體積分數(shù)的增大紫山藥花青苷得率逐漸增大,花青苷提取效率隨著乙醇體積分數(shù)的增大而增加。當乙醇體積分數(shù)為60%時,花青苷得率達到最高,當乙醇體積分數(shù)高于60%并繼續(xù)增加時花青苷得率呈現(xiàn)明顯的下降趨勢。這可能是由于乙醇體積分數(shù)升高,對于花青苷這種極性高的黃酮類化合物的提取率下降,而對其他雜質(zhì)的提取率升高。因此,綜合考慮選擇乙醇體積分數(shù)為60%為最佳。
2.4.5 鹽酸質(zhì)量分數(shù)對紫山藥花青苷提取的影響

圖8 鹽酸質(zhì)量分數(shù)對提取效果的影響Fig.8 Influence of hydrochloric acid concentration on the extraction efficiency of anthocyanins
由圖8可知,在一定范圍內(nèi),紫山藥中花青苷得率隨著鹽酸質(zhì)量分數(shù)的增大而增加。鹽酸質(zhì)量分數(shù)在5?~8?之間時花青苷得率隨鹽酸質(zhì)量分數(shù)變化明顯大于鹽酸質(zhì)量分數(shù)為8?~10?和10?~15?,說明在此階段,鹽酸質(zhì)量分數(shù)對花青苷得率的影響大于后者。當鹽酸質(zhì)量分數(shù)達到15?時,花青苷得率達到最大。繼續(xù)增大鹽酸的濃度,花青苷得率呈現(xiàn)明顯下降的趨勢。可能原因是紫山藥花青苷與鹽酸中的H+形成穩(wěn)定的烊鹽離子而利于紫山藥中花青苷的溶出,同時當鹽酸質(zhì)量分數(shù)為15?時,此時提取溶劑的極性也與紫山藥花青苷的極性最為接近而使得花青苷最大程度的溶出,花青苷得率也達到最大。因此,紫山藥花青苷的最佳鹽酸質(zhì)量分數(shù)為15?。
2.4.6 超聲頻率對紫山藥花青苷提取的影響

圖9 超聲頻率對提取效果的影響Fig.9 Influence ofultrasonic frequency on the extraction efficiency of anthocyanins
由圖9可知,當超聲頻率在20~80 Hz之間時,紫山藥花青苷得率隨著超聲頻率的增大而增大。80 Hz時花青苷得率達到最大,80 Hz之后花青苷得率基本維持不變。是由于紫山藥中花青苷含量一定的情況下,超聲頻率為80 Hz后花青苷的溶出達到最大,不再隨超聲頻率的增大增加。因此選擇超聲頻率選擇80 Hz為最佳。
2.5 響應面法優(yōu)化提取紫山藥花青苷
2.5.1 響應面試驗方案及結(jié)果
結(jié)合生產(chǎn)實際情況,在單因素試驗結(jié)果的基礎(chǔ)上,選取影響紫山藥花青苷提取效果比較顯著的5 個因素:X1(提取溫度)、X2(提取時間)、X3(液料比)、X4(乙醇體積分數(shù))、X5(鹽酸質(zhì)量分數(shù))。利用Design-Expert 8.0.6設(shè)計五因素三水平的Box-Behnken響應面試驗方案,進一步進行五因素三水平的響應面分析試驗。測定結(jié)果見表2,其中試驗序號1~40為析因試驗,41~46為5 個估計試驗誤差的中心試驗。

表2 響應面試驗方案及結(jié)果Table 2 Experimental design and results for response surface analysis
2.5.2 響應面數(shù)學模型建立與顯著性檢驗
經(jīng)Design-Expert 8.0.6統(tǒng)計分析軟件對表2中響應面試驗數(shù)據(jù)進行線性二次多項式回歸擬合,以花青苷得率(Y)為響應值,以提取溫度(X1)、提取時間(X2)、液料比(X3)、乙醇體積分數(shù)(X4)、鹽酸質(zhì)量分數(shù)(X5)為自變量,建立二次多元回歸方程:
Y=3.94+0.17X1+0.30X2+0.22X3+0.25X4+0.34X5-0.059X1X2+0.10X1X3-0.13X1X4-0.046X1X5-0.060X2X3-0.050X2X4+0.10X2X5+0.049X3X4+0.084X3X5+0.045X4X5-0.54X12-0.047X22-0.13X32-0.054X42+1.833×10-4X52
該方程的回歸分析與方差分析結(jié)果見表3。由表3可知,回歸方程的各因變量和自變量間的線性關(guān)系明顯,該數(shù)學模型回歸高度顯著(P<0.000 1),失擬項顯著且模型的R2=0.994 6,=0.990 3說明該數(shù)學模型與試驗擬合較好,自變量與響應值間線性關(guān)系顯著,故可以用于該反應的理論推測。

表3 模型和回歸系數(shù)顯著性檢驗Table 3 Significance test of the fitted model and its regression coefficients
2.5.3 單因素間的交互作用
由F檢驗可以判斷自變量對因變量(紫山藥花青苷得率)的影響順序為:X5(鹽酸質(zhì)量分數(shù))>X2(提取時間)>X4(乙醇體積分數(shù))>X3(液料比)>X1(提取溫度)。其中X1、X2、X3、X4、X5、X1X3、X1X4、X2X5、X12、X32達到了高度顯著的水平,X1X2、X1X5、X2X3、X2X4、X3X5、X4X5、X22、X42達到顯著的水平。表明提取溫度和液料比、提取溫度和乙醇體積分數(shù)、提取時間和鹽酸質(zhì)量分數(shù)之間的交互作用高度顯著;提取溫度和提取時間、提取溫度和鹽酸質(zhì)量分數(shù)、提取時間和液料比、提取時間和乙醇體積分數(shù)、液料比和鹽酸質(zhì)量分數(shù)、乙醇體積分數(shù)和鹽酸質(zhì)量分數(shù)之間的交互作用顯著。響應面可以反映各單因素(自變量)交互作用對響應值(因變量)影響效果的大小,響應面坡度越陡,則表明他們對響應值的影響效果越顯著。各因素的交互作用見圖10、11(僅以X1X3、X1X4為例)。

圖10 提取溫度和液料比對紫山藥花青苷得率的等高線和響應曲面圖Fig.10 Contour and response surface plots for the effect of extraction temperature and material-to-liquid ratio on the yield of purple yam anthocyanins

圖11 提取溫度和乙醇體積分數(shù)對紫山藥花青苷得率的等高線和響應曲面圖Fig.11 Contour and response surface plots for the effect of extraction temperature and ethanol concentration on the yield of purple yam anthocyanins
2.5.4 提取驗證實驗
根據(jù)線性二次多項式 回歸方程計算得出紫山藥花青苷最佳提取工藝參數(shù)為提取溫度80.34 ℃ 、提取時間3.5 h、液料比24.99∶1、乙醇體積分數(shù)70%、鹽酸質(zhì)量分數(shù)18?,此時,紫山藥花青苷的理論得率為4.986 mg/g,結(jié)合實際修正后的提取工藝參數(shù)為提取溫度80 ℃、提取時間3.5 h、液料比25∶1、乙醇體積分數(shù)70%、鹽酸質(zhì)量分數(shù)18?。以修正后的提取工藝參數(shù)條件進行紫山藥花青苷提取驗證實驗,平行實驗5 次,得花青苷平均得率為4.966 mg/g,其相對標準偏差為0.29%與預測值間的相對誤差為0.40%。
2.6 紫山藥花青苷抗氧化活性
2.6.1 清除·OH效果
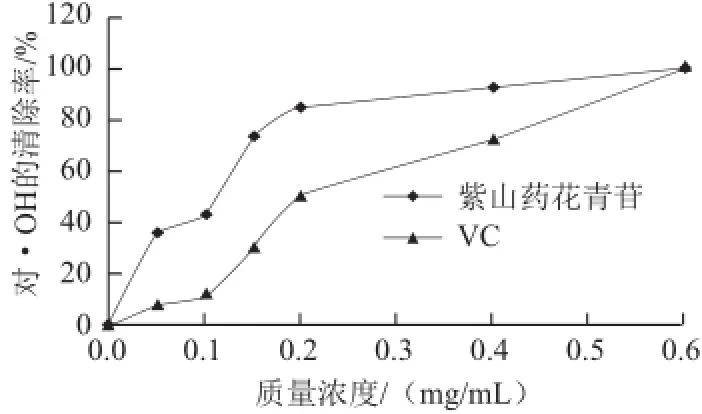
圖12 紫山藥花青苷和VC對·OH的清除效果Fig.12 Scavenging capacity of purple yam anthocyanins and vitamin C on ·OH radical
由圖12可知,紫山藥花青苷對·OH的清除率明顯強于VC。當質(zhì)量濃度在0~0.4 mg/mL之間,隨著質(zhì)量濃度的增大紫山藥花青苷和VC對·OH的清除率也逐漸增大,且紫山藥花青苷對·OH的清除率的變化趨勢與VC的相同,但是明顯高于VC對·OH的清除率。當質(zhì)量濃度在0.4~0.6 mg/mL之間時紫山藥花青苷對·OH的清除率雖然任高于VC。總體而言,紫山藥花青苷清除·OH的能力明顯強于VC。
2.6.2 清除O2-·效果

圖13 不同質(zhì)量濃度紫山藥花青苷提取溶液鄰苯三酚體系的中OO2-·的清除作用Fig.13 Scavenging effect of purple yam anthocyanins at various concentrations on O2-· radical
由圖13可知,將不同質(zhì)量濃度的紫山藥花青苷樣品溶液加入到鄰苯三酚體系中,體系的吸光度隨著樣品溶液質(zhì)量濃度的增大呈現(xiàn)顯著的下降趨勢,說明紫山藥花青苷提取液對體系中 的O2-·有顯著的清除作用,且清除O2-·的能力與紫山藥中花青苷的質(zhì)量濃度呈正相關(guān)。
3 結(jié) 論
對紫山藥花青苷的提取采用響應面法進行工藝優(yōu)化研究表明,提取溫度、提取時間、液料比、乙醇體積分數(shù)、鹽酸質(zhì)量分數(shù)對花青苷得率的影響高度顯著,影響大小的順序為X5(鹽酸質(zhì)量分數(shù))>X2(提取時間)>X4(乙醇體積分數(shù))>X3(液料比)>X1(提取溫度)。并且提取溫度和液料比、提取溫度和乙醇體積分數(shù)、提取時間和液料比、提取時間和鹽酸質(zhì)量分數(shù)之間存在交互作用。通過Design-Expert 8.0.6軟件建立出的數(shù)學模型得出紫山藥花青苷最優(yōu)提取工藝條件為提取溫度80.34 ℃、提取時間3.5 h、液料比24.99∶1(mL/g)、乙醇體積分數(shù)70%、鹽酸質(zhì)量分數(shù)18?。經(jīng)5 次平行驗證實驗得出在修正后的最優(yōu)提取工藝條件下花青苷平均得率達到4.966 mg/g,相對標準偏差為0.29%,與數(shù)學模型的得率間的相對誤差小于1.0%。單因素試驗和響應面試驗測得的最佳提取溫度80℃高于現(xiàn)有文獻[6,15,28]報道的研究,可能原因是在該提取實驗條件下紫山藥花青苷形成了耐高溫的穩(wěn)定結(jié)構(gòu)。具體原因有待對此結(jié)構(gòu)通過高效液相色譜-二極管陣列檢測器-電噴霧電離、質(zhì)譜、核磁共振等技術(shù)做進一步實驗研究。
通過紫山藥花青苷提取液抗氧化活性實驗,發(fā)現(xiàn)紫山藥花青苷提取液對·OH的清除率與花青苷的質(zhì)量濃度有關(guān),在一定范圍內(nèi)花青苷質(zhì)量濃度越大其清除·OH的能力越強,且明顯強于VC;將不同質(zhì)量濃度的紫山藥花青苷樣品溶液加入到鄰苯三酚體系中,體系的吸光度隨著樣品溶液質(zhì)量濃度的升高呈現(xiàn)顯著的下降趨勢,說明紫山藥花青苷 提取液對體系中的O2-·有顯著的清除作用,且清除O2-·的能力與紫山藥中花青苷的質(zhì)量濃度呈正相關(guān)。綜上所述,紫山藥花青苷提取液有較好的抗氧化活性。對于紫山藥花青苷提取液中的花青苷類組分有待做進一步的分離、純化和相關(guān)實驗研究以確定其抗氧化作用的主要成分及結(jié)構(gòu)和各單組分的活性功能。
[1] 徐成基. 中國薯蕷資源[M]. 成都: 四川科技出版社, 2000: 135-138.
[2] 于東, 葉興乾, 方忠祥, 等. 采用HPLC-DAD-ESIMS技術(shù)鑒定紫山藥中的花青苷成分[J]. 中國食品學報, 2010, 10(3): 213-218.
[3] 李四秀. 腳板薯無公害栽培技術(shù)[J]. 農(nóng)村百事通, 2009, 19(6): 34-35. [4] 周新勇, 宋曙輝, 羅輝, 等. 反相高效液相色潽法測定紫山藥中薯蕷皂苷的含量[J]. 食品工業(yè)科技, 2011, 32(7): 420-422.
[5] 潘錫和, 章近富. 萬載山藥及其栽培技術(shù)[J]. 江西園藝, 2001, 8(1): 30-31.
[6] 曾哲靈, 傅婧, 彭超. 紫山藥色素提取工藝研究[J]. 食品工業(yè)科技, 2011, 32(3): 229-231; 236.
[7] 陸國權(quán), 唐忠厚. 紫山藥花青素提取及其純化技術(shù)研究[J]. 糧油食品科技, 2006, 14(1): 34-35.
[8] 王蕊. 山藥的營養(yǎng)保健功能與貯藏加工技術(shù)[J]. 江蘇食品與發(fā)酵, 2006, 28(4): 34-36.
[9] 蔡金輝, 嚴漸子, 黃曉輝, 等. 山藥品種資源的分類研究[J]. 西北農(nóng)業(yè)學報, 1999, 21(7): 44-45.
[10] KNOCZAK I, ZHANG W. Anthocyanins more than natures colours[J]. Journal of Biomedicine and Biotechnology, 2004, 5(13): 239-240.
[11] CLAUDINE M, ANDRZEJ M, AUGUSTIN S. Polyphenols and prevention of cardiovascular diseases[J]. Curr Opin Lipidol, 2005, 16: 77-84.
[12] PRIOR R L, WU X L. Anthocyanins: structural characteristics that result in unique metabolic patterns and biological activities[J]. Free Radical Res, 2006, 40: 1014-1028.
[13] ZHAO Donglan, TANG Jun, LIU Jin, et al. Introduction and standarized cutivation techniques of purple yam in xuzhou area[J]. Acta Agriculturae Jiangxi, 2009, 21(2): 78-79.
[14] LIU Ying, SHI Shanshan, WANG Caisheng. Determination of nutritious composition sand diosgenin contents of purple yam (Dioscorea batatas Decne)[J]. Journal of Anhui Agricultural Sciences, 2010, 38: 4563-4564; 4567.
[15] OZO O N, CAYGIL J C, COURSEY D G. Phenolics of five yam (dioscrea) species[J]. Phytochemistry, 1984, 23(15): 329-331.
[16] YOSHIDA K, KONDO T, KAMEDA K, et al. Structures of alatanin A, B and C isolated from purple yam Dioscorea alata[J]. Tetrahedron Letters, 1991, 32: 5575-5578.
[17] 倪勤學, 高前欣, 霍艷榮, 等. 紫山藥色素的提取工藝及抗氧化性能研究[J]. 天然產(chǎn)物研究與開發(fā), 2012(24): 229-233.
[18] 楊智勇, 李新生, 馬嬌燕, 等. 紫色馬鈴薯“黑金剛”中花青苷組分和含量分析[J]. 食品科學, 2013, 34(14): 271-275.
[19] 王喜強, 董艷萍. 超聲波輔助提取紫薯花青素及抗氧化性研究[J].中國釀造, 2014, 32(1): 77-80.
[20] 陳嬋, 黃瓊, 彭宏, 等. 紫色甘薯原花青素穩(wěn)定性及抗氧化性的研究[J].安徽農(nóng)業(yè)科學, 2012, 40(35): 17308-17310.
[21] 王威. 常用天然色素抗氧化活性的研究[J]. 食品科學, 2003, 24(6): 97-100.
[22] 金華, 劉志剛, 曾曉丹, 等. 超聲提取葡萄籽原花青素工藝的優(yōu)化及其抗氧化活性研究[J]. 中國調(diào)味品, 2014, 39(4): 102-107.
[23] GIUSI M M, RODRIGUEZ-SAONA L E. Molar absorptivity and color characteristics of acylated and non-acylated pelaigonidin-based anthocyanins[J]. Journal of Agricultural and Food Chemistry, 1999, 46: 4731-4737.
[24] 張一凡, 肖志剛, 朱旻鵬, 等. 光照與溫度因素對黑玉米花色苷穩(wěn)定性影響的研究[J]. 食品研究與開發(fā), 2013, 34(24): 29-31.
[25] 王忠民, 石秀花, 李瑾瑜. 野玫瑰色素理化性質(zhì)的研究[J]. 食品科學, 2007, 28(6): 93-97.
[26] 王金華. 烏洋芋理化品質(zhì)及其色素研究[D]. 貴陽: 貴州大學, 2008.
[27] 曹雪丹, 方修鬼, 趙凱. 藍莓汁花色苷熱降解動力學及抗壞血酸對其熱穩(wěn)定性的影響[J]. 中國食品學報, 2013, 13(3): 47-54.
[28] 傅婧. 紫山藥皮中色素的提取純化和穩(wěn)定性研究及結(jié)構(gòu)鑒定[D]. 南昌: 南昌大學, 2011: 21-22.
Optimization of Extraction Process for Purple Yam Anthocyanins by Response Surface Methodology and Their Antioxidant Activity
LIU Shui-ying1, LI Xin-sheng1,2,*, DANG Ya1,2, MI Gui1, ZHAO Xuan1, WANG Xin1, HAN Hao1, YANG Zhi-yong1
(1. College of Biological Science and Engineering, Shaanxi University of Technology, Hanzhong 723000, China; 2. Shaanxi Province Black Organic Food Engineering Technology Research C enter, Shaanxi Key Laboratory of Bio-Resource, Hanzhong 723000, China)
In this paper, the extraction of anthocyanins from purple yam using acidified ethanol was optimized by response surface methodology with Box-Behnken design. A quadratic polynomial model was established with Design-Expert 8.0.6 analysis software. At the same time, the ability of purple yam anthocyanins to scavenge hydroxyl and superoxide anion free radicals was studied. Results indicated that the extraction yield of anthocyanins was influenced in decreasing order by the following parameters: hydrochloric acid concentration, extraction time, ethanol concentration, solvent-to-solid ratio, and temperature. Under the optimal conditions: 80 ℃, 3.5 h, a solvent-to-solid ratio of 25:1 (mL/g), and 70% ethanol with 18? hydrochloric acid at a volume ratio of 15:85, experiments led to an average extraction yield of 4.966 mg/g with a relative standard deviation (RSD) of 0. 29%, showing a relative error below 1.0% compared to the expected value. Purple yam anthocyanins had a stronger free radical scavenging activity than vitamin C.
purple yam; anthocyanins; response surface methodology; extraction process; antioxidant
TS207.3
A
1002-6630(2014)22-0084-08
10.7506/spkx1002-6630-201422016
2014-05-28
陜西省科技統(tǒng)籌創(chuàng)新工程計劃項目(2014KTCL02-18);陜西理工學院科研基金項目(SLGKY14-10);陜西理工學院研究生創(chuàng)新基金項目(SLGYCX1419)
劉水英(1987—),女,碩士研究生,研究方向為生物化學及其在資源生物。E-mail:snutlsy@163.com
*通信作者:李新生(1956—),男,教授,碩士,研究方向為生物資源開發(fā)及應用。E-mail:lxs9@tom.com

