TMSG-1蛋白不同功能域重組質粒構建及亞細胞定位
,,,,
(青島大學醫學院,山東 青島 266071 1 病理學教研室; 2 附屬醫院病理科; 3 附屬醫院血管外科)
腫瘤轉移抑制基因1(TMSG-1)是馬春樹等[1]于2002年應用mRNA差異顯示技術,在人前列腺癌細胞系中首先克隆出來的一種腫瘤轉移抑制相關基因。TMSG-1定位于染色體1q21.3,轉錄生成的mRNA長約2.4 kb,編碼蛋白質全長為380個氨基酸,相對分子質量為45 000。TMSG-1可以抑制前列腺癌、肺癌、乳癌、肝癌等多種腫瘤細胞的侵襲及轉移能力,又被稱為LASS2或CerS2,LASS2主要促進長鏈脂酰神經酰胺C22:0和C24:0-CoA特異的神經酰胺的合成[2]。目前,對于TMSG-1的研究主要集中于腫瘤轉移抑制和神經酰胺合成方面,對該基因轉錄表達調控的研究鮮有報道。研究結果顯示,TMSG-1蛋白含有Homeodomain結構域和一個潛在的核定位信號(NLS)[3],推測TMSG-1有可能作為轉錄因子發揮對特定基因表達的調節作用。本文把TMSG-1分成長度不同、包含不同結構域的片段,構建不同截短體的真核表達載體,并進一步研究各個截短體的亞細胞定位,探討TMSG-1蛋白的轉錄活性。
1 材料與方法
1.1 實驗材料
TMSG-1全長基因并帶有Flag標簽蛋白的pcDNA3質粒,來自北京大學醫學院分子病理室。大腸桿菌感受態細胞DH5a、pfu DNA聚合酶、2×Taq PCR Master Mix及DNA Marker,均購自北京天根公司;細菌培養用LB培養基、Agarose及氨芐青霉素鈉購自Amreso公司;限制性內切酶Xho Ⅰ和EcoR Ⅰ、T4 DNA連接酶及dNTP Mixture均購自Takara公司;DNA凝膠回收試劑盒及構建質粒提取試劑盒購自Takara公司;質粒中提精提試劑盒購自Promega公司;PCR引物由上海生工公司合成;所有重組質粒由上海生工公司測序鑒定;轉染試劑Lipofectamine 2000購自Invitrogen公司;Flag鼠抗人單克隆抗體購自Sigma公司。
1.2 PCR擴增各截短體基因序列
構建不同截短體(圖1),分別為TLC domain(T1)、Homeodomain+TLC domain(T2)、第一個跨膜區+Homeodomain(T3)、第一個跨膜區(T4)、Homeodomain(T5)及全長TMSG-1。根據Genbank提供的TMSG-1的cDNA序列設計引物,以帶Flag標簽蛋白的TMSG-1全長質粒為模板,引物信息見表1。上游和下游引物5′端分別加EcoR Ⅰ和Xho Ⅰ進行酶切。擴增體系100 μL,內含:全長質粒0.5 μL,上、下游引物(10 μmol/L)各1 μL,2.5 mmol/L的dNTPs 8 μL,10×PS Buffer 10 μL及DNA聚合酶(5×106U/L)0.5 μL,最后加水至100 μL。PCR反應條件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min或30 s,30個循環;72 ℃恒育8 min。產物經瓊脂糖凝膠電泳鑒定結果。
1.3 截短體真核表達載體的構建
將上述凝膠回收的截短體PCR產物和空質粒pcDNA3.0-flag進行EcoR Ⅰ、Xho Ⅰ充分雙酶切,酶切產物再次回收目的片段。再將純化的截短體DNA片段與線性pcDNA3-flag按照1∶4(mol/L)比例進行16 ℃過夜連接,連接產物轉化感受態細胞,經氨芐青霉素挑選陽性克隆,搖菌擴大培養后菌液提取質粒,經雙酶切后凝膠電泳初步鑒定,鑒定正確的克隆進一步測序鑒定。

表1 TMSG-1真核表達載體構建引物表
1.4 Western blot鑒定截短體蛋白表達
轉染前培養細胞增殖至90%且狀態良好,應用Promega試劑盒中量精提質粒,轉染步驟[4]按照Lipofectamine 2000說明書進行,每瓶細胞轉染12 μg質粒。轉染4 h后更換新培養基繼續培養。轉染48 h后用RIPA細胞裂解液收集總蛋白,Westren blot方法[5]鑒定截短體蛋白表達。
1.5 免疫熒光觀察截短體亞細胞定位
截短體重組質粒瞬時轉染24 h后的Hela細胞爬片過夜,冷丙酮固定20 min,PBS漂洗后用體積分數0.01的BSA常溫封閉30 min,加入抗Flag一抗37 ℃孵育2 h,PBS漂洗后加入FITC標記的二抗,PBS漂洗后DAPI染核3 min,甲醇洗8 min,體積分數0.90甘油封片。奧林巴斯BX43熒光顯微鏡下觀察,以出現綠色熒光信號為陽性表達。
2 結 果
2.1 PCR擴增各截短體重組質粒DNA片段
TMSG-1截短體T1長761 bp,為129~380位氨基酸,包括1個TLC結構域;T2長945 bp,為71~380位氨基酸,包括Homeodomain和TLC結構域;T3長390 bp,為1~128位氨基酸,內部包含1個Homeodomain結構域;T4長198 bp,為1~70位氨基酸,僅包含了結構域前端的跨膜序列;T5長185 bp,為71~128位氨基酸,為Homeodomain結構域。見圖2。
2.2 重組質粒酶切鑒定
各截短體及TMSG-1全長重組質粒經EcoR Ⅰ和Xho1雙酶切均得到2條帶,分別為4 500 bp的質粒條帶和TMSG-1基因各截短片段。酶切前后對比結果見圖3。
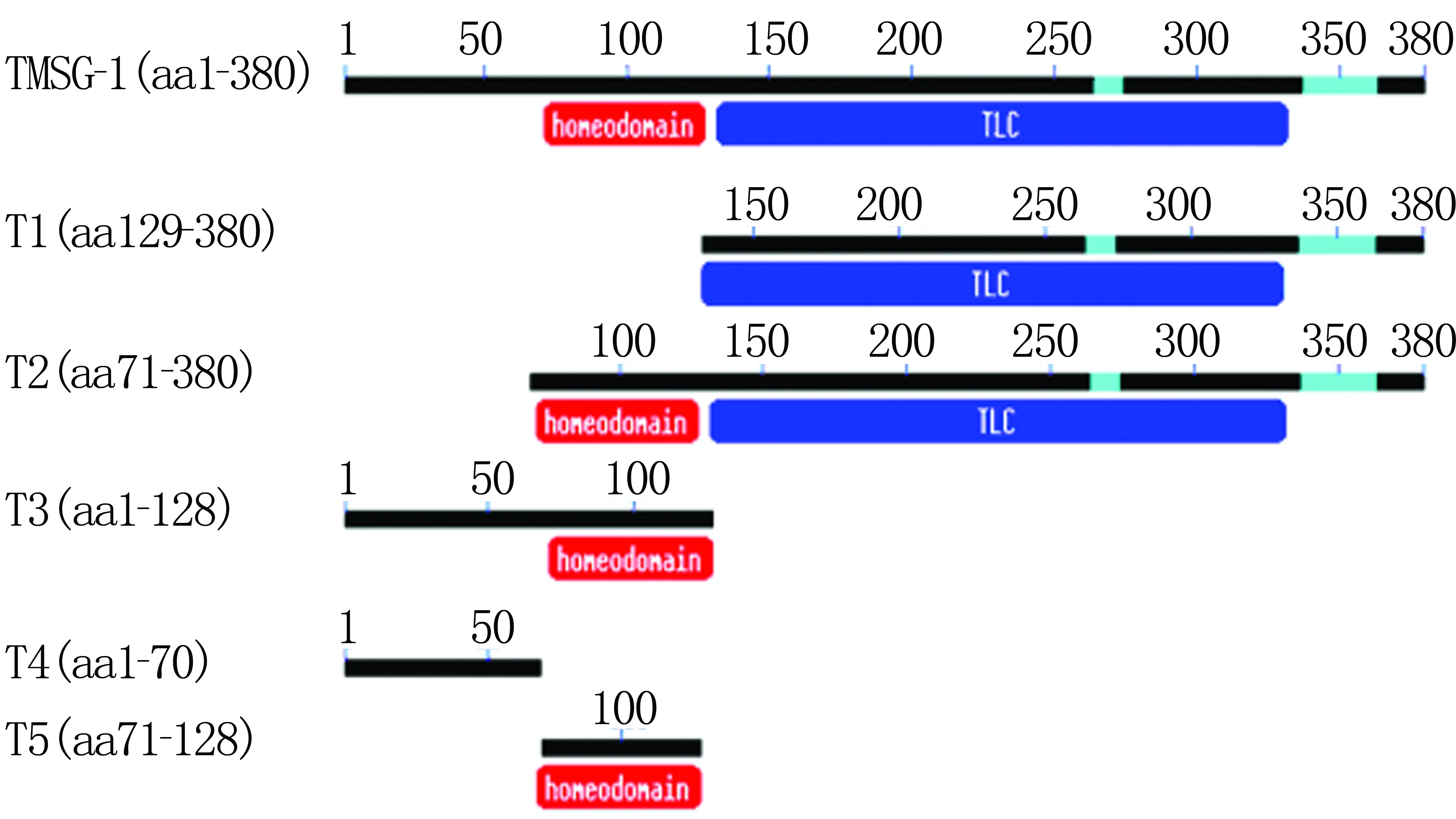
圖1 TMSG-1各截短體示意圖

圖2 PCR擴增TMSG-1全長及各截短體基因片段
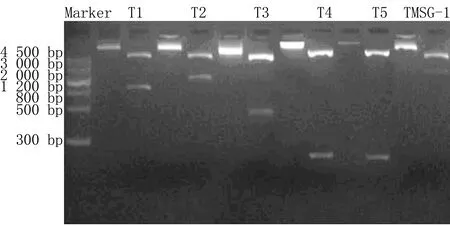
圖3 各截短體及TMSG-1全長質粒酶切結果
每相鄰兩泳道代表酶切前后的重組質粒。酶切前僅一條大于4 500 bp的條帶;酶切后可見兩條帶,大者為約4 500 bp的空質粒條帶,小者分別對應各截短片段長度761、945、390、198、185及1 143 bp。
2.3 截短體蛋白表達
TMSG-1全長蛋白相對分子質量為45 000,根據氨基酸片段長度,預測截短體T1~T5 Flag融合蛋白相對分子質量約為2.5×104、3.4×104、1.6×104、1.0×104、1.0×104。Western blot獲得蛋白條帶位置與預測接近。見圖4。
2.4 截短體亞細胞定位
含有Homeodomain結構域的截短體T2、T3及T5熒光信號主要位于細胞核內,細胞質內的熒光信號較弱,其中T2熒光信號在核內呈顆粒狀或團塊狀彌漫分布,T3及T5主要呈團塊狀分布,類似核仁的形態,考慮為核仁定位;T1、T4、TMSG-1全長及空載體主要在胞質出現綠色熒光信號。見圖5。

圖4 Western blot鑒定TMSG-1全長及各截短體重組質粒蛋白表達
3 討 論
TMSG-1是一種新的腫瘤轉移抑制基因,它可以抑制多種腫瘤細胞的侵襲及轉移,與腫瘤轉移密切相關[6-9]。TMSG-1作為人LASS蛋白家族成員之一,其氨基端均含有1個Homeodomain結構域(LASS1除外)[10]。Homeodomain被證實是一個DNA結合功能域,含有Homeoprotein的蛋白可能與染色體DNA結合,具有轉錄因子活性,有轉錄激活或抑制作用,如Homeobox基因CDX2[11]。轉錄因子存在兩種亞細胞定位模式,一種是細胞核分布,另一種是細胞膜或細胞質分布,在特定的信號刺激之下由細胞質進入細胞核發揮轉錄調節作用,核定位信號在這一轉錄因子調控機制中發揮了重要作用。另外,生物信息學預測也顯示,TMSG-1蛋白Homeodomain結構域中的C末端119~128位氨基酸有連續4個精氨酸RRRR序列,這種結構通常被認定為核定位信號[3]。而潛在核定位信號的存在為TMSG-1有轉錄調節功能的設想提供有力支持。
為了明確TMSG-1蛋白是否能入細胞核,哪段區域能入核,本文初步針對其基因序列進行解體,成功構建不同長度的截短體,分別包含TMSG-1蛋白不同結構域,其中截短體T2、T3和T5均含有Homeodomain結構域,細胞免疫熒光觀察顯示,截短體T2、T3及T5定位于細胞核,其中T2在核內呈顆粒狀彌漫分布,T3及T5則主要呈團塊狀定位于核仁。說明預測的Homeodomain結構域中的核定位信號發揮作用,引導截短體蛋白入核的可能性極大;T3及T5主要定位于核仁,進一步表明這一預測核定位信號極可能是核仁定位信號,類似情況以往有文獻報道過[12]。
TMSG-1基因自1999年被成功克隆之后一直作為一種膜蛋白被研究,未見有其轉錄因子活性的報道。但是膜蛋白同樣可以有轉錄因子活性,如甾醇調節因子結合蛋白(SREBP-1)本身是一種膜結合蛋白,在細胞中被SREBP裂解激活蛋白(SCAP)降解之后入核發揮轉錄因子功能[13]。已有研究結果顯示,腫瘤細胞中含有Homeodomain結構域的截短體能夠入核,且已知約39%的含有Homeoprotein的蛋白為轉錄因子,具有轉錄激活或者抑制作用[14]。因此,我們提出以下設想:TMSG-1蛋白有可能作為轉錄因子發揮作用,TMSG-1有可能和其他轉錄因子如NF-κB、STAT一樣在腫瘤的發生發展過程中有著更為廣泛的作用和更為重要的地位。基于這一目標,本文從基因結構入手,構建TMSG-1不同截短體的真核表達質粒,初步確定各截短體的亞細胞定位,為研究其轉錄功能打下重要基礎。其確切的核定位信號及入核機制有待于進一步研究。
[參考文獻]
[1]馬春樹,劉宇欣,鄭杰,等. 應用mRNA差異顯示技術克隆腫瘤轉移相關基因TMSG-1[J]. 中國科學:C輯, 2002,32(3):270-275.
[2]PEWZNER-JUNG Y, BEN-DOR S, FUTERMAN A H. When do lasses (longevity assurance genes) become CerS (ceramide synthases)? Insights into the regulation of ceramide synthesis[J]. Journal of Biological Chemistry, 2006,281(35):25001-25005.
[3]龔苗子,由江峰,崔湘林,等. 腫瘤轉移抑制相關基因TMSG-1核仁定位信號序列的鑒定[J]. 中華病理學雜志, 2011,40(11):767-771.
[4]王娟,高美華,張蓓. CD59與CD3在T細胞活化信號轉導中的協同作用[J]. 青島大學醫學院學報, 2012,48(4):287-290.
[5]李偉偉,高美華,張蓓,等. CD59配體肽基因對卵巢癌細胞CD59表達的影響[J]. 青島大學醫學院學報, 2010,46(4):301-303,306.
[6]蘇靜,由江峰,王潔良,等. 人腫瘤轉移抑制基因1轉染對人乳腺癌細胞MDA-MB-231體外生物學行為的影響[J]. 中華病理學雜志, 2007,36(10):672-676.
[7]邊巴,馬春樹,由江峰,等. TMSG-1基因轉染對腫瘤轉移表型的影響[J]. 北京大學學報:醫學版, 2003,35(1):18-22.
[8]蘇靜,由江峰,王潔良,等. 腫瘤轉移抑制基因1抑制前列腺癌細胞增殖和侵襲能力[J]. 中華腫瘤雜志, 2008,30(6):404-407.
[9]譚寧,覃文新,萬曉楨,等. LASS2基因抑制HCCLM3肝癌細胞的轉移[J]. 腫瘤, 2007,27(5):335-340.
[10]PEWZNER-JUNG Y, PARK H, LAVIAD E L, et al. A critical role for ceramide synthase 2 in liver homeostasis Ⅰ. Alte-rations in lipid metabolic pathways[J]. Journal of Biological Chemistry, 2010,285(14):10902-10910.
[11]POMERANTZ J L, SHARP P A. Homeodomain determinants of major groove recogntion[J]. Biochemistry, 1994,33(36):10851-10858.
[12]LIU U, DU X, KE Y. Mapping mucleolar localization sequences of 1/A6DRIM[J]. FEBS Lett, 2006,580(5):1405-1410.
[13]BROWN M S, GOLDSTEIN J L. The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor[J]. Cell, 1997,89(3):331-340.
[14]DENG J N, LIU S X, ZOU L Q, et al. Lipolysis response to endoplasmic reticulum stress in adipose cells[J]. J Biol Chem, 2012,287(9):6240-6249.

