乳房浸潤性導管癌組織miR-10b和miR-195表達及意義
,,,,
(青島大學醫(yī)學院,山東 青島 266003 1 附屬醫(yī)院乳腺外科; 2 生物化學與分子生物學教研室)
乳癌是女性最常見的惡性腫瘤之一,我國乳癌的發(fā)病率在近20年呈逐漸上升趨勢,尤其在京、津、滬等大城市,乳癌已位居女性惡性腫瘤發(fā)病率之首,嚴重危害女性健康[1]。micro RNAs(miRNAs)是一類由22個氨基酸組成、高度保守的單鏈非編碼RNA, 廣泛存在于真核細胞生物中,具有轉錄后基因調控功能。成熟的miRNAs通過堿基互補配對的方式與靶mRNA的編碼序列(CDS)或3′-非翻譯區(qū)(3′-UTR)結合,引起靶mRNA 的翻譯抑制或切割降解。miRNAs 具有多種生物學功能,在細胞發(fā)育、分化、增殖、凋亡過程發(fā)揮調控作用[2-4]。研究顯示, miRNA 10b(miR-10b)、miRNA 195(miR-195)在多種腫瘤細胞中表達均下調,與腫瘤的發(fā)生發(fā)展密切相關。本文通過研究miR-10b、miR-195在乳 癌組織中的表達及其與乳癌臨床病理特征之間的關系,探討miR-10b、miR-195在乳癌發(fā)生、發(fā)展中的作用。現將結果報告如下。
1 資料與方法
1.1 標本及其來源
乳癌及癌旁組織(距腫瘤邊緣≥5 cm)標本40例,取自我院2013年1—6月期間手術病人,均為女性,年齡28~77歲,中位年齡49.6歲。經術后病理檢查診斷為浸潤性導管癌。所有病人術前未接受放療、化療及內分泌治療。
1.2 實驗試劑及引物
RNAiso Plus(Total RNA提取試劑)及SYBR熒光定量試劑盒(SYBR?Premix Ex TaqTMⅡ)均由寶生物工程(大連)有限公司提供,逆轉錄試劑盒(BioRT Two Step RT-PCR Kit)購自博日科技有限公司。引物根據miRBASE數據庫設計,以U6作為內參,引物由上海桑尼生物科技有限公司合成,引物序列見表1。
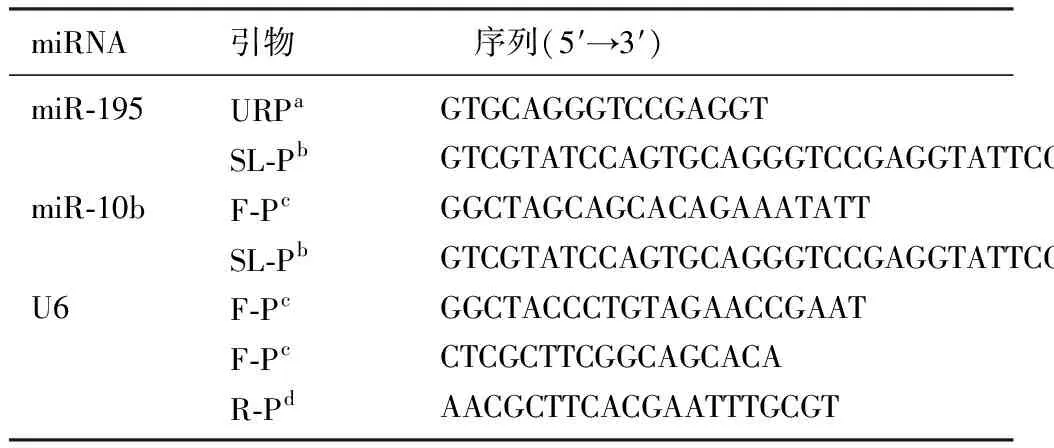
表1 各引物序列
注:a通用正向引物,b莖環(huán)引物,c正向引物,d反向引物。
1.3 檢測指標及方法
1.3.1TRIzol法提取總RNA 按Total RNA 提取試劑所示步驟提取組織中的總RNA,用紫外線分光光度計檢測總RNA濃度及其波長在260 nm和280 nm處吸光度(A)值,所得A260/280值均在1.8~2.0之間。
1.3.2miR-10b、miR-195表達檢測 采用實時熒光RT-PCR 方法。參照SYBR?Premix Ex TaqTMⅡ及BioRT Two Step RT-PCR Kit說明書進行逆轉錄及PCR反應,反應體系均為10 μL。逆轉錄反應條件為:55 ℃ 45 min,95 ℃ 5 min,4 ℃ 5 min;PCR反應條件為:94 ℃預變性10 min,94 ℃變性30 s,60 ℃退火30 s, 72 ℃延伸30 s,30個循環(huán)。以U6為內參基因,對目的基因進行均一化處理,根據熒光閾值(CT值)計算miR-10b、miR-195相對表達量,計算公式為2-△△CT。其中△CT=CT目標miRNA-CTU6,△△CT=△CT癌組織-△CT癌旁組織。
1.4 統(tǒng)計學處理
應用SPSS 16.0軟件進行統(tǒng)計學處理,數據間比較采用t檢驗,相關性分析采用Mann-Whitney U檢驗。
2 結 果
2.1 乳癌及癌旁組織miR-10b、miR-195表達比較
癌旁組織中miR-10b及miR-195的表達量為1.00,miR-10b、miR-195在乳癌組織中的相對表達量分別為0.35±0.40、0.44±0.46,乳癌組織與癌旁組織miR-10b、miR-195表達比較,差異有統(tǒng)計學意義(t=4.35、5.71,P<0.05)。
2.2 乳癌組織miR-10b、miR-195表達與臨床病理特征之間的關系
腫瘤直徑>5 cm的乳癌組織中miR-195表達較直徑≤5 cm者低,有淋巴結轉移及間質脈管癌栓的乳癌組織中miR-195表達明顯低于無淋巴結轉移、無間質脈管癌栓的乳癌組織,差異均有顯著意義(U=-2.127~-2.083,P<0.05);miR-10b表達與腫瘤大小、淋巴結轉移及間質脈管癌栓等均無相關性(P>0.05)。miR-10b、miR-195表達與腫瘤TNM分期、雌激素受體(ER)、孕激素受體(PR)及人表皮生長因子受體-2(Her-2)水平均無明顯相關性(P>0.05)。見表2。
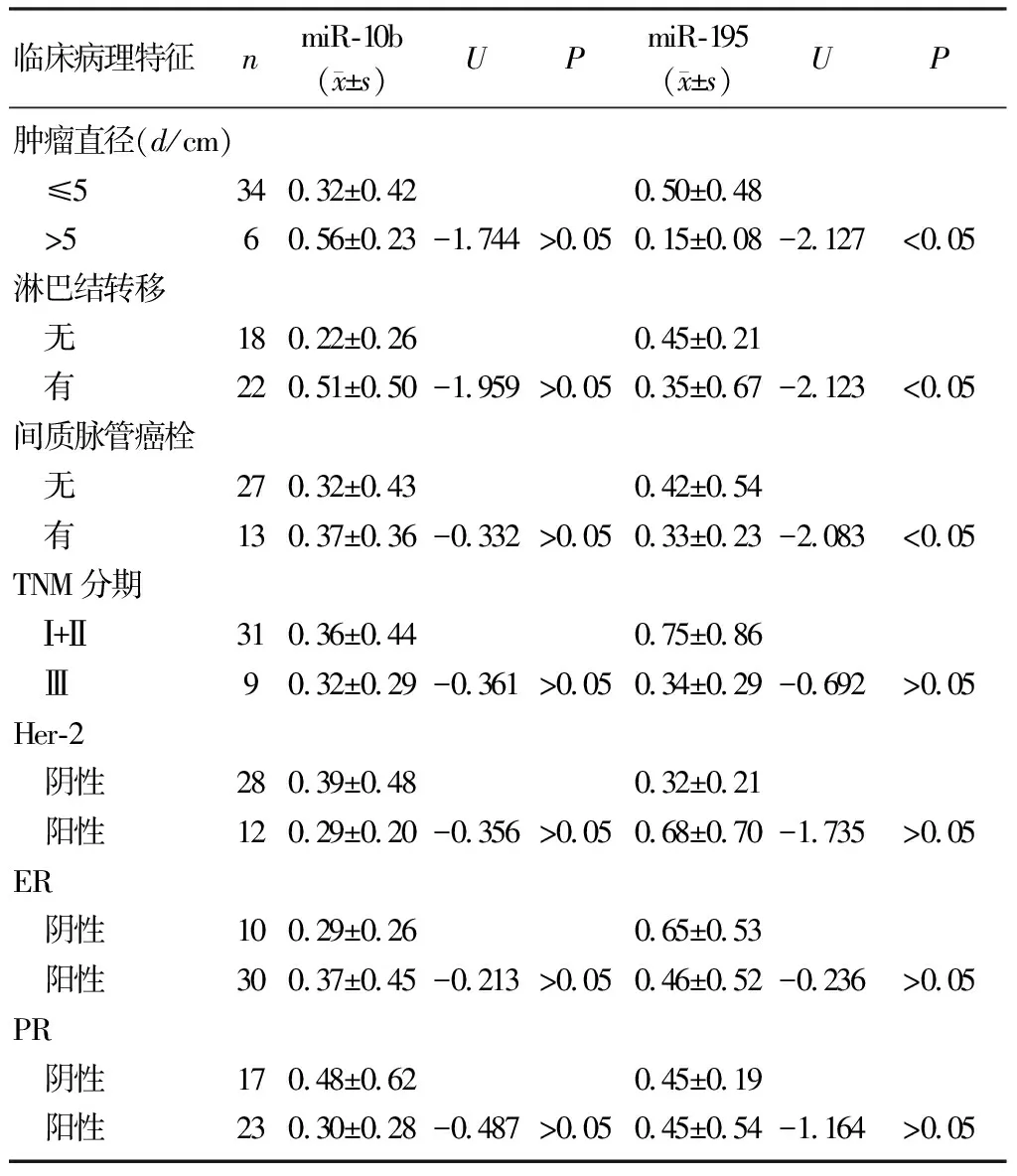
表2 miR-10b、miR-195表達與乳癌臨床病理特征的關系
3 討 論
2002年,CALIN等[5]首次報道m(xù)iRNAs表達異常與腫瘤相關,之后,眾多研究小組在多種人類腫瘤組織中檢測到miRNA異常表達。這些異常表達的miRNAs作用類似于癌基因或抑癌基因,如miRNA155作為癌基因,在一些淋巴瘤亞型中過度表達;而miRNA143和miRNA145作為抑癌基因在結、直腸癌的表達水平下降[6]。與乳癌相關的miRNAs目前也有報道。IORIO等[7]通過對10例正常乳房組織和76例乳癌組織miRNAs的表達水平進行比較,證實miR-125b、miR-145、miR-155和miR-21在乳癌中表達顯著下調,其中miR-155降低程度尤為明顯,miRNAs的表達水平與乳癌的病理生理學特征相關,如病理學分期、增殖指數、ER/PR表達[8]及血管受侵等。TAVAZOIE等[9]研究了一系列與乳癌轉移密切相關的miRNAs,其中miR-335、miR-206與miR-126對腫瘤轉移的抑制發(fā)揮著關鍵性作用。miR-195位于染色體17p13.1,屬于miR-15/16/195家族,該家族與腫瘤發(fā)生、發(fā)展密切相關。早期研究結果顯示,miR-195在肥大心肌細胞中過度表達,可致轉基因小鼠病理性心臟生長及心力衰竭。近期研究顯示,miR-195在多種腫瘤組織表達下調,包括胃癌[10]、肝癌[11]、膀胱癌[12]等。LI等[13]應用miR-195轉染MCF7及ZR-75-30細胞系,結果顯示miR-195高表達可顯著抑制細胞集落形成,誘導細胞G1期阻滯。已有研究顯示,原癌基因絲氨酸-蘇氨酸蛋白激酶(Raf-1)亦是miR-195的作用靶點,引入miR-195則可以抑制Raf-1的表達[14]。Raf-1在MAPK/ERK信號轉導通路中發(fā)揮作用,活化的Raf-1能夠調節(jié)細胞周期、細胞遷移、凋亡及分化。本實驗結果顯示,miR-195在乳癌組織中表達明顯下調,其表達水平與腫瘤大小、淋巴結轉移及脈管癌栓侵犯有關,與腫瘤TNM分期、ER、PR及Her-2水平無明顯相關性。提高miR-195可能對腫瘤的生長、浸潤、轉移起抑制作用。
有研究顯示,miR-10b能夠促進腫瘤細胞侵襲及轉移,其在轉移性乳癌中表達增高[15]。此外,非浸潤性乳癌組織中miR-10b表達上調可致腫瘤侵襲和轉移能力顯著增強。Twist是一種凋亡抑制蛋白,它可以與miR-10b啟動子區(qū)結合并誘導其表達,造成促轉移基因(RHOC)表達增加,從而引起腫瘤的侵襲及轉移[16]。本文研究結果顯示,miR-10b在癌組織中表達下調,其表達水平與腫瘤大小、有無脈管癌栓、TNM分期及ER、PR、Her-2水平等均無明顯相關性。說明miR-10b可能主要在腫瘤進展晚期發(fā)生遠處轉移的階段發(fā)揮作用。
綜上所述,miR-10b及miR-195在乳癌組織中表達明顯下調,可能在乳癌發(fā)生、發(fā)展中發(fā)揮作用,可作為篩查和診斷乳腺腫瘤的潛在生物學指標。
[參考文獻]
[1]邵志敏,沈鎮(zhèn)宙,徐兵河. 乳腺腫瘤學[M]. 上海:復旦大學出版社, 2013:1-5.
[2]HE L, HANNON G J. MicroRNAs: small RNAs with a big role in gene regulation[J]. Nat Rev Genet, 2004,5(7):522-531.
[3]VASUDEVAN S, TONG Y, STEITZ J A. Switching from repression to activation: microRNAs can up-regulate translation[J]. Science, 2007,318(5858):1931-1934.
[4]張騰龍,張鵬,孟月生,等. 多發(fā)性骨髓瘤組織微小RNA-19表達及其臨床意義[J]. 齊魯醫(yī)學雜志, 2013,(1):14-16.
[5]CALIN G A, DUMITRU C D, SHIMIZU M, et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia[J]. Proc Natl Acad Sci U S A, 2002,99(24):15524-15529.
[6]BOMMER G T, GERIN I, FENG Y, et al. p53-mediated activation of miRNA34 candidate tumor-suppressor genes[J]. Curr Biol, 2007,17(15):1298-1307.
[7]IORIO M V, FERRACIN M, LIU C G, et al. MicroRNA gene expression deregulation in human breast cancer[J]. Can-cer Res, 2005,65(16):7065-7070.
[8]JIANG S, ZHANG H W, LU M H, et al. MicroRNA-155 functions as an OncomiR in breast cancer by targeting the suppressor of cytokine signaling 1 gene[J]. Cancer Res, 2010,70(8):3119-3127.
[9]TAVAZOIE S F, ALARCON C, OSKARSSON T, et al. Endogenous human microRNAs that suppress breast cancer metastasis[J]. Nature, 2008,451(7175):147-152.
[10]GUO J, MIAO Y, XIAO B, et al. Differential expression of microRNA species in human gastric cancer versus non-tumorous tissues[J]. J Gastroenterol Hepatol, 2009,24(4):652-657.
[11]XU T, ZHU Y, XIONG Y, et al. MicroRNA-195 suppresses tumorigenicity and regulates G1/S transition of human hepatocellular carcinoma cells[J]. Hepatology, 2009,50(1):113-121.
[12]ICHIMI T, ENOKIDA H, OKUNO Y, et al. Identification of novel microRNA targets based on microRNA signatures in bladder cancer[J]. Int J Cancer, 2009,125(2):345-352.
[13]LI D, ZHAO Y, LIU C, et al. Analysis of miR-195 and miR-497 expression, regulation and role in breast cancer[J]. Clin Cancer Res, 2011,17(7):1722-1730.
[14]VAN ROOIJ E, SUTHERLAND L B, LIU N, et al. A signature pattern of stress-responsive microRNAs that can evoke cardiac hypertrophy and heart failure[J]. Proc Natl Acad Sci U S A, 2006,103(48):18255-18260.
[15]MA L, TERUYA-FELDSTEIN J, WEINBERG R A. Tumour invasion and metastasis initiated by microRNA-10b in breast cancer[J]. Nature, 2007,449(7163):682-688.
[16]BIAGIONI F, BOSSEL BEN-MOSHE N, FONTEMAGGI G, et al. miR-10b, a master inhibitor of the cell cycle, is down-regulated in human breast tumours[J]. EMBO Mol Med, 2012,4(11):1214-1229.

