中晚期肝癌患者肝門阻斷血流動力學和動脈血氣變化
趙德芳
(內蒙古醫科大學附屬醫院普通外科,呼和浩特 010059)
在肝癌患者的治療中,最常見的方法是肝葉切除手術。由于肝臟組織及解剖結構特點,肝葉切除術中有極易損傷肝靜脈和下腔靜脈引起大量出血的危險。臨床采用入肝血流阻斷法可有效減少肝出血,但肝門阻斷后對血流動力和血氣有影響[1-2]。本研究主要分析中晚期肝癌患者行入肝血流阻斷術的血流動力學和動脈血氣變化,為臨床治療提供依據。
1 對象與方法
1.1研究對象 收集2009年5月至2012年2月內蒙古醫科大學附屬醫院收治并確診的中晚期肝病患者36例,均行擇期肝葉切除術。其中原發性肝癌30例、肝海綿狀血管瘤 6例,男25例、女11例,年齡35~57(46.5±8.0)歲,符合美國麻醉醫師協會制訂的術前病情評估標準Ⅱ~Ⅲ級,肝功能分級均為A級,肺功能正常。排除標準:伴有系統性心、肺和腎疾病的患者;不能耐受全肝血流阻斷者;資料不齊患者;不配合治療者。
1.2手術方法 全身麻醉,取肋緣下切口,全方位拉鉤充分暴露手術視野,觸摸探查肝臟質地、硬化程度等,分離門靜脈、肝動脈和膽管左右支,阻斷左中肝靜脈和右肝靜脈,按第一肝門-肝下、肝上下腔靜脈順序依次阻斷肝血供,阻斷入肝血流時遇到迷走動脈,給予同時阻斷,行規則性和非規則性肝段或肝葉切除,由淺入深血管和膽管行鉗夾結扎,直至完整切除腫瘤,肝斷面對攏縫合或用生物膠封閉。術后足量應用廣譜抗生素,預防肺感染,利尿保肝,適當營養支持。
1.3觀察指標 術中記錄所有患者一般情況,肝門阻斷前,阻斷1、5、10、20 min和最終解除阻斷后30 min監測血流動力學指標,包括心率(heart rate,HR)、心臟指數(cardiac index,CI)、平均動脈血壓(mean artery pressure,MAP)、心排血量(cardiac outpout,CO)、左心做功指數(left ventricular work index,LCWI);肝門阻斷前、阻斷20 min和最終解除阻斷后30 min后抽取動脈血,行動脈血氣分析,包括血液酸堿度(pH)、中心靜脈壓(central venous pressure,CVP)、動脈血氧分壓(PaO2)、動脈CO2分壓(PaCO2)、堿剩余(base excess,BE)。
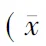
2 結 果
2.1肝門阻斷的血流動力學變化 與阻斷前比,CI 、CVP 隨著阻斷時間延長變化不顯著(P>0.05);HR隨著阻斷的時間延長而增高(P<0.05),MAP降低(P<0.05),CO降低(P<0.05),解除阻斷30 min 所有血流動力學指標均恢復至阻斷前水平(P>0.05)(表1)。
2.2肝門阻斷的動脈氣血變化 與阻斷前比,阻斷20 min后,pH、PaO2、PaCO2、BE均降低(P<0.05);解除阻斷30 min所有動脈氣血指標均恢復至阻斷前水平(P>0.05)(表2)。
2.3手術時間、出血量和術后并發癥 36例患者的平均手術時間為(121.1±26.4) min,平均出血量為(268±132) mL。術中未發生下腔靜脈及肝靜脈出血和空氣栓塞;術后1周大部分患者肝功能恢復正常,無繼發性大出血、肝靜脈流出道狹窄和死亡發生。3例患者術后胸腔積液,行抽液治愈,腹水2 例,保肝利尿治療后治愈出院。

表1 肝門阻斷的血流動力學變化
HR:心率;CI:心臟指數;MAP:平均動脈血壓;CO:心排血量;LCWI:左心做功指數

表2 肝門阻斷的動脈氣血學變化
PaO2:動脈血氧分壓;PaCO2:動脈CO2分壓;BE:堿剩余;1 kPa=7.6 mm Hg
3 討 論
肝切除術仍是目前治療肝臟腫瘤的主要方法。肝切除階段容易發生大出血,大量輸血又會增加術后感染風險,增加腫瘤手術的復發概率,甚至死亡。肝門阻斷法,又稱為入肝血流阻斷法,可顯著減少切肝時的出血量,是目前最常用的肝血流阻斷技術[3],無需分離和解剖肝門結構,操作簡便迅速[4]。
入肝血流阻斷法常用的阻斷時限為15~20 min,本研究中36例中晚期肝癌患者均行入肝血流阻斷法,阻斷時限為20 min,復流5 min后再次阻斷,最多者循環了3次,阻斷解除后30 min的血流動力和氣血指標均恢復至未阻斷前水平,未嚴重影響肝功能恢復。有研究采用阻斷時間15 min,阻斷時間縮短,可能會倉促結扎脈管,影響止血效果[5],因此應適當延長阻斷時間,尤其是肝癌患者絕大部分伴有肝硬化,對于巨大肝葉切除或鄰近第二、三肝門腫瘤切除者,可從容手術,止血效果較為滿意。同時要掌握手術指征,切忌對肝硬化患者肝門阻斷時間太長,缺血時間長可導致肝細胞缺血、缺氧,嚴重者加重術后肝功能紊亂[6]。
肝動脈可以提供50%以上的肝供氧量,實施下腔靜脈阻斷入肝血流的方法可阻斷一半以上的循環血液回流,血壓有所下降,本研究結果顯示MAP從阻斷前的(136.7±26.8) mm Hg降至阻斷20 min的(110.5±18.8) mm Hg(P<0.05)。但此時HR代償性增快(P<0.05);同時,正常人的胰十二指腸大部分位于腹膜之后,與體循環存在(如奇靜脈等)較多的側支循環,肝癌患者的側支循環更豐富,所以在門靜脈阻斷后,促使下半身和腹腔臟器的血液通過門體側支循環通路迅速回到體循環,因此本研究的患者行入肝血流阻斷術時CI、MAP、CVP、CO和LCWI有變化,但變化幅度較小,小部分的反流有助于減輕肝臟缺血/再灌注損傷。有研究顯示門靜脈阻斷時,盡管入肝血流量降低,但肝組織的氧分壓仍然可以滿足肝組織代謝需要的氧分[7-8]。本研究結果顯示,血液的PaO2、PaCO2與阻斷前比,變化幅度也較小,PaO2、pH的變化也在正常范圍內,因此血氣參數的小幅度波動和阻斷后恢復至阻斷前水平也佐證了上述觀點,與文獻結果類似[9]。對于肝癌伴有動脈硬化患者的耐受性相對較差,當阻斷下腔靜脈時,容易出現CO和血壓持續下降而不能耐受的情況,一般在釋放阻斷后,血氣和血流動力指標也可恢復正常[10]。另外,本研究中的總阻斷時間較短,出血量較少與該組患者的肝臟功能恢復狀況較好有密切關系。
綜上所述,對于中晚期肝癌患者采用肝門阻斷的方法行肝切除手術是安全、可靠的,具有以下優勢:可有效防止肝靜脈破裂引起的大出血和空氣栓塞;全身血液動力學和血氣相對穩定;采用間歇性阻斷,使切肝過程更加從容,操作簡單,不需要特殊儀器或器械,提高了手術切除率,安全性得到提高。
[1] 孫自強,靳松,馬國棟,等.肝血流阻斷技術的研究進展[J].國際外科學雜志,2010,37(11):762-764.
[2] Wu JX,Wang LM,Liu LG,etal.Application of selective and timely regional hepatic vascular occlusion for resection of large centrally located liver tumors:report of 133 cases[J].Zhonghua Zhong Liu Za Zhi,2012,34(11):850-854.
[3] 陳勇,張乙川,李金龍,等.三種不同肝血流阻斷方式在肝腫瘤切除術中的應用[J].實用臨床醫學,2009,10(3):37-39.
[4] Yi B,Qiu YH,Liu C,etal.Hepatic blood inflow occlusion with/without hemihepatic artery control versus the Pringle maneuver in resection of hepatocellular carcinoma:a retrospective comparative analysis[J].Chin Med J,2010,123(11):1413-1416.
[5] Wu CC,Yeh DC,Ho WM,etal.Occlusion of hepatic blood inflow for complex cent ral liver resections in cirrhotic patients:a randomized comparison of hemihepatic and total hepatic occlusion techniques[J].Arch Surg,2002,137(12):1369.
[6] Ishizaki Y,Yoshimoto J,Miwa K,etal.Safety of prolonged intermittent pringle maneuver during hepatic resection[J].Arch Surg,2006,141(7):649-654.
[7] 王鵬飛,李尚輝,張愛群.不同入肝血流阻斷方式對大鼠肝切除術后肝再生的影響[J].中國醫學科學院學報,2012,34(1):14-16.
[8] 文天夫,嚴律南.肝切除術中肝臟血流阻斷技術的研究進展[J].中國普外基礎與臨床雜志,2008,15(4):299-302.
[9] 傅思源,孫玉明,李愛軍,等.全肝血流阻斷和肝靜脈阻斷對肝腫瘤切除術中血流動力學的影響比較[J].肝膽胰外科雜志,2010,22(3):196-199.
[10] 姜德清,立全晰,耿強中晚期肝癌患者肝門阻斷時間和出血量與肝功能及預后的關系[J].中國綜合臨床,2005,21(2):151-153.

