黃芪甲苷抑制糖尿病大鼠足細胞凋亡的作用和機制研究
陳宜方 陳建國 王虹 鄭志貴 崔曉萌 何東元
●論 著
黃芪甲苷抑制糖尿病大鼠足細胞凋亡的作用和機制研究
陳宜方 陳建國 王虹 鄭志貴 崔曉萌 何東元
目的 探討黃芪甲苷(AS-IV)抑制糖尿病大鼠足細胞凋亡的作用及其機制,為糖尿病腎病的治療開辟新途徑。方法將體重180~220g健康雄性SD大鼠按配伍法分為正常對照組、糖尿病組和糖尿病AS-IV治療組,每組10只,鏈脲霉素(STZ)腹腔注射法建立糖尿病大鼠模型,糖尿病AS-IV治療組予AS-IV 10mg/(kg·d)治療,共8周;糖尿病組予等量1%CMC混懸液;正常對照組不予處理。第8周末測量大鼠體重、24h尿白蛋白、血糖、糖化血紅蛋白(HbA1c)、ALT、血尿素氮、肌酐水平;PAS、Masson染色,光鏡觀察腎臟病理變化;腎母細胞瘤基因1(WT-1)免疫組織化學染色觀察腎小球足細胞密度變化,TUNEL染色觀察足細胞凋亡,real-time PCR及Western blot測大鼠腎皮質凋亡相關蛋白Bcl-2、Bax及其mRNA表達的變化。結果 與正常對照組相比,糖尿病組大鼠血糖、HbA1c和24h尿白蛋白增高,腎小球足細胞數量減少,系膜增生,足細胞凋亡增加,Bcl-2及其mRNA表達下調,Bax及其mRNA表達上調,差異均有統計學意義(均P<0.05)。AS-IV可顯著改善糖尿病大鼠蛋白尿,抑制腎小球足細胞數目減少、系膜區增生、足細胞凋亡,上調Bcl-2表達,抑制Bax表達。結論 AS-IV對早期糖尿病大鼠足細胞具有保護作用,可能與其調節凋亡蛋白Bcl-2和Bax,抑制足細胞凋亡相關。
黃芪甲苷 糖尿病腎病 足細胞 凋亡
糖尿病腎病是糖尿病微血管并發癥,是糖尿病患者死亡的重要原因之一。在歐美等發達國家和我國沿海發達城市,糖尿病腎病已經成為慢性腎臟疾病的首要病因[1]。足細胞和腎小球基底膜、毛細血管內皮細胞共同組成腎臟濾過屏障,足細胞功能障礙和(或)數量減少直接導致蛋白尿的產生[2]。既往研究顯示,足細胞凋亡在糖尿病腎病的發生、發展過程中起重要作用,但目前尚無針對足細胞凋亡的特異性藥物[3]。黃芪是祖國中醫治療腎臟疾病的傳統中藥之一,黃芪甲苷(AS-IV)是黃芪主要活性成分之一。前期研究顯示,AS-IV可抑制高糖誘導的足細胞凋亡[4],現進一步探索AS-IV能否抑制糖尿病大鼠足細胞凋亡并探索相關機制,旨在為糖尿病腎病的治療提供新的思路,現報道如下。
1 材料和方法
1.1 材料 鏈脲霉素(STZ)、AS-IV單體(TLC純度達98%)、羧甲基纖維素(美國Sigma公司),Trizol試劑、逆轉錄試劑盒SuperScript RT kit Total(美國Invitrogen公司),兔源性抗腎母細胞瘤基因1(WT-1)(一抗)、抗Bcl-2、抗Bax、抗β-actin抗體、辣根過氧化物酶標記的山羊抗兔(二抗)、ECL化學發光劑(美國Santa Cruz公司),TUNEL染色試劑盒(美國Roche公司),Triton X-100裂解緩沖液、BCA蛋白檢測試劑盒(中國上海聯碩生物科技有限公司);便攜式血糖儀(美國Roche公司),自動生化分析儀(美國Technicon公司),免疫發光分析儀(美國雅培公司),Bio-Rad2000凝膠成像系統(美國Bio-Rad公司),Rotor-Gene3000 PCR儀(澳大利亞Corbett Research公司)。
1.2 糖尿病模型的建立及處理 體重180~220g健康雄性SD大鼠30只(浙江大學動物實驗中心)按照配伍法分為正常對照組、糖尿病組和糖尿病AS-IV治療組,每組10只。STZ溶于0.1mol/L檸檬酸沖液(pH 4.2)中,65mg/kg一次性腹腔注射法建立糖尿病模型。STZ注射后72h斷尾采血,空腹血糖>16.7mmol/L認為糖尿病造模成功。AS-IV溶于1%羧甲基纖維素(CMC)中。糖尿病AS-IV治療組大鼠在造模成功后予AS-IV 10mg/(kg· d)灌胃,共8周。糖尿病組給予等量1%CMC混懸液。正常對照組不予處理。第8周末收集各組大鼠24h尿液,免疫比濁法測尿白蛋白。測量大鼠體重,戊巴比妥納麻醉后心臟取血,用于生化指標檢測。留取雙側腎臟,用于光鏡病理、免疫組化、Western blot及real-time PCR檢測,多余組織液氮速凍后-80℃保存。
1.3 生化項目檢查 便攜式血糖儀檢測血糖,化學發光法測血糖化血紅蛋白(HbA1c),自動生化分析儀檢測ALT、肌酐、尿素氮。
1.4 病理檢查 腎組織以4%中性甲醛固定,常規石蠟包埋、切片,分別行PAS和Masson染色,光鏡下觀察腎組織形態學變化。每張腎臟切片隨機觀察20個視野。PAS染色觀察腎小球系膜增生,用圖像分析軟件Image-Pro Plus 6.0[5]對腎小球系膜區進行吸光度掃描,計算每個腎小球系膜區與腎小球總面積,以系膜區總面積/腎小球總面積半定量表示系膜增生情況。Masson染色觀察間質纖維化,半定量評分標準如下:0,無纖維化;1,纖維化面積<10%;2,纖維化面積10%~25%;3,纖維化面積25%~50%;4,纖維化面積>50%[6]。
1.5 腎小球足細胞密度檢測 免疫組化檢測足細胞特異抗原WT-1。加入一抗,二氨基聯苯胺顯色,WT-1陽性的足細胞染成棕色。平均每只大鼠觀察20個腎小球,圖像分析軟件為Image pro plus 6.0,WT-1陽性面積/腎小球面積代表足細胞密度,計算均值和標準差。
1.6 足細胞凋亡檢測 根據說明書采用TUNEL染色試劑盒染色大鼠腎組織石蠟切片,凋亡細胞染成棕色。位于腎小球基底膜外側的陽性細胞為凋亡足細胞。平均每只大鼠觀察5個400倍視野,統計凋亡足細胞,計算均值和標準差。
1.7 Western blotTriton X-100裂解緩沖液溶解腎組織并在冰浴中充分勻漿。BCA蛋白檢測試劑盒檢測腎組織蛋白濃度。SDS-PAGE凝膠電泳分離樣品,100V電轉膜至PVDF膜。含 2%牛血清白蛋白的TBST(20mmol/L Tris-HCl,150mmol/L NaCl,0.1%Tween 20)室溫孵育60min封閉非特異性位點,抗Bax、Bcl-2、βactin抗體4℃孵育24h,加入二抗室溫孵育60min,ECL液顯色檢測蛋白信號,Bio-Rad2000凝膠成像系統掃描蛋白條帶的光密度。實驗重復3次,計算均值和標準差。
1.8 real-time PCR檢測 Trizol法提取腎組織總RNA。根據說明書采用逆轉錄試劑盒SuperScript RT kit Total合成cDNA。Bcl-2引物上游序列為5'GGGATGCCTTTGTGGAACTATATG3',下游序列為5'CAGCCAGGAGAAATCAAACAGA3'。Bax引物上游序列為5'AGACACCTGAGCTGACCTTGGA3',下游序列為5'CGCTCAGCTTCTTGGTGGAT3';GAPDH為內參,上游序列為5'TCCCTCAACATTGTCAGCAA3',下游序列為 5'AGCTCCACAACGGATACATT3'。采用Rotor-Gene3000 PCR儀進行real-time PCR檢測。反應條件為94℃預變性5min,95℃變性10s,59℃退火15s,72℃延伸20s,擴增40個循環最后72℃延伸5min。熒光定量分析軟件讀取并計算目標mRNA/GAPDH mRNA的比值。實驗重復3次,計算均值和標準差。
1.9 統計學處理 采用SPSS 17.0統計軟件。計量資料以表示,組間比較采用單因素方差分析。
2 結果
2.1 各組大鼠8周末24h尿白蛋白水平的比較 正常對照組8周末24h尿白蛋白水平為(308.60±41.23)mg,糖尿病組為(3 203.78±492.14)mg,糖尿病AS-IV治療組為(2 080.52±412.31)mg。與正常對照組相比,糖尿病組、糖尿病AS-IV治療組大鼠尿白蛋白水平均顯著增加,差異均有統計學意義;糖尿病AS-IV治療組大鼠尿白蛋白水平低于糖尿病組,可見AS-IV能顯著降低糖尿病大鼠尿白蛋白水平。
2.2 各組大鼠腎組織光鏡及半定量分析結果的比較光鏡病理示糖尿病大鼠腎小球系膜增生,部分腎小管間質纖維化,AS-IV治療后可顯著緩解糖尿病大鼠腎臟系膜增生和間質纖維化;與正常對照組比較,糖尿病組、糖尿病AS-IV治療組的系膜增生比例、間質纖維化指數均明顯增高,差異均有統計學意義;AS-IV治療后系膜增生比例、間質纖維化指數明顯低于糖尿病組,差異有統計學意義,詳見圖1(見插頁)、表1。

表1 各組大鼠腎組織系膜增生比例和間質纖維化指數比較
2.3 各組大鼠腎組織WT-1免疫組化染色及足細胞密度半定量分結果析的比較 WT-1免疫組織化學染色結果顯示,AS-IV可抑制糖尿病大鼠腎臟足細胞減少;半定量分析結果顯示,正常對照組足細胞密度為4.13×10-4±7.62×10-5,糖尿病組為8.67×10-5±1.64×10-5,糖尿病AS-IV治療組為2.48×10-4±7.29×10-5,糖尿病大鼠腎臟足細胞密度較正常對照組顯著降低,而糖尿病AS-IV治療組足細胞密度高于糖尿病組,差異均有統計學意義,詳見圖2(見插頁)。
2.4 各組大鼠腎臟TUNEL染色和凋亡足細胞半定量分析 TUNEL染色結果顯示,AS-IV可抑制糖尿病大鼠足細胞凋亡;半定量分析結果顯示,正常對照組凋亡足細胞(0.867±0.571)個,糖尿病組為(7.933±1.388)個,糖尿病AS-IV治療組為(6.033±1.326)個。糖尿病大鼠足細胞凋亡較正常對照組顯著增加,而AS-IV治療后凋亡足細胞數明顯減少,差異均有統計學意義,詳見圖3(見插頁)。
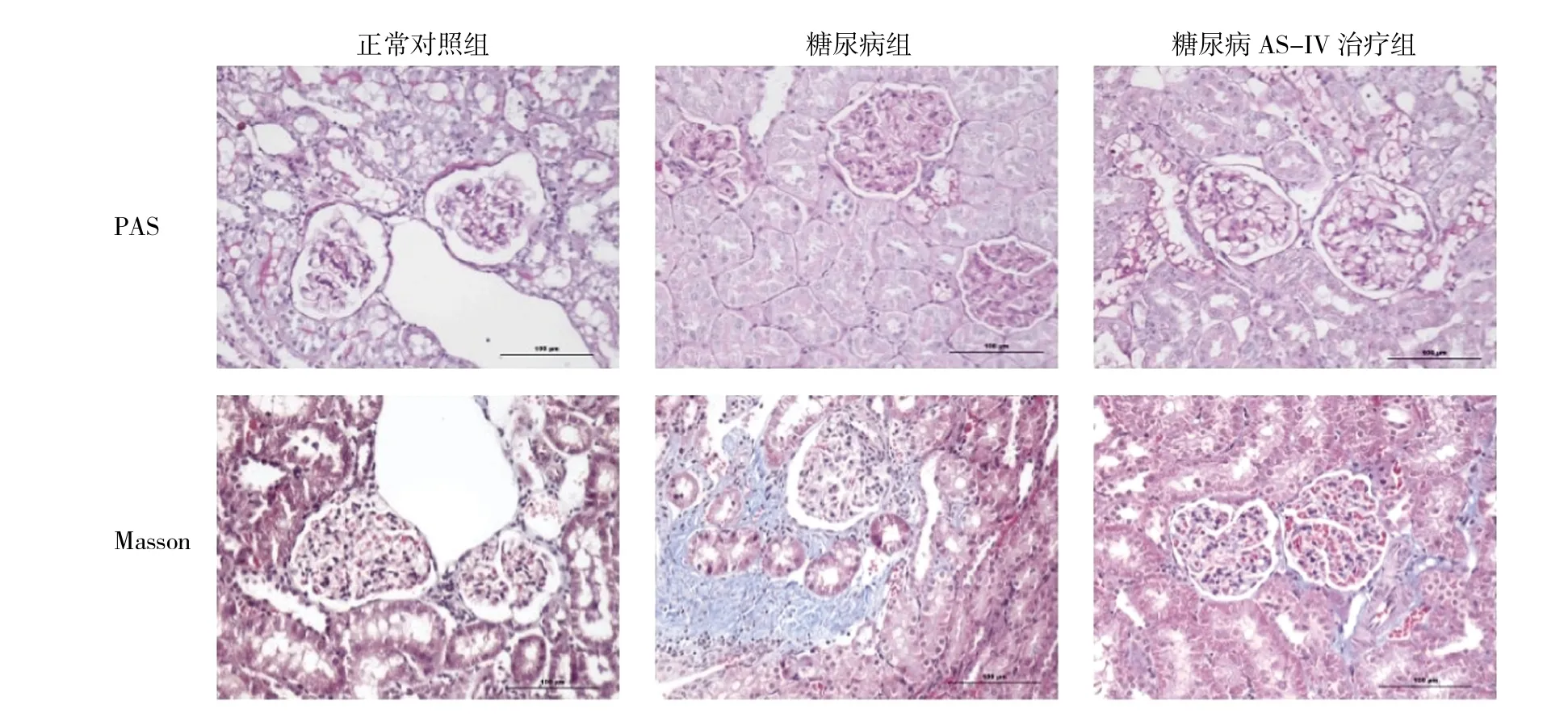
圖1 各組大鼠腎組織光鏡結果(腎組織PAS和Masson染色,×200)

圖2 各組大鼠腎組織WT-1免疫組化染色結果(棕色為WT-1陽性足細胞;×200)
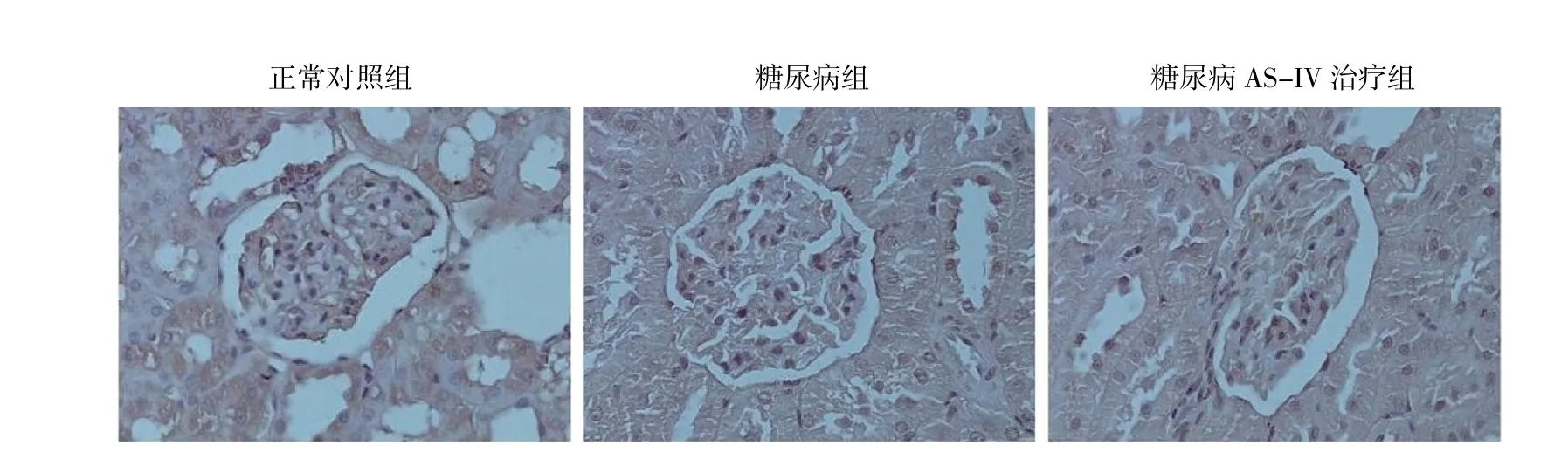
圖3 各組大鼠腎臟TUNEL染色結果(位于腎小球基底膜外側的棕色細胞為凋亡的足細胞;×400)
2.5 各組大鼠腎組織Bax、Bcl-2及其mRNA表達的比較 和正常對照組相比,糖尿病大鼠Bcl-2 mRNA表達降低,Bax mRNA表達增加;AS-IV可部分恢復Bcl-2 mRNA的表達,抑制Bax mRNA表達增加,差異均有統計學意義。Western blot檢測顯示,各組大鼠腎臟Bcl-2、Bax變化趨勢和mRNA表達一致。和正常對照組相比,糖尿病大鼠Bcl-2表達降低,而Bax表達增加,AS-IV治療可抑制Bax的升高和Bcl-2的降低,詳見圖4、表2。
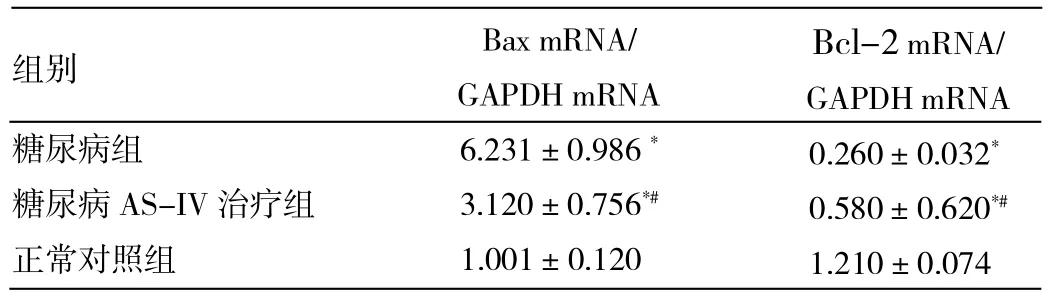
表2 各組大鼠腎組織Bax、Bcl-2 mRNA表達
2.6 各組大鼠8周末體重和生化指標的比較 與正常對照組大鼠相比,糖尿病組大鼠體重明顯降低,血糖、HbA1c明顯升高,差異均有統計學意義,ALT、尿素氮、肌酐雖有升高,但差異均無統計學意義。AS-IV治療對血糖、HbA1c、尿素氮、肌酐無顯著影響,詳見表3。
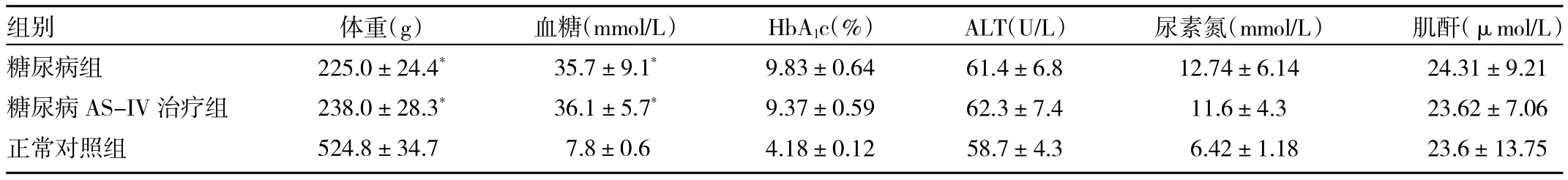
表3 各組大鼠8周末體重和生化指標的比較
3 討論
目前糖尿病腎病已經成為終末期腎衰竭的首要病因,其早期表現為微量白蛋白尿,晚期有腎小球濾過率(GFR)的下降以及心血管并發癥[7]。糖尿病腎病的主要病理改變有:腎小球基底膜增厚、系膜區擴張、系膜細胞增生、基質增多等。本研究通過STZ腹腔注射法建立糖尿病大鼠模型。糖尿病大鼠血糖、HbA1c和24h尿白蛋白水平顯著高于正常對照組,8周末血尿素氮、肌酐也顯著升高,光鏡病理顯示腎臟系膜增生和間質纖維化,說明AS-IV治療可改善糖尿病大鼠蛋白尿以及腎組織病理學。
足細胞是腎小球濾過屏障的最外層,是高度分化的特異細胞,幾乎沒有增殖能力。足細胞數目減少直接導致蛋白尿的發生[8-9]。Siu等[10]研究發現糖尿病大鼠足細胞數量和密度從2周起就出現減少,且隨著病程的延長而加劇。Steffes等[11]研究發現1型糖尿病患者足細胞數量減少與年齡、病程長短無明顯相關。因此,抑制足細胞減少應成為糖尿病腎病的治療靶點。
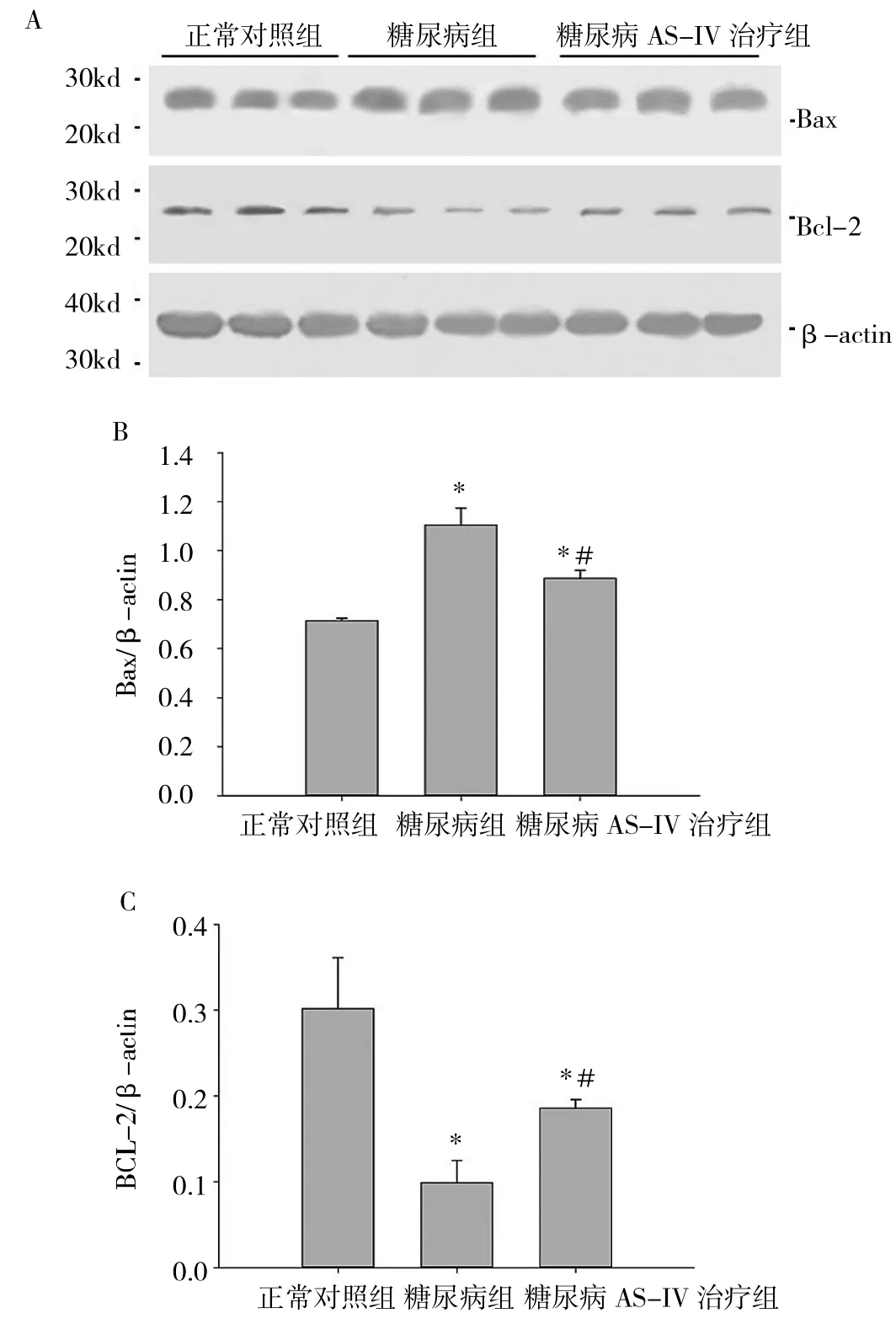
圖4 各組大鼠腎組織Bax、Bcl-2及其mRNA表達和半定量分析(A:Bax、Bcl-2光密度圖;B:Bax表達半定量分析;C:Bcl-2表達半定量分析;與正常對照組比較,*P<0.05;與糖尿病組比較,#P<0.05)
WT-1為足細胞特異性蛋白,與腎臟發育密切相關,出生后僅在于成熟足細胞表達,對足細胞功能的維持起重要作用[12]。本研究中采用WT-1免疫組化染色標記足細胞,并通過圖像分析軟件對足細胞密度進行半定量分析,結果表明糖尿病大鼠足細胞密度較正常對照組顯著降低,而AS-IV治療可緩解足細胞密度下降。
凋亡是糖尿病腎病足細胞減少的重要原因[13],這一過程伴隨著抗凋亡蛋白Bcl-2和促凋亡蛋白Bax的表達變化[14]。高糖的滲透作用不是糖尿病足細胞凋亡的原因,相同滲透濃度的D-甘露醇并不能誘導足細胞凋亡[4]。為探索AS-IV的緩解足細胞丟失的相關機制,筆者觀察了足細胞凋亡和Bax、Bcl-2 mRNA的表達變化。Bax介導TGF-β1誘導的足細胞凋亡[7]。在人類IgA腎病中,足細胞Bcl-2表達下降與腎小球進行性損傷及預后不良相關[15]。本研究結果顯示糖尿病大鼠足細胞凋亡增加,腎皮質Bax及其mRNA表達增加,Bcl-2及其mRNA表達降低。AS-IV可抑制糖尿病大鼠腎臟足細胞凋亡,抑制Bax、Bcl-2及其mRNA的表達變化,提示可能ASIV通過調節Bax和Bcl-2,抑制足細胞凋亡,抑制足細胞數量的減少。
最后,筆者研究了各組大鼠體重和生化指標的變化。糖尿病AS-IV治療組和糖尿病組大鼠的血糖、HbA1c、ALT、血肌酐和尿素氮差異均無統計學意義,提示AS-IV抗足細胞凋亡和降低蛋白尿的作用和血糖調控無關,且無明顯肝腎毒副反應,表明AS-IV可能成為一種安全有效的藥物用于治療糖尿病腎病。
綜上所述,AS-IV可通過調節Bax、Bcl-2的表達,抑制足細胞凋亡,減少蛋白尿,緩解糖尿病腎病,該研究結果對開發直接針對腎小球足細胞的腎臟保護藥物提供了實驗基礎。
[1]Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].The Lancet,2012, 379(9818):815-822.
[2]Mundel P,Shankland S J.Podocyte biology and response to injury[J].Journal of the American Society of Nephrology,2002,13 (12):3005-3015.
[3]Marshall S M.The podocyte:a potential therapeutic target in diabetic nephropathy[J]?Current pharmaceutical design,2007, 13(26):2713-2720.
[4]Gui D,Guo Y,Wang F,et al.Astragaloside IV,a novel antioxidant,prevents glucose-induced podocyte apoptosis in vitro and in vivo[J].PloS one,2012,7(6):e39824.
[5]So B I,Song Y S,Fang C H,et al.G-CSF prevents progression of diabetic nephropathy in rat[J].PloS one,2013,8(10):e77048.[6]Fujihara C K,Noronha I D L,Malheiros D M A C,et al.Combined mycophenolate mofetil and losartan therapy arrests established injury in the remnant kidney[J].Journal of the American Society of Nephrology,2000,11(2):283-290.
[7]Parving H H.Diabetic nephropathy:prevention and treatment[J].Kidney international,2001,60(5):2041-2055.
[8]Kim Y H,Goyal M,Kurnit D,et al.Podocyte depletion and glomerulosclerosis have a direct relationship in the PAN-treated rat[J].Kidney international,2001,60(3):957-968.
[9]Shankland S J.The podocyte's response to injury:role in proteinuria and glomerulosclerosis[J].Kidney International,2006,69 (12):2131-2147.
[10]Siu B,Saha J,Smoyer W E,et al.Reduction in podocyte density as a pathologic feature in early diabetic nephropathy in rodents:prevention by lipoic acid treatment[J].BMC Nephrology, 2006,7(1):6.
[11]Steffes M W,Schmidt D,Mccrery R,et al.Glomerular cellnumber in normal subjects and in type 1 diabetic patients[J].Kidney international,2001,59(6):2104-2113.
[12]Michaud J,Kennedy C.The podocyte in health and disease: insightsfromthemouse[J].Clinicalscience,2007,112:325-335.
[13]Xu J,Li Z,Xu P,et al.Protective effects of leukemia inhibitory factor against oxidative stress during high glucose-induced apoptosis in podocytes[J].Cell Stress and Chaperones,2012, 17(4):485-493.
[14]Schiffer M,Bitzer M,Roberts I S D,et al.Apoptosis in podocytes induced by TGF-β and Smad7[J].The Journal of clinical Investigation,2001,108(108(6)):807-816.
[15]Qiu L Q,Sinniah R,Stephen I,et al.Downregulation of Bcl-2 by podocytes is associated with progressive glomerular injury and clinical indices of poor renal prognosis in human IgA nephropathy[J].Journal of the American Society of Nephrology, 2004,15(1):79-90.
Inhibitory effects of astragaloside IV on apoptosis of podocytes and its mechanism in diabetic rats
Objective To investigate the effects of astragaloside IV(AS-IV)on apoptosis of podocytes and its mechanism in diabetic rats.Methods Male SD rats were randomly divided into normal control group,diabetes group and diabetes with AS-IV treatment group with 10 in each group.Diabetes was induced by STZ intraperitoneal injection in rats.Rats in treatment group were given AS-IV 10mg/kg/d for 8 weeks.At the end of the 8th week,24h microalbumin,body weight,blood glucose, blood glycated hemoglobin A1c,alanine aminotransferase,blood urea nitrogen and creatinine were measured;renal pathological changes were evaluated by light microscopy with PAS and Masson staining;glomerular podocyte density was examined by WT-1 immunohistochemical staining;podocyte apoptosis was detected by TUNEL;the mRNA and protein expression of Bax and Bcl-2,apoptosis-related proteins in rat renal cortex were determined by Western blot and real time-PCR. Results Hyperglycemia,increased 24h microalbumin,mesangial expansion,interstitial fibrosis,podocyte loss and podocyte apoptosis,increased mRNA and protein expression of Bax and decreased mRNA and protein expression of Bcl-2 were detected in diabetic rats.AS-IV treatment inhibited podocyte apoptosis,ameliorated podocyte loss and renal histopathology,decreased microalbumin,partially restored mRNA and protein expression of Bax and Bcl-2.Conclusion AS-IV may inhibit podocyte apoptosis and ameliorate diabetic nephropathy by inhibiting the expression of Bax and restoring the expression of Bcl-2 in diabetic rats.
Astragaloside IV Diabetic nephropathy Podocyte Apoptosis
2014-07-03)
(本文編輯:嚴瑋雯)
浙江省自然科學基金項目(LY12H05001)
310013 杭州,浙江醫院腎內科
何東元,E-mail:hdy331@qq.com

