葡萄花色苷的合成及穩定性研究進展
王維茜,鄧潔紅 *,魏一枝,劉永紅
(1.湖南農業大學 食品科學技術學院 食品科學與生物技術湖南省重點實驗室,湖南 長沙 410128;2.湖南生物機電職業技術學院,湖南 長沙410127)
隨著葡萄酒業的規模化和快速發展,葡萄酒業已遍布全球五大洲,葡萄酒的生產大國也不再局限于西歐國家,在美洲、大洋洲、非洲和亞洲也崛起了一些葡萄酒生產大國。國際知名的釀酒葡萄品種有黑皮諾(Point Noir)、佳美(Gamay)、西哈(Syrah)、歌海娜(Grenache)、慕爾維特(Mourvedre)、佳麗釀(Carignan)、美樂(Merlot)、呂麗珠(Cabernet Franc)、赤霞珠(Cabernet Sauvignon)、馬爾貝克(Malbec)、塔娜(Tannat)、神索(Cinsaut)等,國內葡萄品種比較匱乏,研究比較多的葡萄品種有巨峰(Kyoho)、山葡萄(Vitis amurensis)、刺葡萄(Vitis davidiiFoex)等。不同葡萄品種花色苷含量有顯著差異,花色苷具有抗氧化作用,可以清除體內的自由基;能降低高血脂水平,改善高甘油脂脂蛋白膽固醇含量;具有抗腫瘤、抗變異、抗過敏、保護胃粘膜等多種生理功效。目前,絕大部分的葡萄都用來生產葡萄酒和葡萄汁,而花色苷含量高的葡萄皮渣變成生產廢料,是一種巨大的能源浪費,開發利用葡萄皮中花色苷具有非常重要的實用價值和廣闊的應用前景。
1 葡萄花色苷的研究概況
1.1 葡萄花色苷的結構及性質
自然條件下游離的花色素極少,在植物中花色苷均以糖苷的形式存在。花色苷的結構母核是2-苯基苯并吡喃陽離子,如圖1所示。重要的花色苷有6類,即花青素、飛燕草色素、錦葵素、芍藥素、牽牛花色素和天竺葵色素,常與1 個或多個葡萄糖、半乳糖、木糖、鼠李糖、阿拉伯糖等通過糖苷鍵與花色素C環3位或5位羥基相連形成花色苷;與花色素結合的二糖有槐糖、蕓香糖;三糖有2G-木糖苷蕓香糖、葡萄糖苷蕓香糖。最常見的4種花色素配糖形式是3-單糖苷、3-雙糖苷、3,5-二糖苷、3,7-二糖苷[1]。一般認為花色素呈色反應其顏色差異決定于取代基的不同。最常見的酰化形式是酰化取代基與C-6位的羥基酯化或與C-3位的糖鍵合,能引起酰化的酸主要有咖啡酸、對香豆酸、對羥基苯甲酸、芥子酸、阿魏酸、蘋果酸、丙二酸、乙酸和琥珀酸。AMICO V等[2]認為紅葡萄酒之中的花色苷含量與組成,與葡萄的品種、地理位置、季節、成熟度、產量都有關系;即使是同一個種內的不同品種,花色苷的組成與分布也有差異,并使品種具有其顏色特征。歐亞種葡萄中花色苷主要有5種,分別為錦葵素、甲基錦葵素、花青素、二甲基花青素、芍藥素。紅葡萄皮中的花色苷主要為錦葵素3-O-葡萄糖苷、芍藥素3-O-葡萄糖苷、錦葵素3-O-(6-O-乙酰)-葡萄糖苷[3]。花色苷溶于水和乙醇,不溶于乙醚、氯仿等有機溶劑。遇醋酸鉛試劑會沉淀,并能被活性炭吸附。其顏色隨pH值不同而變化,在酸性條件下呈紅色,在中性、近中性條件下呈無色,在堿性條件下呈藍色。
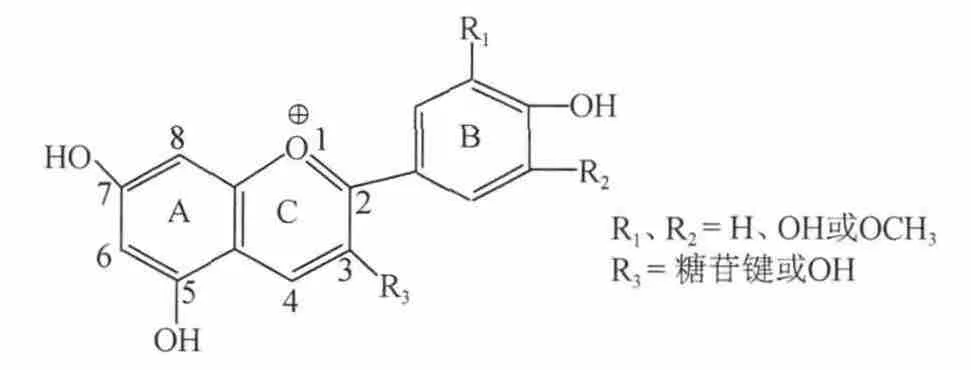
圖1 花色苷的化學結構Fig.1 The chemical structure of anthocyanins
1.2 葡萄花色苷的合成
許多研究發現花色苷合成的最初前體物質為苯丙氨酸,這一過程極其復雜,而且由不同的酶催化。花色苷的生物合成有特定的調節機制,并受兩套基因控制,即結構基因和調節基因。結構基因即直接編碼色素合成的酶,是所有植物共有的,通過轉錄起作用。相關酶包括花色苷合成酶(anthocyanins synthetase,ANS)、二氫黃酮醇-4-還原酶(dihydroflavonol-4-reductase,DFR)、查爾酮合成酶(chalonesynthase,CHS)、查爾酮異構酶(chalcone isomerase,CHI)、黃烷酮-3-羥基化酶(flavanone-3-hydroxylase,F3H)、類黃酮葡萄糖基轉移酶(UDP-glycose:flavonoid glycosyltransferase,UFGT)。調節基因即調節結構基因活性和表達,決定了花色苷積累的時間和分布。相關酶包括苯丙氨酸解氨酶(phenylalanine ammonialyas,PAL)和類黃酮-3-O糖基轉移酶(3-O-glycosyltransferases,3GT)、肉桂酸-4-羥基羧化酶(cinnamate-4-hydroxylase,C4H)、對香豆酰-CoA連接酶(4-coumaryl:CoA ligase,4CL)、黃酮合酶(flavonol synthase,FS);異黃酮合酶(isoflavone synthase,IFS)、黃烷酮-3′-羥基化酶(flavanone-3-hydroxylase,F3′H)、黃烷酮-3′,5′羥基化酶(flavanone-3′,5′-hydroxylase,F3′5′H)、黃酮醇合成酶(flavonol synthase,FLS)等[4]。苯丙氨酸解氨酶(phenylalaninammonia-lyase,PAL)是多酚物質代謝途徑中的一個限速酶,F3′H是過氧化物酶,催化二氫黃烷酮生成二氫山奈酚(dihydrokaempferol,DHK),二氫黃酮醇-4-還原酶(dihydro flavonol-4-reductase,DFR)是催化二氫山奈酚、二氫楊梅黃酮(dihydromyricetin,DHM)和二氫槲皮素(dihydroquercetin,DHQ)分別是生成無色天竺葵苷元、無色飛燕草色素和無色花青素的關鍵酶,查爾酮合成酶(CHS)是催化生成苯基苯乙烯酮的關鍵酶,花色苷合成酶(ANS)催化無色花青素轉變為有色花青素,F3′H和F3′5′H決定花色苷的羥化模式,最后3GT催化花青素與糖基形成花色苷[5]。花色苷的合成途徑分3個步驟:第一步由PAL催化苯丙氨酸生成肉桂酸,再形成香豆素-CoA;第二步由香豆素-CoA和丙二酰-CoA反應生成無色的柚苷配基;第三步由柚苷配基還原成花白素,生成的最終產物花青素經3GT催化與糖縮合形成花色苷貯存在液泡中[6]。花色苷合成途徑見圖2,氣候條件、栽培條件對花色苷的形成與積累有很大影響。一般認為隨著海拔高度和緯度的增加,紫外線照射加強,果實的著色率和著色度會明顯提高。晝夜溫差對花色苷合成和葡萄漿果著色影響較大。光照、較低的溫度、適度限制灌水都能促進花色苷的形成。而高施氮肥會抑制花色苷的形成,過多地施氮肥會導致果實的著色不良[7]。

圖2 花色苷合成途徑Fig.2 The way of anthocyanins synthesis
2 葡萄皮花色苷穩定性的影響因素
花色苷有其獨特的缺電子結構,極其不穩定。花色苷的4種結構變化形式為藍色的醌式堿(A)、紅色的二苯并吡喃陽離子(AH+)、無色的甲醇假堿(B)、無色的查爾酮(C),這四種物質的相互轉化能造成花色苷顏色的變化,穩定性也直觀的體現在顏色的變化上。花色苷的穩定性受到許多因素的影響,如光和熱、pH值、金屬離子、酶、糖類和等。
2.1 光和熱
花色苷在不同溫度下的降解遵循一級動力學反應規律,二苯基苯并吡喃陽離子(AH+)的失電子過程:AH+→A是一個放熱反應,而水解反應AH+→B和開環反應B→C均為吸熱反應,因此當溫度升高時,平衡向著無色的查爾酮(C)和甲醇假堿(B)形式轉化,但當冷卻和酸化時,醌式堿(A)和甲醇假堿(B)還可轉變成陽離子(AH+)形式,而查爾酮(C)則很難再轉化為陽離(AH+)子形式。在光照條件下,單糖苷、非酰化的二糖苷、酰基化的二糖苷穩定性依次增大[8]。FURTADO P等[9]提出光降解的最終產物與熱降解的最終產物相同,但是兩者的降解途徑不同。光降解的途徑可能為:花色苷首先降解生成C4 羥基中間產物,然后該中間產物在C2 位水解開環,生成查爾酮(C),最后查爾酮迅速降解,生成苯甲酸及2,4,6-三羥基苯甲醛等終產物。
2.2 pH值
花色苷易受pH的影響,一般在酸性條件下較穩定,在中性或堿性條件下易降解,但是,含有2個或2個以上酰基的花色苷在整個pH范圍內都表現出很好的顏色穩定性。花色苷在pH<2時,主要以紅色陽離子(AH+)的形式存在;pH為4~5時,主要為無色醇型堿(B)或查爾酮(C)形式;pH值>6時,主要為藍色醌式假堿(A)形式。SADILOVA E等[10-11]對pH 1.0和pH 3.5 條件下的矢車菊素-3-葡萄糖苷的熱降解產物進行了分析,發現在2種pH條件下都會產生原兒茶酸和2,4,6-三羥基苯甲醛2種終產物,但只有在pH值為3.5條件下能夠檢測到中間產物查爾酮(C),在pH值為1.0條件下沒有發現,這一現象的原因可能是查爾酮在pH 1.0條件下不穩定,說明pH會對花色苷熱降解途經產生影響。
2.3 氧化劑及過氧化劑
花色苷在酸性和中性條件下的氧化降解途徑不同。在pH 1~3的酸性溶液中,O3或H2O2生成自由基類物質,并與花色苷結合生成花色苷-H2O2復合物,H2O2與花色苷的C2位發生親核反應,使C2和C3之間的共價鍵斷裂,生成苯甲酰苯基乙酸酯,該酯極易在堿性條件下發生水解,形成酚酸、苯甲酸和2,4,6-三羥基苯乙酸。在pH 6~7的中性溶液中,錦葵素-3,5-二葡萄糖苷(malvidin-3,5-di-glucoside)在加熱條件下先轉化為醌式堿,進而生成香豆素衍生物3,5-二葡糖基-7-羥基香豆素[3,5-di-(O-β-D-glucosyl)-7-hydroxycoumarin],運用此法可判斷糖取代基的位置[12]。OZKAN M等[13]實驗發現,H2O2可以促使花色苷降解,H2O2主要通過3個反應,生成·OH,使花色苷的苯環發生降解最后生成CO2和H2O,并得出H2O2主要是通過兩種途徑來影響花色苷降解:一是H2O2裂解生成大量的具有非偶電子的基團或原子即自由基和過氧氫根離子HOO-;二是大量醌類物質的生成。
2.4 金屬離子
金屬離子對花色苷具有一定的輔色效果,與Ca2+、Zn2+、Cu2+、Al3+、Sn2+或其他金屬離子的絡合能對顏色能起穩定性作用。金屬離子對不同種類的花色苷的影響不同,有增色效應也有破壞作用,同種離子對不同種花色苷的影響也有差異,這與花色苷本身的分子結構和濃度有很大關系。研究發現只有在B-環上含有鄰位羥基的花色苷才能與金屬離子絡合。因此,可以通過向花色苷添加某種金屬離子,再觀察其最大吸收波長是否移動,來區別具有這種B-環上含有鄰位羥基的花色苷和其他普通花色苷[14]。雖然金屬離子對花色苷的穩定性具有一定增強作用,但這一效應也不是有益無害的,主要體現在增色的同時形成的金屬-單寧絡合物可導致花色苷褪色。
2.5 酶
在花色苷的降解過程中主要的酶有2種:一是糖苷酶(glyeosidase)可水解花色苷得到游離的糖和花青素,花青素很不穩定,可自發生成無色的物質。葡萄糖、葡萄糖-δ-內酯和葡萄酸是糖苷酶的競爭性抑制劑。二是多酚氧化酶(polyphenol oxidase,PPO)通過偶合氧化機理作用于作用于存在鄰-二酚羥基的花色苷,產生的中間產物-鄰醌能使花色苷轉化為氧化的花色苷及其降解產物。多酚氧化酶(PPO)的活性可有效的被SO2、亞硫酸鹽、單寧、苯肼和半胱氨酸抑制。其他參與降解的酶還有過氧化物酶和果膠酶[15]。KADER F等[15]采用Sephadex G-25柱層析將咖啡酸的氧化產物咖啡酸醌(caffeic acid O-quinone,CQ)進行了純化,然后與天竺葵色素-3-葡萄糖苷反應,采用紫外可見光譜、高效液相等化學分析方法進行鑒定,發現產物中有咖啡酸和殘存的天竺葵色素-3-葡萄糖苷,這是因為竺葵素-3-葡萄糖苷不是鄰位酚羥基結構,所以不會生成咖啡酸,因此推斷出咖啡酸是由鄰苯二醌咖啡酸生成的,并證明了多酚氧化酶(PPO)本身不能促進花色苷的降解,而是當有咖啡酸等酚類存在時,多酚氧化酶能促進多酚生成O-醌類化合物,這一中間產物與花色苷反應生成花色苷-O-醌的縮合物,從而加快花色苷的降解[16]。
2.6 糖
在高濃度的糖存在時,水分活度降低,花色苷生成假堿式(B)的速度減慢,因此花色苷的顏色得到了保護;但是在低濃度的糖存在時,花色苷的降解或變色卻加快。果糖、乳糖、阿拉伯糖和山梨糖的這種作用比蔗糖、葡萄糖和麥芽糖表現的更強[17]。CAO S等[18]研究發現,因為蔗糖為二糖,首先分解生成葡萄糖和果糖后,才能生成糠醛,而己酮糖(ketohexose)較己醛糖(aldohexose)更易轉化為糠醛,所以糖對花色苷的降解速率表現為果糖>蔗糖>葡萄糖。
2.7 SO2
低濃度的SO2用作防腐劑,對花色苷具有穩定作用,因其可與抗壞血酸有效地結合。SO2雖然具有這樣的穩定化作用,但實際上卻由于生成亞硫酸鹽使色素褪色。SO2對花色苷的漂白作用分為可逆或不可逆。當SO2用量為500~2 000μg/g時,是可逆的,在后續的加工處理中,能通過大量水洗脫后恢復顏色。SO2在有機酸的作用下形成亞硫酸氫根,其對花色苷C4親核攻擊生成無色的花色苷亞硫酸鹽復合物[19]。由于無色的花色苷亞硫酸鹽復合物形式僅和陽離子(AH+)形式存在平衡,可以得出SO2比溶液的pH對葡萄酒花色苷的褪色作用還要大。
2.8 親核試劑
非酰化和單酰化的花色苷對C2位和C4位上的親核進攻特別敏感。對于氨基酸和碳親核試劑,這一進攻往往發生在花色苷親電的C4位上。這些生成物具有很高活性,根據C4位上取代基的性質還會進一步發生反應,最終使花色苷褪色。研究表明[20],C4位被甲基或苯基取代的陽離子(AH+)對親核進攻具有抵御作用,這表明花色苷穩定化的有效措施是使C4位被取代。花色苷母核結構上的羥基和糖苷基上的羥基,都可以與一個或幾個咖啡酸、香豆酸、脂肪酸、對羥基苯甲酸和阿魏酸通過酯鍵結合形成酰基化的花色苷,從而增強其穩定性。BKOWSKA-BARCZAK A等[21]通過實驗研究發現酰化能增強花色苷的穩定性其作用機理是通過花色苷吡喃環的酰基堆積鈍化花色苷對親核試劑的敏感性,從而阻止花色苷從紅色的陽離子(AH+)水解成無色的查耳酮(C)或藍色的醌酮(A)。
2.9 抗壞血酸
OZKAN M[22]研究發現抗壞血酸本身并不會使花色苷的降解,而是抗壞血酸的降解產物脫氫抗壞血酸、H2O2和糠醛使花色苷發生了降解反應。花色苷對抗壞血酸的耐性與抗壞血酸的濃度和反應體系的溫度有關。低溫條件下,抗壞血酸對花色苷具有保護作用;高溫處理時,花色苷在低濃度的抗壞血酸中穩定,在高濃度抗壞血酸中加速降解。還有研究表明在花色苷降解過程中,抗壞血酸和氧起協同作用,在有Cu2+存在的情況下也能加速花色苷的降解。因此,在花色苷的生產或富含花色苷產品的加工處理過程中,不宜用抗壞血酸作為抗氧化劑。
3 提高葡萄皮花色苷穩定性的方法
常見花色苷經提純后穩定性差、極易變色。然而,自然生化條件下,幾乎所有花色苷在植物組織中的都是非常穩定的,特別是陽光和溫度對其并沒有造成影響,這一現象說明花色苷還是可以通過某些方法來提高穩定性的。目前國內外可用來提高花色苷穩定性較好的方法有分子內或分子間輔色、化學改性、生物工程和組織培養技術。
3.1 分子內輔色
通過花色苷分子內基團起到的穩定作用稱之為分子內輔色作用。輔色作用的機理是阻止水化,現已發現了數種在中性或微酸性水溶液中保持穩定的花色苷衍生物,這些衍生物結構上的共同點在于在花色苷的C3、C5、C7位上連接有2個或2個以上酰化糖苷基團,使花色苷因水化平衡而失色的活化能增大,從而阻止有色的花色苷轉化成無色的假堿(B)[23]。例如符合類似該結構的二咖啡酰飛燕草色素3,7,3-三葡萄糖苷在整個pH范圍內表現出相當好的穩定性,這是一種典型的分子內輔色,其機理為該分子結構中咖啡酸的芳香基團與母核上的芳香基團通過上下疊加的π-π共軛作用和極性基團的氫鍵連接形成高空間阻礙作用,從而提高分子的穩定性。
3.2 分子間輔色
分子間輔助成色機理為輔色劑分子中含有豐富電子,這些電子與陽離子(AH+)相互作用,避免水的親核攻擊,使輔色素與花色苷分子以氫鍵和非共價鍵結合形成水平(頭尾連接)或π-π共軛垂直層疊的“花色苷-輔色素”復合物[24],影響體系的能級躍遷,從而使花色苷的成色效果加強,同時最大吸收波長向長波方向移動。鐘瑞敏等[25]從玫瑰香葡萄色素中提取出錦葵色素-3-葡萄糖苷和香豆酰錦葵色素-3-葡萄糖苷,添加β-羥乙基蘆定酯30后分別測量最大吸收波長,前者的紅移量為20nm,顏色強度為原有的102%,后者的紅移量為26nm,顏色強度為原有的105%。這類輔色劑包括多糖、金屬離子、黃酮、生物堿、有機酸、氨基酸、核苷酸、及花青素本身。BARANAC J等[26]通過實驗研究發現,將分別含有60mg/mL和120mg/mL花色苷的糖漿置于20℃光照條件下,2種糖漿質量濃度下花色苷的半衰期分別是29周和33周,由此得出加大花色苷的添加量可以提高色素本身的穩定性這一結論。在一定條件下,花色苷的濃度越大,或花色苷甲基化和糖基化的程度越大,或輔色素與花色苷的摩爾比越大,輔助成色作用的效果越顯著[27]。
3.3 化學改性
通過分子改性、化學修飾可以提高花色苷的穩定性。大部分天然花色苷與植物組織分離后不穩定的原因除了失去了自然生化條件外,主要還是因為花色苷配基C4上和C8上沒有基團,這兩個位置具有較大活性,在溫和條件下容易受到SO2和VC等還原性物質或某些親電基團的攻擊,破壞色素生色團的共軛體系[23]。BAKKER J等[28]用間苯二酚、間苯三酚和查爾酮的衍生物、和苯基β-二酮合成了一系列C4和C8位上帶有苯基、烷基等基團的花色苷,其顏色從黃、橙到紅色,并對SO2、VC和Fe3+表現出抗性。BAKKER J等[28]為提高葡萄酒色澤穩定性在室溫條件下用兒茶酸和微量乙醛對葡萄酒中的花色苷進行了化學改性,葡萄酒的色澤穩定性和顏色強度都得到了明顯提高。但由于花色苷結構的不同,穩定性提高程度有很大差異,這一變化的機理為兒茶酸和微量乙醛與花色苷在C8形成了新的色素衍生物,改變了體系的共軛強度,使光吸收紅移,并形成空間位阻,從而使穩定性得到提高。
3.4 生物工程
大量研究表明,植物合成花色苷與生長時間、光照和其所需的營養物質等因素有關,利用生物工程技術生產穩定性高的花色苷可以克服由于地理環境、氣候、季節和病蟲害等原因引起的價格和供應的波動。KONCZAK I等[29]通過基因調控使甜薯細胞內的酚酸大量表達,培養出了穩定性高、花色苷含量高、生理活性強的植株。生物工程學家發現了部分天然色素合成的植物基因,通過克隆技術使一些花朵、果實改變顏色。近幾年,科學家開始研究合成穩定的3-二咖啡酰槐糖苷-5-葡萄糖苷飛燕草色素的基因,然后通過克隆技術培育能產生高含量花色苷的植株。但飛燕草色素通常表現為深紫色到藍色,而不是紅色[30],所以大范圍色澤的高穩定性花色苷的獲取還需同時使用其他方法。
4 展望
葡萄皮色素是一種優良的天然食品色素,安全無毒有較好著色力,主要用于飲料和酒類的調色,也廣泛用于果醬、腌制品、果凍、冰激凌、糖果等食品中,可利用其具備的多種生理活性功能開發相應的保健品。從葡萄酒廠的生產廢料中提取花色苷具有重要的經濟價值。研究花色苷的合成機理,通過控制環境條件來達到提高花色苷產量的目的,研究花色苷穩定性影響因素間的協同作用,通過控制外界因素來提高花色苷在加工應用中的穩定性。
[1]ORDAZ-GALINDO A,WESCHE-EBELING P,WROLSTAD R E,et al.Purification and identification of Capulin (Prunus serotinaEhrh) anthocyanins[J].Food Chem,1999,65(2):201-206.
[2]AMICO V,NAPOLI E M,RENDA A,et al.Constituents of grape pomace from the Sicilian cultivar‘Nerello Mascalese’[J].Food Chem,2004,88(4):599-607.
[3]GARCíA-BENEYTEZ E,REVILLA E,CABELLO F.Anthocyanin pattern of several red grape cultivars and wines made from them[J].Eur Food Res Technol,2002,215(1):32-37.
[4]GROTEWOLD E.The genetics and biochemistry of floral pigments[J].Annu Rev Plant Biol,2006,57(10):761-780.
[5]SRIVASTAVA A,AKOH C C,FISCHER J,et al.Effect of anthocyanin fractions from selected cultivars of Georgia-grown blueberries on apoptosis and phase II enzymes[J].J Agr Food Chem,2007,55(8):3180-3185.
[6]TANAKA Y,SASAKI N,OHMIYA A.Biosynthesis of plant pigments:anthocyanins,betalains and carotenoids[J].Plant J,2008,54(4):733-749.
[7]SPAYD S E,TARARA J M,MEE D L,et al.Separation of sunlight and temperature effects on the composition ofVitis viniferacv.Merlot berries[J].Am J Enol Viticult,2002,53(3):171-182.
[8]MARKAKIS P.Anthocyanins as food colors[M].New York:Academic Press Inc,2012.
[9]FURTADO P,FIGUEIREDO P,CHAVES DAS NEVES H,et al.Photochemical and thermal degradation of anthocyanidins[J].J Photoch Photobiol A,1993,75(2):113-118.
[10]SADILOVA E,STINTZING F C,CARLE R.Thermal degradation of acylated and nonacylated anthocyanins[J].J Food Sci,2006,71(8):C504-C512.
[11]SADILOVA E,CARLE R,STINTZING F C.Thermal degradation of anthocyanins and its impact on color andin vitroantioxidant capacity[J].Mol Nutr Food Res,2007,51(12):1461-1471.
[12]HRAZDINA G,FRANZESE A J.Oxidation products of acylated anthocyanins under acidic and neutral conditions[J].Phytochemistry,1974,13(1):231-234.
[13]OZKAN M,YEMENICIO LU A,CEMERO LU B.Degradation of various fruit juice anthocyanins by hydrogen peroxide[J].Food Res Int,2005,38(8):1015-1021.
[14]BROUILLARD R.Chemical structure of anthocyanins[M].New York,Academic Press:1982.
[15]KADER F,IRMOULI M,ZITOUNI N,et al.Degradation of cyanidin 3-glucoside by caffeic acid o-quinone.Determination of the stoichiometry and characterization of the degradation products[J].J Agr Food Chem,1999,47(11):4625-4630.
[16]李 躍,劉延吉.果實花青苷代謝機制及調控技術研究[J].安徽農業科學,2007,35(16):4755-4756.
[17]HENDRY G A F,HOUGHTON J D.Natural food colorants[M].London:Champion&Hall,1996.
[18]CAO S,LIU L,LU Q,et al.Integrated effects of ascorbic acid,flavonoids and sugars on thermal degradation of anthocyanins in blood orange juice[J].Eur Food Res Technol,2009,228(6):975-983.
[19]JACKMAN R L,YADA R Y,TUNG M A,et al.Anthocyanins as food colorants-a review[J].J Food Biochem,11(3):201-247.
[20]任玉林,李 華.天然食用色素—花色苷[J].食品科學,1995,16(7):22-27.
[21]BKOWSKA-BARCZAK A.Acylated anthocyanins as stable,natural food colorants-a review[J].Pol J Food Nutr Sci,2005,14(2):107-116.
[22]OZKAN M.Degradation of anthocyanins in sour cherry and pomegranate juices by hydrogen peroxide in the presence of added ascorbic acid[J].Food Chem,2002,78(4):499-504.
[23]BARANAC J,AMIC D,VUKADINOVIC V.Spectrophotometric study of the influence of individual substituted positions on flavylium chromophore stability[J].J Agr Food Chem,1990,38(4):932-936.
[24]王 鋒,鄧潔紅,譚興和,等.花色苷及其共色作用研究進展[J].食品科學,2008,29(2):472-476.
[25]鐘瑞敏.花色苷結構與穩定性的關系及其應用研究[J].韶關學院學報,2001,22(12):79-83.
[26]BARANAC J M,PETRANOVIC N A,DIMITRIC-MARKOVIC J M.Spectrophotometric study of anthocyan copigmentation reactions[J].J Agr Food Chem,1996,44(5):1333-1336.
[27]BROUILLARD R,CHASSAING S,FOUGEROUSSE A.Why are grape/fresh wine anthocyanins so simple and why is it that red wine color lasts so long?[J].Phytochemistry,2003,64(7):1179-1186.
[28]BAKKER J,TIMBERLAKE C F.Isolation,identification,and characterization of new color-stable anthocyanins occurring in some red wines[J].J Agr Food Chem,1997,45(1):35-43.
[29]KONCZAK I,TERAHARA N,YOSHIMOTO M,et al.Regulating the composition of anthocyanins and phenolic acids in a sweetpotato cell culture towards production of polyphenolic complex with enhanced physiological activity[J].Trends Food Sci Technol,2005,16(9):377-388.
[30]BARANAC J M,AMIC D S.Spectrochemical investigations of the influence of pH on the mechanism of structural transformations of the 4-substituted flavylium chromophore[J].J Serb Chem Soc,1985,50:299-305.

