RNA干擾的研究進展
何潔凝 田生禮
摘要:RNA干擾(RNA interference,RNAi)是一種由雙鏈RNA誘發的轉錄后水平的基因沉默現象,是近幾年發展起來的基因表達調節新機制。RNAi廣泛存在于真菌、植物和動物中,這種調控可以由siRNA、shRNA及miRNA等小分子RNA參與。在此主要對RNAi的研究進展如背景、分子調控機制、存在的問題和應用前景等進行了綜述。
關鍵詞:RNA干擾;小分子RNA;研究進展
中圖分類號:Q819
文獻標識碼:A
文章編號:1007-7847(2014)03-0265-04
2006年,美國斯坦福大學的Andrew Z.Fire和美國馬薩諸塞大學的CraigC.Mello分別被授予了諾貝爾生理學和醫學獎,以表彰他們發現了RNA干擾(RNA interference,RNAi)現象,即用雙鏈RNA使基因沉默(RNA interference gene silencingby double-stranded RNA)。自發現RNAi現象至2006年的8年間,在PubMed網站上能搜索到的有關RNAi的文章已經達到8900多篇,可見,從RNA干擾理論提出到現在已經歷十余年時間,人們對其機制和應用的研究熱情始終沒有冷卻。為了加深對該技術的了解與追蹤,本文主要對RNAi的發現、作用機制、應用的研究進展予以綜述。
1RNAi的發現
RNA干擾是一種在進化過程中存在的高度保守、由雙鏈RNA分子(double-stranded RNA,dsRNA)誘發同源mRNA高效特異性降解的基因轉錄后沉默現象(post-transcriptional gene silenc-ing,PTGS)。1990年初,科學家在向矮牽牛花導入能使花卉變得更鮮艷的查爾酮基因后,結果卻發現,一些花的顏色不但沒有變鮮艷反而被“漂白”了。這種過度表達內源基因而引發的基因沉默的現象當時被稱為共阻遏。1998年Fire等在向線蟲中分別導入正義、反義和雙鏈RNA同樣干擾par-l基因表達,結果發現單鏈反義RNA和雙鏈RNA均能特異性沉默靶基因的表達,雙鏈RNA的效果明顯比單鏈RNA的沉默效果強,于是他們將這種雙鏈RNA抑制基因表達的現象稱為RNA干擾(RNA interference,RNAi),把引發RNA干擾現象的RNA分子稱為干擾RNA[1]。此后,RNA干擾這種現象被證明廣泛存在于多種真核生物中。
2RNAi的作用機制
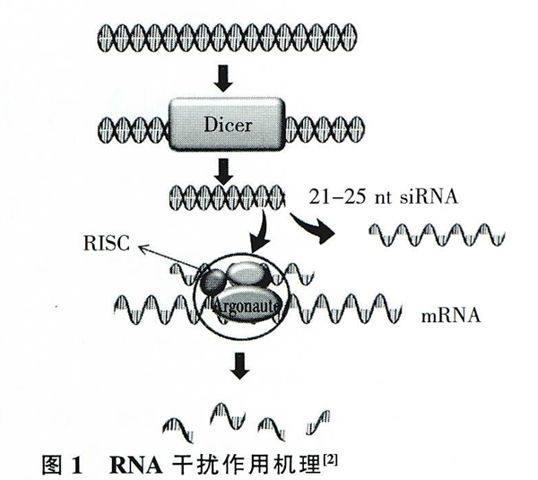
眾所周知,RNAi的分子主要包括以下幾種:siRNA、shRNA、miRNA,雖然它們在結構上各不相同,但是所有這些分子都具有誘導基因沉默的能力,它們在細胞中的作用機制主要有3個步驟[2]:
起始階段:外源性或內源性雙鏈RNA分子被核酸酶Dicer加工剪切成21~25個核苷酸長度的小分子雙鏈。
RISC (RNA-induced silencing complex)的組裝:產生的小分子雙鏈RNA中其中一條鏈與相關的蛋白(主要是Argonaute蛋白)組裝形成具有活性的沉默復合體RISC。
效應階段:組裝形成的具有活性的RISC作用于與其上的單鏈小分子RNA序列互補的mR-NA,并將該mRNA降解,使其翻譯受到抑制,最終導致基因的沉默。siRNA、shRNA與miRNA對靶基因mRNA沉默時作用的位點有所不同,siRNA沉默目的基因主要作用于mRNA的編碼序列,而miRNA主要作用于mRNA的3的非翻譯區。
在RNAi過程中,研究得較清楚的蛋白主要是Argonaute蛋白家族:Argonaute(Ago)蛋白屬于一個高度保守的蛋白家族,包括Agol、Ago2、A-go3、Ago4。它的大小約100kD,這4種蛋白都包含兩個重要的結構域:PAZ、MID結構域,分別與miRNA3'與5'端相互作用。在所有的Ago蛋白中只有Ago2所包含的PIWI結構域具有切割活性,Agol、Ago3、Ago4沒有此活性[3,4]。Argonaute能跟不同的小分子RNA(miRNA、siRNA)結合,根據小分子RNA結構的不同,它們所結合的Argonaute蛋白也有所區別,其中miRNA與Agol結合,而siRNA則與Ago2結合[5]。最近研究發現,Ago2能提高細胞中miRNA的穩定性及提高成熟miRNA在細胞中的水平[6];Ago3蛋白的PIWI與Piwi-in-teracting RNAs (piRNAs)相互作用產生沉默轉座子的作用;Ago4在調控哺乳動物精細胞進入減數分裂和減數分裂性染色體失活(MSCI)中起作用[7]。
3RNAi的應用
3.1基因功能研究
在后基因組時代,基因功能的研究顯得尤其迫切,可是,由于我們在進行研究基因功能實驗時難以直接在人活體內進行,建立有效的轉基因或基因敲除的動物模型顯得格外重要,RNAi技術在此方面做出重大貢獻。Kim等利用針對影響胚胎發育的兩種內源性的Oct3/4和c-mos基因的siRNA,將其植入鼠卵母細胞前胚胎中,成功地清除了內源性的Oct3/4和c-mos產物,建立了敲除Oct3/4和c-mos基因的動物模型[8];其次利用RNAi文庫也是基因功能研究的重要手段,RNAi文庫是人工構建的一種混合文庫,研究者能通過它誘導RNAi抑制眾多種不同基因表達。目前,研究者利用RNAi文庫已經發現了許多與生物功能相關的新基因和治療疾病的新靶點。Buss等在秀麗隱桿線蟲中通過全基因組RNAi篩選的方式,發現煙堿型乙酰膽堿受體(nicotinic acetylcholine re-ceptor subunit ACR-7)是抗精神病藥物的靶點[9]。
3.2臨床基礎研究
RNAi技術具有簡單、快速、特異性沉默任意基因的特點,使其被廣泛用來研究腫瘤、肺動脈高壓、先天性遺傳病等疾病的治療靶點,并取得了一定成果。最近Ku等證實通過脂質體的方式向T24膀胱癌細胞中導入針對生存素(survivin)的siRNA,該siRNA能特異性地干擾膀胱癌細胞中生存素的表達,同時加速了膀胱癌細胞的凋亡[10]。Wedg-wood等運用RNAi技術研究發現過氧化氫酶在新生兒肺動脈高壓中血管的重塑中起著重要作用,有望成為該疾病治療的靶點[11]。Leachman等對先天性厚甲遺傳病患者通過皮下注射siRNA的方式針對突變的K6a角質蛋白進行沉默,3個月后成功對該蛋白進行沉默的同時發現患者皮膚起繭情況明顯得到好轉。此外,RNAi治療并沒有給患者帶來其他負面影響[12],這是RNAi在藥物治療方法上的重要進展。RNAi技術還被應用于整形外科方面,整形外科的開展主要以手術為主,RNAi技術的應用為整形外科的開展注入了新的力量。眾所周知,當人體皮膚深層受到創傷后,機體產生的炎癥反應及應激反應會導致基質層許多生長因子異常增多,從而誘使皮膚深層基質細胞變性轉化疤痕組織,產生疤痕,這是目前整形外科研究的熱點和難點。Liu等將RNAi技術與膠原殼聚糖硅橡膠皮膚再生材料(collagen-chitosan/sili-cone membrane bilayer dermai equivalent)結合起來應用于背部皮膚嚴重缺損的豬的皮膚修復上,研究發現siRNA能明顯抑制TGF-βi生長因子的表達并同時抑制皮膚修復過程中疤痕的產生[13]。在整形外科軟骨移植中,經常會發現軟骨外質細胞被大量降解,出現使細胞質中蛋白多糖與膠原水平失衡的現象,Wang等采用RNAi的手段通過抑制軟骨細胞多聚蛋白聚糖酶1,2(aggrecanase)的表達,減少其對蛋白多糖的分解,維持軟骨移植后軟骨細胞外基質的平衡[14]。
3.3藥物開發研究
RNAi技術還被應用于鑒定藥物靶點和篩選藥物方面。RNAi技術的應用明顯地縮短了從篩選到鑒定藥物靶基因功能的時間,有助于藥物開發過程中對已知靶基因功能的高通量分析。在鑒定RNAi藥物靶點上,Watanabe等研究發現通過siRNA干擾的方式在小鼠中沉默蛋白轉移酶9(proprotein convertase subtilisin/kexin type 9,PC-SK9)能有效地減少血清中膽固醇水平,首次證明通過沉默PCSK9有望成為降低膽固醇的治療靶點[15]。在篩選藥物上,Liu-Sullivan[16]等通過pooledshRNA的方法發現維甲酸類藥物能增強pkll激酶抑制劑藥物GSK461364的抑制作用,進而阻止細胞有絲分裂,加速了癌細胞凋亡的速度。
4影響RNAi效率的因素及RNAi應用中存在的問題
4.1影響RNAi效率的因素
4.1.1RNAi序列的設計
RNAi技術的關鍵是如何有效發揮siRNA的干擾作用。在RNAi的實際應用中經常發現合理設計的siRNA不能發揮有效的干擾作用,分析影響siRNA干擾效果的因素包括dsRNA雙鏈末端的穩定性、siRNA與RISC的結合情況及干擾載體的轉染效率。在對siRNA特異性研究中,發現siRNA最好設計在19~25個堿基之間,且siRNA的GC含量應在30%~52%之間。此外,在siRNA特定的位置應設計特定的核苷酸,例如:siRNA的sense序列的5'端的第一個堿基最好是U,第3、10位堿基最好是A[17],因為A在熱力學上結合力更低,因此會降低siRNA雙鏈的穩定性使RISC更好解開雙鏈siRNA,同時增加siRNA的基因沉默效率。相反,若siRNA序列中存在反向重復序列會降低siRNA的沉默效果。
4.1.2RNAi序列的穩定性
一般siRNA在血清的環境下,很容易被降解以致其難以在細胞中發揮其RNAi作用。因此對siRNA進行適當的化學修飾是必要的。
目前已經存在很多siRNA優化方法,研究發現siRNA經過tricyclo-DNA修飾后能明顯提高siRNA在血清中的穩定性[18]。除了上述修飾外,還有一種化學修飾稱LNAs修飾(locked nucleic acids),它是一種核酸類似物,其能使RNA/DNA增加耐受核酸酶的能力,此外,這種修飾能降低siRNA對細胞的毒性。Petri等[19]研究發現利用LNAs修飾后的siRNA更利于Ago2聚集和剪切,從而能明顯提高siRNA的穩定性及減少siRNA的脫靶效應。
4.1.3RNAi序列的導入方式
RNAi技術被廣泛的應用,成功將RNAi分子導入目的細胞,是實現RNAi的先決條件。RNAi分子存在易降解和不穩定的特點,為了保證RNAi分子能有效地被運送到目的組織細胞,需要特定的導入方式。文獻報道的導入方式有多種,比如浸泡、注射、脂質體包裹轉染、納米材料導入、噬菌體包裝轉染或通過物理的方式直接導入等,其中,很多研究者會選擇采用病毒載體,利用病毒高感染率、高表達的特性開展RNAi實驗研究。但是它同時也存在著一些風險,比如病毒會誘發細胞中基因產生突變或會引起細胞中各種炎癥反應等。
針對于病毒載體給細胞帶來的各種影響,非病毒性的導入方式越來越受到研究者的青睞。目前,有一種著名的tkRNAi運輸shRNA小分子的技術,這種技術主要是用非治病性的大腸桿菌內含產生特定shRNA的質粒DNA,并將其運送到細胞中以產生RNAi的效果。Kruhn等運用該技術將針對ABCB1的shRNA導入到人胃癌細胞中,shRNA能有效干擾ABCB1蛋白的表達,調節了癌細胞中由ABCB1蛋白介導的多藥抗性的表型[20]。
4.2RNAi技術應用中存在的問題
4.2.1免疫反應
細胞中免疫系統對自身的核酸和外源核酸總是有區別對待的,這種反應主要體現在細胞水平上和分子水平上,其主要的機理是:外源的RNA或DNA會刺激細胞中IFN(type I interferon)因子和細胞炎癥因子的產生。在RNAi過程中,依賴dsRNA的激酶(dsRNA dependent protein kinase,PKR)能激活2'-5'寡腺苷酸合成酶( 2'-5'oligoadenylate synthetase,OAS),OAS會刺激ATP形成2'-5'寡腺苷核苷酸,進一步激活細胞中核糖核酸酶(RNaseL)形成,進而降解細胞中的RNA,包括RNAi小分子,降低RNAi的沉默效率[21]。適當的化學修飾能改善siRNA引起的細胞免疫反應,如將siRNA用2'-O-Me,2'-O-F加以修飾足以改善siRNA的免疫刺激活性并能更好地優化siR-NA的沉默效果[22]。
4.2.2脫靶效應
眾所周知,Ago-RISC對靶mRNA的剪切是具有高度特異性的,可是在siRNA的應用過程中也會出現許多脫靶效應從而誘發細胞毒性。siR-NA的脫靶效應主要與其序列中靠近5'端的2~8個堿基密切相關,因為它們與mRNA的3'UTR互補并與RISC結合緊密。為了減少siRNA的脫靶效應,提高siRNA的特異性主要通過以下方式:1)降低siRNA中5'端的熱力學穩定性;2)在選擇靶mRNA位置時要避免靠近mRNA的起始編碼區;3)通過使用siRNA pools的方法,在既能保持siRNA的沉默效率下,又能減低siRNA的脫靶效應[23];4)文獻報道,在siRNA的第7位加入一個不穩定的unlocked nucleic acid (UNA)修飾能減少siRNA的脫靶效應[24]。
4.2.3飽和現象
在正常細胞中,小RNAi分子與其靶基因之間始終保持著一種平衡的狀態,這使細胞一直保持著正常的生理功能。大量外源的siRNA/shRNA被導入到細胞內,使細胞中正常RNAi水平達到一種不平衡的狀態。大量外源的siRNA/shRNA進入細胞會與內源的miRNA競爭某些蛋白因子,如Dicer、Ago蛋白等,以致細胞內的miRNA不能行使正常的功能。在細胞中,即使使用弱啟動子表達了大量shRNA也會誘發生物體內細胞毒性。為了避免上述問題的產生,Grimm等將Ago2、Exp5、L6-shRNA共同導入到小鼠內,結果發現shRNA的干擾效果明顯增強,同時檢測小鼠肝臟毒性明顯降低[25]。為了避免內源miRNA與外源的shRNA競爭Dicer因子,Liu等最近研究出一種Ago2shRNA,該shRNA可以不通過Dicer而直接利用Ago2行使剪切功能,這種設計有望能在進一步提高RNAi的同時避免引起RNA干擾效果的脫靶效應[26]。
5展望
RNA干擾技術是一個生物學研究的亮點,它給許多疾病的治療與藥物的開發提供了新的思路,其中RNAi藥物具有藥效測試周期短,在理論上適合于任何基因治療的特點,其中比如anti-sense RNAi藥物,它的特異性非常強,有可能在RNAi藥物開發中引來新的一場革命。目前,許多RNAi藥物迅速地進入了臨床研究階段。雖然還存在一些問題,如出現脫靶效應、免疫反應等問題,但我們始終相信這些問題最終會被解決,使RNAi技術能更好地被廣泛地應用在基礎研究、臨床研究及RNAi藥物研發之中。
參考文獻( References):
[1]FIRE A,XU S,MONTGOMERY M K,et al.Potent and specific genetic interference by double-stranded RNA in Caenor-habditis elegans[J]. Nature, 1998, 391(6669):806-811.
[2]SIOMI H,SIOMI M C.On the road to reading the RNA-inter-ference code[J]. Nature, 2009, 457(7228):396-404.
[3]JUVVUNA P K,KHANDELIA P,LEE L M,et al.Argonauteidentity defines the length of mature mammalian microRNAs[J].Nuclcic Acids Research, 2012, 40(14):6808-6820.
[4]WEI N,ZHANC L HUANG H,et al.siRNA has greatly ele-vated mismatch tolerance at 3'-UTR sites[J]. PLoS One, 2012,7(11):e49309.
[5]GHILDIYAL M,ZAMORE P D Small silencing RNAs: an ex-panding universe[J]. Nature Reviews Gcnctic, 2009, 10(2):94-108.
[6]WINTER J,DIEDERICHS S.Argonaute proteins regulate mi-croRNA stability: Increased microRNA abundance by Argo-naute proteins is due to microRNA stabilization[J]. RNA Biology,2011, 8(6):1149-1157.
[7]MODZELEWSKI A J,HOLMES R J,HILZ S,et al.AGO4regulates entry into meiosis and influences silencing of sexchromosomes in the male mouse germline[J]. Developmental Cell,2012, 23(2):251-264.
[8]KIM M H,YUAN X,OKUMURA S.et al.Successful inactiva-tion of endogenous Oct-3/4 and c-mos genes in mouse, preim-plantation embryos and oocytes using short interfering RNAs[J].Biochemical and Biophysical Research Communications, 2002,296(5):1372-1377.
[9]SAUR T,DEMARCO S E,ORTIZ A,et al.A genome-wideRNAi screen in Caenorhabditis elegans identifies the nicotinicacetylcholine receptor subunit ACR-7 as an antipsychoticdrug target[J]. PLoS Genetics, 2013, 9(2):e1003313.
[10]KU J H,SEO S Y,KWAK C,et al.Cytotoxicity and apoptosisby survivin small interfering RNA in bladder cancer cells[J].BJU International, 2010, 106(11):1812-1816.
[11]WEDGWOOD S,LAKSHMINRUSIMHA S,CZECH L et al.Increased p22(phox)/Nox4 expression is involved in remodelingthrough hydrogen peroxide signaling in experimental persistentpulmonary hypertension of the newborn[J]. Antioxidants&Re-dox Signaling, 2013, 18(14):1765-1776.
[12]LEACHMAN S A, HICKERSON R P, SCHWARTZ M E, etal. First-in-human mutation-targeted siRNA phase Ib trial ofan inherited skin disorder[J]. Molecular Therapy , 2010, 18(2):442-446.
[13]LIU X, MA L, LIANG J, et al. RNAi functionalized collagen-chitosan/silicone membrane bilayer dermal equivalent for full-thickness skin regeneration with inhibited scarring[J]. Biomateri-als, 2013, 34(8):2038-2048.
[14]WANG Z H, YANG Z Q, HE X J, et al. Lentivirus-mediatedknockdown of aggrecanase-l and -2 promotes chondrocyte-engineered cartilage formation in vitro[J]. Biotechnology and Bio-engineering, 2010, 107(4):730-736.
[15]DUFF C J,HOOPER N M. PCSK9: an emerging target fortreatment of hypercholesterolemia[J]. Expert Opinion on Ther-apeutic Targets, 2011, 15(2):157-168.
[16]LIU -SULLIVAN N, ZHANG J, BAKLEH A, et al. PooledshRNA screen for sensitizers to inhibition of the mitotic regulator polo-like kinase(PLKl)[J]. Oncotarget, 2011, 2(12):1254-1264.
[17]DYXHOOM D M, LIEBERMAN J. Running interference:prospects and obstacles to using small interfering RNAs assmall molecule drugs[J]. Annual Review of Biomedical Engineer-ing, 2006, 8:377-402.
[18]ITTIG D. LUISIER S, WEILER J, et al. Improving gene si-lencing of siRNAs via tricyclo-DNA modificacion[J]. ArtificialDNA. PNA & XNA, 2010, 1(1):9-16.
[19]PETRI S, DUECK A, LEHMANN G, et al. Increased siRNAduplex stability correlates with reduced off-target and elevatedon-target effects[J]. RNA, 2011, 17(4):737-749.
[20]KRUHN A, WANG A, FRUEHAUF J H, et al. Delivery ofshort hairpin RNAs by transkingdom RNA interference modu-lates the classical ABCBl-mediated multidrug-resistant phe-notype of cancer cells[J]. Cell Cycle, 2009, 8(20):3349-3354.
[21]SIOUD M. Recent advances in small interfering RNA sensingby the immune system[J]. New Biotechnology, 2010, 27(3):236-242.
[22]ROBBINS M, JUDGE A, MACLACHLAN I. siRNA and innateimmunity[J]. Oligonucleotides, 2009, 19(2):89-102.
[23]BRAMSEN J B, KJEMS J. Chemical modification of small in-terfering RNA[J]. Methods in Molecular Biology, 2011, 721:77-103.
[24]BRAMSEN J B, PAKULA M M, HANSEN T B, et al. Ascreen of chemical modifications identifies position-specificmodification by UNA to most potently reduce siRNA off-targeteffects[J]. Nucleic Acids Research, 2010, 38(17):5761-5773.
[25]GRIMM D, WANG L, LEE J S, et al. Argonaute proteins arekey determinants of RNAi efficacy, toxicity, and persistence inthe adult mouse liver[J]. The Journal of Clinical Investigation,2010, 120(9):3106-3119.
[26]LIU Y P, SCHOPMAN N C,BERKHOUT B. Dicer-indepen-dent processing of short hairpin RNAs[J]. Nucleic Acids Research,2013, 41(6):3723-3733.

