腸道干細胞移植對創傷后腸黏膜屏障功能障礙的影響
李云
深圳市龍崗區南灣人民醫院外科,廣東 深圳 518000
腸道干細胞移植對創傷后腸黏膜屏障功能障礙的影響
李云
深圳市龍崗區南灣人民醫院外科,廣東 深圳 518000
目的:觀察腸道干細胞移植對創傷后腸黏膜屏障的治療作用,尋找腸道干細胞治療腸黏膜屏障功能障礙的方法。方法:利用熒光激活細胞分類法將腸上皮干細胞分離,通過腸腔人工生物支架等組織工程方法建立理想的ISC移植模型,實現腸道干細胞的體外培養,并將體外分離培養的腸道干細胞群移植入放射性小腸損傷動物模型鼠腸腔中。結果:正常組大鼠小腸黏膜各層結構正常,絨毛排列整齊;模型組7天大鼠黏膜絨毛嚴重受損,脫落明顯;治療組7天黏膜破壞較少,黏膜增厚,逐漸恢復正常。同時對治療組和模型組進行RIS評分比較,結果顯示治療組的黏膜損傷程度明顯低于模型組(P<0.05)。結論:ISCs移植可促進損傷后腸黏膜的修復,腸道干細胞移植有望成為治療某些腸道疾病的新方法。
腸黏膜屏障功能障礙;腸道干細胞;移植
正常腸黏膜屏障由機械屏障、化學屏障、免疫屏障、生物屏障構成,能有效阻止腸道內細菌和內毒素易位。機體在遭受各種創傷如放射性損傷后,腸黏膜屏障的結構將發生一系列病理生理變化,如腸黏膜萎縮、腸絨毛短而稀疏,可導致黏膜通透性增加,黏膜屏障功能障礙,使腸腔內細菌穿過腸黏膜屏障到達其他器官定植和過度生長,引發感染,甚至出現系統性炎癥反應綜合征(SIRS)和多器官功能障礙綜合征(MODS),嚴重者可危及生命。因此,探索創傷(放射性損傷)后腸黏膜屏障功能障礙的有效治療方法,減少其對機體的嚴重損害具有重要的臨床價值。本研究擬利用熒光激活細胞分類法將腸上皮干細胞分離,然后通過腸腔人工生物支架等組織工程方法建立理想的ISC移植模型,實現腸干細胞體外培養,將體外分離培養的腸干細胞群移植入放射性小腸損傷動物模型鼠腸腔中,觀察ISCs對放射性小腸損傷的修復作用,探討治療腸黏膜屏障功能障礙的新途徑。
1 材料與方法
1.1實驗試劑及儀器Hoechst33342、碘化丙啶溶液(均購自Sigma Corporation);兔抗musashi1多克隆抗體(Chemicon);HBSS溶液(Gibco);中性蛋白酶、Ⅲ型膠原(FACS420);流式細胞儀(美國BD公司),兔抗musashi-1多克隆抗體(Chemicon)。
1.2腸上皮干細胞的分離、鑒定及培養參照Dekaney CM等[1]方法:將小鼠空腸段剪碎至1 m m3大小,利用中型蛋白酶和Ⅲ型膠原將組織塊消化,經70μm孔濾膜過濾后制成每100μL含1×106個細胞懸液;熒光染色劑Hoechst33342(濃度5mL),37℃孵育90分鐘;再與FIT C標記的抗CD45抗體(滴度為1∶100)低溫孵育10分鐘,以區別造血干細胞,然后加濃度為2μg/m L碘化吡啶(PI)溶液4℃染色10~1 5分鐘,以區別死亡細胞;接著在流式細胞儀上進行S P細胞分離,利用波長350nm紫外光源激發Hoechst33342和PI,450nm/30nm帶通收集藍光,670nm/30nm帶通及655nm長通收集紅光;575nm/26nm帶通收集PI發射的紅光。去除PI陽性死亡細胞后,收集、分離Hoechst33342陽性和陰性細胞。將腸道組織作為腸上皮干細胞的生長支架,參照StelznerM等[2]利用EDTA將小鼠小腸黏膜剝離,保留黏膜下組織,然后把分離的腸干細胞移植至經上述方法處理后的腸腔中。
1.3干細胞特性鑒定檢測Musashi-lmRNA表達水平。培養細胞按RNeasy Mega總RNA提取試劑盒操作說明提取總R N A,以o l i g o d T j為引物,用逆轉錄酶逆轉錄cDNA,最后以逆轉錄的c D N A為模板;以上游引物5′C G A G C T C G A C T C C A A A A C A A T-3′,下游引物5′-G G C T T T C T T G C A T T C C A C C A-3′進行R T-P C R擴增;條件為:9 4 C 2 m i n變性,9 4 C l 5 S,5 3 C 3 0 S,7 2 C 3 0 S,擴增3 5個循環,P C R產物用1%瓊脂糖電泳鑒定。
1.4放射性腸損傷動物模型的建立選用成年Wistar雌性大鼠30只,體質量240~260g。10%水合氯醛麻醉(3.5m L/kg),仰臥在特制的固定盒中,以X.S.S.Z250型深部X線機(貴陽醫療儀器廠生產)給予全腹部照射,大鼠腹部給予1 c m的組織補償,從劍突到恥骨聯合,照射面積為8.5cm×8.5cm,源皮距60cm,單次照射劑量5Gy,每隔7 2小時照射1次,共5次。
1.5動物分組將輻射大鼠隨機分為ISCs治療組、模型組、正常對照組各10只。ISCs治療組大鼠分別于第3、4、5次照射后,當日尾靜脈注射同種異體腸干細胞1mL,濃度為每100μL含1×106個細胞;正常對照組和模型組不做其他處理,于最后一次注射ISCs后第7天處死各組動物,免疫組化染色觀察小腸黏膜結構。
1.6放射性腸損傷評分(RIS)對移植后第7天模型組大鼠進行R I S評分,分析放射性腸損傷黏膜組織形態變化,具體評分標準參照文獻[3]。
1.7統計學方法采用SPSS18.0進行統計分析,計量資料采用t檢驗,P<0.05表示差異有統計學意義。
2 結果
2.1大鼠腸道干細胞的分離培養結果分離出CD44和Hoechst33342雙陰性SP細胞占細胞總數的1.1%~2.1%,雖然高于腸上皮干細胞比例的理論數值(0.5%),卻表明小鼠小腸段含有較豐富的腸上皮干細胞;新生小鼠來源的小腸黏膜單細胞懸液中包含的特定細胞群體即側群細胞,染包液中加入維拉帕米后,側群細胞被阻斷后消失,經RT-PC R擴增,側群細胞中顯示有MSI-1 mRNA及蛋白的表達;新生小鼠的小腸黏膜側群細胞富集小腸黏膜干細胞。
2.2各組大鼠小腸黏膜組織學觀察結果正常組大鼠小腸黏膜各層結構正常,絨毛排列整齊;模型組7天大鼠黏膜絨毛嚴重受損,脫落明顯,排列紊亂,隱窩結構破壞,間質明顯水腫,炎性細胞浸潤;治療組7天黏膜破壞較少,黏膜增厚,絨毛逐步再生,逐漸恢復正常(見圖1—2)。RIS評分顯示治療組大鼠黏膜損傷程度明顯低于模型組(P<0.05),見表1。
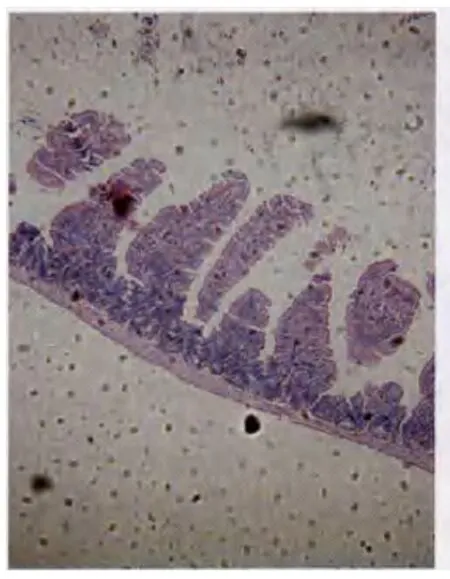
圖1 損傷后的腸黏膜病理形態

表1 照射損傷后大鼠RIS評分

圖2 ISCs移植后逐漸修復的腸黏膜形態
3 討論
腸黏膜是更新很快的組織,目前認為腸道干細胞增生、分化是腸黏膜更新的主要細胞學基礎。腸道干細胞參與腸道正常生理過程和一些病理過程,位于腸黏膜隱窩基底部,即基底隱窩是腸道干細胞的細胞庫。腸上皮所有細胞均來自隱窩干細胞。腸上皮經歷了艱難而又卓越的進化,增殖的隱窩和分化的絨毛折疊形成的“谷”和“脊”構成了獨一無二的二維拓撲結構,這對于維持腸道屏障結構和功能的完整性以及損傷后的修復具有重要作用[4]。
近年研究表明腸道上皮存在一類組織特異性腸道干細胞(ISCs),ISCs具有長期自我更新潛能和產生至少一種終末分化細胞的能力[5],其中尤為突出的研究結果是揭示了腸上皮干細胞的持續增殖、分化,以及對促進腸道損傷后結構與功能修復的研究。已有研究證實體外存活生長的腸道干細胞可以被外來基因所轉染,KawaguchiAL等[6]通過研究證實基因轉染的IEC6細胞(來源于腸道隱窩的細胞)移植至網膜下或小腸內可以存活,并且迅速生長,采用聚碳酸酯膜作為載體,進一步研究發現[7]移植的腸道干細胞可持續生長并穩定表達基因產物,骨髓或干細胞移植對炎癥性腸病有治療作用。
隨著細胞分選和基因標記技術的逐漸成熟,干細胞研究由原來的干細胞移植雛形-骨髓移植研究逐步發展成為一門新興學科。作為機體內細胞更新最快的組織器官之一小腸,其干細胞的研究日益受到人們的關注。腸上皮干細胞具有終身自我更新的能力[8],由于小腸黏膜單層上皮細胞的簡單結構和特有的晝夜更新節律,使得小腸干細胞成為繼造血干細胞和皮膚干細胞之后新的研究熱點。同時,由于部分腸道疾病導致的黏膜破壞,腸功能難以自我代償,小腸干細胞移植為腸黏膜的再生和腸黏膜屏障功能的恢復提供了新的前景。前期研究通過“微克隆分析法”發現,腸道隱窩的某些細胞具有重建上皮的能力。腸道上皮損傷后,這些位于李培昆氏(1ieberkuhn)隱窩的干細胞具有很強的組織修復作用,以維持上皮的完整性。PottenCS等[9]報道,小腸放射性損傷模型的小腸隱窩干細胞在胰島索樣生長因子和肝細胞生長因子的作用下能夠迅速分化修復損傷。將小鼠含有干細胞的隱窩“細胞團(organoid)”分離出來并接種到受體小鼠的皮下等部位后發現,這些細胞團能夠形成新的黏膜樣結構,并且具有一定的原始腸黏膜功能。通過組織工程技術將隱窩細胞團種植到小鼠腹腔內培育了新的原始小腸,并將這些原始小腸與正常小鼠空腸吻合。結果顯示,這些新產生的小腸形態、增殖速度、解剖學特征以及轉運功能等都與正常黏膜類似。這些實驗的成功使腸道干細胞移植從基礎到臨床又邁進了一步。本研究利用熒光激活細胞分類法成功完成了腸上皮干細胞分離,然后通過腸腔的人工生物支架等組織工程方法建立了理想的ISC移植模型,為腸上皮干細胞提供良好的生長環境,實現腸干細胞的體外培養,并成功建立了放射性小腸損傷模型,將體外分離培養的腸干細胞群移植入放射性小腸損傷動物模型鼠腸腔中,通過免疫組化染色觀察ISCs對放射性小腸損傷的修復作用,結果顯示正常組大鼠小腸黏膜各層結構正常,絨毛排列整齊;模型組7天大鼠黏膜絨毛嚴重受損,脫落明顯,排列紊亂,隱窩結構破壞,間質明顯水腫,炎性細胞浸潤;治療組7天黏膜破壞較少,黏膜增厚,逐漸恢復正常,說明ISCs參與了放射性小腸損傷的修復過程。
當前對于胃腸道黏膜屏障的治療主要集中于胃腸道黏膜屏障的保護方面,包括氧化劑、谷氨酰胺、短鏈脂肪酸以及微生態制劑等的應用,但隨著損傷的進一步加重,單純保守治療常難以治愈。隨著研究方法的不斷進步,腸上皮干細胞的許多生物學特征將被揭示,可為提高消化道黏膜疾病(如吸收不良、潰瘍和腫瘤等)的治療水平奠定理論基礎,也可為腸上皮干細胞的進一步應用提供理論指導。隨著腸干細胞移植治療及腸道黏膜屏障研究的不斷深入,胃腸黏膜損傷,尤其是炎癥性腸病等一系列自身免疫性疾病的治療將不再是醫學的難題。
[1]Dekaney CM,Rodri guez JM,GraulMC,etal.Isolation and characterization of a putativeint estinal stem cell fract i on fromm ouse j ej unum[J].G ast roent erol ogy,2005,129(5):1567-1580.
[2]St el zner M,Chen D C.To m ake a new i nt est i nal m ucosa[J].Rej uvenat i on Res,2006,9(1):20-25.
[3]Langberg CW,W al dron JA,Baker M L,et al.Si gni fi cance ofoveral lt reat m entt i m e fort he devel opm entof radi at i on i nduced i nt est i nalcom pl i cat i ons.A n experi m ent al st udy i n t he rat[J].Cancer,1994,73(10):2663-2668.
[4]Radt ke F,Cl evers H,Riccio0.From guthom eost asi s t o cancer[J].Curr M ol M ed,2006,6(3):275-289.
[5]付焱,劉志蘇,江從慶.腸道干細胞標志物研究進展[J].臨床外科雜志,2010,18(1):55-57.
[6]K aw aguchiA L,D unn JC,Fonkal srud EW.In vi vo grow t h oft ranspl ant edgenet i cal l yal t eredi nt est i nal st em cel l s[J].J Pedi at r Surg,1998,33(4):559-563.
[7]K hal i lPN,W ei l er V,N el son PJ.eta1.N onm yel oabl at i ve st em cel lt herapyenhancesm i croi rcul at i onand t i ssueregenerat i oni nm uri nei nfl am m at orybow el di sease[J].G ast roent erol ogy,2007,132(3):944-954.
[8]魏亞明,聶玉強,李瑜元,等.炎癥性腸病及其干細胞移植再生修復[J].世界華人消化雜志,2006,14(13):1314-1317.
[9]Pot t en CS,El l i s JR.A dul t sm al l i nt est i nal st emcel l s:i dent i fi cat i on,l ocat i on,charact eri st i cs,and cl i nical appl i cat i ons[J].Ernst Scheri ng Res Found W orkshop,2006(60):81-98.
Effects of Intestinal Stem Cells Transplant on Dysfunction of Intestinal Mucosal Barrier after Trauma
LI Yun
Surgery Department of Nanwan People's Hospital in Longgang District,Shenzhen 518000,China
Objective:To find the method of intestinal stem cells(ISCs)in the treatment for dysfunction of intestinal mucosal barrier by observing intestinal stem cells for intestinal mucosal barrier after trauma.Methods:Intestinal epithelial stem cells were separated by fluorescence-activated cell sorting(FACS)method,the models for ISCs transplant were established by artificial frame of intestinal cavity to realize the cultivation of ISCs in vitro,ISCs cultivated in vitro could be transplanted to mouse model with radiation damage of small intestine.Results:The structures of different layers in the mucosa of rats in the normal group were normal,fine hairs were arranged in good order;the fine hairs of mucosa of rats in the model group were damaged severely,and dropped obviously;the damages of mucosa in the treatment group were less,the mucosa thickened,and returned to normal gradually.The treatment group and the model group were evaluated by RIS scale,the results demonstrated that the degree of mucosal damage in the treatment group was lower than that of the model group(P<0.05).Conclusion:Transplant of intestinal stem cells could promote the recovery of intestinal mucosa after the injury,and the transplant could be the new method of treating intestinal diseases.
dysfunction of intestinal mucosal barrier;intestinal stem cells;transplant
R457.7
A
1004-6852(2014)05-0009-04
2013-06-25
李云(1963—),男,碩士學位,副主任醫師。研究方向:胃腸道腫瘤的診治。

