P16INK4a及Ki-67免疫細胞化學檢測對ASC-US中高級別病變檢出的意義*
葉洪楠,游 珂,郭艷利,張小為,耿 力,李子健
(北京大學第三醫院婦產科,北京 100191)
宮頸癌是第二常見的女性惡性腫瘤,全球每年新發病例約50萬例,其中80%發生在發展中國家;我國每年新發病例約14萬,約占世界宮頸癌新發病例的28.8%[1-2]。從宮頸上皮內瘤變(cervical intraepithelial neoplasia,CIN)到宮頸浸潤癌是一個連續的發展過程。大量臨床研究證實,由高危型HPV感染進展為宮頸原位癌(Cervical cancer insitu,CIS)大約需要7~12年的時間[3]。因此早期篩查、早期診斷和早期治療在宮頸癌的防治工作中顯得尤為重要。P16INK4a基因是一種直接作用于細胞周期、抑制細胞分裂的抑癌基因。Ki67是一種核增殖標志基因,屬于非組蛋白抗原,其表達水平的高低對評價細胞增殖活性、研究腫瘤的生物學行為和預后具有重要意義[4]。目前國內外研究普遍認為P16INK4a與Ki-67兩種標記物在組織學中可以用于宮頸癌的輔助診斷、治療效果的評價及預后判斷[5-8],但在宮頸細胞學中P16INK4a、Ki-67免疫細胞化學檢測對提高宮頸高級別病變的檢出作用還有待于研究。我們應用宮頸液基細胞學剩余標本進行P16INK4a及Ki-67免疫細胞化學檢測,并與高危型HPV的檢測結果進行比較,探討其作為檢出宮頸癌前病變的輔助方法的可行性。
1 材料與方法
1.1 標本來源
2010年1月至2012年6月間,選取北京大學第三醫院婦產科門診因宮頸細胞學異常就診并進行陰道鏡檢查及宮頸活檢者50例。按照病理學診斷分為慢性炎癥、CIN1、CIN2、CIN3。根據2001年美國陰道鏡檢查與子宮頸病理學會(ASCCP)共同制定出的宮頸癌前病變處理指南,CIN1級可以隨診觀察為主,CIN2級及CIN3級危險度較高,需進行相應治療。故本研究中,我們將CIN2級以下26例患者歸為低級別病變組,CIN2級及以上24例患者歸為高級別病變組。
1.2 標本處理
采用宮頸液基細胞學剩余標本,使用 Auto PREP薄層細胞制片系統制成薄層細胞學涂片,95%酒精室溫固定72小時,10%中性甲醛固定30分鐘,室溫下蒸餾水沖洗5分鐘。放入5%EDTA(pH8.0)中用微波爐強力高火檔10分鐘行抗原修復。室溫自然冷卻后,0.3%過氧化氫室溫下孵育15分鐘,阻斷內源性過氧化物酶活性。PBS洗片3次。
1.3 免疫細胞化學檢測及結果判斷
免疫細胞化學染色具體實驗步驟如下:1、取出冷藏的TCT涂片,室溫放置1小時;2、用PBS(PH=7.4)沖洗涂片3次,每次2分鐘;3、每張涂片滴加100μl的3%過氧化氫溶液,室溫孵育10分鐘,以消除內源性過氧化酶活性;4、0.01M PBS沖洗3次,每次2 分鐘;5、0.01mol/L 枸櫞酸緩沖液(PH 6.0)在97°C水浴鍋孵育半小時,以恢復抗原性;6、待涂片恢復常溫,每張涂片滴加100μl的第一抗體,4℃冷室過夜;7、0.01M PBS沖洗3次,每次2分鐘。甩去PBS,每張涂片加兩滴或100μl的聚合物增強劑(試劑 A),室溫下孵育20分鐘;8、PBS沖洗3次,每次2分鐘。甩去PBS,每張涂片滴加100μl的酶標抗兔聚合物(試劑 B),室溫下孵育30分鐘;9、PBS沖洗3次,每次2分鐘。甩去PBS,每張涂片滴加100μl新鮮配制的DAB顯色液,顯色3~5分鐘,蘇木素復染45秒鐘,0.5%鹽酸酒精分化,逐級酒精脫水,二甲苯透明,中性樹膠封片,鏡檢。
結果判定:采用半定量的方法統計陽性細胞數目,具體操作方法為選取代表性的幾個高倍視野計數300個細胞,計算著色鱗狀上皮細胞所占比例,并乘以100作為Ki-67的標記指數[9-10],p16采用相同的方法。
1.4 診斷標準
液基細胞學采用2001年TBS(The Bethesda System,伯塞斯達系統)診斷標準。
1.5 高危型HPV-DNA檢測
采用免疫捕獲雜交二代(Hybird Capture II,HCII)法。
1.6 統計方法
采用SPSS17.0統計軟件進行統計分析。由于P16INK4a及Ki-67的原始數據為非正態分布,故進行數據轉換,獲得新變量lgP16INK4a及lgKi-67后,數據呈正態分布,進行后續統計分析。采獨立樣本t檢驗及單因素方差分析比較不同組別P16INK4a及Ki-67的表達,當 P<0.05認為差異具有統計學意義。對P16INK4a及Ki-67的表達繪制ROC曲線,并根據靈敏度和特異度之和最大的原則選取相應界值及計算相關統計學指標。
2 結果
2.1 細胞學與宮頸組織病理學診斷
50例患者中,細胞學診斷為ASC-US(atypical squamous cells of undetermined significance,診斷意義不明的不典型鱗狀細胞)、LSIL(low-grade squamous intraepithelial lesion,低度鱗狀上皮內病變)和HSIL(high-grade squamous intraepithelial lesion,高度鱗狀上皮內病變)的分別為27例、10例和13例,其與組織病理學診斷結果的對應關系見表1。
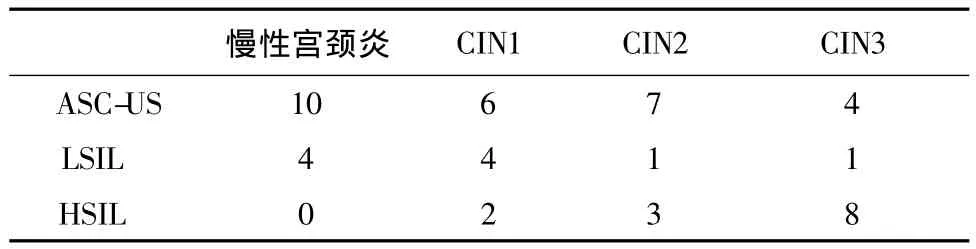
表1 細胞學診斷與組織病理學關系
2.2 高危型HPV預測ASC-US患者中高級別宮頸病變準確度
27例ASC-US中高危型HPV陽性23例,組織病理學診斷CIN2及以上病變共11例(見表2),由表1計算得出高危型HPV預測高級別病變的敏感度為1(11/11)、特異度為0.25(4/16)、陽性預測值為0.478(11/23)、陰性預測值為1(4/4)。
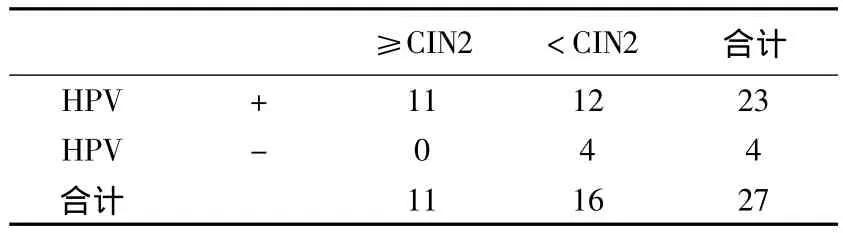
表2 ASC-US中高危型HPV檢測與宮頸組織病理學的關系
2.3 P16INK4a檢測預測宮頸異常細胞學及ASC-US患者中高級別宮頸病變準確度
2.3.1 P16INK4a表達與宮頸組織病理學診斷的關系 在CIN2及以上組和CIN2以下組中,P16INK4a的表達量差異具有統計學意義(t=4.811,P<0.05),在炎癥組 CIN1組、CIN2 組、CIN3 組中,其表達量隨CIN級別升高而升高,且組間差異有統計學意義(F=16.094,P <0.01)(見圖1,表3)。
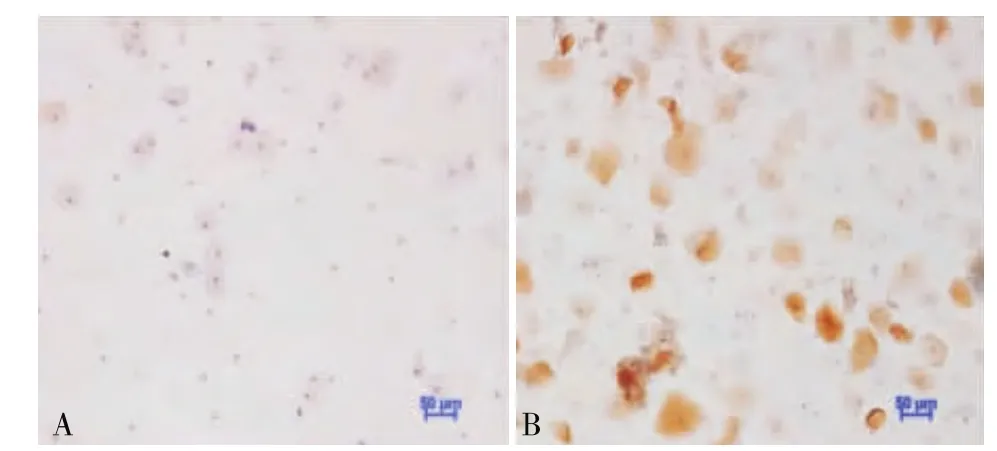
圖1 P16INK4a表達與宮頸組織病理學診斷的關系
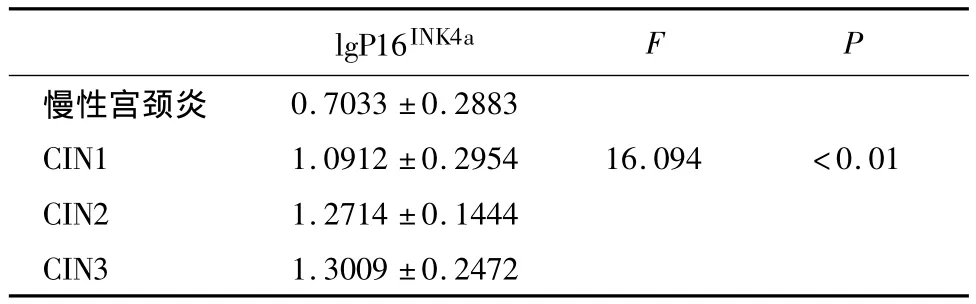
表3 P16INK4a的表達
2.3.2 P16INK4a在宮頸異常細胞學及 ASC-US 中對高級別病變預測的準確性 對于全部50例樣本中P16INK4a的表達繪制ROC曲線,以敏感度及特異度的和最大為標準確定界值,選取12.25為界值(見圖2)。在全部50例異常細胞學樣本中P16INK4a預測高級別病變的敏感度為0.792(19/24)、特異度為0.808(21/26)、陽性預測值為 0.792(19/24)、陰性預測值為0.808(21/26)(見表4);在27例 ASCUS樣本中P16INK4a預測高級別病變的敏感度為1(11/11)、特異度為 0.875(14/16)、陽性預測值為0.846(11/13)、陰性預測值為1(14/14)(見表5)。
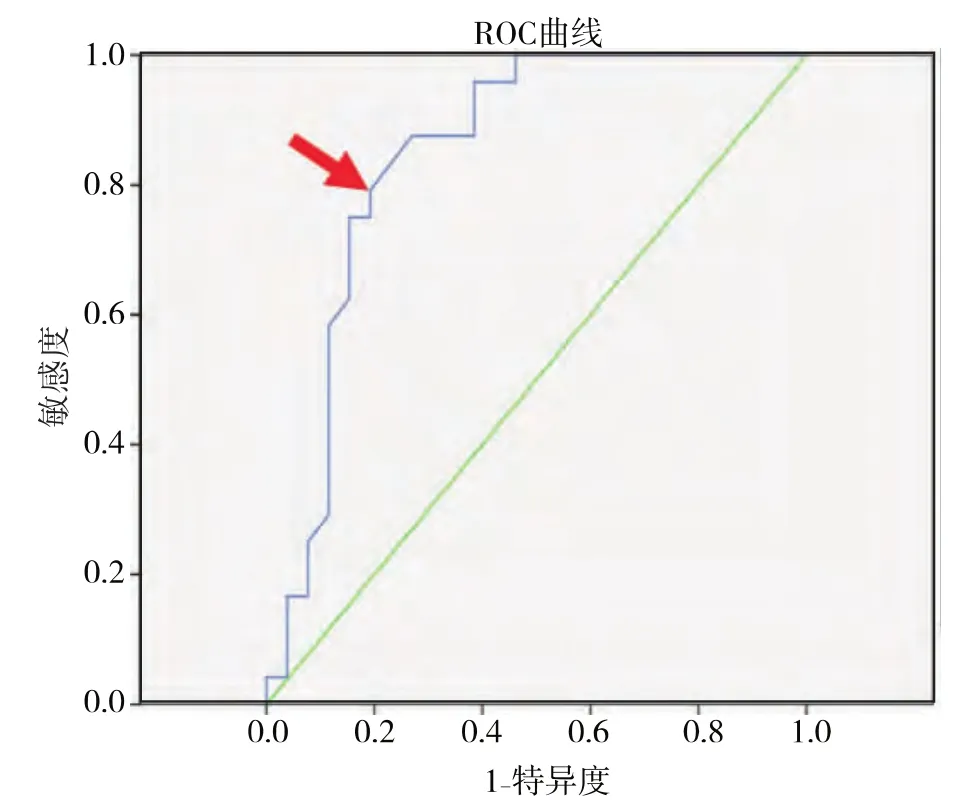
圖2 P16INK4a表達在異常細胞學中檢出高級別病變的ROC曲線
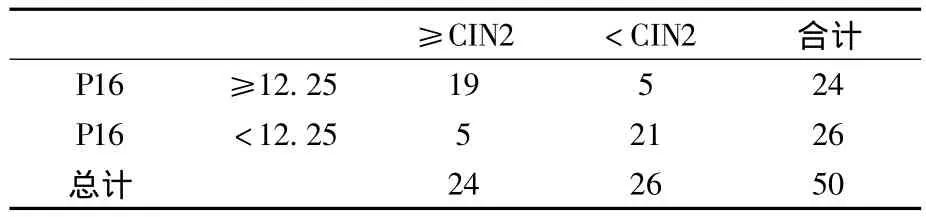
表4 異常細胞學中P16INK4a表達量與宮頸組織病理學關系
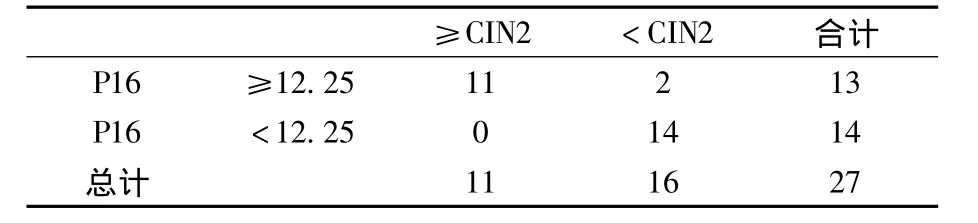
表5 ASC-US中P16INK4a表達量與宮頸組織病理學關系
2.4 Ki-67檢測預測宮頸異常細胞學及ASC-US患者中高級別宮頸病變的準確性
2.4.1 Ki-67表達與宮頸組織病理學診斷的關系
在CIN2及以上組和CIN2以下組中,Ki-67的表達量差異具有統計學意義(t=4.698,P <0.05),其中炎癥組、CIN1組、CIN2組、CIN3組中,其表達量隨CIN級別升高而升高,且組間差異有統計學意義(F=15.177,P <0.01)(見圖 3,表6)。
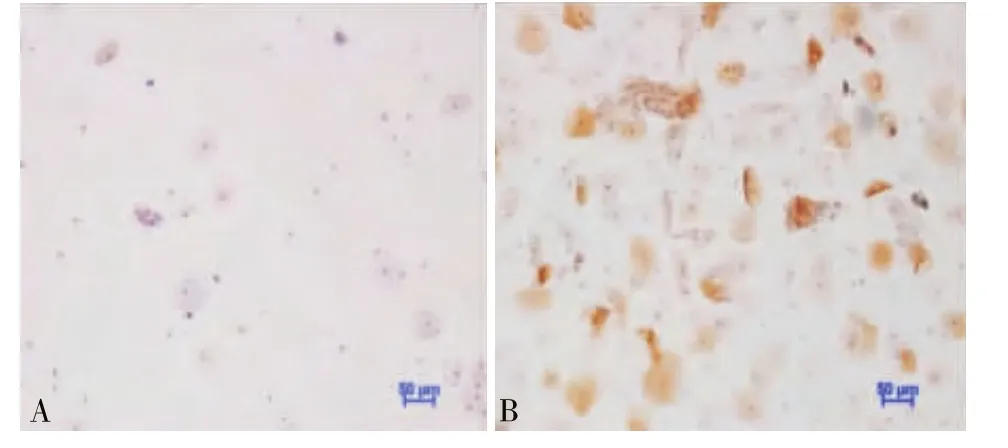
圖3 Ki-67表達與宮頸組織病理學診斷的關系
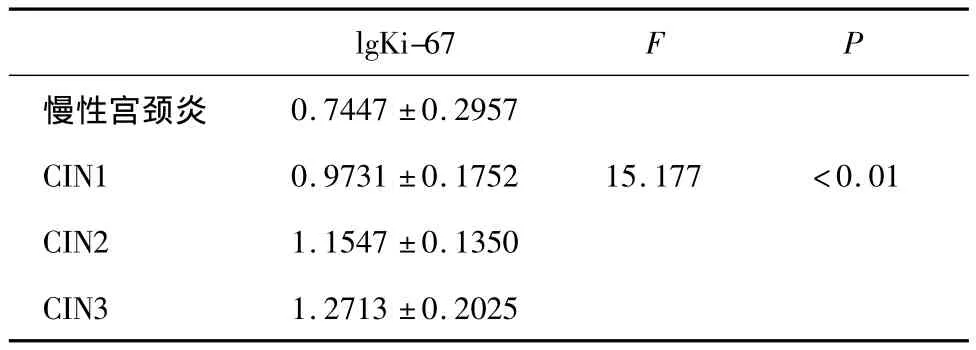
表6 宮頸不同病變Ki-67的表達
2.4.2 Ki-67在宮頸異常細胞學及ASC-US中對高級別病變預測的準確性 對于全部50例樣本中Ki-67的表達繪制ROC曲線,以敏感度及特異度的和最大為標準確定界值,選取12.5為界值(見圖4)在全部50例異常細胞學樣本中,Ki-67預測高級別病變的敏感度為0.708(17/24)、特異度為0.846(22/26)、陽性預測值為 0.810(17/21)、陰性預測值為0.759(22/29)(見表7);在27例 ASC-US樣本中Ki-67預測高級別病變的敏感度為0.818(9/11)、特異度為 0.875(14/16)、陽性預測值為 0.818(9/11)、陰性預測值為0.875(14/16)(見表8)。
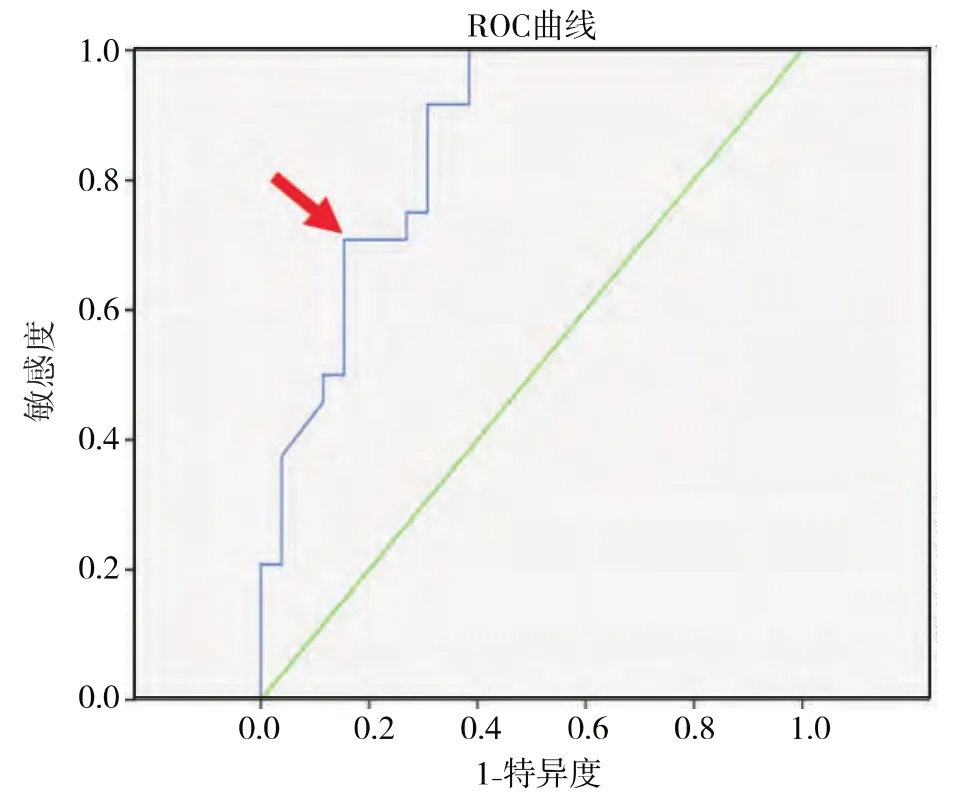
圖4 Ki-67表達在異常細胞學中檢出高級別病變的ROC曲線
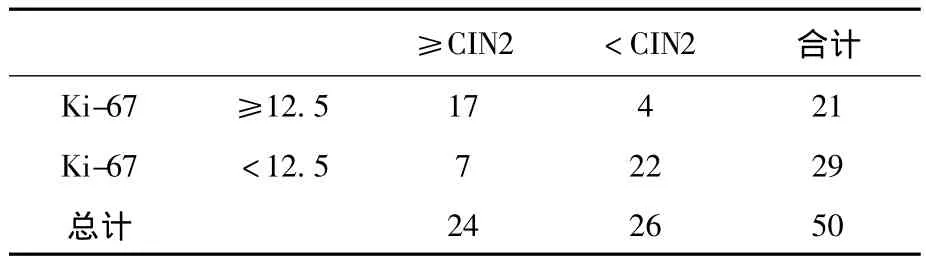
表7 異常細胞學中Ki-67表達量與宮頸組織病理學關系

表8 ASC-US中Ki-67表達與宮頸組織病理學學診斷的關系
2.5 P16INK4a及Ki-67與高危型HPV在ASC-US中分流管理作用的比較
2.5.1 P16INK4a與高危型 HPV 在 ASC-US 中分流管理作用的比較 通過表9可以看出,P16INK4a檢測在ASC-US中預測宮頸高級別病變的特異度和陽性預測值均顯著高于高危型HPV檢測;敏感度和陰性預測值二者相當。
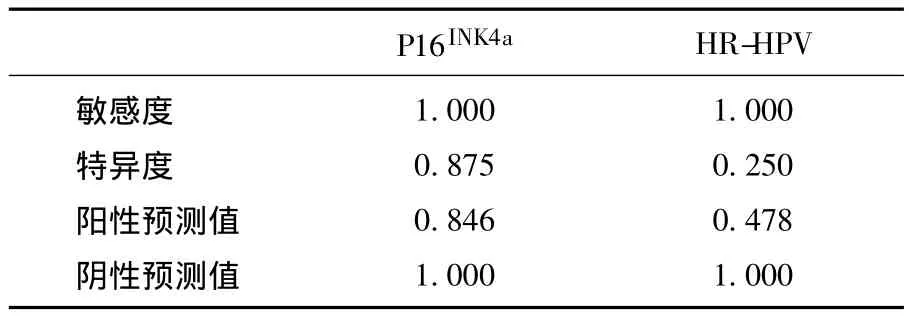
表9 P16INK4a和高危HPV檢測在ASC-US中的分層價值比較
2.5.2 Ki-67與高危型HPV在ASC-US中的分流管理作用的比較 通過表10可以看到,Ki-67檢測在ASC-US中預測宮頸高級別病變的特異度和陽性預測值均顯著高于高危型HPV檢測;敏感度和陰性預測值略低于高危型HPV。
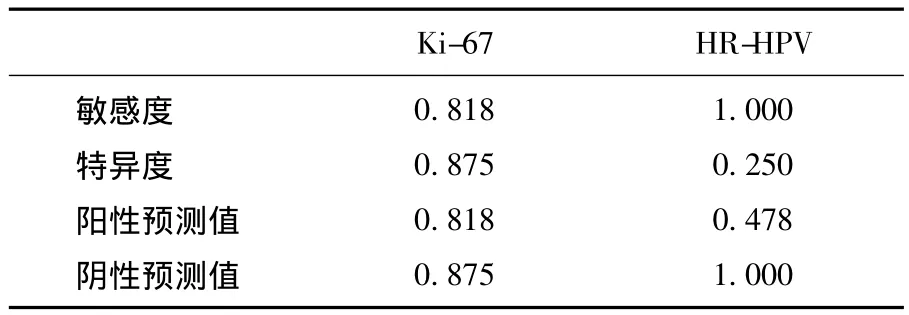
表10 Ki-67和高危HPV檢測在ASC-US中的分層價值比較
3 討論
目前對宮頸癌前病變的早期篩查主要采用細胞學檢測,液基細胞學檢測(liquid based cytology test,LCT)彌補了傳統細胞涂片法的一些不足,能較為有效地篩檢宮頸癌前病變及早期宮頸癌,但是該方法存在一定的假陰性和假陽性,會造成一部分高危患者的漏診,因此需要通過聯合一些輔助診斷,提高細胞學篩查的準確性。將P16INK4a及Ki-67作為診斷宮頸病變的標記物已經得到普遍認可[11-12]。之前的研究多采用免疫組化的方法對P16INK4a及Ki-67進行檢測,免疫組化檢測需活檢組織,對患者有一定的創傷,且存在一定比例的假陰性和假陽性。與組織學標本相比,采用宮頸脫落細胞檢測P16INK4a、Ki-67,不僅具有取材方便、無創的特點,同時又可以極大的減小細胞學單純依賴細胞形態學改變為診斷依據對結果帶來的主觀影響。因此,這一新方法對降低傳統宮頸癌篩查法的假陽性率和假陰性率,提高篩查的敏感度和特異度都具有重要意義。
本研究顯示,P16INK4a的表達水平隨著宮頸病變級別的升高而提高。近年研究表明,在幾乎所有HPV陽性的宮頸癌及癌前病變中P16INK4a呈高表達,且細胞學診斷為HSIL的表達率顯著高于LSIL的表達率[13]。Horn等[14]研究表明,P16INK4a蛋白表達可作為判斷宮頸癌惡性程度的指標。Juric等[15]研究顯示,P16INK4a過表達對診斷宮頸高危病變及宮頸癌具有重要價值,這些研究均支持我們的研究結果。本研究中,Ki-67的表達水平隨著宮頸病變級別的升高而提高。其他研究表明,隨著宮頸上皮細胞病變程度增加,其表達率明顯升高[16]。正常情況下,Ki-67表達于成熟宮頸鱗狀上皮的基底細胞和基底旁細胞,隨著宮頸癌前病變的加重,Ki-67的表達向上皮表層上移,其在鱗狀上皮上2/3層生的表達被認為提高了CIN診斷的特異度[17]。這些均與我們的結果一致。易為等[18]研究還發現,Ki-67單獨用于診斷宮頸病變漏診率小,但誤診率高。
由于宮頸脫落細胞中P16INK4a及Ki-67的表達水平隨宮頸病變級別升高而升高,因此我們需要找到一個臨界點,使P16INK4a及Ki-67診斷宮頸高級別病變的靈敏性和特異度有最佳的結合。“接受者操作特性曲線(ROC曲線)”是一種反應某個診斷指標的效度的方法,也是確定最佳診斷參考值的有效方法。ROC曲線下面積(AUC)可用于評價診斷準確性,其值在0.5至1之間。AUC越接近于1,說明診斷效果越好。本研究所有病例的P16INK4a的界值為12.25,ROC曲線下面積達到0.848(95%可信區間0.734 ~0.961,p<0.05);Ki-67 的界值為 12.5,ROC曲線下面積達到0.856(95%可信區間0.753~0.959,p<0.05)。以上結果說明通過免疫細胞化學方法檢測宮頸脫落細胞P16INK4a及Ki-67的表達水平對檢出宮頸高級別病變具有很好的效度。我們比較了P16INK4a及Ki-67對于異常細胞學以及ASCUS中高級別病變預測的準確性。我們發現,細胞學診斷為ASC-US的P16INK4a及Ki-67對高級別病變預測的敏感度、特異度、陽性預測值、陰性預測值均要優于異常細胞學,這說明相對于LSIL及HSIL,P16INK4a及Ki-67對于ASC-US中高級別病變預測的準確性更高。
大量研究結果表明,ASC-US可能是反應性變化,也可能隱藏著宮頸病變[19]。Srodon等[20]研究認為,宮頸細胞學檢查為ASC-US的患者中有5%~10%為宮頸高級別病變,宮頸浸潤癌約占0.1%。對于ASC-US病例若只進行隨訪,部分患者會喪失最佳治療時機;若全部直接進行陰道鏡檢查及宮頸活檢,又會使大量良性病變患者承受不必要的檢查,造成醫療資源的浪費。有研究表明在ASC-US中,高危型HPV檢測相對于細胞學檢測其檢出高級別病變的敏感度可以提高10% ~15%[21],因此高危型HPV檢測對于ASC-US具有分流管理的作用。本研究病例中,ASC-US中高危型HPV檢測CIN2及以上病變的敏感度為1、特異度為0.25、陽性預測值為0.478、陰性預測值為1。可見高危型HPV檢測在ASC-US中檢出高級別病變具有令人滿意的靈敏度和陰性預測值,但特異度和陽性預測值不盡如人意。另有報道稱HPV檢測和細胞學篩查聯合后雖然提高了檢出高級別病變的敏感度,但降低了特異度[22-23]。因此有必要尋找一種具有更高特異度和陽性預測值的生物學指標。在本研究中,我們比較了高危型HPV檢測和P16INK4a、Ki-67檢測在預測ASC-US中高級別病變的準確性的差異,發現P16INK4a及Ki-67檢測的特異度和陽性預測值明顯高于高危型HPV,而敏感度、陰性預測值兩者相當。這說明單獨應用P16INK4a或Ki-67免疫細胞化學檢測對ASC-US中高級別病變進行預測不僅保留了高危型HPV檢測較高的敏感度和陰性預測值,同時彌補了高危型HPV檢測在特異度和陽性預測值上的不足,因此單獨應用P16INK4a或Ki-67免疫細胞化學檢測對ASC-US中高級別病變進行預測其準確性要優于單獨應用高危型HPV檢測。
綜上,高危型HPV檢測對細胞學診斷為ASCUS的患者的進一步處理具有分流管理的意義,但存在低特異度和低陽性預測值的缺陷。本研究表明,單獨應用P16INK4a或Ki-67免疫細胞化學檢測對ASC-US中高級別病變的檢出作用均要優于高危型HPV檢測。因此本研究提示宮頸脫落細胞P16INK4a及Ki-67免疫細胞化學檢測相比于高危型HPV檢測可以提高對ASC-US中高級別病變的檢出作用。后續我們還需要更大樣本量的臨床觀察和實驗來驗證此結論。
[1]徐海燕,辛曉燕.人乳頭瘤病毒感染與宮頸癌的研究進展[J].中國婦幼健康研究,2007,18(5):436-440.
[2]Schmid MP,Kirisits C,Nesvacil N,et al.Local recurrences in cervical cancer patients in the setting of image guided brachytherapy:a comparison of spatial dose distribution within a matched pair a-nalysis[J].Radiother Oncol,2011,100(3):468.
[3]Mae?le Saunier,Sylvain Monnier-Benoit,Fre'de'ric Mauny,et al.Analysis of human papillomavirus type16(HPV16)DNA Load and physical state for identification of HPV16-infected women with high-grade lesions or cervical carcinoma[J].Clinical Microbiology,2008,46(11):3678-3685.
[4]Wiman KG.Pharmacological reactivation of mutant p53:from protein structure to the cancer patient[J].Oncogene,2010,29(30):4245.
[5]Tozawaono A,Yoshida A,Yokomachi N,et al.Heat shock protein 27 and p16 immunohistochemistry in cervical intraepithelial neoplasia and squamous cell carcinoma[J].Hum Cell,2012,25(1):24-28.
[6]Wentzensen N,Bergeron C,Bergeron C.Evaluation of a nuclear score for p16INK4a-stained cervical squamous cells in liquidbased cytology samples[J].Cancer,2005,105(6):461-467.
[7]Longatto Filho A,Utagawa ML,Shirata NK,et al.Immunocytochemical expression of p16INK4A and ki-67 in cytologically negative and equivocal pap smears positive for oncogenic human papillomavirus[J].Int J Gynecol Pathol,2005,24(2):118-124.
[8]Gatta L B,Berenzi A,Balzarini P,et al.Diagnostic implications of L1,p16,and Ki-67 proteins and HPV DNA in low-grade cervical intraepithelial neoplasia[J].Int J Gynecol Pathol,2011,30(6):597-604.
[9]徐 萍,宋美芳,高 怡,等.Ki-67在慢性宮頸炎、宮頸上皮不典型增生及宮頸鱗癌中的表達及意義[J].復旦學報(醫學版),2005,32(2):253-254.
[10]張雪寶,陸天才,張 超,等.宮頸原位癌中Ki-67的表達及其與細胞凋亡的關系[J].診斷病理學雜志,2004,11(6):418-420.
[11]Redman R,Rufforny I,Liu C,et al.The utility of p16(Ink4a)in discriminating between cervical intraepithelial neoplasia1 and nonneoplastic equivocal lesions of the cervix[J].Arch Pathol Lab Med,2008,132(5):795-799.
[12]Agoff SN,Lin P,Morihara J,et al.P16(INK4a)expression correlateswith degree of cervical neoplasia:a comparison with Ki-67 expression and detection of high-riskHPV types[J].Mod Pathol,2003,16(7):665-673.
[13]Tringler B,Gu PCJ,Singh M,et al.Evaluation of P16 and pRb expression in cervical squamous and glandular neoplasia[J].Hum Pathol,2004,35(6):689-696.
[14]Horn LC,Reichert A,Oster A,et al.Immunostaining for p16INK4a used as a conjunctive tool improves interobserver agreement of the histologic diagnosis of cervical intraepithelial neoplasia[J].Am J Surg Pathol,2008,32(4),502-512.
[15]Juric D,Mahovlic V,Rajhvajn S,et al.Liquid-based cytologynew possibilities in the diagnosis of cervical lesions[J].Coll Antropol,2010,34(1):19-24.
[16]Resnick M,Lester S,Tate JE,et al.Viral and histopathlogic correlates of MN and MIB-1 express in cervical intraepithelial neoplasia[J].Human Pathol,1996,27(3):234-239.
[17]McCluggage WG,Buhidma M,Tang L,et al.Monoclonal antibody MIB1 in the assessment of cervical squamous intraepithelial lesions[J].Int J Gynecol Pathol,1996,15(2):131-136.
[18]易 為,王建六,魏麗惠.p16ink4a與Ki-67用于人宮頸病變輔助診斷的比較[J].解剖學報,2008,39(3):440-442.
[19]Yuan Q,Wilbur DC.Original cervical cytology and follow-up biopsy results in positive high risk human papillomavirus DNA tests with high-level results[J].Acta Cytol,2008,52(5):557.
[20]Jones HW.Clinical treatment of women with atypical squamous cells of undetermined significance or atypical glandular cells of undetermined significance cervical cytology[J].Clin Obstet Gynecol,2000,43(2):381.
[21]Arbyn,Buntinx F,Van Ranst M,et al.Virologic versus cytologic triage of women with equivocal Pap smears:a meta-analysis of the accuracy to detect high-grade intraepithelial neoplasia[J].Natl Cancer Inst,2004,96(4):280-293.
[22]Wright T,Sehiffman M,Solomon D.Iterim guidance for the use of human papillomavirus DNS testing as an adjunct to cervical cytology for screening[J].Obstet Gyneeol,2004,103(2):304-309.
[23]Ekalaksananan T,Pientong C,SriamPom S,et al.Usefulness of combining testing for P16 protein and human papillomavirus(HPV)in cervical carcinoma screening[J].Gyneeol Oneol,2006,103:62-66.

