三水碳酸鎂粒度分布影響因素的研究
韓 冰 ,沙作良 ,Louhi-Kultanen Marjatta
(1. 天津市海洋資源與化學重點實驗室,天津科技大學海洋科學與工程學院,天津 300457,中國;2. 拉彭蘭塔理工大學化學工藝學院,拉彭蘭塔 53851,芬蘭)
碳酸鎂是一種非常復雜的化合物,是白色無氣味的粉末狀物質,依據其制備過程中MgCO3、Mg(OH)2和 H2O組成的不同量的比例和不同的形成條件可以形成不同的晶形和復鹽,如無水菱鎂礦(MgCO3)、三水碳鎂石(MgCO3·3H2O)、五水碳鎂石(MgCO3·5H2O)、纖菱鎂礦(Mg5(CO3)4(OH)2·3H2O)和水菱鎂礦(Mg5(CO3)4(OH)2·4H2O)等.由于這些化合物有著特殊的性質,因此可以應用到不同的工業領域,如藥物、化妝品、橡膠、涂料和作為其他含鎂化學材料的前體等[1–3].其中三水碳鎂石和水菱鎂礦有著獨特的物理化學性質,它們的分解是吸熱反應,分解出的二氧化碳和水都是無毒無害的,因此,在一定程度上這兩種鎂化合物可以用作阻燃物[4].
文獻中報道了很多通過液液反應合成碳酸鎂的過程.例如,用 MgCl2溶液與(NH4)2CO3或 Na2CO3溶液反應[5–7],或是通過 MgSO4·7H2O 溶液與 Na2CO3溶液反應[8]制備三水碳酸鎂.如今,全球變暖已經變得越來越嚴重,所以二氧化碳的吸收是一個研究的熱點,二氧化碳可以為碳酸鎂的制備提供碳源.一些文獻[9–11]已經報道了用二氧化碳作為反應物合成碳酸鎂的沉淀結晶過程.Botha等[12]研究了通過鼓吹二氧化碳氣體到氫氧化鎂懸濁液中來析出碳酸鎂化合物的過程,探討了懸濁液的溫度、鹽酸的加入量、干燥溫度和干燥時間等因素對沉淀過程的影響. Mitsuhashi等[13]介紹了改變氫氧化鈉的加入量對氫氧化鎂和二氧化碳反應生成碳酸鎂結晶過程的影響,發現針狀顆粒分布是由氫氧化鈉的濃度決定的.結晶溫度、反應物濃度、pH等因素會形成不同形態和大小的碳酸鎂晶體.這些學者只考慮了在不同實驗條件下會產生何種產品,然而,如何控制最終產品的粒度分布以及何種因素是影響產品的主要因素還沒有闡述透徹.
本文以氫氧化鎂和二氧化碳為反應物,研究不同因素對碳酸鎂水合物的半間歇反應結晶過程的影響,找到在結晶過程中控制粒度分布的基本方法.
1 實 驗
1.1 實驗方法
實驗用氫氧化鎂(分析純)和二氧化碳(純度≥99.7%)作為初始反應物,用去離子水來配制氫氧化鎂懸浮液.
實驗裝置如圖1所示.
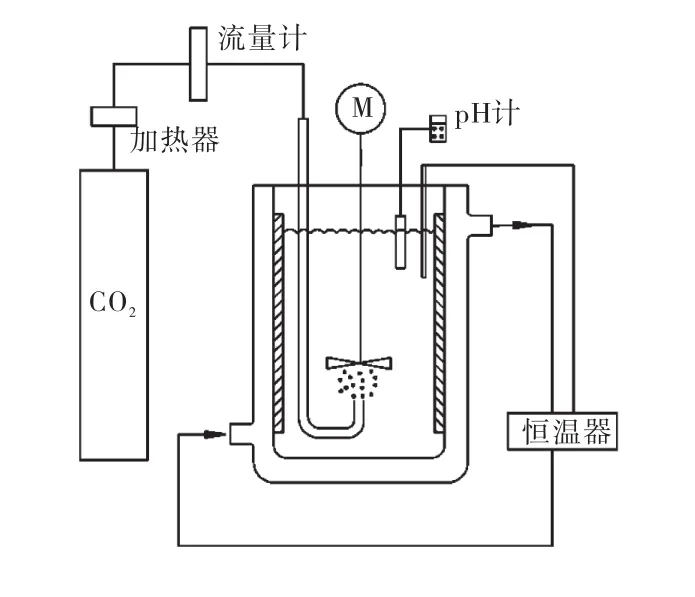
圖1 實驗裝置示意圖Fig.1 Schema of experimental set-up
間歇操作中,在一個帶有夾套的玻璃結晶器中放入一定量的氫氧化鎂和3,L去離子水,通過攪拌使其混合均勻.為了能夠使懸浮液較好地懸浮和防止漩渦的產生,將 4個擋板均勻地放置在結晶器的內壁上.氫氧化鎂懸浮液的溫度采用連接于恒溫器的外置探針監測.當懸浮液溫度到達預期溫度時,通過多孔氣體分布器從結晶器的底部通入二氧化碳.在結晶過程中,pH計用于監測反應體系 pH的變化,當pH達到穩定時停止通入二氧化碳氣體.反應結束時取出固液樣立即進行過濾分離,將固相樣在室溫自然條件下晾干.這主要是因為在溫度高的情況下晶體的組成和形態在干燥過程中可能會發生改變[12].
1.2 晶體分析
采用 Beckman Coulter LS13320 型激光粒度分析儀分析固相樣的顆粒粒度分布.通過 X射線粉末衍射儀來鑒定產品的組成和水合物的形態.
2 結果與討論
2.1 溫度對產品粒度分布的影響
在二氧化碳通氣流量為 9,L/min、攪拌速度為310,r/min、氣體分布器孔徑為60,μm和初始固體含量為 3.8%的情況下,選用了 25、40、62,℃ 3個溫度進行半間歇反應結晶的研究,溫度對最終產品粒度分布的影響如圖2所示.
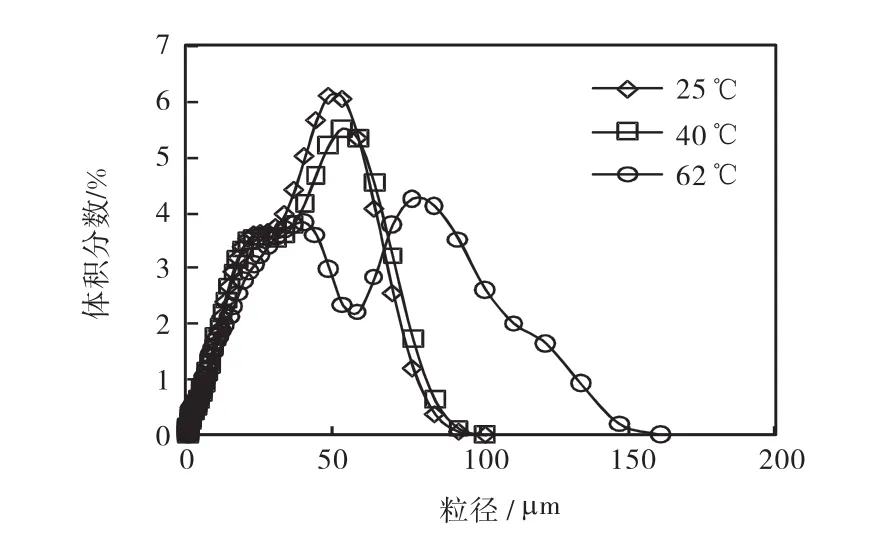
圖2 溫度對產品粒度分布的影響Fig.2 Effect of temperature on crystal size distribution of the final product
從圖2可以看出:產品粒度隨著溫度的升高而逐漸增大,這與Wang等[5]得到的結果一致.從25,℃到40,℃,產品的粒度略有增大.在 62,℃時,粒度分布呈現了雙峰形態,經 XRD鑒定,產品組成并沒有發生改變,仍然是三水碳酸鎂.由于溫度的升高有利于氣液兩相的傳質,增大了 CO2的溶解速率.當溫度在25~40,℃時,CO2溶解速率的增加對于晶體生長有促進作用,因而造成晶體粒度有所增大.當 CO2溶解速率達到一定程度,在短時間內形成大量的碳酸鎂,其主要是以成核的形式形成晶體,因而導致了晶核團聚現象.因此,62,℃時產品會出現雙峰.另一方面,在溫度較高時,溶液的黏度相對較低,溶液的表面張力較小,也是促進初級成核的另一因素.通過 pH監測結果可以得知反應溫度越高,pH下降的速度越快,從而證實了 CO2的溶解速率隨溫度升高而加快的假設.
2.2 氣體分布器孔徑對產品粒度分布的影響
在 25,℃、固體含量 3.8%、二氧化碳通氣流量9,L/min、攪拌速度 310,r/min的實驗條件下,選擇了40,μm與60,μm兩個不同孔徑大小的氣體分布器,得到的最終產品粒度分布特征如圖3所示.
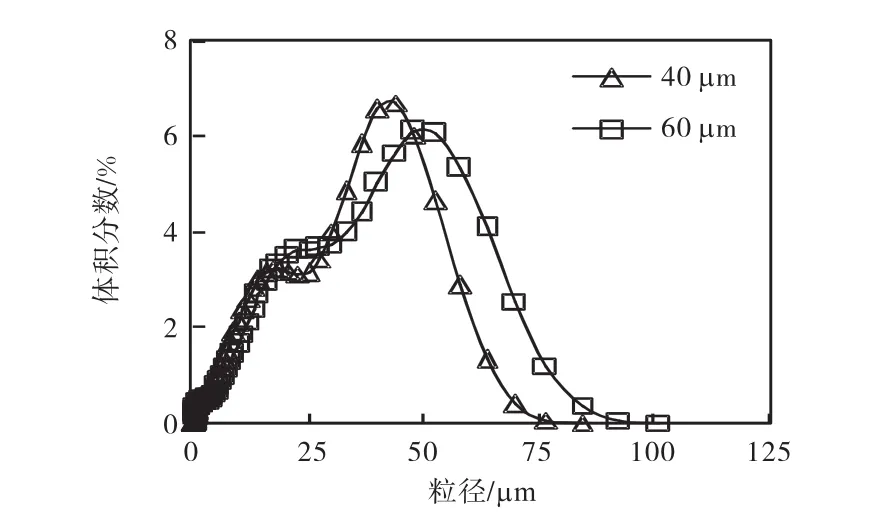
圖3 氣體分布器孔徑對產品粒度分布的影響Fig.3 Effect of pore size of sparger on the particle size distribution of the final product
由圖 3可以看出:隨著氣體分布器孔徑的變大,產品的粒度增大.其原因是氣體分布器孔徑越小,氣體在懸浮液中分散程度越好,氣泡越小,從而增加了氣液兩相的接觸面積,提高了兩相間的傳質速率,且增加了CO2的溶解速率.氣體更易溶于液相中,液相中碳酸根的濃度越高,過飽和度越大,成核過程就越占優勢,所以導致產品的粒度變小.從產品的粒度來看,過程主要還是成核,生長起的作用不太顯著.
2.3 氫氧化鎂懸浮液的初始固體含量對產品粒度分布的影響
Park等[14]發現氫氧化鈣的初始固體含量能夠影響結晶析出的碳酸鈣的晶體粒度分布.因此,在本文研究的體系中,認為氫氧化鎂的初始固體含量也有可能對碳酸鎂的產品粒度產生影響.
在恒溫 25,℃、攪拌速度 310,r/min、通氣流量9,L/min、氣體分布器孔徑為40,μm的實驗條件下,設置了 3個不同的氫氧化鎂初始固體含量,分別為3.8%、2.9%、2.0%,研究它們各自的半間歇反應結晶過程,3個過程體系的 pH變化趨勢如圖 4所示.由圖 4可知:隨著氫氧化鎂懸浮液初始固體含量的降低,體系的 pH降低速度加快.然而,在氫氧化鎂懸浮液的初始固體含量為 2.0%時,反應結束時并沒有晶體析出.這種情況有可能是二氧化碳把氫氧化鎂都轉化成了碳酸氫鎂溶液,如文獻[13]中采用二氧化碳和氫氧化鎂制備碳酸氫鎂溶液,然后再通過滴加氫氧化鈉來控制三水碳酸鎂的晶形.這很可能是二氧化碳的通氣流量太大,導致 pH降低得太快而不能形成碳酸鎂所造成的.為了證實我們的猜測,準備了相同固體含量(2.0%)的氫氧化鎂懸浮液,其他條件均相同的情況下,以比較低的通氣流量(1,L/min)進行測試,反應最后有極少量的晶體析出.由此可見,pH在整個結晶過程中起著非常重要的作用.
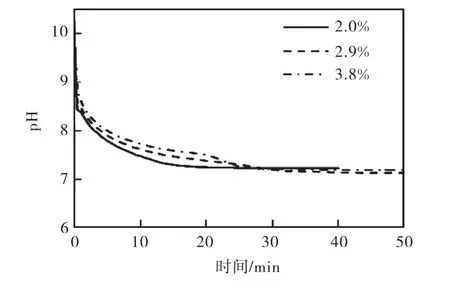
圖4 氫氧化鎂初始固體含量對體系pH的影響Fig.4 Effect of the initial slurry concentration of magnesium hydroxide on pH
在氫氧化鎂初始固體含量為2.9%和3.8%的情況下與二氧化碳反應所得到的產品粒度分布結果如圖5所示.
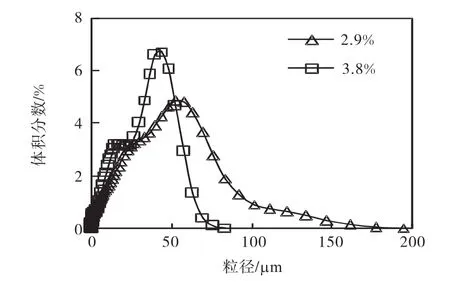
圖5 氫氧化鎂初始固體含量對產品粒度分布的影響Fig.5 Effect of initial slurry concentration of magnesium hydroxide on the particle size distribution of the product
從圖 5可以看出:相比于初始固體含量為 2.9%的氫氧化鎂懸浮液,固體含量為3.8%的懸浮液得到的碳酸鎂晶體顆粒小.在反應開始階段,不同固含量的懸浮液中鎂離子的濃度是一樣的,隨著二氧化碳的通入,體系的pH降低,促進了氫氧化鎂的溶解速率.在較高的氫氧化鎂懸浮密度的情況下,具有較多的氫氧化鎂顆粒,固液之間的界面面積相對較高,從而具有較高的溶解速率,提高了碳酸鎂的過飽和度,加快了碳酸鎂的成核速率,因此產品的顆粒粒度變小.
2.4 氫氧化鎂晶體粒度對產品粒度分布的影響
為了研究氫氧化鎂的晶體粒度對產品粒度分布是否存在影響,在結晶實驗開始前,首先手工研磨氫氧化鎂原料形成細小顆粒,采用激光粒度分析儀測量的晶體粒度分布如圖6所示.由圖6可知:研磨前氫氧化鎂原料的中值粒徑為 6.6,μm,研磨后的中值粒徑為 2.9,μm.
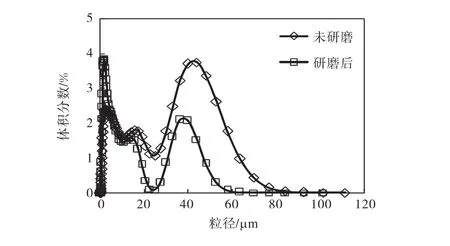
圖6 研磨前和研磨后氫氧化鎂晶體的粒度分布Fig.6 Crystal size distribution of raw and milled magnesium hydroxide
在恒溫 25,℃、攪拌速度 310,r/min、初始氫氧化鎂懸浮液固體含量 3.8%、氣體分布器孔徑為 40,μm時,采用5,L/min和9,L/min的通氣流量,研究氫氧化鎂初始晶體粒度對產品粒度分布的影響.在二氧化碳通氣流量為 5,L/min時,使用不同粒度的氫氧化鎂作為反應物,pH隨時間的變化完全一樣,而且結晶析出的碳酸鎂產品的粒度分布也幾乎完全相同.但是,在二氧化碳通氣流量為 9,L/min情況下,氫氧化鎂初始粒度的減小,促使體系 pH降低的速度加快,形成了較大顆粒的碳酸鎂晶體,其產品粒度分布如圖7所示.
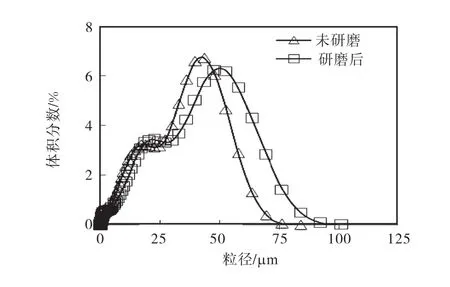
圖7 二氧化碳氣流量為 9,L/min時氫氧化鎂初始粒度對最終產品粒度分布的影響Fig.7 Effect of the initial particle size of magnesium hydroxide on the particle size distribution of the final product at a flow rate of 9,L/min
粒度的減小,增大了溶解表面,提高了溶解速率,但是結晶過程主要還是由二氧化碳的溶解速率控制.當二氧化碳通氣流量低的情況下,對于產品的粒度并沒有很大影響,而高速率的氣流量通入的時候,使得氣液傳質加快,相對提高了溶液的過飽和度,增加了生長速率,使得晶體變大.
2.5 結晶產物的鑒定
通過 XRD對所有產品進行鑒定,反應結晶所得到的最終產品均為三水碳酸鎂,即三水碳鎂石,與參考數據庫中的 JCPDS 20-0669卡片匹配.該結果與文獻[15]中報道的在室溫條件下通常形成三水碳鎂石的結果一致.但邵平平等[16]發現當溫度高于323,K時三水碳酸鎂會變為堿式碳酸鎂.這與本文在 62,℃條件下仍然得到三水碳酸鎂并不一致,不同溫度下結晶產品的XRD譜圖如圖8所示.這可能是由于反應的體系,或者是液液反應和氣液反應的機制不同所造成的.文獻[17]中采用分子動態模擬方法說明:盡管鎂離子比鈣離子僅僅略小(因此有著較高的電荷密度),但是在鎂離子周圍的水分子壽命卻約為數百皮秒,而像鈣、鉀、鈉等離子周圍水分子的壽命只有幾皮秒.所以鎂離子的親水性極強,這對于在反溶劑過程中鎂離子形成無水碳酸鹽造成了很大的限制,所以一般條件下鎂離子都會形成鎂的水合物.
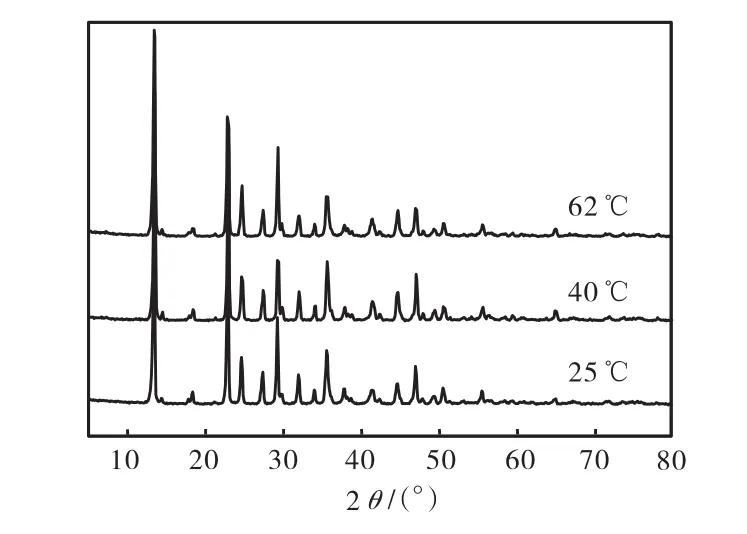
圖8 不同溫度下產品的XRD圖Fig.8 XRD patterns of the products at different temperatures
3 結 語
在常溫常壓條件下,通過適當地調整操作參數,三水碳酸鎂可以通過氫氧化鎂懸浮液和二氧化碳的反應結晶得到,且三水碳酸鎂一般在 pH 7~7.6形成.溫度的升高和氣體分布器孔徑的增大,都會使最終三水碳酸鎂產品的粒度增大.然而,氫氧化鎂懸浮液初始固體含量的增大會形成較小的三水碳酸鎂顆粒.研究結果還表明氫氧化鎂粒度的大小對最終產品的粒度分布在二氧化碳通氣流量低的情況下并沒有影響,而在通氣流量高的情況下產生了顯著的影響.本文所研究的內容能夠提供在氣液固復雜的反應結晶過程中如何控制產品粒度分布的基本方法,這將對于結晶過程中最優操作條件的選取和過程的優化設計起到至關重要的作用.
[1] Birchal V S S,Rocha S D F,Ciminelli V S T. The effect of magnesite calcination conditions on magnesia hydration[J]. Minerals Engineering,2000,13(14/15):1629–1633.
[2] Freitag F,Kleinebudde P. How do roll compaction/dry granulation affect the tableting behaviour of inorganic materials? Comparison of four magnesium carbonates[J]. European Journal of Pharmaceutical Sciences,2003,19(4):281–289.
[3] Rittidech A,Portia L,Bongkarn T. The relationship between microstructure and mechanical properties of Al2O3–MgO ceramics[J]. Materials Science and Engineering:A,2006,438/439/440:395–398.
[4] Hollingbery L A,Hull T R. The thermal decomposition of huntite and hydromagnesite:A review[J]. Thermochimica Acta,2010,509(1/2):1–11.
[5] Wang Y,Li Z B,Demopoulos G P. Controlled precipitation of nesquehonite(MgCO3·3H2O)by the reaction of MgCl2with(NH4)2CO3[J]. Journal of Crystal Growth,2008,310(6):1220–1227.
[6] Cheng W T,Li Z B. Precipitation of nesquehonite from homogeneous supersaturated solutions[J]. Crystal Research and Technology,2009,44(9):937–947.
[7] 程文婷,李志寶,柯家駿. MgCO3·3H2O 晶體生長及晶形的影響因素[J]. 中國有色金屬學報,2008,18(s1):230–235.
[8] Ohkubo T,Suzuki S,Mitsuhashi K,et al. Preparation of petaloid microspheres of basic magnesium carbonate[J].Langmuir,2007,23(11):5872–5874.
[9] H?nchen M,Prigiobbe V,Baciocchi R,et al. Precipitation in the Mg-carbonate system:Effects of temperature and CO2pressure[J]. Chemical Engineering Science,2008,63(4):1012–1028.
[10] Ferrini V,Vito C D,Mignardi S. Synthesis of nesquehonite by reaction of gaseous CO2with Mg chloride solution:Its potential role in the sequestration of carbon dioxide[J]. Journal of Hazardous Materials,2009,168(2/3):832–837.
[11] Teir S,Eloneva S,Fogelholm C J,et al. Fixation of carbon dioxide by producing hydromagnesite from serpentinite[J]. Applied Energy,2009,86(2):214–218.
[12] Botha A,Strydom C A. Preparation of a magnesium hydroxy carbonate from magnesium hydroxide[J]. Hydrometallurgy,2001,62(3):175–183.
[13] Mitsuhashi K,Tagami N,Tanabe K,et al. Synthesis of microtubes with a surface of “house of cards” structure via needlelike particles and control of their pore size[J].Langmuir,2005,21(8):3659–3663.
[14] Park S Y,Choi W S. Effects of operating factors on the particle size distribution and particle shape of synthesized precipitated CaCO3:Effect of reaction temperature,blowing rate of CO2gas and initial slurry concentration of Ca(OH)2on reaction completion time[J]. Advanced Powder Technology,2004,15(1):1–12.
[15] Langmuir D. Stability of carbonates in the system MgOCO2-H2O[J]. The Journal of Geology,1965,73(5):730–754.
[16] 邵平平,李志寶,密建國. 碳酸鎂水合物在 283~363,K范圍內的晶體組成及晶型[J]. 過程工程學報,2009,9(3):520–525.
[17] Jiao D,King C,Grossfield A,et al. Simulation of Ca2+and Mg2+solvation using polarizable atomic multipole potential[J]. The Journal of Physical Chemistry B,2006,110(37):18553–18559.

