鹽酸頭孢卡品酯片在中國健康受試者體內的藥動學*
周文佳,張全英,黃明,華雯妍,王蒙,宗順麟,俞蘊莉
(蘇州大學附屬第二醫院臨床藥理實驗室,蘇州 215004)
鹽酸頭孢卡品酯片在中國健康受試者體內的藥動學*
周文佳,張全英,黃明,華雯妍,王蒙,宗順麟,俞蘊莉
(蘇州大學附屬第二醫院臨床藥理實驗室,蘇州 215004)
目的 研究中國健康受試者單/多次口服鹽酸頭孢卡品酯片的藥動學。方法將30例受試者隨機分為3組,每組10例,男女各半,一組進行鹽酸頭孢卡品酯片低劑量(100 mg)的單/多次給藥人體藥動學試驗,受試者每天服藥3次,每次100 mg,一共服藥12次;一組進行鹽酸頭孢卡品酯片中劑量(200 mg)的單次給藥人體藥動學試驗;一組進行鹽酸頭孢卡品酯片高劑量(300 mg)的單次給藥人體藥動學試驗。采用高效液相色譜-串聯質譜(HPLC-MS/MS)法測定活性代謝產物頭孢卡品的血濃度,采用DAS 2.0版軟件計算其主要藥動學參數,采用SPSS 17.0版軟件對主要參數進行統計分析。結果單次空腹口服鹽酸頭孢卡品酯片100,200和300 mg后主要藥動學參數:tmax分別為(1.42±0.54), (1.80±0.59)和(2.10±0.81)h;t1/2分別為(1.45±0.17),(1.60±0.22)和(1.44±0.18)h;MRT0-12h分別為(2.75±0.42), (2.99±0.33)和(3.31±0.57)h;Cmax分別為(1 419±384),(2 128±366)和(2 438±655)μg·L-1;AUC0-12h分別為(4 369± 1 078),(7 477±1 616)和(9 091±3 735)μg·h·L-1;AUC0-∞分別為(4 389±1 080),(7 528±1 640)和(9 146±3 749) μg·h·L-1;V/F分別為(52.13±21.81),(63.60±14.78)和(76.06±23.29)L;CL/F分別為(24.27±7.06),(27.61± 5.42)和(36.49±10.31)L·h-1。多次口服鹽酸頭孢卡品酯片100 mg后主要藥動學參數:tmax為(1.90±0.70)h;t1/2為(1.63±0.16)h;MRT0-12h為(2.87±0.52)h;Cssmax為(1 133±200)μg·L-1;AUCss為(3 607±730)μg·h·L-1;AUC0-12h為(3 731±775)μg·h·L-1;AUC0-∞為(3 757±785)μg·h·L-1;V/F為(66.15±20.29)L;CL/F為(27.85±6.66)L·h-1,Cssmin為(105.4±57.17)μg·L-1;Cav為(450.9±91.2)μg·L-1;DF為(2.33±0.47);觀察蓄積比Ro為(0.870±0.131)。結論鹽酸頭孢卡品酯片在劑量為100~300 mg范圍內呈線性藥動學特征,口服鹽酸頭孢卡品酯片,每日3次,每次100 mg,未發現蓄積現象。
頭孢卡品酯,鹽酸;頭孢卡品;藥動學;LC-MS/MS
頭孢卡品酯是1985年由日本鹽野義制藥研究所開發的口服頭孢菌素類抗菌藥物。臨床研究顯示,頭孢卡品酯片治療呼吸系統、泌尿系統急性細菌感染抗菌活性強,細菌清除率高[1]。鹽酸頭孢卡品酯水合物吸收時通過腸壁酯酶水解生成抗菌活性體頭孢卡品,頭孢卡品通過阻斷細菌細胞壁合成而發揮抗菌作用,頭孢卡品與金黃色葡萄球菌的殺菌靶點青霉素結合蛋白(penicillin-binding protein,PBP)1,2,3有高親和力,與大腸埃希菌及普通變形桿菌細胞壁合成的必要酶PBP3也有高親和力[2]。體外抗菌研究顯示,頭孢卡品對我國近3年臨床分離的致病菌仍保持較好的抗菌作用,特別是對流感嗜血桿菌和鏈球菌屬。與臨床常用品種比較,頭孢卡品對革蘭陽性菌和革蘭陰性菌作用比較均衡,與頭孢妥侖抗菌活性相似,針對革蘭陽性菌,優于頭孢泊肟和頭孢克肟,針對革蘭陰性菌,優于頭孢泊肟[3]。目前,鹽酸頭孢卡品酯片僅在50~200 mg范圍內的藥動學參數有報道[4],筆者在本試驗中首次報道了中國健康受試者空腹口服鹽酸頭孢卡品酯片100,200和300 mg后的藥動學參數,為臨床合理用藥提拱參考。
1 材料與方法
本臨床試驗已獲得國家食品藥品監督管理總局的臨床批準及蘇州大學附屬第二醫院倫理委員會批準,嚴格遵守《赫爾辛基宣言》(the Declaration of Helsinki)的《人體醫學研究的倫理準則》及國家食品藥品監督管理總局頒布《藥物臨床試驗規范》(Good Clinical Practice,GCP),研究人員向受試者說明了試驗藥物的性質、試驗目的及方法、參加試驗的獲益及風險和自愿參加的原則,并獲得了受試者的書面知情同意書。
1.1 受試者選擇 健康受試者30例,男女各15例,均不吸煙、不嗜酒,無心臟、呼吸、內分泌、新陳代謝、腎臟、肝臟、胃腸道、皮膚、感染、惡性腫瘤、血液、神經系統疾病或精神病/機能紊亂等病史,一般體檢、生化,血、尿常規及12導聯心電圖無有臨床意義的異常,哺乳期或妊娠期婦女、育齡期婦女采用恰當的避孕措施,無藥物、食物等過敏史,無直立性低血壓史,入選前3個月內無獻血史,入選前3個月內未參加過其他臨床試驗,試驗前2周內未服用任何其他藥物。30例健康受試者中男女各15例,平均(24±2)歲(20~30歲),身高(1.68±0.08)m(1.52~1.81 m),體質量(59.8± 8.0)kg(50.0~76.0 kg),體質量指數19~24。
1.2 試驗設計 采用單周期、開放、平行設計方法進行鹽酸頭孢卡品酯片單/多次給藥人體藥動學試驗。30例受試者隨機分為3組,每組10例(男女各半),一組進行鹽酸頭孢卡品酯片低劑量(100 mg)單/多次給藥人體藥動學試驗,一組進行中劑量(200 mg)單次給藥人體藥動學試驗,一組進行高劑量(300 mg)單次給藥人體藥動學試驗。根據預試驗結果,頭孢卡品血漿半衰期(t1/2)為1.5 h,tmax為1.0 h,根據《化學藥物臨床藥動學研究技術指導原則》,設計采血時間點為給藥前和給藥后20,40 min,1,1.5,2,2.5,3,4,5,6,8,10和12 h,共14個點。
1.2.1 單次給藥藥動學 低、中、高劑量3組受試者于試驗前禁食過夜10 h,于次日6∶30分別空腹口服鹽酸頭孢卡品酯片100,200和300 mg,溫開水250 mL送服,給藥后2 h內禁水,4 h內禁食。按采血時間點由前臂靜脈采血3 mL,置肝素化離心試管中,立即離心(4℃,4 000 r·min-1,5 min),分離血漿,于-70℃冷凍保存待測。
1.2.2 多次給藥藥動學 低劑量組受試者在單次給藥藥動學試驗采血結束后進行多次給藥藥動學試驗。即試驗第1天晚(22∶30)、試驗第2~4天早(6∶30)、中(14∶30)、晚(22∶30)和試驗第5天早(6∶30)分別空腹口服鹽酸頭孢卡品酯片100 mg,250 mL溫開水送服。一共給藥12次。在第3,4,5天早晨(6∶30)給藥前由前臂靜脈采血3 mL測定谷濃度,第5天給藥后按單次給藥藥動學試驗方法采集血樣,血樣處理方法同上。
1.3 樣本的測定
1.3.1 試劑和儀器 鹽酸頭孢卡品酯片[石藥集團中奇制藥技術(石家莊)有限公司,批號:20100801,規格:每片100 mg];頭孢卡品標準品[石藥集團中奇制藥技術(石家莊)有限公司,批號:20100928-4,含量: 99.52%];頭孢拉定標準品[內標,中國食品藥品檢定研究院,批號:130427-200306,含量:91.8%);甲醇(美國Tedia公司,色譜純),水為純凈水,醋酸銨(南京化學試劑有限公司,分析純)。LC-MS/MS系統包括API-4000型三重四極桿串聯質譜儀(美國Applied Biosys-tem Sciex公司);Agilent 1200高效液相色譜儀(美國Agilent公司);數據處理系統為Analyst 1.4.2(美國Applied Biosystem Sciex公司)。XS 105DU型分析天平(瑞士METTLER TOLEDO公司)。
1.3.2 測定方法 受試者血樣采用已驗證的LC-MS/MS方法進行測定[2]。血漿樣品經甲醇沉淀蛋白法處理,以頭孢拉定作為內標,用C18柱(Waters公司,Symmetry C18,3.9 mm×150 mm,5 μm)進行分離,以甲醇-2.5 mmol·L-1醋酸銨緩沖液(32∶68)為流動相,選用電噴霧(electrospray ionization,ESI)離子源,在負離子電離模式下,采用多反應監測(multiple reaction monitoring,MRM)的質譜掃描方式,頭孢卡品的檢測離子為:m/z452.1→409.1,內標頭孢拉定的檢測離子為m/z348.1→270.0。在選定的條件下,頭孢卡品和內標頭孢拉定的保留時間為2.35和3.82 min,內源性物質對測定無干擾;頭孢卡品的線性范圍為:3.600~3 600 μg·L-1,r=0.9998;最低定量限為3.600 μg·L-1;低、中、高濃度質控樣本(10.00,300.0, 3 000 μg·L-1)批內RSD分別為4.3%,1.1%和0.8%,批間RSD分別為1.8%,2.1%和1.2%;血漿基質效應分別為92.0%,92.5%和94.2%;平均提取回收率分別為102.5%,98.3%和97.0%;內標頭孢拉定的基質效應為97.2%,提取回收率為99.7%;穩定性試驗考察結果顯示低、中、高濃度血漿質控樣本在室溫下放置4 h、-70℃反復凍融3次、-70℃凍存17 d后仍穩定,處理后的待測樣本在自動進樣器8℃中放置26 h后仍穩定;儲備液于-40℃冰箱中儲存21 d后仍穩定[2]。試驗結果顯示測定方法符合要求。
1.4 藥動學參數計算方法 采用DAS 2.0版軟件計算藥動學參數,tmax和Cmax均用實測值,AUC0-t和AUC0-∞以梯形面積法求;t1/2=0.693/Kel,AUC0-t=Σ(Ci+Ci-1)(ti+ti-1)/2,AUC0-∞=AUC0-t+Ct/Kel,AUMC0-t=Σ (Citi+Ci-1ti-1)(ti+ti-1)/2,MRT0-t=AUMC0-t/AUC0-t,CL/F=D/AUC0-∞。式中Kel為末端相消除速率常數,由末端相的ln(濃度)與時間的線性回歸求得,Ct為服藥后12 h的血藥濃度。穩態谷濃度(Cssmin)和穩態峰濃度(Cssmax)為實測值,穩態曲線下面積AUCss=Σ(Ci+Ci-1) (ti+ti-1)/2,波動度DF=(Cssmax-Cssmin)/Cav,平均穩態血藥濃度Cav=AUCss/τ,τ為給藥時間間隔8 h,觀察蓄積比R0=AUC0-t(多次)/AUC0-t(單次)。
1.5 數據處理與統計方法 采用SPSS 17.0版統計軟件進行藥動學參數分析,對各劑量組主要藥動學參數性別間差異采用獨立樣本的t檢驗,對tmax進行Mann-Whitney非參數檢驗。對各劑量組間的t1/2采用Kruskal-Wallis非參數檢驗,分別對lnCmax-lndose、lnAUC0-t-lndose和ln AUC0-∞-lndose進行相關分析。對受試者多次口服鹽酸頭孢卡品酯片100 mg后的tmax和t1/2進行Wilcoxon非參數檢驗。P<0.05表示差異有統計學意義。
2 結果
2.1 不良事件 低、中、高劑量單次給藥藥動學試驗和低劑量多次給藥藥動學試驗過程中均未發生不良事件。試驗完成后,對受試者進行出組體檢,體檢結果均無有臨床意義的異常。
2.2 主要藥動學參數 30例受試者單次空腹口服不同劑量鹽酸頭孢卡品酯片后的主要藥動學參數見表1, 10例受試者多次口服鹽酸頭孢卡品酯片100 mg后的主要藥動學參數如下:AUCss(τ=8 h)為(3 607±730) μg·h·L-1,AUC0-12h為(3 731±775)μg·h·L-1, AUC0-∞為(3 757±785)μg·h·L-1,tmax為(1.90± 0.70)h,t1/2為(1.63±0.16)h,MRT0-t為(2.87± 0.52)h,Cssmin為(105.4±57.17)μg·L-1,Cssmax為(1 133±200)μg·L-1,Cav為(450.9±91.2)μg·L-1,CL/F為(27.85±6.66)L·h-1,V/F為(66.15±20.29)L,Ro為(0.87±0.13),DF為(2.33±0.47)。
2.3 受試者平均血藥濃度-時間曲線 30例受試者單次空腹口服鹽酸頭孢卡品酯片100,200和300 mg后的平均血藥濃度-時間對比曲線見圖1。低劑量組10例受試者單、多次空腹口服鹽酸頭孢卡品酯片后的平均血藥濃度-時間對比曲線見圖2。
表1 受試者單次空腹口服鹽酸頭孢卡品酯片100,200和300 mg后的藥動學參數Tab.1 Pharmacokinetic parameters of cefcapene pivoxil hydrochloride tablets after a single oral dose of 100,200 mg and 300 mg in 30 fasting volunteers ±s,n=10

表1 受試者單次空腹口服鹽酸頭孢卡品酯片100,200和300 mg后的藥動學參數Tab.1 Pharmacokinetic parameters of cefcapene pivoxil hydrochloride tablets after a single oral dose of 100,200 mg and 300 mg in 30 fasting volunteers ±s,n=10
組別tmax/h Cmax/μg·L-1AUC0-12hAUC0-∞(μg·h·L-1) V/F/L t1/2MRT0-12 h h CL/F/(L·h-1) 100 mg組1.42±0.541 419±3844 369±1 0784 389±1 08052.13±21.811.45±0.172.75±0.4224.27±7.06 200 mg組1.80±0.592 128±3667 477±1 6167 528±1 64063.60±14.781.60±0.222.99±0.3327.61±5.42 300 mg組2.10±0.812 438±6559 091±3 7359 146±3 74976.06±23.291.44±0.183.31±0.5736.49±10.31
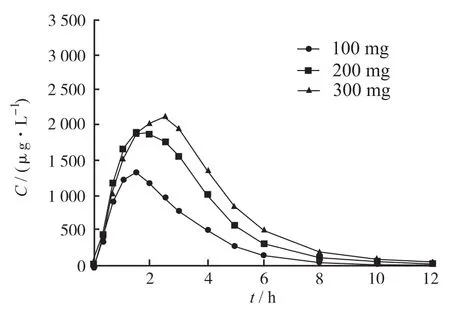
圖1 30例受試者單次空腹口服100,200和300 mg鹽酸頭孢卡品酯片后的平均血藥濃度-時間對比曲線Fig.1 Mean plasma concentration-time curves after a single oral dose of 100,200 mg and 300 mg cefcapene pivoxil hydrochloride tablets in 30 fasting volunteers
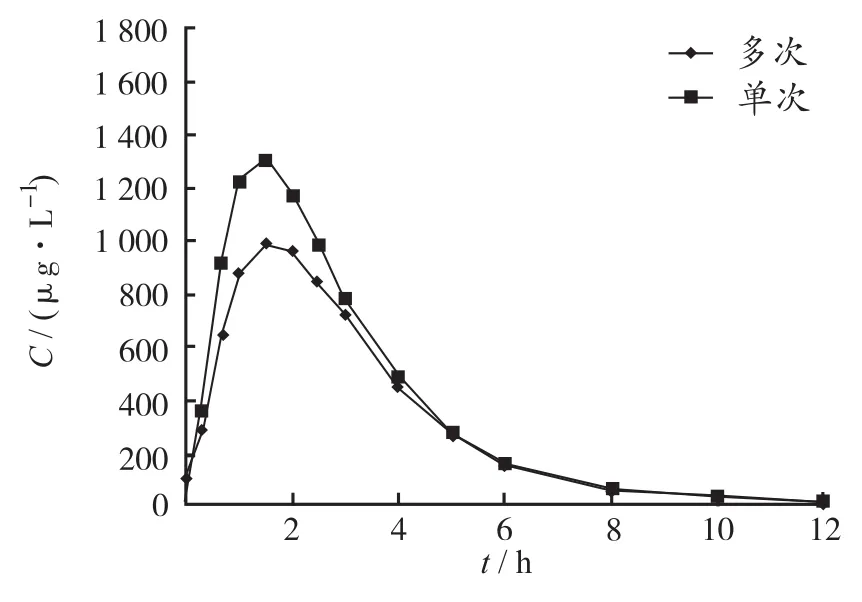
圖2 10例受試者多次口服100 mg鹽酸頭孢卡品酯片后的平均血藥濃度-時間對比曲線Fig.2 Comparison of mean plasma concentration-time curve after single or multiple oral dose of 100 mg cefcapene pivoxil hydrochloride tablets in 10 fasting volunteers
3 討論
3.1 給藥方案確定依據 為了考察該藥在人體內藥動學的線性特征,單次給藥試驗中選擇100,200和300 mg進行試驗。其中100 mg為鹽酸頭孢卡品酯片的最小劑量單位,根據該藥的說明書,成人服用鹽酸頭孢卡品酯片每次100 mg,每日3次,因此本試驗采用日劑量300 mg作為最大單次給藥劑量進行考察。多次給藥試驗服藥方案參考臨床用藥的常規服藥劑量和療程制定。
3.2 藥動學特征
3.2.1 主要藥動學參數的性別差異 采用SPSS17.0版統計軟件對受試者單次空腹口服100,200和300 mg鹽酸頭孢卡品酯片以及多次口服100 mg鹽酸頭孢卡品酯片后的藥動學參數進行性別間差異的獨立樣本t檢驗,對tmax進行Mann-Whitney非參數檢驗。結果顯示僅當受試者單次空腹口服鹽酸頭孢卡品酯片300 mg后,tmax、t1/2和MRT0-t性別間差異有統計學意義(P<0.5),其他單次給藥組的藥動學參數性別間差異無統計學意義。說明當劑量較高時,不同性別受試者對鹽酸頭孢卡品酯片的吸收和代謝速度不同,但不影響吸收程度。多次給藥組的藥動學參數性別間差異無統計學意義。
3.2.2 主要藥動學參數與劑量相關性 用SPSS 17.0版統計軟件分別對受試者單次空腹口服鹽酸頭孢卡品酯片100,200和300 mg后的lnCmax-lndose、lnAUC0-12hlndose和ln AUC0-∞-lndose進行相關分析,結果顯示lnCmax-lndose、lnAUC0-12h-lndose和lnAUC0-∞-lndose的Pearson相關系數r分別為0.702 1(P<0.01),0.742 7 (P<0.01),0.743 6(P<0.01),說明Cmax、AUC0-12h、AUC0-∞與劑量存在線性相關關系,且相關程度較強。對t1/2進行Kruskal-Wallis非參數檢驗,結果顯示3個劑量組間t1/2差異無統計學意義,說明在劑量為100~300 mg范圍內,鹽酸頭孢卡品酯片在人體內的藥動學行為呈線性藥動學特征。
3.2.3 單/多次給藥對藥動學參數的影響 用SPSS 17.0版統計軟件分別對受試者多次口服鹽酸頭孢卡品酯片100 mg后的時間參數tmax和t1/2進行Wilcoxon非參數檢驗,結果顯示多次服藥達穩態的tmax與單次服藥后的tmax差異無統計學意義,但t1/2差異有統計學意義(P<0.5),說明連續給藥后頭孢卡品的吸收速度沒有改變,而代謝速度發生了改變。穩態情況下的蓄積比(R0)= 0.87±0.13,波動度(DF)=2.33±0.47,可見受試者空腹口服100 mg鹽酸頭孢卡品酯片,1日3次,每次100 mg,連續服藥12次,達穩態情況下Cmax、AUC0-12h、AUC0-∞不存在蓄積現象,且吸收有降低趨勢,但波動度較大。
本試驗結果表明,鹽酸頭孢卡品酯片后在中國健康受試者中一般耐受性良好,不良反應發生率低,在劑量為100~300 mg范圍內,鹽酸頭孢卡品酯片在人體內的藥動學行為呈線性藥動學特征。口服鹽酸頭孢卡品酯片1日3次,每次100 mg,不存在蓄積現象。
[1] 王慧玲,霍麗,王鎮山,等.鹽酸頭孢卡品匹酯片治療急性細菌性感染多中心雙盲隨即對照臨床研究[J].中國臨床藥理學雜志,2012,28(1):3-5.
[2] 王蒙,周文佳,黃明,等.液相色譜-質譜串聯法測定人血漿頭孢卡品濃度[J].醫藥導報,2012,31(11):1423-1425.
[3] 李耘,呂媛,劉健,等.頭孢卡品體外抗菌作用研究[J].中國抗生素雜志,2013,38(2):135-145.
[4] HONGFEI D,LI D,XIAOBING L,et al.Determination of cefcapene acid by LC-MS and their application to pharmacoki-netic study in healthy Chinese volunteers[J].J Pharm Anal, 2013,3(2):84-92.
DOI 10.3870/yydb.2014.03.007
Pharmacokinetics of Cefcapene Pivoxil Hydrochloride Tablets in Healthy Chinese Volunteers
ZHOU Wen-jia,ZHANG Quan-ying,HUANG Ming,HUA Wen-yan,WANG Meng,ZONG Shun-lin,YU Yun-li
(Laboratory of Clinical Pharmacology,the Second Affiliated Hospital of Soochow University,Suzhou 215004,
China)
Objective To assess the pharmacokinetics of single and multiple-dose of cefcapene pivoxil hydrochloride tablets in healthy Chinese subjects.MethodsThirty healthy subjects were divided into three groups(each group consisting of 5 males and 5 females)by arandomized blind design.Two groups were administered with 200 mg and 300 mg cefcapene pivoxil hydrochloride tablets,respectively for a single dose test of pharmacokinetics profile.The third group was enrolled for a multipledose study,in which patients received cefcapene pivoxil hydrochloride tablets at 100 mg three times daily for 4 days.Pharmacokinetics profile was assessed by determining concentrations of cefcapene acid with a validated HPLC-MS/MS method.The pharmacokinetic parameters were calculated by DAS 2.0 and analyzed by SPSS 17.0.ResultsAfter a single dose of oral administration,the main pharmacokinetic parameters for cefcapene acid at doses of 100,200 and 300 mg were as follow:tmaxas(1.42± 0.54),(1.80±0.59)and(2.10±0.81)h;t1/2 as(1.45±0.17),(1.60±0.22)and(1.44±0.18)h;MRT0-12has(2.75± 0.42),(2.99±0.33)and(3.31±0.57)h;Cmaxas(1 419±384),(2 128±366)and(2 438±655)μg·L-1;AUC0-12has (4 369±1 078),(7 477±1 616)and(9 091±3 735)μg·h·L-1;AUC0-∞as(4 389±1 080),(7 528±1 640)and(9 146± 3 749)μg·h·L-1;V/Fas(52.13±21.81),(63.60±14.78)and(76.06±23.29)L;CL/F as(24.27±7.06),(27.61± 5.42)and(36.49±10.31)L·h-1,respectively.The main pharmacokinetic parameters for cefcapene acid at 100 mg from the a multi-dose study were that:tmaxas(1.90±0.70)h,t1/2as(1.63±0.16)h,MRT0-12has(2.87±0.52)h,Cssmaxas(1 133± 200)μg·L-1,AUCssas(3 607±730)μg·h·L-1,AUC0-12has(3 731±775)μg·h·L-1,AUC0-∞as(3 757±785) μg·h·L-1,V/Fas(66.15±20.29)L,CL/F as(27.85±6.66)L·h-1,Cssminas(105.4±57.17)μg·L-1,Cavas (450.9±91.2)μg·L-1,DFas(2.33±0.47),andRoas(0.870±0.131).ConclusionCefcapene pivoxil hydrochloride exhibits linear pharmacokinetics in human at doses from 100 to 300 mg after single-dose oral administration.No drug accumulation is found after multiple dose of administration.
Cefcapene pivoxil,hydrochloride;Cefcapene acid;Pharmacokinetics;LC-MS/MS
R978.1;R969
A
1004-0781(2014)03-0299-05
2013-06-24
2013-08-01
*蘇州藥學會-常州四藥臨床藥學科研基金,蘇州市2011年度科技發展計劃(應用基礎研究-醫療衛生, SYSD2011139)
周文佳(1982-),女,江蘇蘇州人,主管藥師,碩士,研究方向:體內藥物分析及藥動學。電話:0512-67783687, E-mail:zwjaja@163.com。
張全英(1962-),女,江蘇蘇州人,主任藥師,學士,研究方向:藥動學及醫院藥學。電話:0512-67783687, E-mail:sdfeyyq@163.com。

