β2腎上腺素能受體激動劑/拮抗劑對大鼠成骨細胞骨堿性磷酸酶比活性的影響
彭 莉,李雙慶
(1上海市浦東新區公利醫院,上海200135;2四川大學華西金卡醫院)
研究發現,骨量的調控不僅取決于激素水平、營養狀態、物理因素、免疫功能和遺傳基因,交感神經系統(SNS)也可對骨量調控發揮重要作用。Pasco等[1]研究發現,β腎上腺素能受體拮抗劑能增加骨密度,降低骨折的危險性。Levasseur等[2]發現,懸吊大鼠喂食普萘洛爾后大鼠股骨遠側干骺端骨密度較未懸吊組及安慰劑組高。SNS廣泛分布于外周組織器官,成骨細胞(OB)和骨小梁附近有交感神經纖維存在,OB和破骨細胞(OC)上都具有β2腎上腺素能受體(ADRβ2R)[3]。骨堿性磷酸酶(bALP)是 OB的表型標志物之一,可直接反映OB的活性或功能狀態。2007年 9月 ~2008年 3月,我們觀察ADRβ2R激動劑/抑制劑作用于OB后對bALP比活性的影響,并探討SNS對骨代謝的調節機制。
1 材料與方法
1.1 材料 新生(24 h)SD大鼠顱蓋骨分離得到的OB(大鼠來自四川大學華西基礎與法醫學院動物實驗室)。主要試劑:DMEM-HG培養基、胎牛血清(GIBCO);胰蛋白酶、沙丁胺醇、ICI-118551(美國Sigma公司);堿性磷酸酶(ALP)測定試劑盒(南京建成生物工程研究所)、考馬斯亮蘭蛋白測定試劑盒(南京建成生物工程研究所)。主要儀器:CO2細胞孵箱(Heraeus);Olympus IX50倒置相差顯微鏡(日本Olympus公司);YJ-2450醫用凈化工作臺(蘇州凈化設備廠);LD5-2A型臺式離心機(北京醫用儀器廠)。
1.2 方法
1.2.1 OB分離、提取、培養 將10只SD大鼠浸泡于75%乙醇中,取出后經過無菌處理,將顱骨片剪成大小約1 mm×1 mm×1 mm骨片,加入胰蛋白酶消化。棄去胰蛋白酶,用培養基清洗數次,將骨片放入培養瓶中做翻轉培養。加入適量培養基,使之恰好浸沒骨片。標記細胞類型、日期和代數,置于孵箱中培養,至少3 d后再觀察細胞貼壁情況。待細胞從骨片周邊呈放射狀長出后,換液,并小心棄去骨片,以后每3 d換液1次。細胞融合時,進行消化傳代。第1代傳代細胞標記為P1;培養細胞再度融合時,依次傳代,標記為 P2、P3。
1.2.2 OB鑒定 取P3做細胞ALP重氮鹽法染色及礦化結節茜素紅S染色進行OB鑒定。
1.2.3 bALP比活性檢測 取P3OB接種于6孔培養板和96孔培養板中繼續培養,將OB隨機分成3組,即ADRβ2R激動劑組(A 組)、ADRβ2R 拮抗劑組(B組)、生理鹽水組(對照組),A、B組分別加入不同濃度的沙丁胺醇、ICI-118551進行干預。干預培養后第24、72、96 h分別使用AKP測定試劑盒和考馬斯亮蘭蛋白測定試劑盒,按照試劑盒規定的操作步驟操作,分別測出bALP總活性和總蛋白量,然后計算出bALP比活性值。
1.2.4 統計學方法 采用SPSS11.0統計軟件,計量資料以±s表示,多組之間均數比較使用方差分析。如方差齊,兩兩比較用LSD法;如方差不齊,兩兩比較用Tamhane's法。P≤0.05為差異有統計學意義。
2 結果
2.1 OB的培養及鑒定 原代培養第9~12天,細胞可融合80% ~90%。傳代培養的OB 3~4 h開始貼壁,6~8 h貼壁完全,細胞有數個突起,突起的個數和形態各不相同。傳代培養4~6 d后細胞融合成單層。繼續培養,細胞突起互相連接,并可重疊生長而不發生細胞間接觸抑制現象,重疊生長的細胞逐漸形成結節狀,隨后膠原堆積及鈣鹽沉積,最后形成不透光的礦化結節。倒置相差顯微鏡下觀察,細胞呈多角形、長棱形、不規則形,有較多突起,胞核明顯,呈卵圓形,可見1~3個核仁,胞質透亮、飽滿。通過細胞ALP重氮鹽法染色和礦化結節茜素紅S染色鑒定為OB。
2.2 各組OB培養24、72、96 h的bALP比活性 A組bALP比活性隨濃度增加而逐漸下降,B組bALP比活性隨濃度增加而逐漸上升。A、B組bALP比活性隨時間延長逐漸上升。各組在24 h變化幅度較小,72、96 h變化幅度較大。24 h,A、B組與對照組相比差別無統計學意義(P均>0.05);72、96 h,A、B組與對照組相比差別有統計學意義(P均<0.05)。見表1。
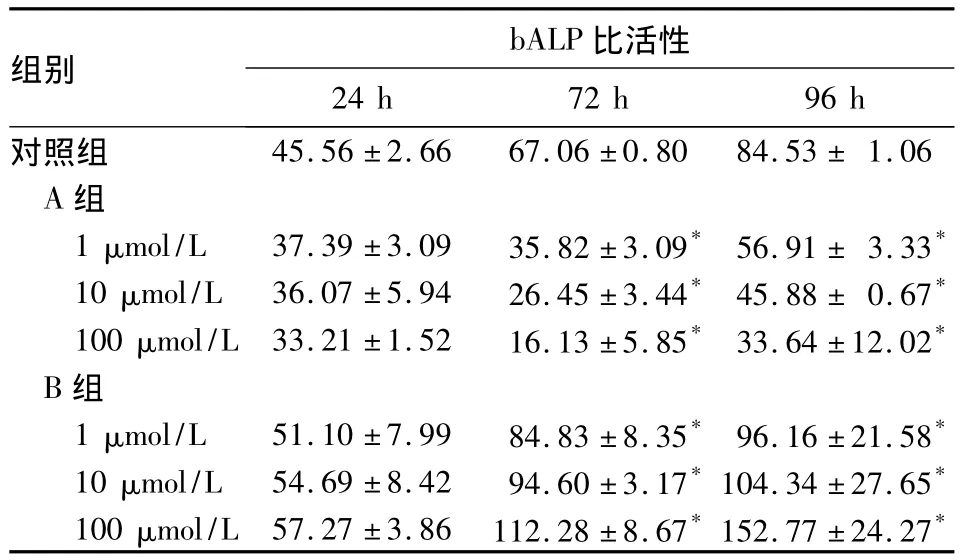
表1 各組OB培養24、72、96 h的bALP比活性(U/g)
3 討論
新近研究發現,SNS在骨量的調控中發揮著關鍵作用。Cherruau等采用胍乙啶破壞交感腎上腺素能纖維的作用,發現切斷交感神經后降鈣素相關肽免疫反應神經纖維(CGRP)的數目增加,通過OB和OC上的CGRP受體可促進OB分化增殖及抑制OC分化和成熟功能[4,5]。骨質疏松患者的OB骨形成能力降低,骨丟失大于骨形成導致骨量減少。OB在骨代謝中扮演著重要角色,它的分化成熟、功能活動以及凋亡決定了代謝過程中骨的形成與礦化的程度。激素、細胞因子等調控著OB的活動,但它們影響OB活動的行為與OB上表達的受體有著密切關系。OB和OC上都具有ADRβ2R,該受體激活刺激骨髓OC生成而導致骨量的下降;相反,抑制該受體則會促進骨形成,增加骨量。bALP比活性反映了細胞的成骨活性,其作用是水解有機磷酸酶釋放出無機磷,用于羥磷灰石的形成,是骨形成的特異指標。因此,我們推測SNS可能影響成骨細胞的bALP比活性,從而調節骨代謝。
體外獲取OB的方法有很多。本實驗提取24 h內出生的SD乳鼠頭蓋骨,采用骨組織塊貼壁培養法獲取OB。該方法操作簡單易行,換液和傳代時采用差速貼壁法可以獲得相對純化的OB。原代培養3 d后可見少數OB自顱骨碎片移出,隨時間延長,移出的OB增多,并且以骨片為中心,向周圍放射狀生長。傳代培養的OB形態與原代相似。目前對OB在體外培養中鑒定檢測,除了細胞形態學的觀察外,主要是通過檢測OB所分泌的骨組織細胞外基質來反映其功能和成骨能力。本研究細胞內ALP重氮鹽法染色結果和礦化結節茜素紅S染色結果,證明實驗培養的細胞為OB。
本研究將培養的P3新生SD大鼠OB給予不同濃度的ADRβ2R激動劑和ADRβ2R拮抗劑處理,結果顯示各OB組bALP比活性隨ADRβ2R激動劑劑量增加逐漸降低,隨ADRβ2R拮抗劑劑量增加而逐漸上升;變化具有時間依賴性,以96 h改變最明顯。本結果表明ADRβ2R激動劑能降低bALP比活性,從而抑制OB的成骨能力,ADRβ2R抑制劑則提高bALP比活性,而促進成骨細胞的成骨能力。說明交感神經遞質可以通過ADRβ2R調節OB的活動,從而影響骨代謝。
[1]Pasco JA,Henry MJ,Sanders KM,et al.Beta-adrenergic blockers reduce the risk of fracture partly by increasing bone mineral density:geelong of teoporsis study[J].J Bone Miner Res,2004,19(1):19-24.
[2]Levasseur R,Sabatier JP,Potrel-Burgol C,et al.Sympathetic nervous system as transmitter of mechanical loading in bone[J].Joint Bone Spine,2003,70(6):515-519.
[3]盛健,崔燎.下丘腦—瘦素—交感神經系統和骨量的調控[J].國外醫學:內分泌學分冊,2005,(5):333-335.
[4]Cherruau M,Morvan FO,Saffar JL.Chemical,sympathectomy-induced changes in TH-,VIP-,and CGRP-immunoreactive fibers in the rat mandible periosteum:influence on bone resorption[J].J Cellular Physiol,2003,194(3):341-348.
[5]韓慶林,茍三懷,王琪.降鈣素基因相關肽(CGRP)調控成骨細胞功能研究進展[J].中國矯形外科雜志,2005,13(7):544-549.

