大豆蛋白酶解過程中聚集行為的研究
趙沙沙 孔祥珍 蘇 芮 華欲飛
(江南大學食品學院食品科學與技術國家重點實驗室,無錫 214122)
大豆以及大豆產品如豆漿、豆腐等具有豐富的營養價值。大豆中的蛋白質主要包括儲藏蛋白和生理活性蛋白,其中儲藏蛋白中約65%為大豆球蛋白(glycinin),35%為 β-伴球蛋白(β-conglycinin)[1],根據其沉降系數分別又稱作11S和7S。11S分子質量為340~375 ku,主要由酸性亞基(A1、A2、A3、A4、A5和 A6)和堿性亞基(B1、B2、B3、B4、B5和B6)通過二硫鍵連接形成(A4酸性亞基除外)。7S分子質量為180~210 ku,主要由α、α'和β 3種亞基組成[2]。
對大豆蛋白進行酶水解是一種提高其功能性質的有效方法。水解后可以提高大豆蛋白的溶解性、乳化性、起泡性[3]。但是另一方面,水解卻帶來了一個弊端,即在水解過程中會形成不溶性聚集體,使得大豆蛋白的水溶性降低,從而降低了得率。目前,大豆分離蛋白、大豆球蛋白酶解過程的聚集現象研究已較多,對于酶解過程中聚集機理研究也較為透徹[4-6]。但是,在酶解過程中大豆球蛋白以及β-伴球蛋白各自所起的作用以及β-伴球蛋白對大豆球蛋白酶解過程的聚集的影響卻鮮有報道。Kuipers等[7]對大豆蛋白的酶解聚集方面進行了研究,即制備不同水解度的酶解物,研究酶解物在不同pH下的溶解情況,以期獲得7S、11S酶解物對聚集的作用。
本研究在Kuipers等[7]的研究基礎上,從另一角度出發,主要通過監測酶解液的濁度變化研究不同大豆蛋白(7S、11S、SPI即大豆分離蛋白)在酶解過程中的聚集現象,通過與模擬濁度值比較更直觀地獲得7S/11S不同比例的蛋白在酶解過程中的聚集行為,并采用液相色譜法以及電泳技術探究酶解過程中7S和11S酶解物對聚集的貢獻,并以此初步探究酶解過程中7S酶解物對11S酶解物聚集的抑制機理。
1 材料與方法
1.1 材料
脫脂豆粕:山東萬德福有限公司;堿性蛋白酶(Alcalase):諾維信生物技術有限公司;苯甲基磺酰氟(PMSF):生工生物工程(上海)股份有限公司;乙腈,色譜純:國藥;其余試劑均為分析純。
1.2 儀器及設備
高效液相儀、LGJ-10高速冷凍離心機:日本日立公司;LGJ型冷凍干燥機:北京四環科學儀器廠;DYY-8C電泳儀:北京六一儀器廠;GX-2005循環水浴鍋:上海比朗儀器有限公司;868型pH計:上海熱電儀器公司。
1.3 試驗方法
1.3.1 大豆蛋白的制備
大豆蛋白的提取采用Nagano等[8]法并稍作改良。醇洗脫脂豆粕按1∶10的料液比加入去離子水,充分溶解后,用2 mol/L NaOH溶液調節至7.0,室溫下低速攪拌1 h,以10 000 r/min,4℃下離心30 min,棄去沉淀,上清液用2 mol/L HCl溶液調節至4.5,以10 000 r/min,4℃下離心30 min,棄去上清液,得到的蛋白質凝乳使用大體積去離子水洗3次除去殘留的鹽離子。得到的凝乳加入少量去離子水并用2 mol/L NaOH將溶液回調至7.0,經攪拌充分溶解后,溶液在10 000 r/min離心30 min以棄去少量不溶物質,上清液經冷凍干燥,干燥的大豆分離蛋白在4℃條件下保存。11S的提取過程與SPI的提取方法類似,具體步驟見圖1。
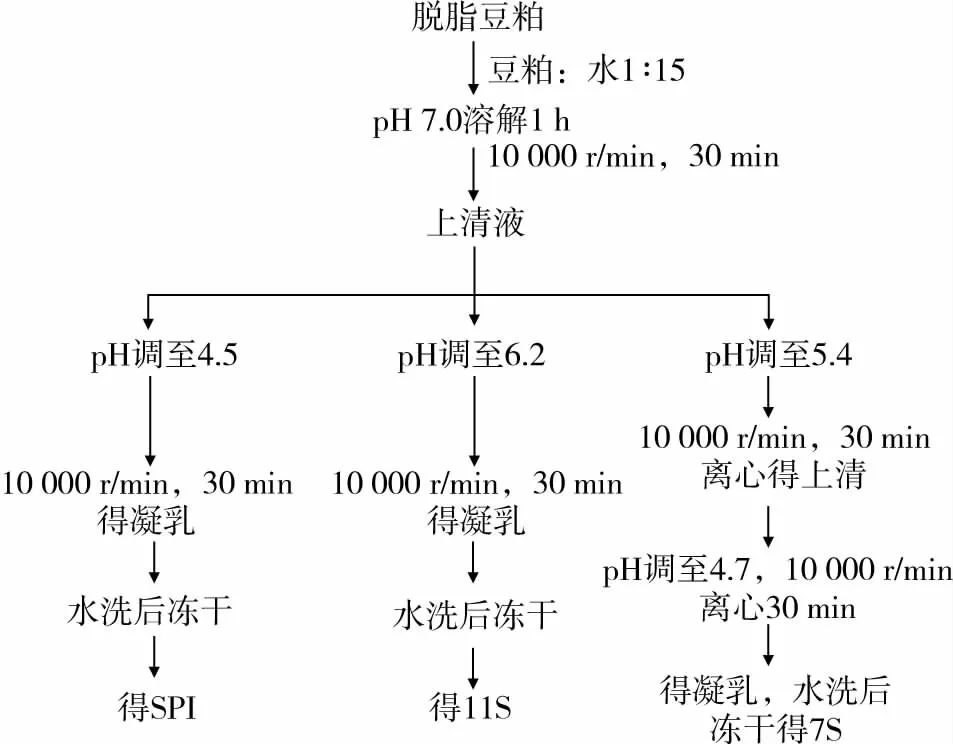
圖1 大豆蛋白(SPI、11S、7S)的提取工藝流程圖
1.3.2 Alcalase 水解大豆蛋白
大豆蛋白10%溶于pH 8.0的去離子水中,常溫下攪拌2 h,充分溶解后于19 000 r/min離心30 min以除去少量不溶性物質。離心后取上清液,凱氏定氮測定溶液中蛋白濃度,此溶液為母液,每次酶解前均需新鮮配制。將此溶液準確稀釋至蛋白濃度為2%,置于200 mL的酶解器中,于60℃預熱攪拌10 min,加入Alcalase進行酶解。其中,底物與酶的比例為100∶1。酶解至一定水解度后,加入酶抑制劑PMSF,使其終濃度為1 mmol/L,終止反應。取酶解液于19 000 r/min離心30 min,以獲得水溶性成分和水不溶性成分,其中水不溶性成分即為酶解過程中產生的聚集體。
1.3.3 水解度的測定
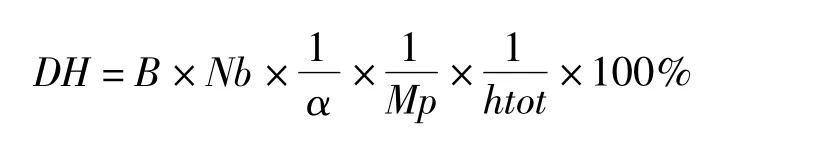
水解度的測定采用pH-stat法[9]。水解過程中逐漸滴加0.1 mol/L的NaOH以維持Alcalase的最適pH 8.0。其中水解度(DH)的計算公式為:式中:B為NaOH的體積/mL;Nb為NaOH的濃度,0.1 mol/L;1/α為α-氨基的平均解離度(60℃,pH 8.0條件下為1.08);Mp為溶液中蛋白質的質量/g;htot為底物中肽鍵的含量/meqv/g蛋白。
1.3.4 濁度的測定
酶解液的濁度變化采用分光光度計監控。用spectrumlab22PC分光光度計在室溫下操作,載樣的比色皿為厚度1 mm的玻璃比色皿。每隔一段時間取出一定量的酶解液于660 nm下測定溶液的吸光度。
1.3.5 聚集物干物質產率的測定
當水解結束后,加入PMSF終止反應。取出一定量溶液,準確稱其質量,記為m1,置于105℃烘箱中烘干,恒重后稱其質量為m2;另取一部分溶液,準確稱其質量為m3,并于19 000 r/min離心30 min,棄去上清,得沉淀于105℃烘箱恒重至m4。聚集物占總蛋白干基的比率計算公式為:
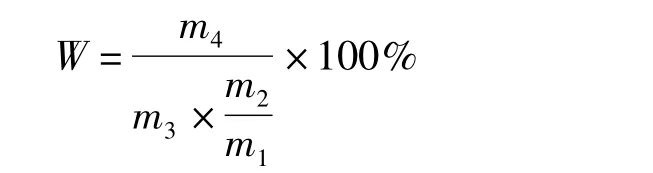
1.3.6 高效液相測定酶解液分子質量分布
采用高效液相色譜法(HPLC)測定酶解后水溶性成分和水不溶性聚集體的分子質量分布。上清液溶于純水中,水不溶性成分溶于8 mol/L鹽酸胍或30 mmol/L DTT中,樣品濃度均為10 mg/mL。色譜柱:TSKgel2 000SWXL 300 mm × 7.8 mm(Tosoh,Tokyo,Japan);流動相:乙腈/水/三氟乙酸,45/55/0.1;檢測波長:UV(220 nm);流速:0.5 mL/min;柱溫:30℃;分子質量校正曲線所用標準品:細胞色素C(MW 12 500 u),抑菌肽(MW 6 500 u),桿菌肽(MW 1 450 u),Gly-Gly-Arg-Tyr(MW 451 u),Gly-Gly-Gly(MW 189 u)。
1.3.7 SDS-聚丙烯酰胺凝膠電泳(SDS-PAGE)分析
SDS-PAGE凝膠電泳法參照Laemmli法[10]。分離膠和濃縮膠濃度分別為12.5%和4%,恒流電泳,電流先調至10 mA,待樣品進入濃縮膠后調至30 mA。樣品為不同水解度的上清液和水不溶性聚集體。
2 結果與討論
2.1 不同大豆蛋白Alcalase酶解液聚集的觀察
溶液在可見光范圍內的吸光度可以作為樣品溶液中顆粒大小和濃度的測定指標[11],因此,測定大豆蛋白溶液酶解過程中的吸光度,可以動態地跟蹤水解過程蛋白質及聚集物的濃度和大小的變化趨勢。11S、SPI以及7S使用Alcalase進行酶解,底物濃度均為2%,底物與酶的比例為100∶1。由圖2可以看出,在相同蛋白濃度下使用Alcalase進行酶解時,11S的濁度增加要比7S、SPI劇烈,11S酶解液的濁度在較短時間內(18 min)就達到了最大值,達到最大值之后濁度緩慢減小。濁度的變化說明酶解過程可以分為2個階段:第1階段為濁度上升的階段,在這一階段小分子肽段的聚集要快于酶對蛋白和聚集體的降解,可以認為酶對蛋白的降解是這一階段的限速反應;第2階段為濁度下降的階段,在這一階段酶對蛋白和聚集體的降解快于肽的聚集,從而導致了濁度的下降。
與11S相比,SPI的聚集程度明顯降低,而且聚集開始的時間(第55 min)也比11S延遲很多,從濁度開始上升到最大值出現所用的時間也較11S長。而7S的濁度自始至終(2 h內)都沒有明顯變化,這說明在2 h的酶解過程中,7S酶解物并沒有出現聚集現象。比較三者可以得出,在蛋白濃度相同時,11S的Alcalase酶解物更易發生聚集,而且聚集物的產量也較大,但聚集產物并不穩定,易于降解,SPI酶解過程中出現了輕微的聚集現象,而7S酶解物基本不會發生聚集。
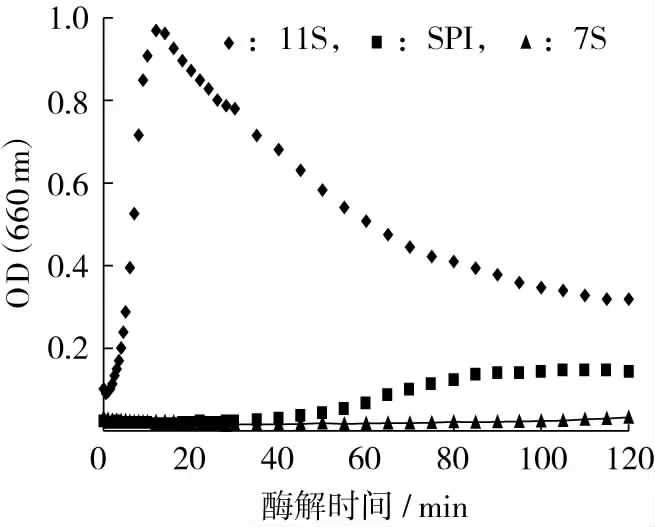
圖2 不同蛋白Alcalase酶解時濁度變化曲線
2.2 不同11S/7S比例對聚集的影響
基于圖2中11S與7S酶解液濁度隨酶解時間的變化結果,模擬11S/7S不同比例的蛋白混合物的濁度隨酶解時間的變化情況(圖3)。所模擬的11S/7S的比例分別為 50∶1、25∶1、10∶1、5∶1 以及 1.76∶1。其中當11S/7S為1.76:1時與SPI中11S/7S比例相當。由圖3可以看出,隨著7S比例的增大,相同時刻的濁度值逐漸減小。
同時,對不同比例的11S/7S蛋白,采用Alcalase進行酶解,并對酶解物的濁度隨酶解時間的變化進行了試驗測定,結果如圖4所示。試驗通過固定11S的濃度和酶解溶液的體積,添加不同量的7S來完成。由于添加不同量的7S,導致總蛋白濃度發生了變化,但是7S的濃度始終未達到2%。由圖2可以看出,當7S濃度為2%時,酶解時間在2 h之內均未出現聚集現象。由此可以忽略總蛋白濃度的變化對聚集的影響。隨著蛋白混合物中7S比例的增大,相同酶解時刻的濁度呈現逐漸減小的趨勢,并且濁度最大值出現的時間點隨7S/11S比例的增大而增大。假定7S與11S混合后,其酶解互不影響,那么酶解物濁度值隨酶解時間的變化應該如圖3所示。但結合圖4的結果分析比較可知,不同比例7S和11S混合后酶解,酶解液實際的濁度測定結果要小于理論模擬值,并且濁度最大值出現的時間較模擬值推遲。這說明7S和11S混合酶解后,濁度的變化不單單是由于二者比例的變化從而造成濁度的下降,最主要的原因是由于添加7S與11S混合酶解,對酶解物的聚集產生了抑制。

圖3 11S/7S不同比例下濁度模擬圖
大豆分離蛋白中含有較高含量(約65%)的11S蛋白,在其酶解時發生的聚集程度較大,更容易發生聚集。若大豆蛋白中7S蛋白含量增大,整體蛋白的聚集現象減弱。在11S濃度不變的情況下,通過添加不同量的7S對11S酶解過程中肽的聚集有影響,即7S酶解物對11S酶解物聚集有一定的抑制作用,而且隨著7S添加量的增大,其抑制作用更為明顯。
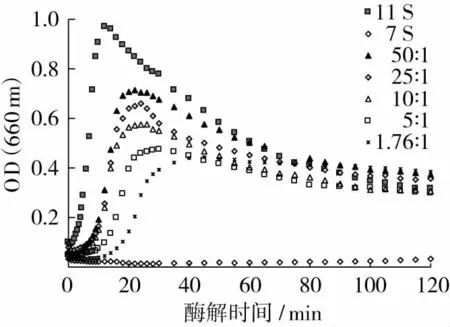
圖4 不同比例11S/7S酶解過程中濁度變化曲線
定義濁度最大值時的吸光度為OD1,吸光值穩定時的濁度為OD2。則ΔOD=OD1-OD2,ΔOD可以作為聚集物產量的一個指標。由表1可以看出,隨著11S/7S比例的逐漸減小,OD1與OD2之間的差距即ΔOD逐漸縮小,這說明在酶解過程中的聚集體的產量隨7S添加量的增加而減小。而且,隨著11S/7S比例的減小,OD2呈現先減小后增大的趨勢,這說明7S對11S酶解物的聚集有一定的抑制作用,并且對聚集物的穩定性有一定的作用。11S/7S為1.76的濁度曲線與SPI的濁度曲線對比可以發現,相同時刻混合樣品(11S/7S=1.76)的濁度值要大于SPI的濁度值。
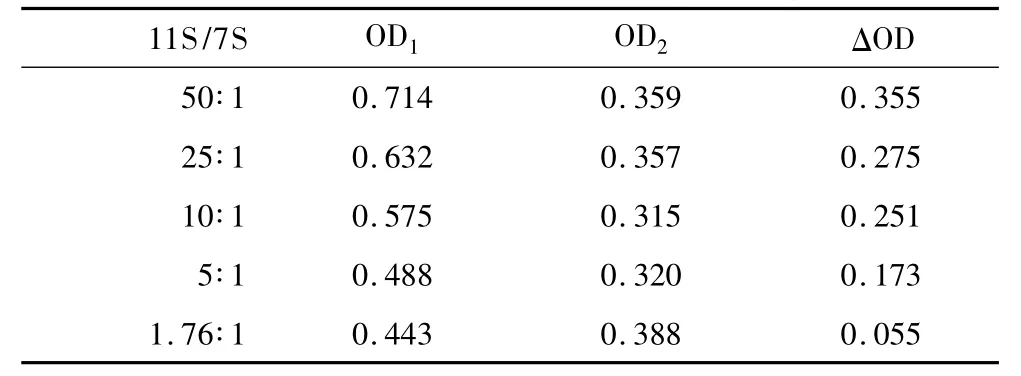
表1 不同11S/7S比例的OD值(660 nm)
2.3 聚集物產量的表征
對DH=5時不同比例的11S/7S酶解后不溶性聚集物的產量進行了測量。聚集物占總蛋白的比例見圖5。由圖5可以看出隨著11S/7S比例的減小,聚集物占總蛋白的比例也逐漸減小,這說明7S酶解產物對11S酶解產物的聚集有抑制作用,這與濁度檢測的結果是一致的。
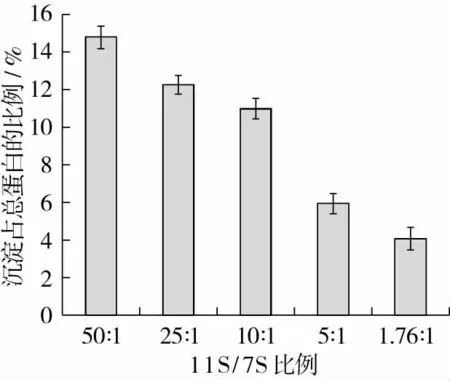
圖5 不同比例11S/7S在DH=5聚集物產量占總蛋白的比(干基)
2.4 不同比例11S/7S水解產物的HP-SEC圖譜分析
采用HP-SEC對不同比例的11S/7S在DH=5時制備的酶解物上清液和不溶性聚集體的分子質量進行表征,結果如表2~表4所示。其中上清液使用超純水溶解,樣品可以完全溶解。水不溶性聚集體使用8 mol/L鹽酸胍溶液可以完全溶解,使用30 mmol/LDTT不能完全溶解。由表2和表3對比可以看出,上清液中分子質量分布主要集中于大于10 000 u以及5 000 u以下部分,而沉淀中組分的分子質量主要集中于5 000 u以下。這說明上清液中既有大分子質量的組分,也有小分子質量的成分。而沉淀主要是一些小分子質量的組分,這說明在酶解過程中形成聚集體主要是一些分子質量較小的肽段。這與于鴻鵬等[12]的結論相符。沉淀中可以溶于30 mmol/L DTT溶液中的成分的分子質量主要分布于5 000 u以下,約占90%。這說明DTT處理沉淀可以得到一些小分子質量且可溶于水的親水性肽段。這些小肽以二硫鍵連接的形式結合在聚集體上。
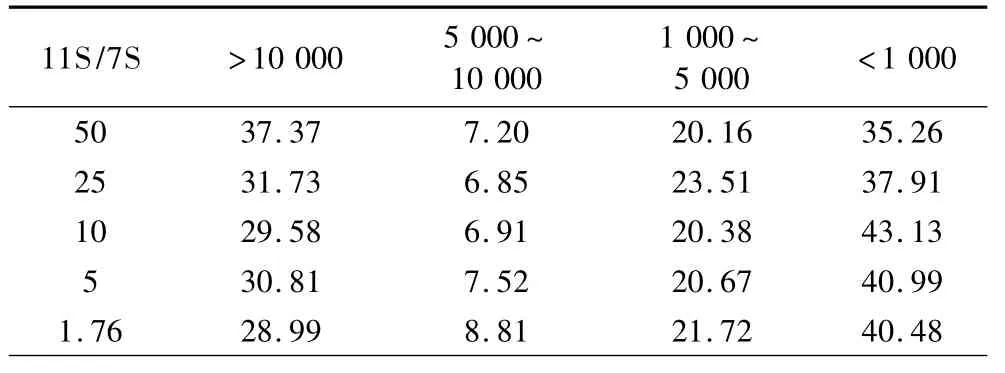
表2 不同比例11S/7S上清液分子質量分布/%
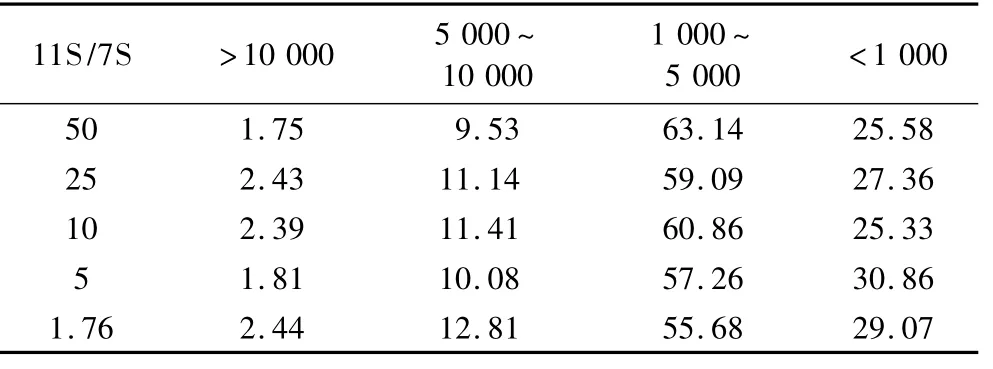
表3 不同比例11S/7S酶解不溶性聚集物分子質量分布/%
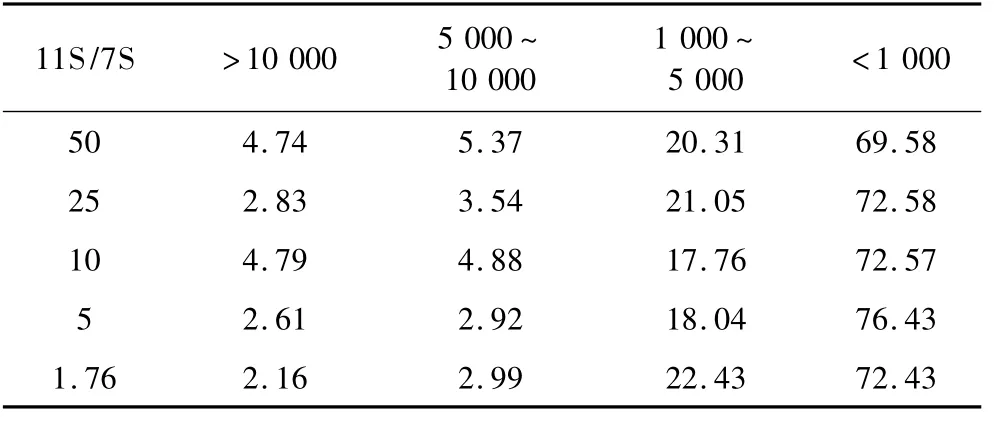
表4 DTT處理不同比例11S/7S不溶性聚集物分子質量分布/%
2.5 SDS-PAGE分析
不同比例的11S/7S酶解后進行離心,得到的上清液進行SDS-PAGE。圖6a中的條帶1是AB肽鏈聚合體,條帶2可能是酶解過程中產生的可溶性聚合體,條帶3為A5B3聚合體。區域1是在酶解過程中形成的一些小分子質量肽段,與還原后的SDSPAGE(圖6b)相比,區域1基本消失,說明這些肽段含有二硫鍵,還原后形成了一些分子質量更小的片段。由圖6b可以看出,7S的α'與α亞基已被完全降解,而β亞基仍有殘留,這說明β亞基不易被Alcalase降解。11S的A肽鏈有少許殘留,B肽鏈仍有較多的殘留。
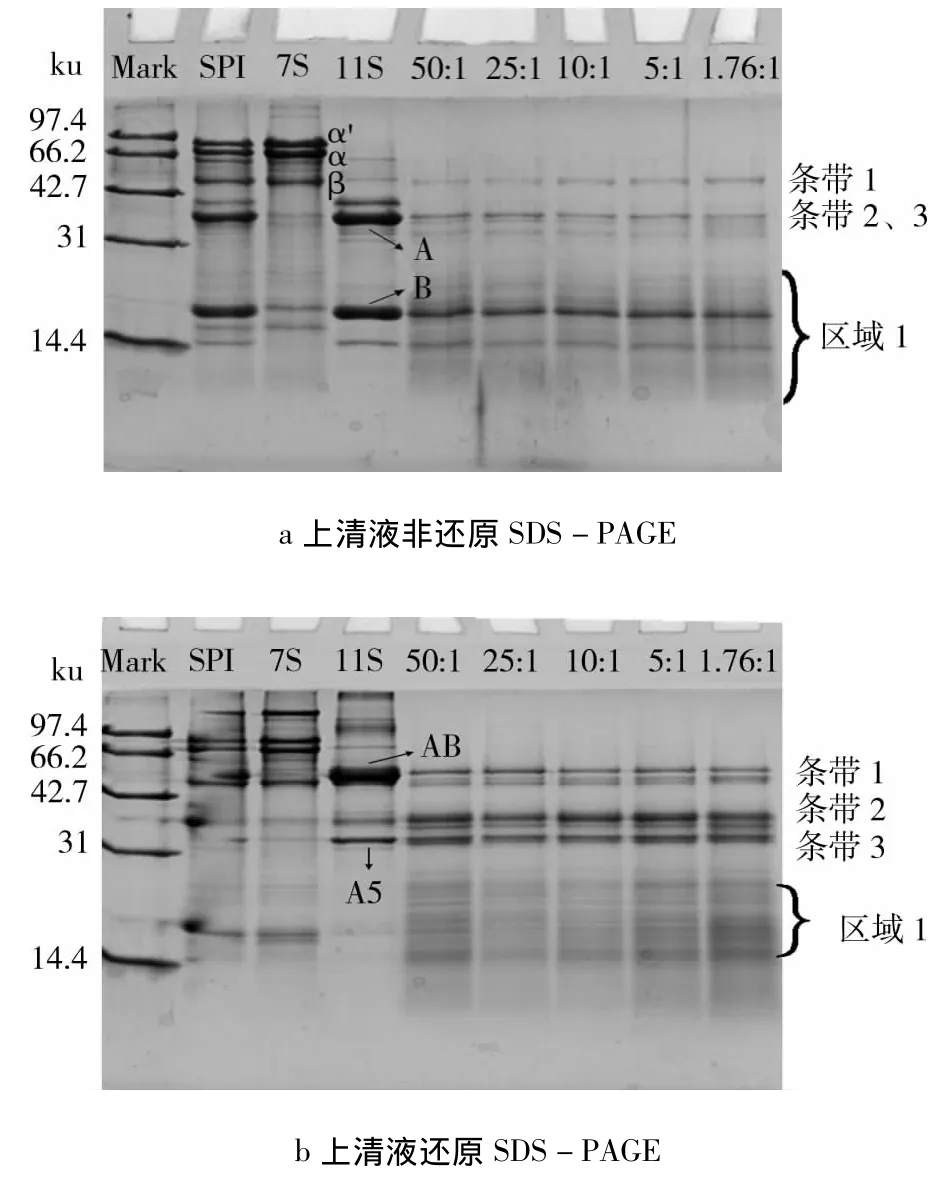
圖6 上清液SDS-PAGE圖
3 結論
本研究表明,大豆中的7S、11S、SPI蛋白在使用Alcalase進行酶解時,產生的聚集現象不同。其中11S酶解物最易發生聚集,而SPI酶解物稍有聚集現象,但不明顯,而7S在酶解時基本不會有聚集現象發生。在改變7S與11S的比例進行酶解時發現,固定11S的濃度不變,隨著7S添加量的增大11S酶解物聚集現象有所減小,這說明7S酶解物對11S酶解物的聚集有抑制作用,而抑制的機理還需進一步探究。
[1]Liu C,Wang X S,Ma H,et al.Functional properties of protein isolates from soybeans stored under various conditions [J].Food Chemistry,2008,111(1):29 -37
[2]Remkema J M S,Knabben J H M,Vliet T V.GEL formation by β - conglycinin and glycinin and their mixtures[J].Food Hydrocolloids,2001,15(4 -6):407 -415
[3]Panyam D,Kilar A.Enhancing the functionality of food proteins by enzymatic modification [J].Trends in Food Science& Tchnology,1996,7(4):120 -125
[4]Nagai K,Inouye K.Insights into the reaction mechanism of the coagulation of soy protein isolates induced by subtilisin carlsberg[J].Journal of Agricultural and Food Chemistry,2004,52:4921 -4927
[5]Inouye K,Nagai K,Takita T.Coagulation of soy protein isolates induced by subtilisin carlsberg[J].Journal of Agricultural and Food Chemistry,2002,50:1237 -1242
[6]Kuipers Bas J H,Harry G.Identification of strong aggregating regions in soy glycinin upon enzymatic hydrolysis[J].Journal of Agricultural and Food Chemistry,2008,56:3818 -3827
[7]Kuipers Bas J H,Gerrit A,Arno C,et al.Opposite contributions of glycinin and β-conglycinin derived peptides to the aggregation behavior of soy protein isolate hydrolysates[J].Food Biophysics,2006(1):178 -188
[8]Nagano T,Motoyoshiya J,Kakehi A,et al.Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J].Journal of Agricultual and Food Chemistry,1992,40(6):941-944
[9]Adler- Nissen J.Enzymic hydrolysis of food proteins[M].London:Elsevier Applied Science Publishers,1986,122 -123
[10]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage[J].Nature,1970,227:680-685
[11]Berne B J.Interpretation of the light scattering from long rods[J].Journal of Molecular Biology,1974,89:755 - 758
[12]于鴻鵬,唐傳核,曾慶孝,等.大豆分離蛋白水解多肽聚集物的組成及相互作用[J].華南理工大學學報,2006,34(8):105-109.

