復合反膠束后萃花生蛋白提取條件優化
郭 珍 陳復生 李潤潔
(河南工業大學,鄭州 450001)
花生是我國主要的油料資源,同時富含24%~36%的蛋白質。花生蛋白含有多種必需氨基酸,不含膽固醇[1]。與大豆蛋白相比,抗營養因子較少,可消化性強。目前我國利用花生制油過程造成了花生蛋白的損失與變性,因此,探尋一種新型制備花生蛋白技術有著重要的意義。
反膠束萃取技術是一種新型的可用于提取具有生物活性物質的技術[2]。已有研究顯示,反膠束萃取技術可以實現大豆中蛋白質和油脂同時分離,并減少蛋白質的變性,且大多數采用的都是AOT單一反膠束體系,而研究發現,把不同類型表面活性劑混合起來制備可以形成具有良好性質的混合反膠束體系,增加增溶水量[3-4],因此本試驗將陰離子表面活性劑AOT與SDS混合配制復合反膠束進行研究。
本試驗采用AOT-SDS/異辛烷-正辛醇復合反膠束對花生蛋白進行提取,考察pH、時間、KCl、溫度對后萃率的影響,采用二次通用旋轉組合設計,以后萃率為指標獲取較佳工藝條件,為反膠束在花生蛋白提取過程中的應用獲得數據指導。
1 材料與儀器
1.1 試驗原料
全脂花生粉:河南帝鑫食品有限公司。
1.2 主要試劑
丁二酸二異辛酯磺酸鈉(AOT):上海海曲化工廠;十二烷基硫酸鈉(SDS):天津市科密歐化學試劑有限公司;異辛烷、正辛醇,磷酸二氫鉀、磷酸氫二鉀,氯化鉀均為分析純。
1.3 試驗儀器
BS210S型電子天平:德國Sartorius公司;GL–20L型高速冷凍離心機、ZSD–2J型自動水分滴定儀:上海安亭電子儀器廠;pH 211型酸度計:意大利HANNA公司;Nichipet EXII型移液槍:日本Nichiryo公司;UV-1901型紫外分光光度計:北京普析通用儀器有限責任公司;KQ-250B型超聲波清洗器:昆山市超聲儀器有限公司。
2 試驗方法
2.1 蛋白質標準曲線制作[5]
以牛血清蛋白為標準,紫外分光光度計測定不同濃度標準蛋白液在280 nm處吸光值,以蛋白質濃度為橫坐標,對應吸光值為縱坐標繪制標準曲線,見圖1。
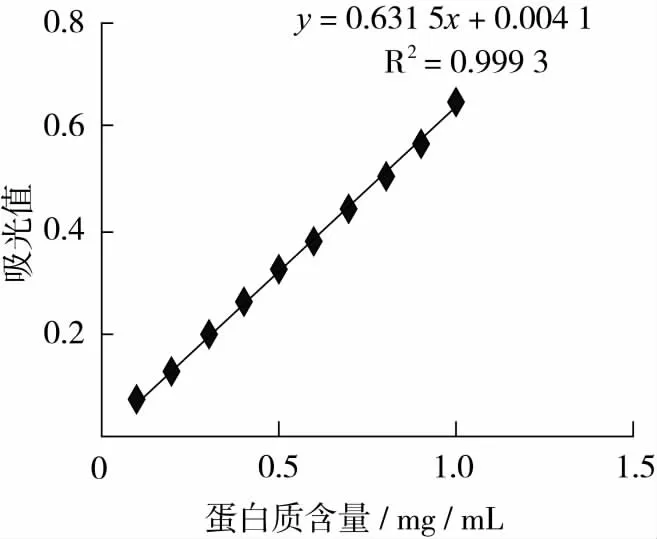
圖1 280 nm處牛血清白蛋白濃度與吸光值的關系
2.2 AOT/SDS 反膠束溶液配制[6]
稱取1.6 g AOT與1.2 g SDS表面活性劑置于100 mL錐形緩沖溶液瓶中,同時加入32 mL異辛烷,3 mL正辛醇和適量pH為8的KH2PO4-K2HPO4緩沖溶液,磁力攪拌使之混合均勻,再超聲處理一定時間至溶液透明。
2.3 蛋白質前萃液的配制
按0.01 g/mL將全脂花生粉加入配制好的反膠束溶液中,在35℃條件下超聲15 min,超聲功率為210 W,然后以3 000 r/min的速度離心15 min,取上清液(即前萃液),采用紫外分光光度法在280 nm處測其吸光值。
2.4 蛋白質后萃液的配制及后萃率的計算
取一定體積的前萃液與等體積的一定濃度一定pH的KCl的KH2PO4-K2HPO4緩沖液混合,超聲處理一定時間后在4 000 r/min條件下離心15 min,取下層水相(后萃液)在280nm處測其吸光值。
蛋白質后萃率=后萃液中蛋白質量(g)/前萃液中蛋白質量(g)×100%
2.5 二次通用旋轉試驗設計
選取pH、時間、KCl、溫度4個因素進行優化試驗。主要以蛋白質后萃率作為評價指標,采用二次通用旋轉組合設計的方法優化花生蛋白的提取工藝參數,結合DPS v7.05軟件進行分析,試驗因素、水平及編碼見表1。
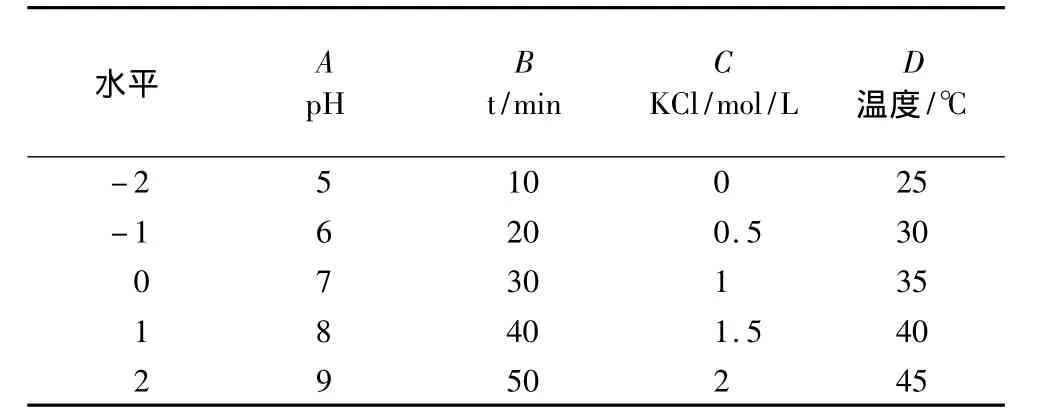
表1 二次通用旋轉組合設計因素水平編碼表
3 結果與討論
3.1 四因素二次通用旋轉設計的試驗結果
采用四因素二次通用旋轉設計試驗,研究pH、溫度、時間、KCl濃度對后萃率的影響。試驗結果如表2。

表2 二次通用旋轉組合試驗方案設計試驗結果

表2(續)
3.2 模型的建立及其顯著性檢驗
利用DPS軟件對表2試驗數據進行回歸方差分析,分析結果見表3,得到的二次回歸模型為:Y=73.039 49+10.472 14A+0.791 24B+6.589 34C+0.716 203D -1.693 95A2-0.666 15B2-3.064 35C2-0.568 26D2-0.893 21AB -8.171 01AC -0.193 32AD -2.410 43BC -2.655 15BD+1.617 56CD,在 α =0.10顯著水平剔除不顯著項后,簡化后的回歸方程:Y=73.039 49+10.472 14A+6.589 34C -3.064 35C2-8.171 01AC。
由表3可知,回歸方程失擬檢驗 F1=1.323<F0.05(10,6)=4.06,說明未控制因素對試驗影響很小,可進一步對回歸模型進行擬合檢驗;擬合檢驗F2=4.984 > F0.05(14,16)=2.35,說明回歸模型達到顯著水平,方程與實際情況擬合良好,能夠較好的反映pH、時間、KCl濃度、溫度與后萃率的關系。單因素中,pH(A)以及KCl濃度(C)對萃取率的影響極顯著,交互項AC(溫度和KCl濃度)達到了極顯著水平。由殘差分析圖2也可以看出,實際觀測值與回歸擬合值之差落在-3~3范圍內,說明回歸模型良好。
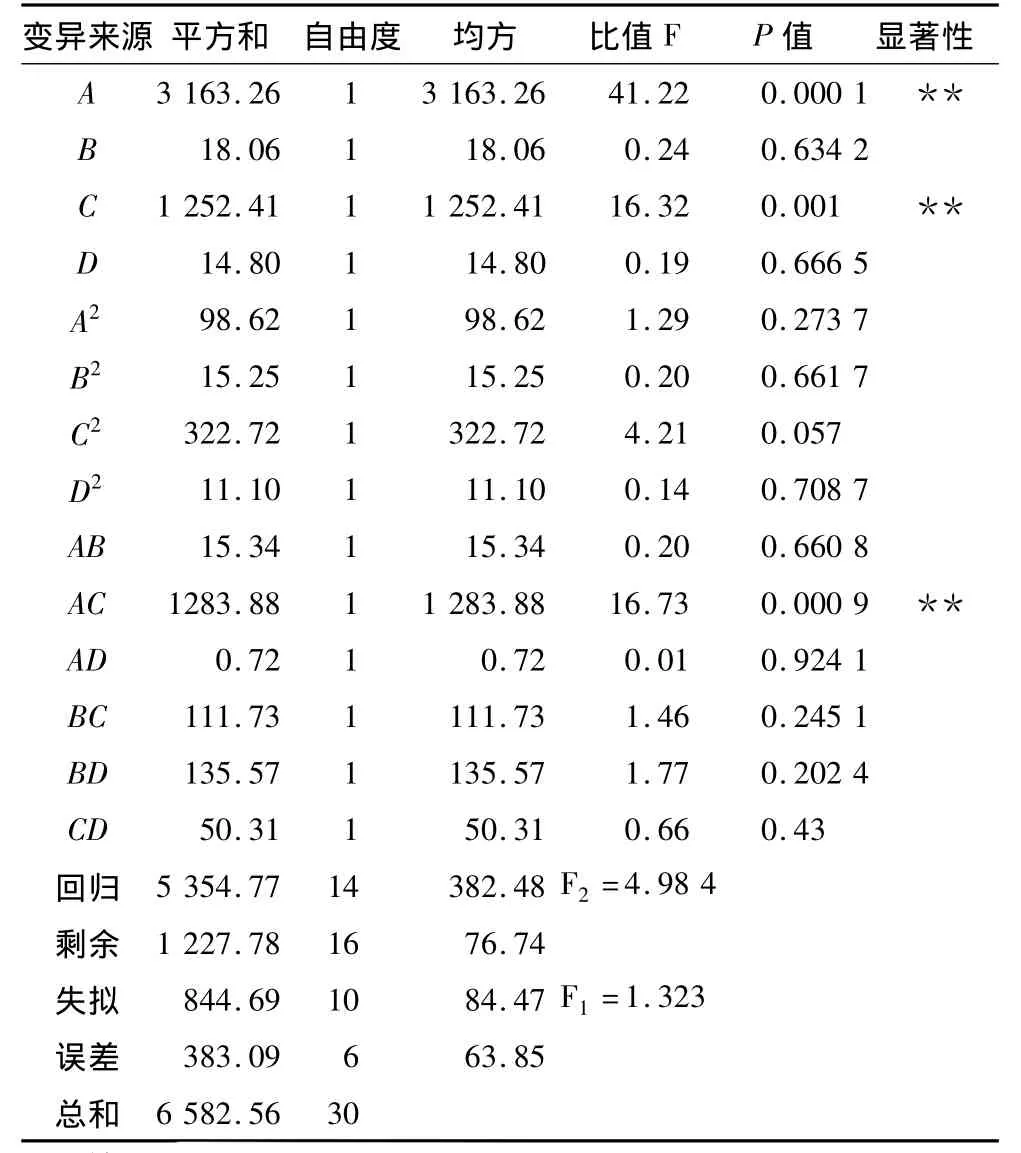
表3 試驗結果方差分析表

圖2 殘差分析圖
3.3 主因子效應分析
從所建立的回歸方程的偏回歸系數絕對值的大小可判明因子的重要程度,系數的正負表示因子效應作用的方向[7]。因此,各因素在試驗取值范圍內對蛋白質后萃率作用大小依次為:pH(A)>KCl濃度(C)>溫度(B)>時間(D),對試驗結果的影響都是正效應。
3.4 單因素效應分析
將4個因素中3個因素固定在零水平,對數學模型進行分析,得到以另一個因素為決策變量的偏回歸模型,分析結果見表4及圖2。
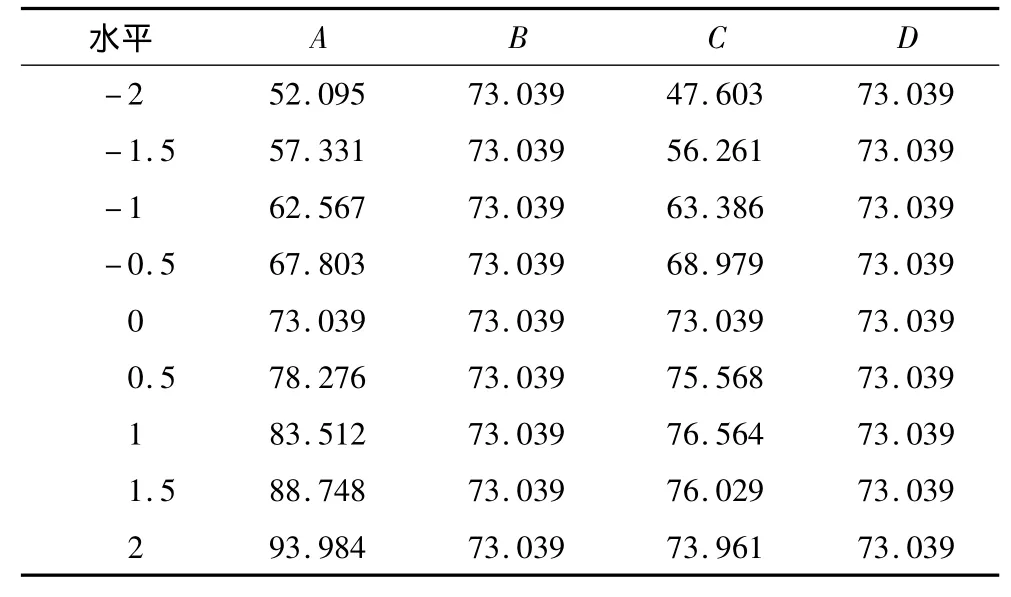
表4 單因素效應分析

圖3 單因素與后萃率的關系
由表4及圖3可以看出,隨著時間(B)以及溫度(D)的升高,蛋白質的后萃率幾乎沒有變化,即時間與溫度對試驗結果影響不顯著,而pH(A)以及KCl濃度(C)的變化會引起后萃率顯著的變化。
在pH為5~9范圍內(試驗水平為-2~2),隨著pH的升高,后萃率逐漸上升。后萃過程相當于水萃取過程,與蛋白質在水中的溶解度有關。AOT與SDS都是陰離子表面活性劑,極性頭朝內使反膠束內層帶負電荷,隨著pH逐漸升高,蛋白質分子帶負電荷的密度逐漸增加,與反膠束之間的靜電斥力逐漸增大,使溶進“水池”中的蛋白質逐漸反向萃取到水相中,后萃率逐漸增大。
在離子濃度為0~2 mol/L范圍內(試驗水平為-2~2),隨著離子濃度的升高,后萃率先升高后降低。當離子濃度升高時,反膠束內表面的雙電子層變薄,一方面減弱了表面活性劑極性頭之間的排斥作用,使反膠束尺寸變小,迫使蛋白質溶出,另一方面又使靜電引力減小,蛋白質在“水池”中的溶解度下降,但當離子濃度過高,會導致蛋白質發生鹽析作用,有可能引起蛋白質的變性從而與表面活性劑發生聚集,使得后萃率降低。離子濃度過高也給后續蛋白質的精制帶來困難[8]。
3.5 試驗因子間交互效應分析
根據表3中對數學模型的方差分析可知,交互項偏回歸系數AC項達到了極顯著的水平,其余均未達到顯著水平,因此只對溫度和KCl濃度之間的交互作用進行討論。對其作圖見圖4。
由圖4可以看出,當pH處于較低水平時,隨著KCl濃度的升高后萃率逐漸升高,當pH處于零水平時,隨著KCl濃度的升高后萃率先升高后降低,當pH處于較高水平時,隨著KCl濃度的升高后萃率逐漸下降,pH與KCl濃度同時取較高或同時取較低都會產生一個較低的后萃率。

圖4 KCl濃度與pH對后萃率影響的響應面圖
3.6 工藝優化及驗證
由于試驗過程中,不僅單因素對試驗結果有影響,而且還存在著交互作用,因此很難找出最優條件,同時由于四元二次方程不存在極值問題,因此也無法從回歸模型中得到最佳配比。考慮到不同因素對花生蛋白的影響作用,采用頻率分析的方法對回歸模型進行分析,后萃率大于68.40%的375個方案中,各變量取值的頻率分布見表5。

表5 各變量取值的頻率分布表
由表5可知,在95%的置信區間優化方案為:pH為 7.263 ~7.537,時間為 28.57 ~31.43 min,KCl濃度1.101 ~1.232 5 mol/L,溫度34.285 ~35.715 ℃。考慮到實際可操作性,將方案調整為:pH 7.5,時間30 min,KCl濃度 1.1 mol/L,溫度35 ℃。對此方案進行試驗驗證,平行試驗3次,得到后萃率平均值為79.03%,與優化試驗的理論值78.65%比較接近。
4 結論
4.1 采用AOT-SDS/異辛烷-正辛醇復合反膠束體系實現了對花生蛋白的后萃,采用二次通用旋轉組合設計實現了工藝的優化,得到二次回歸模型:Y=73.039 49+10.472 14A+6.589 34C -3.064 35C2-8.171 01AC。對回歸模型分析可知,pH和KCl以及二者的交互作用對結果影響顯著,時間以及溫度影響不顯著。
4.2 通過頻率分析以及統計尋優得到在95%置信區間后萃率大于67.5%的優化方案為pH為7.263~7.537,時間 28.57 ~ 31.43 min,KCl濃度 1.101 ~1.233 mol/L,溫度34.285 ~35.715 ℃。為貼近實際操作將方案調整為 pH 7.5,時間 30 min,KCl濃度1.1 mol/L,溫度35 ℃,后萃率達79.03%,與理論值78.65%比較接近。
[1]劉傳富,張兆靜.花生蛋白及其在食品中的應用[J].中國食物與營養,2005(1):24-25
[2]Dong Wei Li,Zu De Qi,Xin Liang Ding,et al.Photophysics of three delocalized lipophilic cations in reverse micelles:A fluorescence spectroscopy study[J].Journal of Luminescence,2013,134:830 -836
[3]Bidyut K P,Rajib K M.Water solubilization capacity of mixed reverse micelles:effect of surfactant component,the nature of the oil and electrolyte concentration[J].Journal of Colloid and Interface Science,2005,288(1):261 -279
[4]Mitra R K,Paul B K.Investigation on percolation in conductance of mixed reverse micelles[J].Journal of Colloids and Surfaces,2005,252(2 -3):243 -259
[5]劉海遠,布冠好,陳復生,等.超聲波輔助CTAB反膠束萃取大豆蛋白的研究[J]農業機械,2011(14):68-71
[6]郭珍,陳復生,方志鋒.復合反膠束萃取花生蛋白的工藝優化[J].食品與機械,2013,29(2):1 -7
[7]唐啟義,馮明光.實用統計分析及其數據處理系統[M].北京:科學出版社,2002:159-163
[8]任海偉,陳曉沛,邢超紅,等.反膠束法提取紅蕓豆蛋白后萃工藝的優化[J].農業機械,2012(30):65-68.

