心律失常的轉子機制及其臨床意義
林玉壁 張樹龍 Karl-Heinz Kuck
·綜述·
心律失常的轉子機制及其臨床意義
林玉壁 張樹龍 Karl-Heinz Kuck
轉子是心律失常的重要機制之一,其形成機制與渦流脫落和離子通道機制相關。觸發灶和心臟結構異常促進轉子的形成和維持。相位、主頻、信息熵和CONFIRM標測有望用于標測轉子部位,指導臨床治療。
轉子;螺旋波;心律失常;離子通道;主頻標測;相位標測;射頻導管消融
在心臟電生理領域,轉子(rotor)或螺旋波(spiral wave)已經是一個眾所周知的名詞。在動物模型或人類心臟中,轉子作為一種功能性折返的規律性起源在心動過速和心臟顫動中發揮重要作用。雖然心房和心室的形狀、結構和離子通道特性不同,但兩者轉子或螺旋波的動力學特點相似。本文就轉子理論發展史,轉子的概念、發生和維持機制,標測方法和臨床應用等進行總結,以期指導臨床應用。
1 轉子折返理論發展史
在19、20世紀之交,人們對心臟顫動及其機制進行了大量的研究。1906年,Mayer等發現心肌存在“循環激動”;Mines和Garrey等分別于1913年和1914年在犬心室肌中也發現了“解剖折返”;1921年,Lewis等假設心房顫動和心房撲動起源于這種“循環折返”,兩者的不同取決于“裂隙或波前侵入波尾的特性”——前者有較長的可激動間隙,后者具有較小的部分可激動間隙。20世紀40年代,Wiener和Rosenblueth等深化了上述理論,認為“圍繞心肌障礙的折返”使顫動得以維持;20世紀60年代,Moe等認為多個隨機折返而不是單個折返維持房顫,即“多子波折返”假說;20世紀70年代,Allessie等不僅第一次在犬心房中證實了這個假說,還提出了圍繞心房功能障礙區旋轉的“主導環”假說;同時前蘇聯的Krinsky和美國的Winfree提出了轉子和螺旋波的概念。20世紀90年代,Davidenko等首次在羊心室肌中應用電壓敏感性染料,高分辨率地標測心臟電激動,證實了螺旋波的存在。隨后20余年間,隨著先進分析工具和算法的應用,人們對轉子、螺旋波及其機制的研究更為深入,也提出了一些有關轉子及其在心臟顫動中作用的新概念,但其確切機制(如小數量驅動,或轉子與多子波折返)仍有爭議。下一個10年,仍需對顫動相關轉子、螺旋波及其機制進行深入探討,以明確其在臨床治療中的意義[1]。
2 轉子的概念
傳統看法認為,波傳導類似于環狀傳導(圖1A),波峰和不應期之間存在可激動間隙。傳導波的空間長度取決于傳導速度和心肌的不應期。后來,人們用“主導環”假說描述功能性折返(圖1B)。主導環的波峰和波尾之間沒有完整的可激動間隙和解剖障礙。主導環的內部組織可以不斷接受環的向心性激動,導致內部組織持續處于不應期狀態。轉子與功能性折返類似,卻有明顯不同:彎曲的波峰和波尾僅有單一連接(圖1C,見星號標注),中心組織并不處于不應期。在某些情況下,轉子和螺旋波的概念可以互換使用。心律失常過程中,轉子往往是指驅動或顫動的規律性起源,而螺旋波是指在二維空間自旋轉子在周圍組織形成的彎曲“渦流”。在三維空間,螺旋波也可稱為“回卷波”,旋轉中心是一種空心絲,由螺旋尖端的旋轉軌跡形成(圖1D)。圖1E是從一個平面看圖1D。轉子引起的螺旋波存在彎曲的激動波峰和波尾以及兩者的連接交點。其中,波峰代表去極化細胞區域,激動呈前向傳導;波尾區域代表已經完全興奮(動作電位上升支)和正在恢復靜息電位(動作電位復極)的細胞群。1998年,Gray等[2]通過相位分析研究心臟顫動,發現轉子是一種奇異點或相位奇異點(phase singularity,PS),如圖1E星號所示;且可以用于分析螺旋波及其尖端的時空動力學軌跡。當轉子穩定時,其在環形軌跡周圍以PS為支點,形成螺旋波中心。當轉子蛇曲時,其軌跡形態呈多樣化,取決于組織的興奮性。螺旋波的空心絲呈線柱狀,也可以彎曲成不同的非線性形態,如L形、U形和O形等。然而,如果回卷波進行蛇曲,PS雖不能形成線柱狀,卻可沿著一定的軌跡移動,軌跡的復雜性取決于蛇曲的程度。此時,空心絲也可以呈線性。
轉子和主導環的概念之間有3個主要的不同點。第一,主導環理論并不認為旋轉波、峰彎曲度是控制激動傳導速度和折返動力學的一個因素。轉子理論則認為在二維或三維心肌之間,波峰傳導速度依賴于彎曲度,凹形波峰傳導速度快于平形波峰,后者傳導速度快于凸形波峰。旋轉波包括波峰,且彎曲度向螺旋中心遞增。接近PS、尖端或中心時,凸面彎曲度達到臨界值,激動侵入中心的可能性不大。由此產生第二個不同點:主導環理論假設環的中心完全處于不應期,而不應期的形成是由于向心激動的不斷侵入,形成了圍繞著功能性不可興奮區的環狀激動,與Mines等描述的沿著解剖障礙循環移動折返不同。無論是功能性還是解剖性,主導環中心的障礙使折返環蛇曲或漂移的可能性不大。相反,轉子以可興奮組織為支點進行蛇曲折返。因此,轉子的旋轉并不依賴于PS中心,而是中心顯著陡峭的波峰彎曲度導致傳導速度下降到臨界速度,使波峰無法侵入中心。第三,與主導環不同,轉子產生的螺旋波并沒有固定波長。事實上,波峰與波尾寬度差異較大,在PS之間形成一個功能性距離(圖1E)。這是由于PS中心和其他附近細胞之間形成了電緊張梯度,明顯縮短了中心附近細胞的動作電位。這一點很重要,螺旋波的特點提示波長是多變的,需謹慎應用。通過研究藥物對轉子旋轉頻率、蛇曲程度和波碎裂數目(顫動傳導時發生,且碎裂傳導至周圍組織)的改變,能更準確地量化藥物對轉子折返的影響。
折返的另一個重要概念是可激動間隙。分析轉子和螺旋波時應考慮這一變量(圖1F)。二維薄片(2D sheet)整合了人類心房肌細胞數字離子模型,并顯示轉子激動快照。薄片中的每個細胞模擬持續性房顫細胞動作電位的表型。圖1F中,上圖為薄片中膜電壓分布快照,幫助理解來源于去極化細胞的電流(紅色/橙色)如何侵入其前的靜息細胞/組織(黑藍色);下圖顯示“hj”產生,hj代表Na+通道電流的快(h)、慢(j)失活變量,即INa,是產生螺旋波的主要離子電流,值為0.0~1.0。當hj為0.0時,無INa,組織是不可激動的(圖1F下圖的白色區域);當值為1.0時,組織是完全可激動或可興奮的;當值為0.0~1.0時,可興奮組織或間隙(gap),此時INa也是可興奮的,給予一個刺激可引起一個心肌反應。因此,在2D薄片螺旋波中,可激動間隙決定了螺旋波的形態(圖1F)。
3 轉子形成機制
3.1 渦流脫落啟動轉子和螺旋波
轉子可以通過多種方法啟動,包括標準橫場刺激方案。在心肌組織薄片中給予1個線性刺激,隨后在組織僅有部分恢復時給予第2個垂直刺激;如果第2個刺激發生在適當的時間且落入第1個刺激波峰的不應期尾端,就會引起波碎裂,導致轉子發生。同樣,心肌不定向傳導阻滯也可以啟動轉子,原因是組織存在興奮性、去極化和傳導速度甚至是動力學特性(如動作電位交替)的異質性差異。轉子和螺旋波的發生機制可以用“渦流脫落”現象來解釋。當傳導波遇到障礙的銳利緣時容易出現渦流脫落,其與水流遇到狹小障礙物或分叉時產生的渦流和湍流相似,并提出臨界彎曲度(或臨界曲率)概念。平面波峰傳導速度快于凸形波峰。事實上,波峰彎曲度越大,傳導速度越慢;當彎曲度增加到臨界水平時,就不會發生傳導。Cabo等[3]應用波峰彎曲度(wavefront curvature)R來解釋渦流脫落的機制。圖2A為波峰(白色)到達障礙邊緣(紅色)時R的原理圖。白曲線與障礙的鄰近區域結合,并向左傳導繞行避開障礙物。此區域的半徑r與波峰寬度相似,決定波峰(源,source)能否興奮前方組織(匯,sink)。通過一系列的實驗和刺激,Cabo等[3]證實了渦流脫落導致波碎裂的原理。應用2D心室肌薄片(如羊的心室外膜肌薄片),灌注一種電壓敏感染料進行光學標測。刺激實驗中,在心室肌薄片中蝕刻一條人工的線性障礙(如圖2B,紅色線代表障礙)。如圖2C上圖,當組織的興奮性正常,障礙低右下緣的點刺激啟動了一個激動波,波峰的前向傳導繞行避開障礙,沒有打破障礙或與之分開(第1種情況),最終激動整個薄片而消失。圖2C下圖提示,當組織興奮性有一定程度的下降(第2種情況),比如刺激中INa最大傳導性下降75%,或給組織灌注Na+通道阻滯劑河豚毒素,同樣的刺激方案顯示完全不同的結果。此時波峰向上移動,但與障礙分離,且出現卷縮,并開始圍繞其破碎的尖端進行旋轉,從而產生渦流。圖C上圖(第1種情況),R大于激動的最小半徑,或臨界彎曲度大于RCr;此時波峰沿著側面傳導,但沒有離開障礙,而是成功地繞行避開障礙。當R<RCr時(第2種情況),波峰卷縮,最終離開障礙物,產生圍繞PS的渦流。從Cabo等[3]的研究可以推斷,心室肌缺血、心肌梗死或持續性房顫心房重構均可能導致這種病理生理機制的形成。此時,INa密度下降,在不均勻的纖維化組織存在的情況下形成了大量障礙,導致轉子啟動,引起心動過速或顫動的發生和持續。
轉子啟動時,興奮波峰去極化PS組織及其彎曲張力的不穩定性在轉子的維持過程中發揮重要作用。圖2D顯示激動波峰的彎曲趨勢,其應用螺旋激動波峰的標準化傳導速度和尖端距離作圖(z軸,紅線)。可以看到,波峰彎曲度在尖端最大,導致旋轉中心附近的傳導速度最小;離開尖端后,彎曲度減小,標準化傳導速度增加。尖端常存在一種穩定的失匹配情形,即位于波峰組織需要去極化,所需的電流總量與波峰可用的去極化電流總量不匹配,從而導致轉子沿著復雜的軌跡進行蛇曲;如果存在足夠的可興奮組織,就會發生持續折返。因此,波峰彎曲度相關的尖端匯-源失匹配參與了轉子的啟動(渦流脫落)和維持。
3.2 觸發灶和心臟結構及轉子的形成和維持
心臟顫動的發生和維持需要觸發灶啟動心律失常,并且存在導致心律失常維持的易感基質。臨床研究證實,觸發房顫的大多數異位放電來源于肺靜脈肌袖。在一些患者中,肺靜脈肌袖的肌束電學特征使其更易產生高頻自主或觸發的放電,繼而傳導至左房后壁,此處心肌較厚更易于形成異質性和非均質肌束排列及發生結構的突然改變,進而容易產生“匯-源失匹配”,導致波碎裂和折返的形成。最近一項研究表明,給予簡單的串電刺激可以觸發肺靜脈高頻放電,啟動房顫的大多數波碎裂位于右上肺靜脈附近的間隔肺靜脈的間隔側,此處心肌厚度明顯擴張。某根肺靜脈激動的“源”電流不足以克服左房間隔后移行區的巨大“匯”,進而導致波碎裂,發生折返和房顫。心室的折返和顫動有些不同,但其機制與心房是相似的。例如,浦肯野-心肌連接部位,解剖擴張易于形成傳導延遲和阻滯,特別是在突然出現電流“匯-源失匹配”的區域。Cabo等[3]研究提示,不論是在心房還是心室,匯-源失衡可解釋傳導波與障礙分離以及渦流脫落形成,導致轉子發生和房顫發作。轉子一旦啟動就會以高頻率自旋,產生電紊亂的顫動傳導。在羊心臟中應用慢性右房快速起搏制作持續性房顫模型,并置入雙腔記錄裝置持續監測心臟的節律,證實轉子可以長期維持心臟顫動,不變電重構和結構重構的影響。房顫過程中,體內主頻值進行性增大,長期持續顫動使左房和右房主頻值差別更明顯。隨訪9~24個月,心房標測和隨后的結構分析均證實左房和右房存在主頻梯度以及多種激動形式,轉子在增大的左房中更易于長期維持房顫的動力學。與房顫相似,心室的乳頭肌結構在室速和室顫發生和維持過程中也發揮重要作用。
最近一些新生鼠心室肌細胞培養(NRVM)的單分子層實驗均證實了心肌結構在折返啟動和心律失常發生過程中起重要作用。Auerbach等[4]研究發現單分子層分成2個較大區域,其間連接有較薄的峽部,折返和心律失常的發生率升高。Bian等[5]研究顯示,NRVM單分子層存在一個中心不對稱的Z型圖案的島,快速起搏更容易穩定誘發折返。
3.3 轉子的離子通道機制
許多學者在實驗動物模型中應用藥理工具或數字刺激來研究轉子啟動和維持的離子通道機制。早期的研究主要集中在內向整流鉀離子通道(Ik1)。在豚鼠心臟2D折返電腦實驗模型中,Ik1在維持室顫頻率的空間規律性中發揮重要作用。BaCl2是Ik1通道選擇性阻滯劑。給予濃度1~50μmol/L的BaCl2溶液,室顫頻率降低并終止,進一步提示Ik1的重要性。如果應用乙酰膽堿,則形成左房至右房的房顫頻率空間梯度,可能與另一種內向整流電流,即乙酰膽堿激活的鉀離子電流(IK,ACh)密度差異相關。在慢性房顫的離體心肌細胞中,Ik1密度上調,當給予電腦刺激時,轉子快速傳導,而尖端蛇曲下降,并局限于較小的區域,從而穩定顫動。Ik1升高不僅縮短了動作電位時程,而且通過提高INa的有效率加快了轉子的運動;原因可能是Ik1引起靜息膜電位的超極化,盡管這種超極化的幅度較小(≈5 mV),但靜息膜電位在INa有效曲線陡峭部分發生了改變,導致轉子運動明顯加速。應用過表達Ik1的轉基因(TG)小鼠直接證實了Ik1的作用。離體TG鼠心臟轉子持續時間較長(>1 h)且速度極快(≈50~60 Hz);相反,野生型(WT)鼠心臟轉子較慢(≈20~25 Hz),且持續時間<10 s。如圖3A所示,對比過表達Ik1的TG鼠(右側)和WT鼠(左側)心臟的激動標測,TG鼠的轉子更早地完成1次旋轉(見不同的時間尺度)。應用小鼠心室肌動作電位離子數字模型,包括實驗記錄到的所有主要IK,并進行電腦刺激,也進一步證實了這一結論。這些刺激也印證了Ik1和INa作為重要的離子機制在轉子活動中發揮關鍵的作用。
雖然鉀電流與轉子頻率相關,但小鼠研究并不能說明2個主要的復極化鉀電流,即快和慢延遲整流鉀電流(Ikr和Iks)在人類心室肌中的作用。在小鼠心室肌中,這些電流并不能通過有意義的方式縮短動作電位時程。在高級哺乳動物研究中,并沒有發現Ikr選擇性阻滯劑E-4031能降低室顫頻率。另外,在兔子心臟中應用心室內膜冷凍消融制作的2D折返模型中,Ikr選擇性抑制劑尼非卡蘭能終止轉子激動,可能是轉子在房室溝中碰撞所致。對Rohr等[6]的研究方法進行改進,在合流電偶聯NRVM的單分子層中研究這些延遲整流鉀電流的作用。年齡5~6 d時,NRVM的動作電位存在平臺期和動作電位時程≈200 ms,促進了Ikr和Iks的激活。為了進一步提高Iks或Ikr的密度,分別應用腺病毒轉染kvLQT1-mink或hERG基因序列,并在NRVM單分子層研究其對轉子動力學的影響。令人驚訝的是,Iks的過表達并不能提高轉子的頻率。但隨著時間推移,過表達Iks導致波碎裂的發生率升高。圖3B顯示相位標測對照組和Iks過表達組。在HEK細胞中給予電腦刺激,單分子層波碎裂的發生率提高,原因是動作電位殘留外向Iks電流導致復極后不應期現象。這種現象于20世紀80年代晚期在豚鼠心室肌細胞中得到證實。
圖3C顯示,與對照組相比,Ikr過表達使轉子明顯加速。Ikr增加導致的加速與Ik1過表達引起的加速無可比性。有趣的是,實驗刺激提示轉子加速的機制除了動作電位縮短外,瞬時靜息膜電位超極化,通過調節INa有效性間接地影響了轉子的頻率。Sekar等[7]在過表達Ik1新生兔單分子層進行了類似的實驗,也得到相似的結論。除了鉀通道,Ca2+通道和興奮收縮偶聯也影響了心臟動作電位和復極化,兩者均可能影響螺旋波的動力學。在一項維拉帕米對室顫影響的研究[8]中,主頻值下降,轉子中心的蛇曲增加,室顫轉化成室速,但是對這些結果需要謹慎解釋,因為該研究所應用的維拉帕米濃度阻滯了L型Ca2+通道(ICa、L)和Ikr。細胞內Ca2+對室顫/螺旋波的作用機制尚不清楚,且存在爭議。Warren等[9-10]研究表明,室顫中,細胞內Ca2+動作電位解離是波碎裂的結果,而不是原因,且并沒有自發電壓依賴性細胞內Ca2+波的發生。盡管如此,其他研究挑戰了此觀點[11]。相反,細胞內Ca2+在尖端扭轉性室速和遺傳性心律失常(兒茶酚胺多形性室速)的自發性激動的啟動過程中發揮了重要作用,最終提高了轉子和顫動的發生率。最后Na+電流(INa)決定興奮和心臟動作電位上升支,是正常傳導和轉子激動的驅動波峰的主要電流。通過河豚毒素直接阻滯INa或增加細胞外鉀電流間接阻滯INa,或心肌缺血狀態,均能引起去極化靜息膜電位,限制了INa的有效性。每項研究中,INa下降,降低轉子主頻值,增加轉子的蛇曲。如果INa被完全阻滯(河豚毒素或細胞外鉀離子),轉子就會在邊界碰撞而終止,房顫或室顫終止。在許多情況下,Ⅰ類抗心律失常藥物阻滯INa,如奎尼丁并不總能終止顫動,而是使顫動持續或轉變成室速。TG鼠去掉編碼Na1.5的SCN5A基因,增加了與INa關聯的心律失常的易感性,包括室速或室顫。
4 顫動頻率的普適標度
許多研究采用了不同物種對顫動機制進行了探討,從小動物如鼠類到大動物,包括犬、羊和豬,甚至移植的人類心臟。問題是,在不同的物種是否均觀察到轉子的存在,是否遵循共同的規律?長期以來的爭論是,當體質量小于臨界值時,顫動就不會持續。“臨界質量”的說法第一次受到了Vaidya等研究的挑戰。該研究在小鼠心臟中進行快速心室起搏可以形成引起功能性折返的條件,導致室顫持續,且可以在100 mm2區域觀察到轉子運動。自20世紀中期以來,轉子和螺旋波已經在小鼠、大鼠、豚鼠、兔子、羊、豬和犬等離體心臟中得到證實。為了理解不同物種之間共同的機制,Noujaim等量化了體質量(body mass,BM)和室顫頻率之間的關系。以往研究提示某些生物現象與BM相關,如代謝率、壽命、呼吸頻率、心電圖參數(PR間期)等。普遍的關系式是Y=a×(BM)b,其中Y是生物學興趣變量,a是一個常數,b為一個尺度指數。Noujaim等的研究結果如圖4所示,在小鼠、豚鼠、兔和人類心臟的室顫模型中進行主頻標測,其體質量分別是30 g、600 g、3 kg和90 kg。在每個標測中,主頻以紅色顯示,小鼠38.0 Hz、豚鼠26.0 Hz、兔15.0 Hz和人類心臟6.8 Hz。值得注意的是,盡管從小鼠到人類的體質量呈3個數量級的幅度變化,而主頻值僅改變了1個數量級。在圖4B中,一項meta分析納入了11個不同物種的40項研究,用室顫頻率和BM作雙對數圖。在擬合各數據點顯示,室顫頻率≈18.9×(BM)-1/4,也就是說室顫周長可變換≈53.0×(BM)1/4。因此,室顫主頻分析可用于所有哺乳動物,盡管其中的機制尚不清楚,但物種相關的動作電位時程和心臟大小變化可能發揮了重要作用。
5 轉子標測
5.1 相位標測
1998年,Gray等應用相位標測技術進一步分析轉子的動力學。圖5A顯示,室顫過程中,在兔心外膜面一個點記錄到典型的光學信號。這個時間序列稱為F(t),t表示時間。在圖5B中,應用同樣信號值的F(t+l)和F(t)作2D相位空間圖,其中l是一種嵌入延遲。相位空間圖顯示出一個環圍繞中心旋轉的軌跡。將心肌表面每個部位的相位變量θ定義為θ(t)=arctan[F(t+l)-Fmean,F(t)-Fmean],而Fmean等于閾值,定義為4 s內室顫激動的平均值(≈室顫周長的1/4)。相位標測可以形成顏色相位圖像,量化轉子動力學變化,也可以清楚地識別PS點(圖5C)。每種顏色代表興奮恢復周長中的1個相,由于PS的相是任意的,所以把PS點定義為所有相匯聚的部位;相反,在PS周圍因素是一種持續漸進的等于±2π的相。應用相空間描繪轉子動力學的方法,可以在正常或病理生理狀態下系統地研究轉子的始動、維持和終止情況,但需要謹慎選擇嵌入延遲l。最近的研究中,應用Hilbert變換方法可以計算瞬時相。不管采用哪種方法,波碎裂和PS點的形成是轉子存在的先決條件,且轉子并不穩定,而是沿著復雜的軌跡蛇曲,從而產生復雜的心電圖(圖5D)。在大多數情況下,顫動終止是由于PS點與一個邊界進行碰撞導致螺旋波消失所致。
5.2 主頻標測
20世紀90年代末至21世紀初,研究者應用多種方法在離體心肌房顫和室顫過程中均標測到單個轉子或多個轉子的存在。可視化轉子和相位標測可以顯示轉子的時空軌跡。單形性室速的轉子是穩定的,而多形性室速的轉子通常沿著復雜的軌跡蛇曲,蛇曲的轉子也可見于尖端扭轉型室速或室顫。主頻分析可用于分析轉子相關的時間依賴性激動。在顫動心房或心室的心外膜部位進行心電信號標測,在感興趣的時間窗內應用快速傅立葉變換,將所得到的每個部位的傅立葉頻譜的最大頻率作為主頻值(圖6)。在羊的心房肌進行雙房電信號標測,給予乙酰膽堿后通過快速起搏誘發房顫(圖6A~圖6D)。其中,左側圖應用3 s時間長度的心電信號,經過快速傅立葉變換計算相應的頻譜(右側圖),可以觀察到多個頻率峰值。圖6E采用5 s光學信號標測,通過電荷耦合攝影機記錄多個部位主頻峰值,作出羊左房和右房的主頻標測圖。這與大多數類似的實驗得到的頻譜分析結果是一致的。房顫過程中,左房的心房激動頻率明顯高于右房,其他物種相關研究也能復制類似的結果,如豬。陣發性房顫人群中,對心電圖進行房顫頻率分析,也得到類似的結果。因此,對顫動進行主頻分析,其結果提示房顫或室顫不是隨意的傳導波,而是一種時空規律一致的心房依賴性傳導激動。基于目前的研究結果,可以得到以下假設:①激動存在主頻空間分布層次,在大多數病例中,房顫由左房少量高頻驅動轉子維持,并維持整個心房的激動;②轉子主頻值非常高,能以1∶1的形式驅動其鄰近的組織。除了這種1∶1形式,波峰還可以出現間歇性、空間分布散在的波碎裂,繼而顫動傳導至左房和右房的遠端區域。主頻分析提示某些顫動是規律激動。電腦刺激對新生鼠心室肌細胞單分子層轉子進行標測也觀察到了類似的現象(圖6F~圖6 I)。在這一有代表性的研究中,單分子層的下半部分應用基因編碼hERG構建的腺病毒轉染,該基因編碼與快速延遲整流鉀電流(Ikr)相關,而上半部分不被轉染。結果提示Ikr存在分布密度梯度,下半部分Ikr電壓較高,促進了轉子的形成(圖6F)。Ikr轉染區域,轉子產生螺旋波的波峰在交界區間斷性被阻滯,不能以1∶1形式驅動未轉染區。在圖6G中,主頻標測可以見到明顯的頻率梯度,轉染區的主頻值明顯高于未轉染區。在羊膽堿能房顫和人類陣發性房顫中也觀察到了類似的左房至右房的頻率梯度(圖6E)。另外,規律指數(regularity index,RI)定義為主頻比率∶總光譜功率。利用攝像機記錄2D單分子層電位滴定染料熒光的變化,計算發現其值是不均等分布的。在2D單分子層圓盤中畫一條XX′垂直線(圖6H)以顯示轉染區和未轉染區的RI值,交界處的RI值最低(圖6I)。這些數據變化提示在hERG轉染區和未轉染區的交界處大多可觀察到復雜的碎裂電位,此處不應期由于Ikr密度改變而存在較大的變化。總的來說,主頻標測可用來證實顫動的規律性和頻率的層次性,也提示了心房不同腔之間的離子通道梯度變化和轉子周圍碎裂電位的定位。
5.3 信息熵標測
信息熵是信息論中用于度量信息量的一個概念。一個系統越是有序,信息熵就越低;相反,一個系統越是混亂,信息熵就越高。信息熵也可以說是系統有序化程度的一個度量。信息熵計算如下:①記錄心肌激動的雙極電圖,根據激動電壓間隔類型(橫坐標)和頻率(縱坐標)計算,激動雙極電圖的特征以條形圖(即電壓箱)顯示;②相對概率密度Pi定義為第i個電壓箱的計數除以所有電壓箱計數的總和;③應用信息熵公式∑N|1i=1Pi log2Pi計算,其中,Nl1為所有電壓箱計數的總和。Anand等研究記錄心肌轉子中心和周圍區域激動的雙極電圖,這2個區域激動的雙極電圖形態存在明顯差異(圖7);激動電圖的電壓箱利用信息熵公式計算,轉子中心的信息熵較周圍區域明顯增高,提示越接近轉子中心,激動越混亂無序。通過對人類房顫的心房標測發現,信息熵與平均碎裂電位呈中度相關,但碎裂電位并不是位于信息熵最高部位。目前,信息熵有望用于房顫轉子中心標測和定位,即信息熵標測,然而其臨床價值需要進一步探討。
6 臨床應用
6.1 抗心律失常藥物和轉子
了解轉子的離子通道機制,有助于選擇合適的抗心律失常藥物。Ik1和INa在轉子折返特性(如轉子頻率和蛇曲)中發揮重要的作用。應用藥物阻滯這些離子通道,特別是Ik1,進一步證實了其在折返激動中的作用。對比氯喹(抗瘧藥物)和Ⅰ類抗心律失常藥物奎尼丁對室顫和轉子動力學的作用。圖8A顯示,對過表達Ik1TG鼠在室顫過程中進行主頻標測:上圖顯示奎尼丁的作用,其降低了室顫頻率,但未能終止心律失常;下圖顯示氯喹的作用,其恢復了竇性心律[12-13]。
在奎尼丁/氯喹不存在/存在的情況下,標準化主頻值提示氯喹在所有實驗中終止了室顫(圖8B)。膜片鉗和分子結構數據分析提示,氯喹終止室顫成功率較高的部分原因可能是有效地阻滯了Ik1。最近在羊張力誘發房顫模型中也觀察到了同樣的結果。圖8C顯示,在冠脈灌注氯喹前后,對離體心臟張力誘發房顫的左房后壁進行主頻標測,藥物降低了轉子頻率。再將這些數據與另一種Ⅰ類抗心律失常藥物氟卡尼進行對比(圖8D),氟卡尼在所有實驗中均不能終止房顫;當它達到一定濃度時,在2/5的實驗中可將房顫轉變為房速。相反,氯喹在所有實驗中均可以終止房顫,恢復竇性心律。這些實驗提示轉子理論是房顫和室顫的機制之一。Ik1阻滯藥物可能有效地消除心臟顫動。但這些研究僅僅是藥物治療性研究的開始,設計新的藥物僅能選擇性地阻滯INa和Ik1,而沒有致心律失常作用,需要進一步在心律失常/病理生理動物模型中驗證它們的有效性。一種有趣的假設是心肌區域性冷卻的抗心律失常作用,即轉子激動漂移至周邊,遠離冷卻區域,隨后與邊界碰撞消失;這種擺脫轉子牽制作用能降低室顫的頻率,終止室顫發作[13]。
6.2 人類心臟的螺旋波和導管消融
多數有關轉子的實驗和分析僅局限于動物模型和數字刺激模型。電腦刺激模型通常在人類心房和心室肌簡單的2D薄片或復雜的3D模型中進行,提示持續轉子驅動了房顫和室顫的發生。人類心臟相關的實驗數據較難得到。最近體內或心臟外膜標測研究證實,室顫過程中存在轉子。Noujaim和Masser等[14-15]證實,在Langendorff灌注的人類心臟中,室顫早期存在轉子或回卷波(圖9)。
最近,Narayan等[16]在CONFIRM(focal impulse and rotormodulation)實驗中納入了80例患者,其中54例僅標測房顫起源,而另外26例在標測房顫起源后給予靶向消融。研究應用籃狀電極標測導管,證實持續的轉子起源是驅動房顫的主要機制,持續性房顫較陣發性房顫有更多的“源”和更短的周長。竇性心律時,應用2個籃狀電極標測導管分別在左房和右房進行多點標測。不同患者中,籃狀電極基本適用于個體化的心房結構(圖10A和圖10B),覆蓋心房的大部分區域。圖10D顯示竇性心律的心內電圖和體表心電圖。圖10E顯示右房激動從右房竇房結部位向低位左房側壁傳導,符合竇性激動常見的傳導方式。進一步在房顫過程中進行標測,提示轉子和局灶起源在房顫中是常見的,96%的患者存在穩定的轉子起源。其中86%的患者轉子圍繞著一個中心區域進行持續旋轉激動(圖11A~圖11F)。
29%的患者存在圍繞著一個起源區域旋轉的局灶激動(圖11G和圖11H)。通過分析幾個周期的傳導方向,發現局部起源驅動了顫動發作。研究人群心臟通常存在1個或多個轉子或重復的局灶激動[16](圖12和圖13),雙房轉子的平均數量為(1.8±0.9)個。隨著房顫的進展,共存的轉子數也隨之增加,即持續性房顫的轉子數目達到(2.0± 0.8)個,顯著多于陣發性房顫的轉子數目(1.5± 0.8,P<0.01),與患者是否曾經給予消融治療[第一消融術中標測(1.8±0.9)個,傳統術式消融失敗再行標測(1.8±0.6)個,P=0.84]、年齡、左房體積和房顫病史無關。
房顫的局灶起源是穩定的。應用電腦標測方法,導致房顫的旋轉起源和局灶激動出人意料得穩定,沿著部分重疊周長的外切位點遷移,面積分別是(2.5±1.2)cm2和(2.1±1.8)cm2。術中不同時間分次標測[標測間隔時間(115±57)min],起源定位均是穩定保守的,提示人類心臟顫動的起源可以持續保守存在至少幾個小時。1例患者在傳統方法消融前應用等時標測圖,提示轉子位于左下肺靜脈周圍,但常規消融方法并沒有靶向消融這一起源,導管消融未能終止房顫,術后房顫復發。該例患者8個月后再行消融治療,等時標測圖提示轉子仍然保守存在類似位置,靶向消融轉子起源,房顫終止,進一步提示房顫轉子可以長期保守存在。房顫動物模型中,轉子持續時間較短、空間多變且不穩定,而人類的房顫相關轉子可以穩定持續幾個小時[16](圖14)。
人類心臟中,轉子或局灶激動存在空間約束性和保守性,為導管靶向消融消除轉子提供了可能。26例患者中,有19例為持續性房顫,應用射頻能量均消除了轉子起源;有16例標測到一兩個共同的起源,在旋轉中心或局灶起源的局限遷移位點消融(3.9± 3.8)min,房顫均成功轉復竇性心律(n=13,圖12和圖13)或規律的房撲(n=3)。消融通常在標測到轉子起源60~120 min后進行,也進一步提示了人類房顫起源的時間穩定性。靶向消融通過5~10次消融損傷(每個消融損傷的面積約0.25 cm2),即約2 cm2的組織損傷就可以終止房顫發作。以往對持續性房顫進行傳統導管消融,往往需要50~200次消融損傷,損傷面積往往>12~50 cm2或>心房區域的30%[17],且終止持續性房顫的成功率不超過20%[18]。多數中心在房顫消融過程中盡管能達終止房顫目的,但其間部分或多數房顫先轉化為規律的房速而不是竇性心律。針對轉子區域的靶向消融可以成功終止房顫,機制可能與消融損傷消除了功能性或解剖的異質性有關,比如組織的各向異質性、纖維化、瘢痕或其他因素。靶向消融與傳統消融方法相比,消融時間和組織損傷程度也低一兩個數量級。轉子和局灶起源消融時間與起源的類型和定位無關。例如,左房轉子的旋轉中心靶向消融不足1 min就使房顫轉復竇性心律,而右房轉子靶向消融5.5 min才使房顫轉復竇性心律(圖12)。圖12~圖14中的電解剖結構顯示了消融終止房顫的確切損傷部位。傳統消融方法首先在左房中進行,而僅在右房進行局灶消融終止房顫不常見。房顫起源于右房也常見,持續性房顫54例,左房/右房轉子數46/34個,局灶激動17/1個;陣發性房顫26例,左房/右房轉子數17/6個,局灶激動12/3個。起源分布和靶向消融終止房顫的成功率與患者是否首次消融治療或既往傳統消融治療是否復發無關。26例患者中,10例存在≥3個規律的房顫起源。局部靶向消融2個起源部位后,平均消融(6.3±4.3)min,房顫的頻率明顯降低,通過冠狀靜脈竇電極測得的房顫周長延長了(15±12)%。上述結果顯示,不論是起源定位,還是轉子或局灶激動,消融所有可識別的局灶起源能夠終止房顫發作。
26例患者經靶向消融后,其中22例患者置入了持續心電監測裝置,以直接監測房顫的復發率。16例患者消融一兩個局灶起源,隨訪(359±220)d,93.8%的患者經過單次消融成功維持竇性心律,明顯高于傳統消融報道的成功率;10例患者存在≥3個起源,靶向消融后隨訪(347±272)d,60%的患者經過單次消融維持竇性心律,提示消融所有可識別的轉子或局灶激動能提高房顫消融的長期成功率。該研究結果第一次支持了轉子是人類房顫的關鍵驅動因素。如果這一結果能在其他中心得到重復,則將進一步提高導管消融的安全性,并將使更多患者受益。
2013年,Naryan等[16]在一項研究中納入94例房顫,71.2%是持續性房顫,分為傳統消融組(FIRM-blined)和傳統消融+靶向消融組(FIRM-guided)。前者行FIRM標測,術者并不知道標測結果,傳統消融并不能完全消除所有起源;后者進行FIRM標測,術者在FIRM標測指導下行傳統消融和靶向消融。術中應用64極籃狀電極導管對雙房進行標測。97%的患者具有穩定的房顫起源,鄰近或遠離傳統的消融部位(包括右房)。房顫起源中有22.8%鄰近肺靜脈,16.0%位于左房頂部,28.2%位于左房其他區域,33%位于右房。每個患者起源(2.3±1.1)個。持續性房顫起源較陣發性房顫分布更為廣泛。傳統方法消融覆蓋起源僅占所有病例的45%,并不總能覆蓋消融每個病例的所有起源,這通常取決于患者個體化起源的部位和范圍。44%的患者置入心電監測裝置,一次消融平均隨訪272 d;傳統消融附加FIRM指導靶向消融,使隨訪成功率明顯提高。所有起源成功消融的隨訪成功率最高(23/33,87.9%),部分起源消融的成功率較高(8/12,66.7%),未消融任何起源的成功率最低。
7 展望
動物和人類心臟模型研究表明,轉子是心臟顫動的重要機制之一。在下一個10年,需要研究開發高分辨率算法和裝置用于識別導致房顫和室顫的轉子及螺旋波,從而有助于心臟顫動的導管消融和電學/除顫治療。最近Naryan等[16]FIRM實驗結果提示,導致房顫的轉子是穩定可標測的,靶向消融轉子和/或局灶起源能夠提高房顫導管消融的成功率,可能具有長期有效性。然而這一臨床研究結果仍然需要其他中心加以重復和驗證。此外,轉子的離子/分子機制尚待研究,仍然需要在此基礎上開發更有效、更安全的治療方案。
[1]Pandit SV,Jalife J.Rotors and the dynamicsof cardiac fibrillation[J].Circ Res,2013,112(5):849-862.
[2]Gray RA,Pertsov AM,Jalife J.Spatial and temporal organization during cardiac fibrillation[J].Nature,1998,392(6671):75-78.
[3]Cabo C,Pertsov AM,Davidenko JM,et al.Vortex shedding as a precursor of turbulent electrical activity in cardiacmuscle[J].Biophys J,1996,70(3):1105-1111.
[4]Auerbach DS,Grzda KR,Furspan PB,et al.Structural heterogeneity promotes triggered activity,reflection and arrhythmogenesis in cardiomyocyte monolayers[J].J Physiol,2011,589(Pt9):2363-2381.
[5]Bian W,Tung L.Structure-related initiation of reentry by rapid pacing inmonolayers of cardiac cells[J].Circ Res,2006,98(4):e29-38.
[6]Rohr S,Scho¨lly DM,Kléber AG.Patterned growth of neonatal rat heart cells in culture.Morphological and electrophysiological characterization[J].Circ Res,1991,68(1):114-130.
[7]Sekar RB,Kizana E,Cho HC,et al.IK1heterogeneity affects genesis and stability of spiral waves in cardiac myocytemonolayers[J].Circ Res,2009,104(3):355-364.
[8]Samie FH,Mandapati R,Gray RA,et al.A mechanism of transition from ventricular fibrillation to tachycardia:effect of calcium channel blockade on the dynamics of rotatingwaves[J].Circ Res,2000,86(6):684-691.
[9]Warren M,Zaitsev AV.Evidence against the role of intracellular calcium dynamics in ventricular fibrillation[J].Circ Res,2008,102(9):e103.
[10]Warren M,Huizar JF,Shvedko AG,et al.Spatiotemporal relationship between intracellular Ca2+dynamics and wave fragmentation during ventricular fibrillation in isolated blood-perfused pig hearts[J].Circ Res,2007,101(9):e90-e101.
[11]Ogawa M,Lin SF,Weiss JN,et al.Calcium dynamics and ventricular fibrillation[J].Circ Res,2008,102(5):e52.
[12]Noujaim SF,Stuckey JA,Ponce-Balbuena D,et al.Structural bases for the different anti-fibrillatory effects of chloroquine and quinidine[J].Cardiovasc Res,2011,89(4):862-869.
[13]Filgueiras-Rama D,Martins RP,Mironov S,et al.Chloroquine terminates stretch-induced atrial fibrillation more effectively than flecainide in the sheep heart[J].Circ Arrhythm Electrophysiol,2012,5(3):561-570.
[14]Noujaim SF,Berenfeld O,Kalifa J,etal.Universal scaling law of electrical turbulence in the mammalian heart[J].Proc Natl Acad Sci USA,2007,104(52):20985-20989.
[15]Masse S,Downar E,Chauhan V,etal.Ventricular fibrillation in myopathic human hearts:mechanistic insights from in vivo global endocardial and epicardial mapping[J].Am JPhysiol Heart Circ Physiol,2007,292(6):H2589-H2597.
[16]Narayan SM,Krummen DE,EnyeartMW,et al.Computationalmapping identifies localized mechanisms for ablation of atrial fibrillation[J].PLoS One,2012,7(9):e46034.
[17]Haissaguerre M,Sanders P,Hocini M,et al.Catheter ablation of long-lasting persistent atrial fibrillation:critical structures for termination[J].JCardiovasc Electrophysiol,2005,16(11):1125-1137.
[18]Oral H,Pappone C,Chugh A,etal.Circum ferential pulmonary-vein ablation for chronic atrial fibrillation[J].N Engl JMed,2006,354(9):934-941.
Rotor mechanism of arrhythm ia and its clinical significance
Lin yubi1,Zhang shulong2,Karl-Heinz Kuck3
(Department of Cardiology,1.the First Affiliated Hospital of Jinan University,Guangzhou Guangdong 510630;2.the First Affiliated Hospital of Dalian Medical University,Dalian Liaoning 116011,China;3.Asklepios Klinik St.Georg,Hamburg 20099,Germany)
Objective The rotor is one of the importantmechanisms of arrhythmia.Its formation is related to the vortex shedding and ion channels.Triggers and abnormal cardiac structure can promote the formation andmaintenance of rotors.Phase,dominant frequency,Shannon Entropy and CONFIRM mapping are expected for themapping of rotors,which may improve clinical treatment.
rotor;spiralwave;arrhythmia;ion channel;dominant frequencymapping;phase mapping;radiofrequency catheter ablation
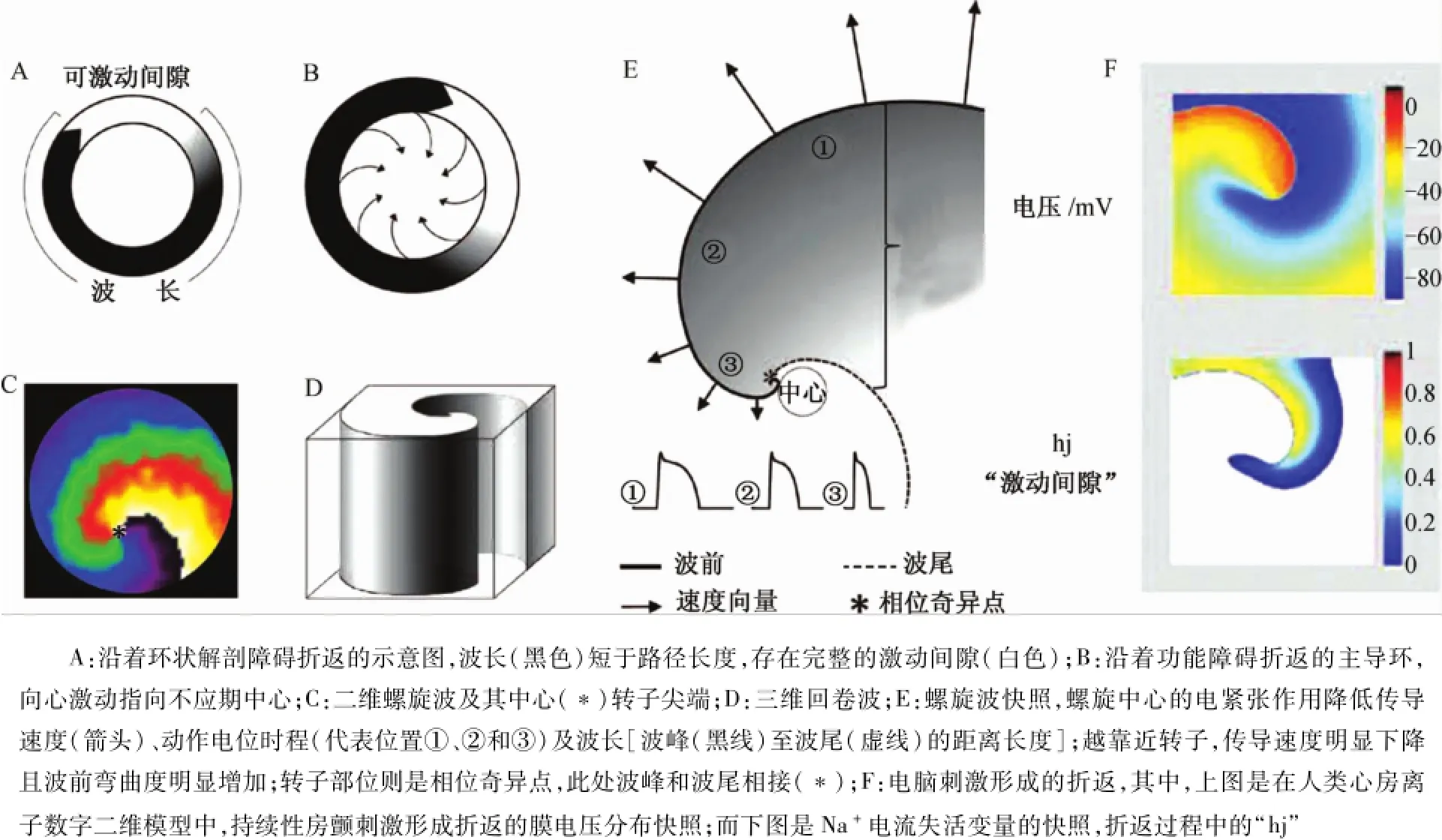
圖1 轉子和螺旋波的基本概念Fig.1 Basic concepts of rotors and spirals
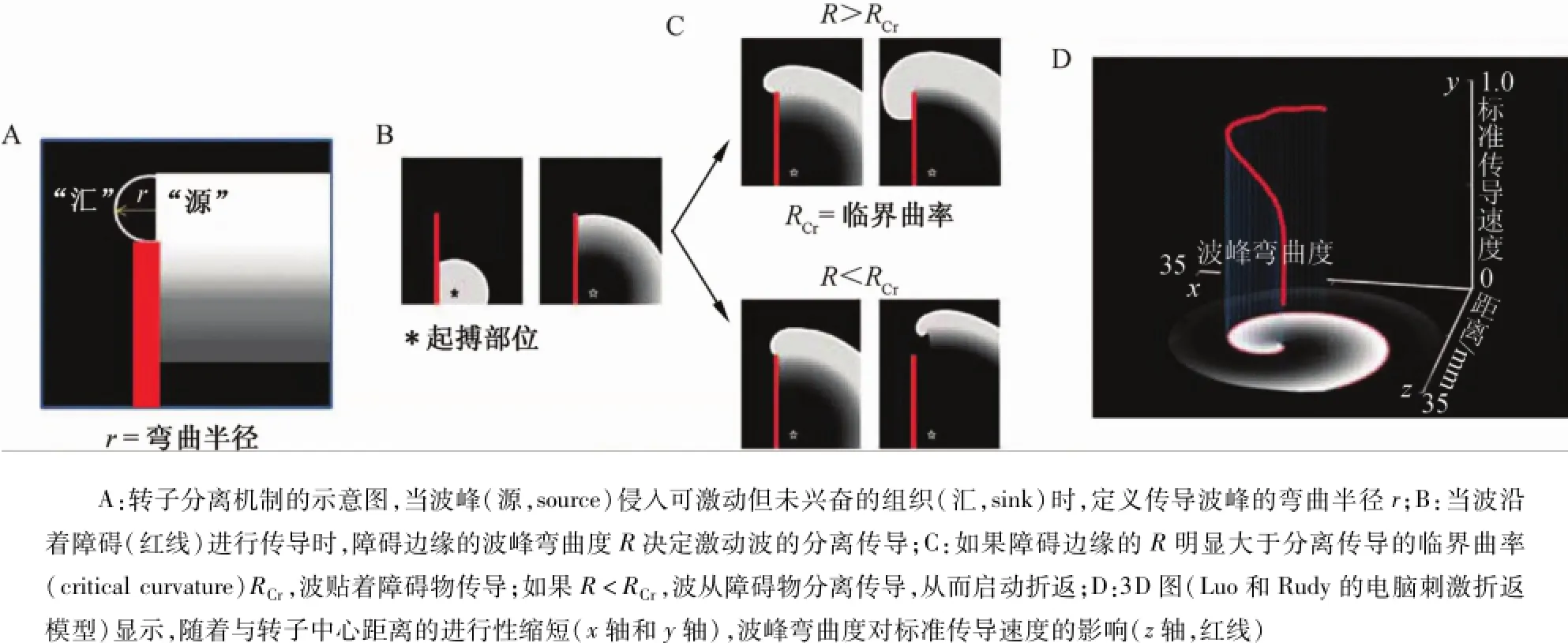
圖2 轉子啟動和渦流脫落Fig.2 Rotor initiation and vortex shedding
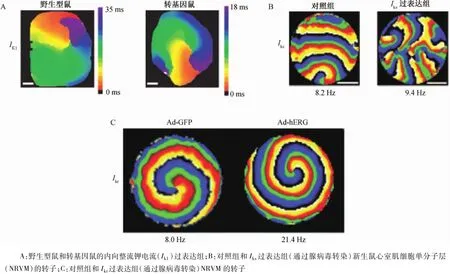
圖3 轉子和離子通道機制Fig.3 Rotors and ionic channel basis
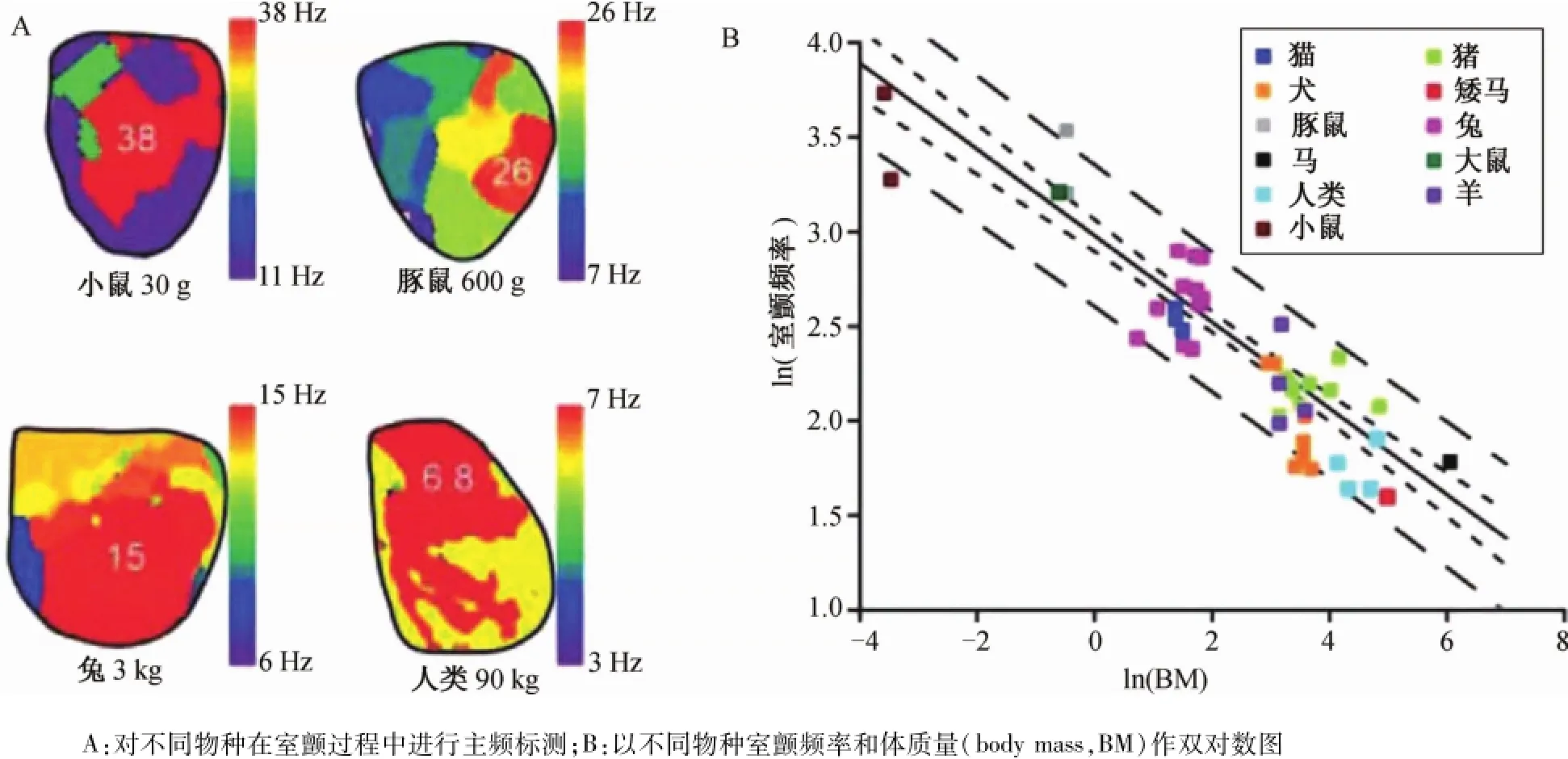
圖4 轉子和顫動頻率的標度Fig.4 Frequency scaling of rotors and fibrillation
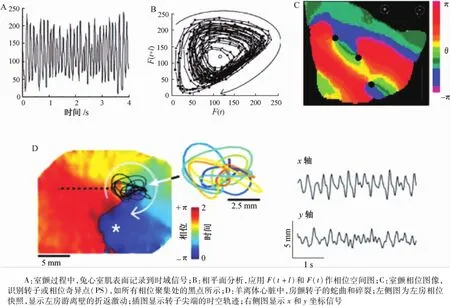
圖5 相平面分析顯示奇異點Fig.5 Singularity poin ts revealed by phase p lane analysis
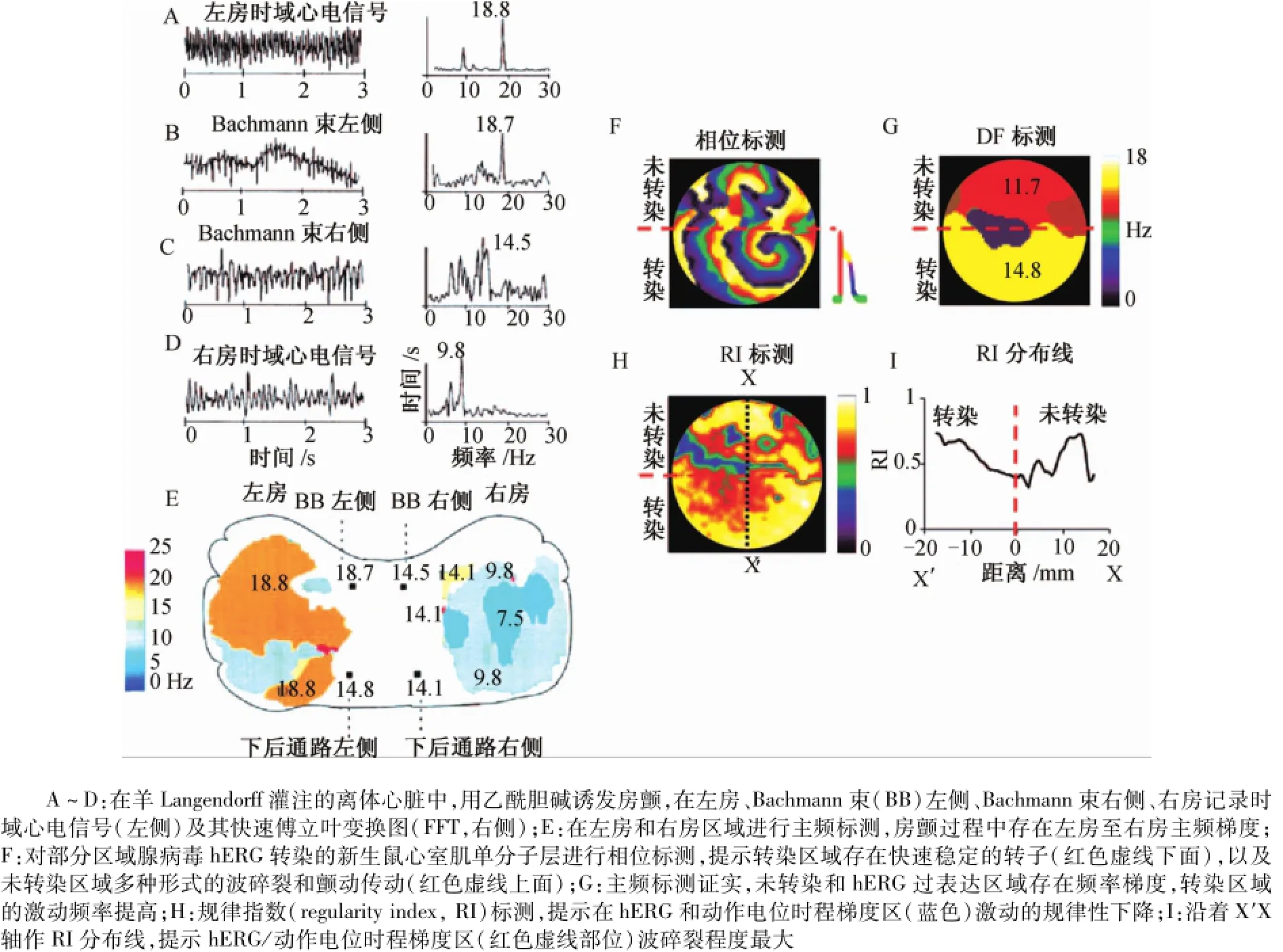
圖6 轉子和顫動傳導的主頻分析Fig.6 Dom inant frequency analysis of rotors and fibrillatory conduction
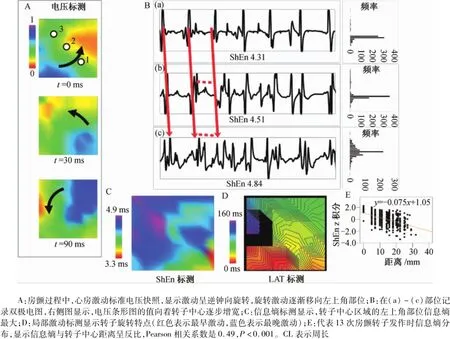
圖7 信息熵在羊房顫折返中的分布Fig.7 Distribution of Shannon entropy(ShEn)in re-entry during sheep atrial fibrillation
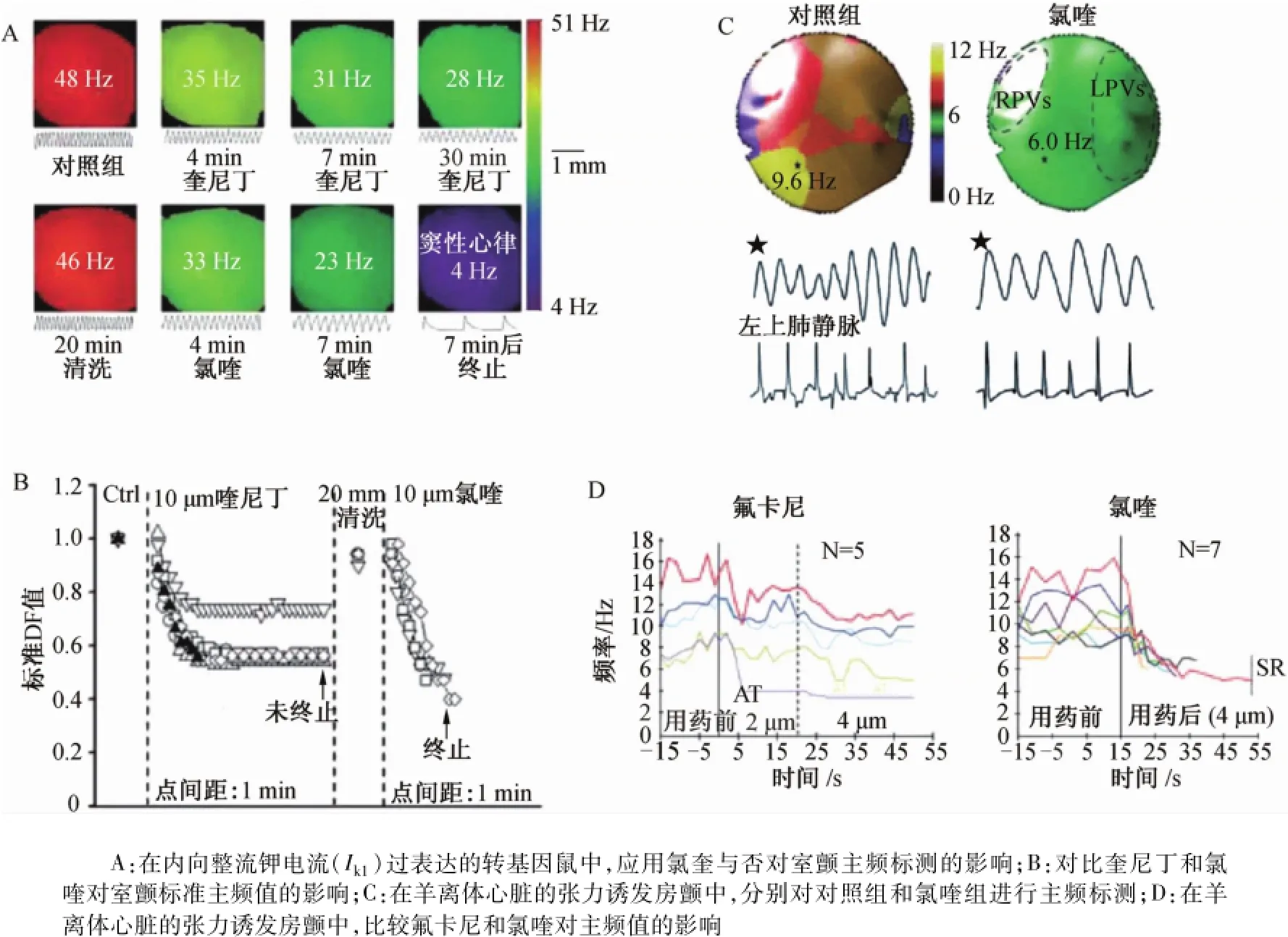
圖8 室顫和房顫中轉子和抗心律失常藥物Fig.8 Rotors and antiarrhythm ic drugs in ventricular fibrillation and atrial fibrillation
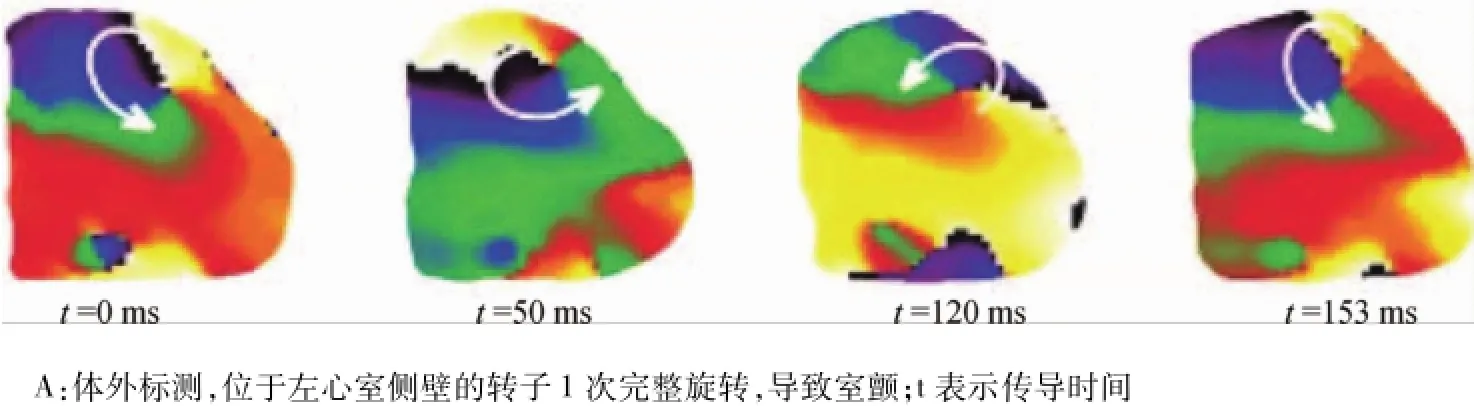
圖9 人類心臟的轉子Fig.9 Rotors in hum an hearts
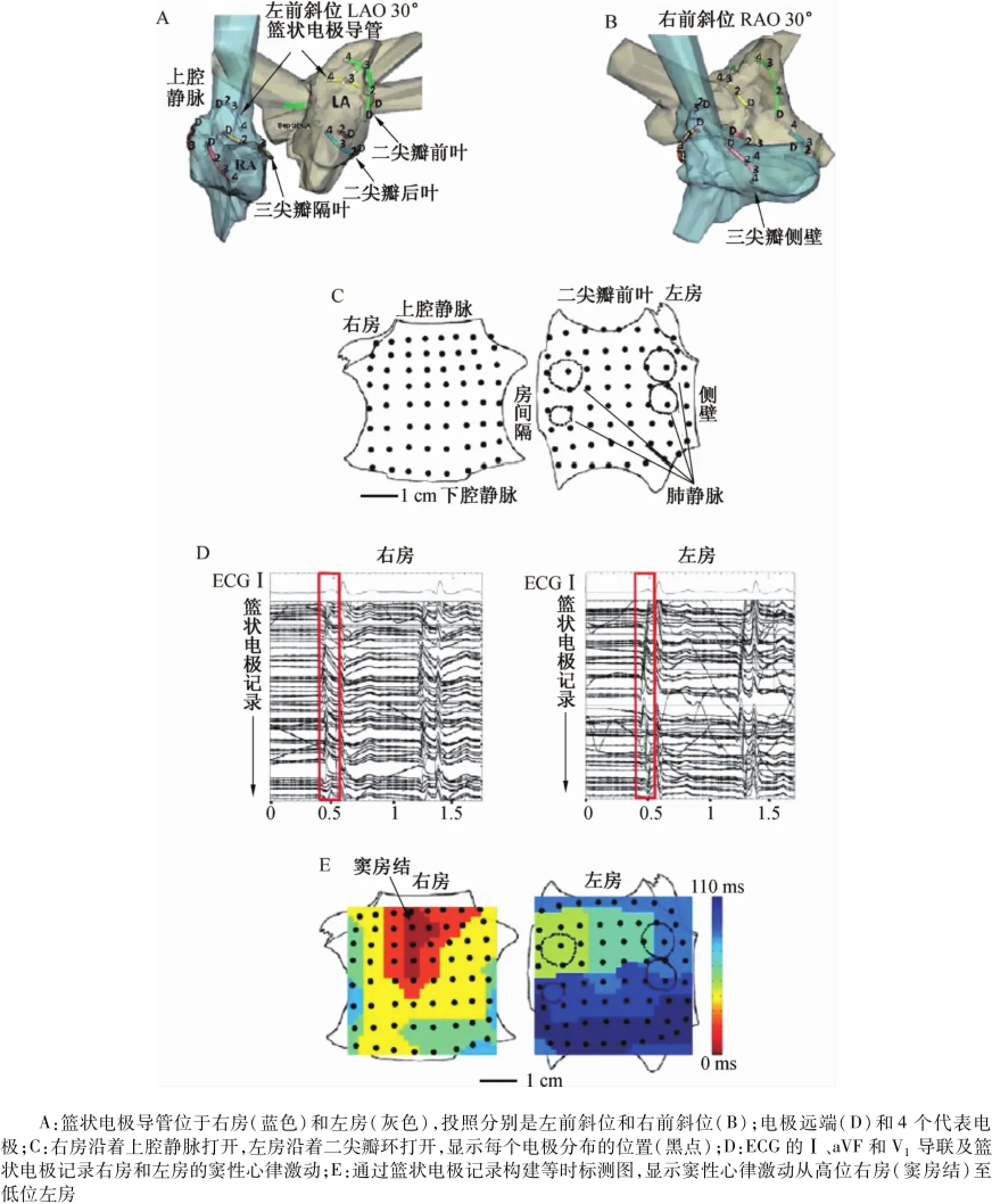
圖10 人類心房電解剖標測Fig.10 Electrical and anatom icmapping of human atria
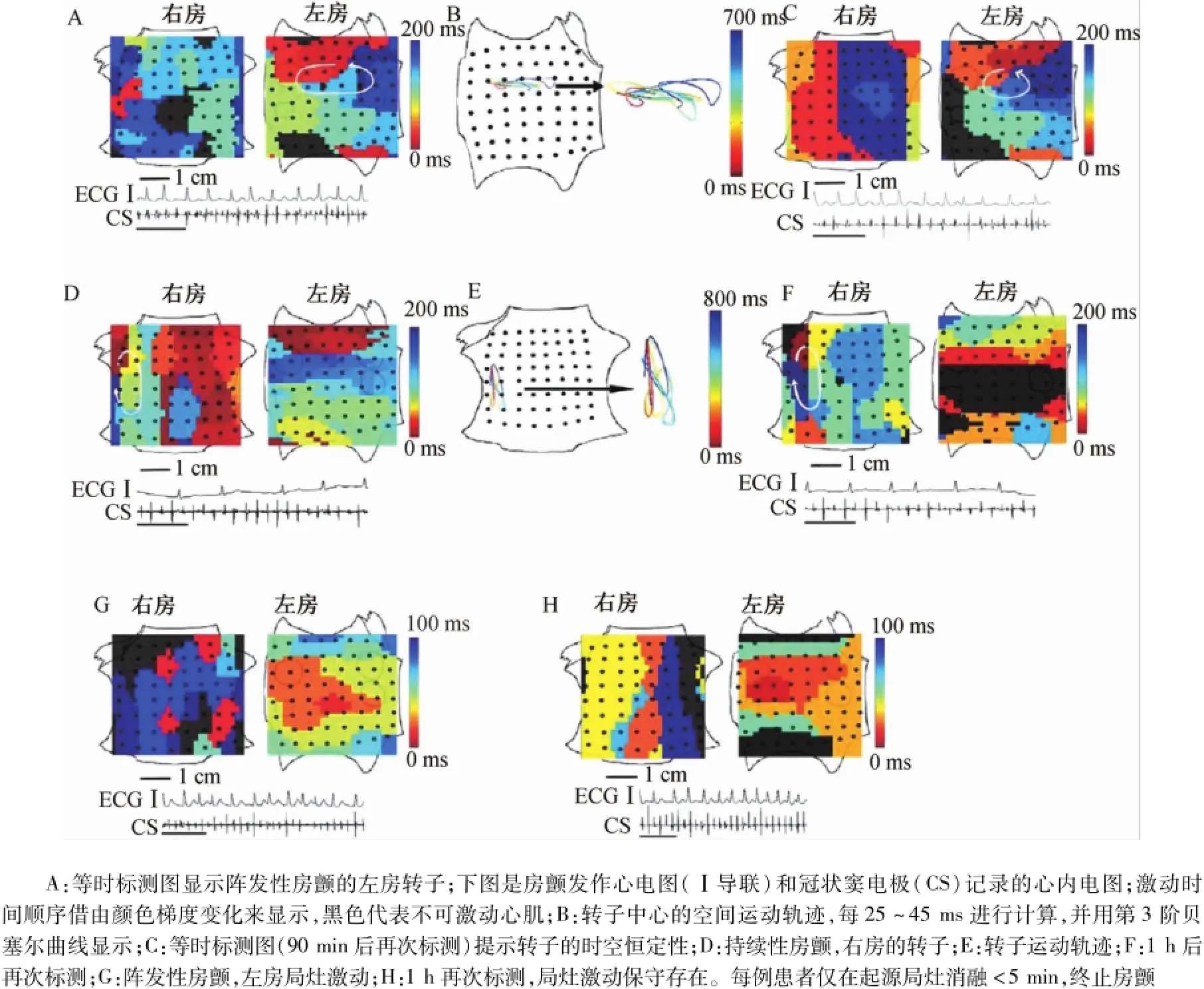
圖11 人類房顫中穩定的起源Fig.11 Stable localized sources underlying human atrial fibrillation
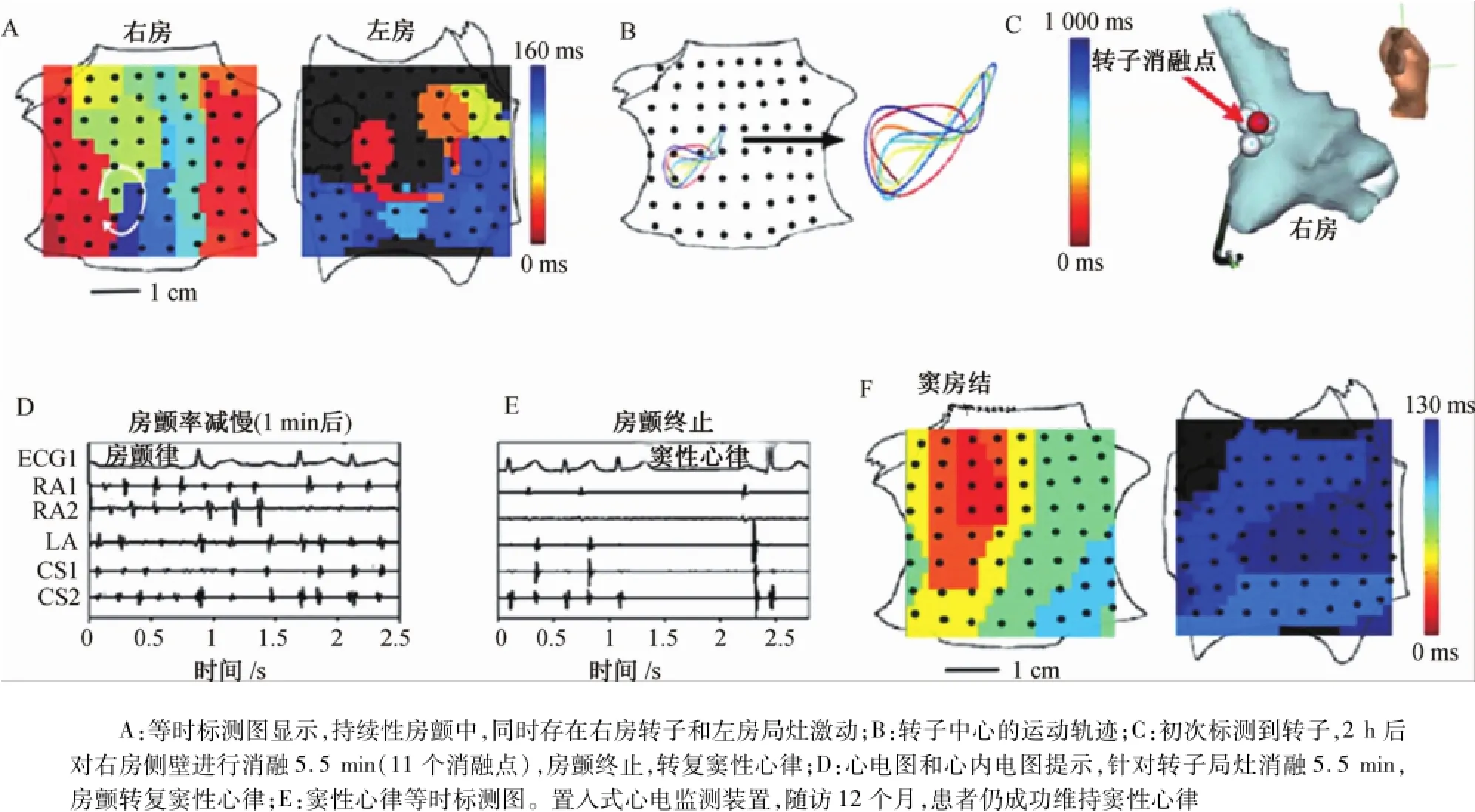
圖12 右房轉子消融,房顫終止Fig.12 Atrial fibrillation term ination by ablation of stable right atrium rotor
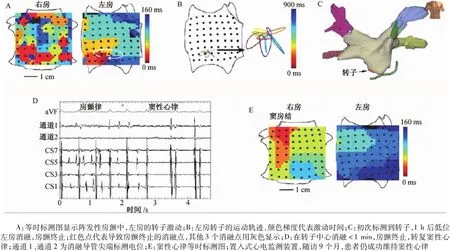
圖13 左房轉子消融,房顫終止Fig.13 Atrial fibrillation term ination by ablation of a stable left atrium rotor
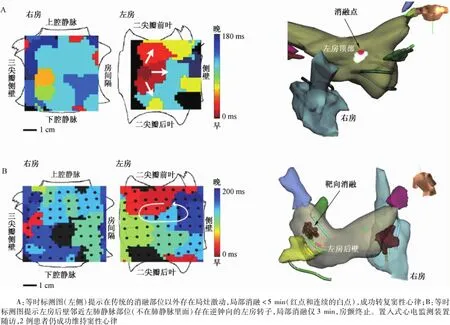
圖14 人類房顫起源的靶向消融Fig.14 Targeted ablation of the origin of human atrial fibrillation
R541.7
A
1008-0740(2014)04-0277-15
2014-07-04)
(本文編輯:顧艷)
10.13308/j.issn.1008-0740.2014.04.015
遼寧省自然科學基金資助項目(2013023032),暨南大學第一臨床醫學院科研培育專項基金(2012207)
510630廣東廣州,暨南大學附屬第一醫院心臟內科(林玉壁);116011遼寧大連,大連醫科大學附屬第一醫院心臟內科(張樹龍);20099漢堡德國,圣·喬治醫院心內科(Karl-Heinz Kuck)
林玉壁,主治醫師,主要從事心臟電生理和起搏領域的研究。
張樹龍,E-mail:zhangshulongmd@yahoo.com

