FeNi3催化劑的制備及其對NaBH4水解制氫的催化活性評價
姚海瑞,鄭喜俊,張 軍,李晶晶,白孝康
(河南科技大學化工與制藥學院,河南 洛陽 471023)
FeNi3催化劑的制備及其對NaBH4水解制氫的催化活性評價
姚海瑞,鄭喜俊,張 軍,李晶晶,白孝康
(河南科技大學化工與制藥學院,河南 洛陽 471023)
以水溶性鎳鹽和鐵鹽為金屬源,通過水合肼作為還原劑,聚乙烯吡咯烷酮作為模板和穩定劑,采用水熱法在堿性溶液中制備出了雙金屬化合物FeNi3。考察了聚乙烯吡咯烷酮和堿液濃度對產物形貌和物相的影響,借助X射線粉末衍射和透射電鏡手段,分別對產物進行了表征和分析。同時,通過調控不同的反應條件,比較了FeNi3以及不同形貌的Ni粉對于NaBH4水解產氫速率的影響,從而對FeNi3的催化活性進行了評價。研究結果表明:在試驗設定的條件下,所得產物均為結晶度良好的微納米整比化合物FeNi3,聚乙烯吡咯烷酮的加入能夠有效地改善產物的結晶習性,而且有助于形成粒徑均勻的高分散性微納米菱形片形狀;在相同的水解條件下,30℃時,反應開始后10 min內FeNi3對NaBH4的催化水解制氫速率比單質金屬鎳微粉高出26.8%以上,表明FeNi3的催化活性明顯高于單質鎳粉。
制備;FeNi3;NaBH4;產氫;催化
0 引言
金屬(或類金屬)組元按照一定化學配比有序結合形成的金屬間化合物,晶體構型有別于相應的單質金屬晶體[1],在微觀結構和物相上,兼具金屬單質和化合物的雙重特點。金屬間化合物的組成復雜,大致可歸結為兩大類:一類是按金屬元素的周期系“族價”,金屬間直接以“族價”相結合,如:Mg2Sn和Mg2Pb(Mg的“族價”為二價,Sn、Pb則是四價元素);另一類則屬于電子化合物,其組成決定于兩種金屬的電子數和原子數之比,周期族系Ⅷ族元素Fe、Co、Ni等所構成的金屬間化合物Ni3Al、Co3V就屬此類。與單質金屬或類金屬相比,金屬間化合物具有獨特的電學、磁學和聲學等物理化學性質,因而在半導體材料、形狀記憶材料、儲氫材料和磁性材料等領域用途廣泛[2-3]。尤為重要的是,金屬間化合物良好的化學穩定性,賦予其優異的抗蝕、抗毒能力,在用作高效催化劑方面具有較大潛力。
微納米金屬鐵具有強磁性,常用作高密度磁記錄材料,而金屬鎳微粉則具有較高的催化活性,被廣泛用作加氫、脫氫等過程的催化劑[4]。通過在適宜工藝條件下,將金屬鎳與金屬鐵相互化合,形成金屬間化合物,兼具兩種金屬元素各自的性能特點,可望獲得一種具有磁選分離特點、低成本的新型高效催化劑。因此,鎳鐵間金屬化合物的研究引起了科技界的廣泛關注。文獻[5]以NaBH4為還原劑,油酸為分散劑,采用液相還原法制備出納米鐵鎳前軀體,通過氮氣保護,500℃焙燒,得到平均粒徑為30 nm的球形FeNi合金,產物呈現超順磁性;文獻[6-7]則通過水熱合成路線,制備了鏈狀、球狀和花狀的鐵鎳合金化合物FeNix;同時,也有學者對不同形貌鎳鐵化合物的形成機制進行了探討[8]。但是,上述工作并未對產物的催化活性進行系統地研究。
本研究采用聚乙烯吡咯烷酮(PVP)為模板和穩定劑,通過調控溶液的堿性,借助于水熱合成路線,一步法制備了微納米尺度的菱片狀FeNi3,并以NaBH4水解制氫作為探針反應,詳細考察對比了產物FeNi3和金屬鎳粉對產氫速率的影響,從而對產物FeNi3的催化性能進行了科學評價。
1 試驗部分
1.1 試驗原料及儀器
乙酸鎳(Ni(CH3COO)2·4H2O,99.0%,分析純),硝酸鐵(Fe(NO3)3·9H2O,98.5%,分析純),氫氧化鈉(NaOH,96.0%,分析純),水合肼(N2H4·H2O,80%,分析純),聚乙烯吡咯烷酮((C6H9NO)n,PVP,K30,M r=10 000),所有試劑使用前均未作進一步純化處理;試驗用水來自本實驗室自制的二次蒸餾水。采用Advance-D8型X射線粉末衍射(XRD)儀(德國Bruker公司)分析產物樣品的物相,測試條件為0.154 06 nm銅靶Kα射線,電壓和電流分別為35 kV、35 mA;產物的形貌和粒徑大小分析,在H-800型透射電子顯微鏡(TEM)(日本Hitachi公司)上完成。
1.2 雙金屬FeNi3催化劑的合成
稱取0.200 0 g PVP和2.540 0 g四水乙酸鎳先后溶于60 m L蒸餾水中,常溫下攪拌30 min,得均勻綠色透明溶液,再加入適量的NaOH固體,攪拌使其完全溶解;然后,加入10 m L水合肼,攪拌均勻,按照n(Fe)∶n(Ni)=1∶3的比例,加入相應量的硝酸鐵,攪拌,充分混合。將混合溶液轉移至100 m L聚四氟乙烯襯里的高壓反應釜中,填充率為80%,于160℃下靜態水熱反應8 h。反應完畢,冷至室溫,傾析,取出黑色固體產物,用蒸餾水和乙醇依次洗滌3~5次,然后置于60℃下真空干燥6 h,即可獲得黑色FeNi3粉末。相同操作,改變PVP加入量、NaOH的濃度等條件,同樣可研究這些因素對產物物相和形貌的影響。
1.3 FeNi3催化劑活性的評價方法
在一定濃度的NaBH4溶液中,加入NaOH以維持適當堿性,然后加入不同類型、不同質量的催化劑(FeNi3或Ni),分別考察各反應條件下單位時間內的水解產氫量,以評價催化劑的催化能力。選用適當容積的三口燒瓶,中口加料,其余兩個口分別安裝溫度計和排水集氣裝置,燒瓶置于恒溫水浴中以保持溫度恒定,用防水式磁力攪拌器對反應液進行擾動。將一定量催化劑、適量的NaBH4堿性水溶液依次放入燒瓶,水解反應發生后,間隔計時,并記錄產氫氣的體積。
2 結果與討論
2.1 產物的物相表征
按照n(Fe)∶n(Ni)=1∶3的比例,配制Ni2+濃度為0.1 mol/L的混合金屬離子溶液,調整混合液的NaOH濃度為4 mol/L,控制PVP添加量為0.034 g/m L,在160℃水熱溫度條件下,反應8 h,所得產物的XRD測試結果如圖1所示。分析圖1發現:該圖與國際粉末衍射標準聯合會(JCPDS)公布的No.38-0419的PDF數據能夠很好地相一致,即在2θ衍射角為44.28°、51.72°和75.82°這3個位置分別出現了FeNi3物相的(111)、(200)和(220)晶面,其空間群相應為Pm-3m[221],立方相結構,晶胞參數為0.354 5 nm×0.354 5 nm×0.354 5 nm(90°×90°×90°)。圖譜中未見其他雜峰,表明沒有其他雜質出現,且FeNi3物相的純度較高,同時也證實了兩種金屬被還原后,形成了雙金屬化合物晶體。相同操作下,改變試驗條件后,所得產物的XRD圖譜均與此類似,相應圖譜省略。
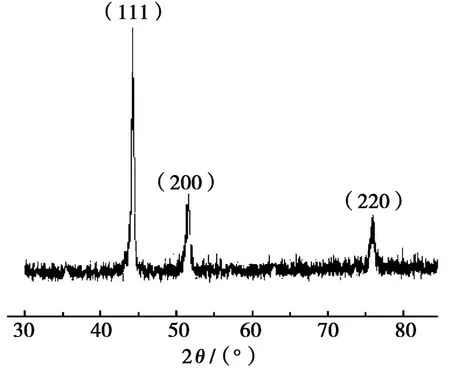
圖1 溫度160℃、反應8 h,所得FeNi3的XRD圖譜
2.2 產物形貌
2.2.1 PVP對產物形貌的影響
為了考察PVP的加入及其添加量(M)對產物形貌的影響,本文通過改變水熱合成溶液體系中PVP的濃度大小,對所得產物進行TEM觀察和分析,從而評判了PVP對產物形貌的調控作用。圖2表示:當水熱時間8 h,反應溫度160℃,n(Ni)∶n(Fe)=3∶1,Ni濃度0.1 mol/L,且NaOH濃度為4 mol/L時,控制PVP添加量分別為0 g/m L、0.017 g/m L、0.034 g/mL時,所得FeNi3產物微粒的TEM圖。

圖2 160℃下,反應時間8 h,PVP添加量(M)不同時,產物FeNi3的TEM圖
當不加入PVP(濃度為0 g/m L)時,產物FeNi3的外形如圖2a所示,產物微粒呈不規則的短棒狀(A-1),它由許多細小顆粒以串鏈狀相互壘積、銜接而成,棒長約200 nm,直徑約20 nm。保持其他反應條件不變,加入0.017 g/m L PVP時,短棒狀產物逐漸收縮聚集成團,如圖2b所示,出現了多邊形結構的規則顆粒(B-2),但顆粒間界面模糊,團聚較多,分散性不好,顆粒大小不一,而且,還出現了六角片狀(B-3)的規則結構,雖然仍可看到有部分短棒狀結構存在(B-1),不過其數量已經變得很少,且棒徑變小。當PVP加入量達到0.034 g/m L時,產物形貌逐漸清晰(見圖2c),顆粒感增強,有明顯棱角,形成平均粒徑約為50 nm的以菱形片狀(C-1)為主的微納米顆粒,仍殘留很少量的不規則結構(C-2),未能形成多邊形顆粒,這可能是由于反應時間過短或反應溫度不足而致。
2.2.2 NaOH濃度對產物形貌的影響
保持反應溫度160℃,反應時間8 h,n(Ni)∶n(Fe)=3∶1,Ni2+濃度0.1 mol/L,且PVP加入量維持在0.034 g/m L,調節NaOH的濃度(N)分別為0.5 mol/L、2.0 mol/L、4.0 mol/L,圖3展示了相應條件下所得FeNi3產物的TEM測試結果。

圖3 NaOH濃度(N)不同時所得FeNi3的TEM圖
從圖3可以看出:NaOH濃度不同,產物的形貌差異很大。當NaOH濃度為0.5 mol/L時,產物的TEM圖如圖3a所示,此時產物類似于小球狀結構,單體顆粒粒徑很小,約10 nm,表面粗糙,互相黏結,團聚現象非常嚴重。圖3b則表示NaOH濃度為2.0 mol/L時所得產物的TEM圖,此時產物的形貌發生了很大變化,顆粒變得規則有序,粒徑增大,大部分產物微粒已經開始向規則多邊形(b-1)轉變,雖有團聚現象,但已不像圖3a那樣嚴重。當NaOH濃度增大至4.0 mol/L時(見圖3c),產物形貌進一步明晰,顆粒大小趨于一致,粒徑均約30 nm,呈微納米菱形片狀(c-1),幾乎無團聚,分散性顯著改善。
關于雙金屬化合物FeNi3特殊形貌的形成機理,本文試作如下解釋:FeNi3雙金屬晶體特殊形貌的形成,主要因晶體沿著某一晶面的定向生長所致。外在工藝條件,如PVP、NaOH、反應溫度和時間等是影響晶體定向生長的重要因素。在FeNi3雙金屬晶體制備過程中,主要涉及到如下反應:
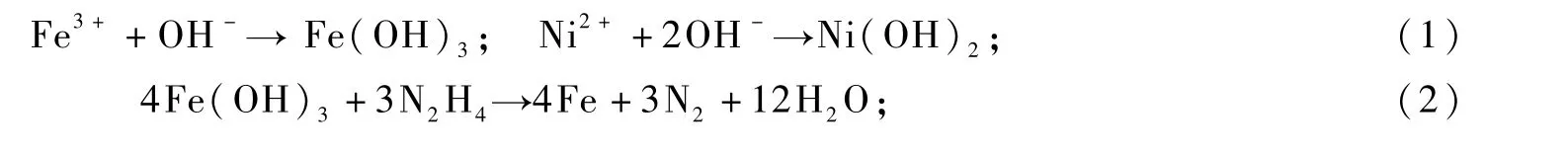
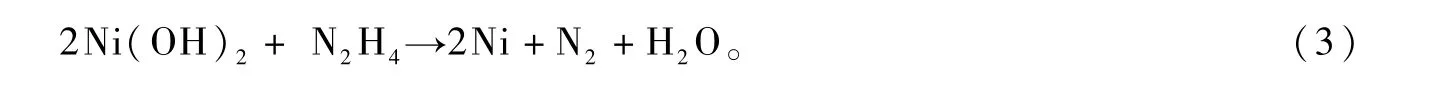
在堿性溶液中,Fe3+、Ni2+首先與OH-結合,形成基于Fe(OH)3和Ni(OH)2的雙電層結構膠體離子,使得溶液中的游離態金屬離子濃度下降,從而使還原反應的速率受到有效控制,有利于初生態晶粒的有序、定向生長[9]。另外,PVP分子中的O和N原子能夠提供孤電子對,與金屬離子形成配位鍵,也可對金屬離子起到穩定和降低濃度的作用[10];同時,PVP分子中O原子的配位能力強于N原子,這種不對稱的配位作用,使得初生態FeNi3晶粒的不同晶面受到不同程度的“封蓋”,致使各晶面生長速率不同,從而呈現不對稱的面和棱[11]。在FeNi3晶體的形核和生長過程中,OH-和PVP的協同作用,是形成菱片狀特殊形貌晶體的關鍵因素[12]。
2.3 催化活性評價
2.3.1 FeNi3催化活性的評價
NaBH4水溶液可以發生水解產生氫氣:NaBH4+2H2O→4H2+NaBO2,但在常溫常壓下該反應自發進行的速度很低,只有借助適當的催化劑,才能夠有效提升其產氫速率。前期研究結果表明:在堿性條件下,不同形貌的金屬鎳粉和非晶態合金[13]均可用作NaBH4水解的催化劑,能夠提高產氫速率。為此,通過設置與前期研究同樣的試驗條件,即溶液中NaBH4和NaOH濃度均設定為5%(質量分數)、催化劑FeNi3的加入量為0.8 mg/m L,詳細考察了5組溫度(20℃、25℃、30℃、35℃、40℃)下,NaBH4溶液水解產氫的體積和速率,具體結果如圖4所示。
分析圖4發現:在20~40℃,FeNi3的催化活性均隨溫度的升高而升高,但一定時間后反應速率不再變化。40℃溫度下,反應進行到18 min,產氫量即可達到最大值(149 m L),然而,20℃下達到最大產氫量(149 m L)需要時間則為50 min。其余3個溫度(35℃、30℃和25℃)條件下,達到最大產氫量的時間分別為25 min、27 m in和39 m in,均比40℃溫度下有不同程度的延長。在達到最大產氫量之前,5個溫度下的產氫量與時間之間,基本上均呈單調的線性上升關系。在反應開始后的前10 min之內,從高到低5個溫度下的產氫速率分別為7.3 m L/m in、5.9 m L/min、5.2 m L/m in、3.7 m L/min、2.1 m L/m in,依次下降,變化趨勢非常明顯。與20℃時的產氫速率(2.1 m L/m in)相比,25℃、30℃、35℃和40℃條件下的產氫速率分別提高了76.2%、147.6%、181.0%和247.6%。由此可見,適當提高反應溫度,可以較大幅度地提高催化劑FeNi3的催化性能。
2.3.2 不同形貌金屬鎳粉催化活性的對比評價
為了對比評價FeNi3的催化性能,本文以自制的不同形貌單質微納米鎳粉作為催化劑,采取與FeNi3催化水解NaBH4溶液相同的試驗工藝條件,同時將溫度設置為30℃,測定了相應的產氫量,并計算了產氫速率,試驗結果如圖5所示。
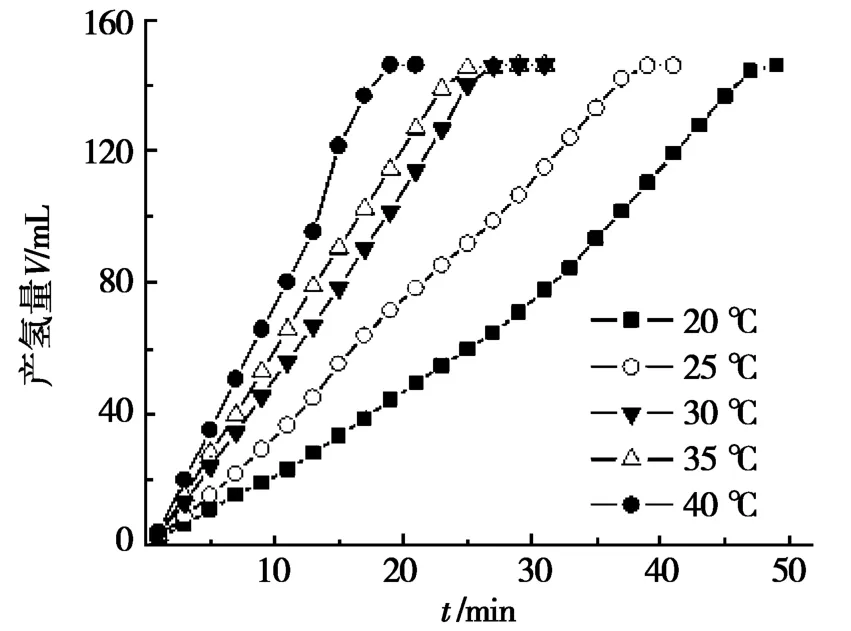
圖4 5%NaBH4、5%NaOH,不同溫度對FeNi3催化水解NaBH4產氫速率的影響
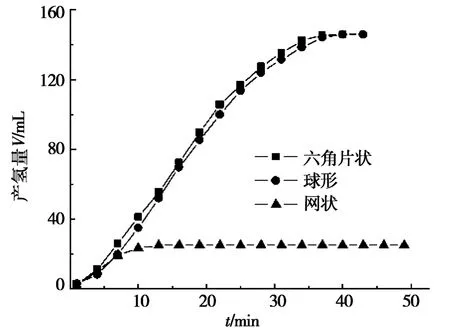
圖5 NaBH4與NaOH濃度均為5%,溫度30℃,Ni粉催化劑形貌對產氫速率的影響
圖5顯示:在反應開始后5 m in內,3種形貌的單質鎳粉催化產氫速率基本相同。反應至10 m in時,網狀微納米鎳粉催化水解產氫量達到最大值28 m L,繼續水解反應,產氫量基本不再增加。對于六角片與球形鎳粉,10 min時的產氫量并未達到最大值,繼續反應,產氫量仍持續上升,且兩者的產氫速率非常接近,當反應進行到38 m in時,兩者幾乎在同時到達最大產氫量148 m L。計算可知:在反應進行到10 min時,六角片狀、球形與網狀微納米鎳粉催化劑的平均產氫速率分別為4.1 m L/min、3.8 m L/min和2.8 m L/m in,其中以網狀鎳粉的產氫速率最低。
將圖4與圖5進行比較不難發現:在相同的催化水解反應條件下,分別采用FeNi3以及不同形貌(六角片狀、球形與網狀)的單質微納米鎳粉作為催化劑來催化水解NaBH4溶液,反應進行至10 m in時,產氫速率分別為5.2 m L/min、4.1 m L/min、3.8 m L/min和2.8 m L/min。六角片狀微納米鎳粉的產氫速率在3種單質鎳粉中為最大,雖然達到了4.1 m L/m in,但與FeNi3的產氫速率5.2 m L/m in相比,FeNi3的催化效率仍然要比六角片狀單質鎳高出26.8%。因此可以判斷,兩種類型鎳基催化劑催化能力大小的順序應為:FeNi3>六角片狀Ni>球形Ni>網狀Ni。
3 結論
以水合肼為還原劑,PVP為模板和穩定劑,采取水熱處理,成功制備出具有特殊形貌的雙金屬互化物FeNi3催化劑,并通過與單質鎳粉催化水解NaBH4的產氫速率進行比較,科學評價了FeNi3的催化能力。綜合分析結果表明:(1)所得產物為分散性好、結晶度高的微納米菱片狀雙金屬化合物FeNi3;(2)PVP和NaOH是形成菱形片的關鍵因素,較低的PVP濃度不足以對晶核形成有效包覆,不能形成明顯的棱角;NaOH為反應提供了必要的堿性環境,而且鐵鹽和鎳鹽所形成的氫氧化物所固有的內在性結構也是菱形片形成的基礎;(3)在催化NaBH4水解過程中,相同反應條件下,水解溫度同為30℃時,反應開始后10 min內,FeNi3的催化率高出單質鎳粉26.8%以上,即產物FeNi3的催化活性明顯高于金屬單質鎳粉。
[1] 陳國良.金屬間化合物材料結構研究現狀與發展[J].材料導報,2000,14(9):1-5.
[2] 陳健,鄭啟,唐亞俊,等.NiAl基金屬間化合物多晶和單晶合金的力學性能研究[J].航空材料學報,1996,16(3):1-10.
[3] 彭超群,黃伯云,賀躍輝.TiAl基合金的工藝-顯微組織-力學性能關系[J].中國有色金屬學報,2001,11(4):527-541.
[4] 朱全力,趙旭濤,趙振興,等.加氫脫硫催化劑與反應機理的研究進展[J].分子催化,2006,20(4):372-383.
[5] 羅駒華.鐵鎳納米合金的制備與表征[J].化學研究與應用,2008,20(8):1018-1020.
[6] Chen Y C,Zheng F C,Min Y L,et al.Synthesis and Properties of Magnetic FeNi3Alloyed M icro-chains Obtained by Hydrothermal Reduction[J].Solid State Sci,2012,14(7):809-813.
[7] Liu L J,Guan JG,ShiW D,et al.Facile Synthesis and Growth Mechanism of Flowerlike Ni-Fe A lloy Nanostructures[J]. J Phys Chem C,2010,114(32):13565-13570.
[8] Zhou X M,Wei X W.Single Crystalline FeNi3Dendrites:Large Scale Synthesis,Formation Mechanism,and Magnetic Properties[J].Cryst Grow th Des,2009,9(1):7-12.
[9] 莊玉貴.納米級氫氧化鎳電極材料的研究進展[J].電源技術,2007,131(5):425-428.
[10] Zhang Z T,Zhao B,Hu L M.PVP Protective Mechanism of Ultrafine Silver Powder Synthesized by Chemical Reduction Processes[J].JSolid State Chem,1996,121(1):105-110.
[11] Sui X M,Liu Y H,Shao C L,et al.Structural and Photo-luminescent Properties of ZnO Hexagonal Nanoprisms Synthesized by M icro-emulsion with Polyvinyl Pyrrolidone Served as Surfactant and Passivant[J].Chem Phy Lett,2006,424(4/6):340-344.
[12] Li F,Ding Y,Gao P X,et al.Single-crystal Hexagonal Disks and Rings of ZnO:Low Temperature,Large-scale Synthesis and Growth Mechanism[J].Angew Chem Int Ed,2004,116(39):5350-5354.
[13] 張軍,李莉莉,王修才,等.反相微乳液法制備納米NiB非晶態合金及其催化NaBH4水解制氫[J].河南科技大學學報:自然科學版,2013,34(3):91-95.
TQ423;O614
A
1672-6871(2014)05-0100-05
國家自然科學基金項目(21076063);河南省科技攻關基金項目(102102210170);洛陽市科技攻關基金項目(1101030A);洛陽市礦產資源化工重點實驗室建設基金項目(1003016A)
姚海瑞(1989-),女,河南信陽人,碩士生;張 軍(1964-),男,河南漯河人,教授,博士,碩士生導師,研究方向為無機功能材料.
2013-12-30

