1-氨丙基-3-甲基咪唑溴鹽水溶液對CO2的吸收特性
楊翠蓮,李 松,畢 崟,郭開華
(中山大學 工學院,廣東 廣州,510006)
環境與化工
1-氨丙基-3-甲基咪唑溴鹽水溶液對CO2的吸收特性
楊翠蓮,李 松,畢 崟,郭開華
(中山大學 工學院,廣東 廣州,510006)
以1-氨丙基-3-甲基咪唑溴鹽([APMim]Br)為功能型離子液體,考察了其水溶液對CO2的吸收性能。實驗結果表明, [APMim]Br水溶液的含水量(w)為65%~85%較適宜,在該含水量下,[APMim]Br水溶液對CO2具有優異的吸收-解吸特性。含水量增大可大幅提高[APMim]Br水溶液對CO2的物理吸收能力。隨壓力的增大,[APMim]Br水溶液對CO2的物理吸收量基本呈線性增長趨勢,遵循亨利定律。溫度對[APMim]Br水溶液物理吸收能力的影響顯著大于對化學吸收能力的影響。當壓力一定時,[APMim]Br水溶液對CO2的吸收-解吸范圍隨含水量的增大而變寬。[APMim]Br水溶液在同等條件下對CO2的吸收能力優于醇胺溶液。
1-氨丙基-3-甲基咪唑溴鹽;功能型離子液體;二氧化碳;吸收
天然氣作為一種高熱值、低碳環保、儲量豐富的潔凈能源,是 21世紀能源消費結構的重要組成部分。CO2是天然氣中常見的雜質氣體,它會導致設備和管道腐蝕、降低天然氣熱值,并且在天然氣液化裝置中,CO2會固化析出而堵塞管道,因此必須脫除天然氣中的CO2。
離子液體對CO2具有良好的選擇性吸收性能[1-2],該性能使離子液體在CO2吸收領域的應用引起廣泛的關注。用于吸收CO2的離子液體主要有常規離子液體和功能型離子液體。Blanchard等[1-3]發現超臨界CO2極易溶于1-丁基-3-甲基咪唑四氟硼酸鹽,他們還獲得了CO2在多種烷基咪唑離子液體中的溶解度數據。Jacquemin等[4-5]發現氣體在離子液體中的溶解度與氣體及離子液體的類型有關。近年來多個課題組研究了常規離子液體對CO2的吸收性能[6-9]。增加烷基取代鏈的長度[10-12]或在陰(陽)離子上增加氟烷基團[9]均可提高離子液體對CO2的吸收性能,且陰離子的作用大于陽離子[13-15]。
常規離子液體對CO2的吸收主要通過物理吸收,吸收性能提升的空間有限,且受壓力影響明顯,當CO2分壓較低時,常規離子液體不能對CO2進行吸收。為提高離子液體對CO2的吸收能力,可引入功能基團以提高離子液體對CO2的化學吸收能力。Bates等[16]合成并證實了氨基功能型離子液體1-(3-氨基丙基)-3-丁基咪唑氟硼酸鹽([NH2pbim][BF4])在常溫常壓下對CO2的吸收量接近理論值0.5 mol(基于每mol [NH2p-bim][BF4])。當陰離子相同時,陽離子氨基經功能化后吸收CO2的能力有較大提高[17-18],吸收量約為非氨基化離子液體的2倍。
由于功能型離子液體在吸收CO2時黏度會成倍增大,其工業應用受到一定限制。將功能型離子液體配制成水溶液,可有效改善其流動性及其對CO2的吸收性能[19-20]。Zhang等[21]研究證實了加入一定量的水可顯著改善胍鹽功能型離子液體對CO2的吸收性能。吳永良等[22-23]考察并發現了含水量(w)分別為55%和68.84%時的1-氨丙基-3-甲基咪唑溴鹽([APMim]Br) 水溶液對CO2具有優良的吸收性能。陽濤等[23]研究發現,當含水量低于60%(w)時,[APMim]Br水溶液對CO2的吸收性能急劇衰減。
本工作以[APMim]Br為功能型離子液體,考察了其水溶液對CO2的吸收性能,為其工業應用提供基礎數據。
1 實驗部分
1.1 主要試劑及儀器
[APMim]Br:純度99%,中國科學科院蘭州物理化學研究所;CO2:純度99.99%,廣州氣體公司。
利用SFY-3A型微量水分滴定儀(淄博海分儀器廠)測得[APMim]Br離子液體的殘留含水量為(4 500±300) mg/kg。
1.2 實驗系統
實驗系統是在文獻[23]報道的測試系統基礎上,將上部進水管取消,直接稱量一定量的[APMim]Br離子液體和去離子水,倒入反應釜,提高了配液的準確性。實驗系統見圖1。從圖1可看出,空氣浴提供穩定的溫度環境。反應釜整體置于空氣浴內的水浴中,用恒溫水槽控制溫度,控制溫度范圍-20~100 ℃。系統中CO2的氣量由計量手泵控制和測定。
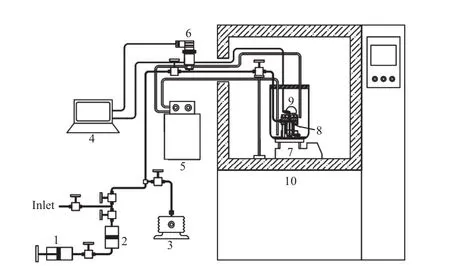
圖1 實驗系統Fig.1 Schematic diagram of experimental apparatus.
1.3 實驗方法
稱取一定量的[APMim]Br離子液體(約5 g)和水,倒入密閉反應釜內,抽真空。當系統起始溫度穩定在5 ℃時,向釜內緩慢通入CO2氣體,并在CO2吸收過程中保持壓力不變,完成等壓吸收,其間保持溫度恒定。當系統壓力平衡后,計量通入CO2氣體并計算離子液體水溶液對CO2的吸收量。此后在等容條件下升高空氣浴和水浴的溫度,進行升溫實驗,待反應釜壓力溫度平衡后,記錄系統溫度和壓力。根據釜內氣相狀態計算離子液體水溶液對CO2的吸收量。在5~75 ℃之間,每隔10 ℃測試一個吸收平衡點。完成一個等容升溫測試后,將系統再次恒溫至5 ℃,注入CO2至較高的壓力等級,重復上述等壓和等容CO2吸收平衡測試,獲得較高壓力下離子液體水溶液對CO2的吸收量數據。
2 結果與討論
2.1 [APMim]Br水溶液對CO2的吸收性能
分別測定含水量不同的[APMim]Br水溶液在不同溫度和壓力下對CO2的吸收量。實驗結果表明,當壓力較低時(0.1~0.5 MPa),[APMim]Br水溶液對CO2的吸收量已相當顯著,約為0.40~0.70 mol(基于每mol [APMim]Br),這主要來自[APMim]Br水溶液對CO2的化學吸收。隨壓力的增大,[APMim]Br水溶液對CO2的物理吸收開始顯著增強。
當含水量低于55%(w)時,即使在較高溫度(75 ℃)下,當壓力小于3.2 MPa時,[APMim]Br水溶液對CO2仍以化學吸收為主,CO2吸收量在0.37~0.40 mol之間。當含水量增至65%(w)時,[APMim]Br水溶液對CO2的物理吸收量約為化學吸收量的2倍。當含水量進一步提高至85%(w)時,在較高壓力下,[APMim]Br水溶液對CO2的吸收趨于飽和。因此,[APMim]Br水溶液的含水量(w)為65%~85%較適宜,在該含水量下,[APMim]Br水溶液對CO2具有優異的吸收-解吸特性。
2.2 含水量對[APMim]Br水溶液吸收性能的影響
不同溫度下[APMim]Br水溶液對CO2的吸收量隨含水量變化的特性曲線見圖2。由圖2可見,[APMim]Br水溶液對CO2的吸收量隨含水量增大的趨勢受壓力的影響較大。當壓力較低時,[APMim]Br水溶液對CO2的吸收主要為化學吸收,含水量對其吸收性能的影響較小,隨含水量的增大,[APMim]Br水溶液對CO2的吸收量呈緩慢增長的趨勢;當壓力較高時,[APMim]Br水溶液對CO2的吸收主要為物理吸收,隨含水量的增大,[APMim]Br水溶液對CO2的吸收量顯著增大,說明含水量增大可大幅提高[APMim]Br水溶液對CO2的物理吸收能力。
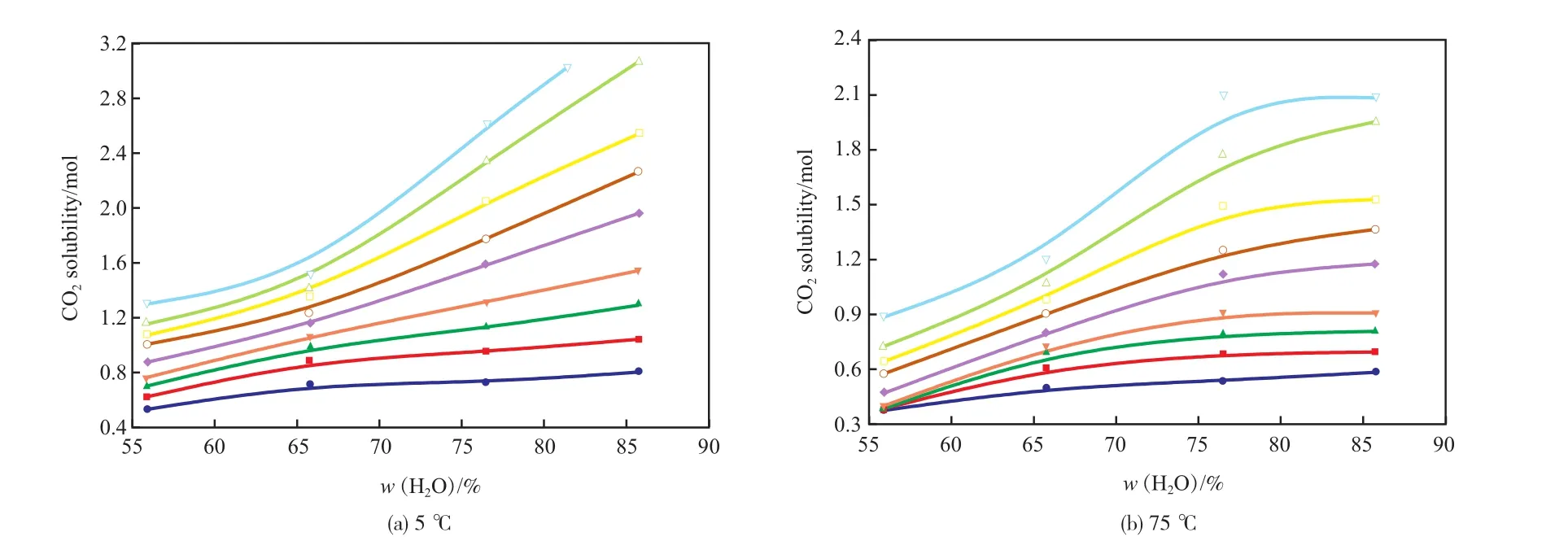
圖2 不同溫度下[APMim]Br水溶液對CO2的吸收量隨含水量變化的特性曲線Fig.2 Absorbability of CO2in the[APMim]Br aqueous solutions vs. the water content at different temperature.
在5 ℃、3.5 MPa的條件下,當含水量(w)從55%增至85%時,[APMim]Br水溶液對CO2的吸收量由1.1 mol增至3.1 mol;在75 ℃、3.5 MPa的條件下,當含水量(w)從55%增至85%時,[APMim]Br水溶液對CO2的吸收量由0.4 mol增至1.1 mol。
[APMim]Br水溶液對CO2的化學吸收量為0.50~0.65 mol。5 ℃時,含水量為85%(w)的[APMim]Br水溶液對CO2的化學吸收量比含水量為55%(w)的[APMim]Br水溶液高33%。壓力對[APMim]Br水溶液的化學吸收能力的影響可忽略,但對其物理吸收能力的影響較大。隨壓力的增大,[APMim]Br水溶液對CO2的物理吸收量基本呈線性增長趨勢,遵循亨利定律。溫度對[APMim]Br水溶液物理吸收能力的影響顯著大于對其化學吸收能力的影響。當溫度由5 ℃升至75 ℃時,[APMim]Br水溶液對CO2的化學吸收量降低約45%;[APMim]Br水溶液對CO2的物理吸收量降低71%~73%。含水量對[APMim]Br水溶液的化學和物理吸收能力都有促進作用。
不同壓力下[APMim]Br水溶液對CO2的吸收-解吸曲線見圖3。從圖3可看出,當壓力一定時,[APMim]Br水溶液對CO2的吸收-解吸范圍隨含水量的增大而增大。當壓力為1.0 MPa時,含水量為55%(w)的溶液對CO2的吸收-解吸范圍僅為0.3 mol;而含水量為85%(w)的溶液的吸收-解吸范圍則約為0.6 mol。在壓力分別為2.0,3.0,4.0 MPa時,[APMim]Br水溶液對CO2的解吸曲線表現出了同樣的特征。對比圖3a~d還可看出,含水量相同時,隨壓力的增大,[APMim]Br水溶液對CO2的吸收-解吸范圍變寬。
對比[APMim]Br水溶液與醇胺溶液的CO2吸收量[24]可知,在40 ℃、1.0 MPa條件下,[APMim]Br水溶液對CO2的吸收量較大,吸收性能優于醇胺溶液;在5~75 ℃時,[APMim]Br水溶液的CO2吸收-解吸范圍最大約為0.6 mol;而醇胺溶液在40~120 ℃時的CO2吸收-解吸范圍不大于0.5 mol。因此,[APMim]Br水溶液在同等條件下對CO2的吸收能力優于醇胺溶液,且再生溫度較低。
2.3 [APMim]Br水溶液中CO2的溶解度
通常采用亨利系數的倒數來表征CO2在[APMim]Br水溶液中的溶解度。[APMim]Br水溶液對CO2等溫吸收的亨利系數倒數見圖4。
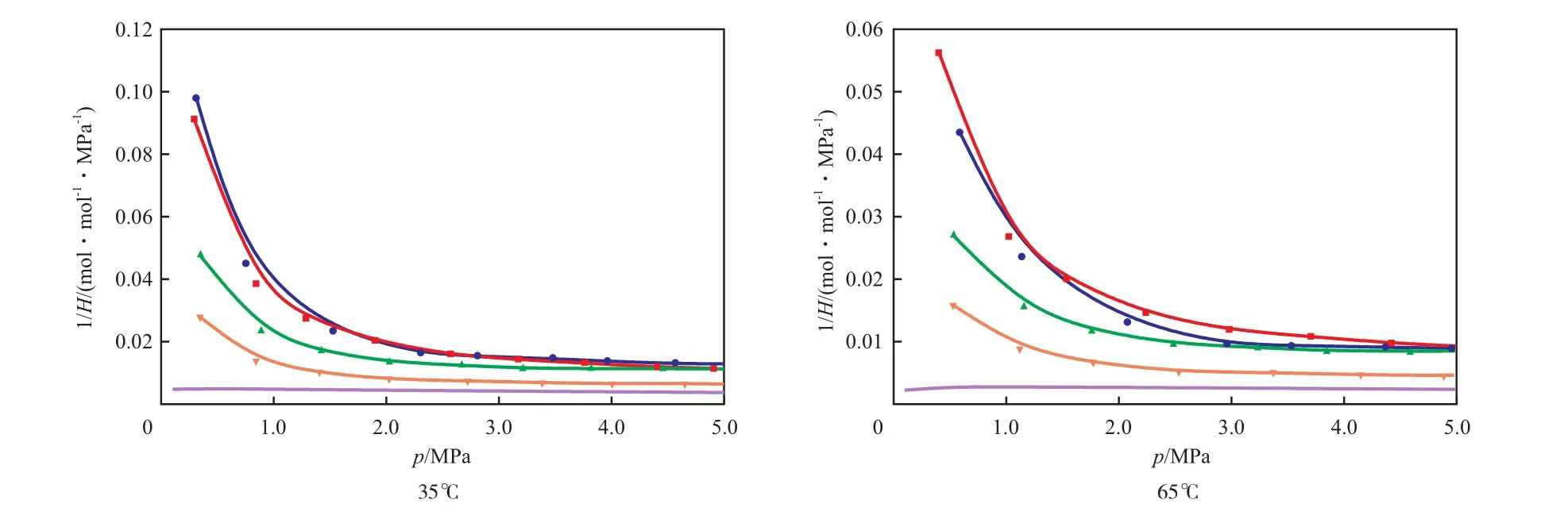
圖4 [APMim]Br水溶液對CO2等溫吸收的亨利系數倒數Fig.4 Reciprocals of Henry’s constants(H) for the isothermal absorption of CO2in the [APMim]Br aqueous solutions.
由圖4可見,CO2在純水中的溶解度很小,當純水中加入[APMim]Br后,CO2在水中的溶解度顯著增大。當壓力較低時,對比純水[25]中CO2的溶解度,CO2在[APMim]Br水溶液中的溶解度可提升10~20倍。
3 結論
1)[APMim]Br水溶液的含水量對其吸收CO2有顯著的影響。[APMim]Br水溶液的含水量(w)為65%~85%較適宜,在該含水量下,[APMim]Br水溶液對CO2具有優異的吸收-解吸特性。
2)[APMim]Br水溶液對CO2的吸收量隨含水量增大的趨勢受壓力的影響較大。含水量增大可大幅提高[APMim]Br水溶液對CO2的物理吸收能力。隨壓力的增大,[APMim]Br水溶液對CO2的物理吸收量基本呈線性增長趨勢,遵循亨利定律。溫度對[APMim]Br水溶液物理吸收能力的影響顯著大于對其化學吸收能力的影響。
3)當壓力一定時,[APMim]Br水溶液對CO2的吸收-解吸范圍隨含水量的增大而增大。含水量相同時,隨壓力的增大,[APMim]Br水溶液對CO2的吸收-解吸范圍變寬。
4)[APMim]Br水溶液在同等條件下對CO2的吸收能力優于醇胺溶液,且再生溫度較低。離子液體的加入極大提高了純水對CO2的物理吸收性能。
[1] Blanchard L A,Gu Zhiyong,Brennecke J F. High-Pressure Phase Behavior of Ionic Liquid/CO2Systems [J]. J Phys Chem,B,2001,105(12):2437 - 2444.
[2] Huang Junhua,Rüther T. Why are Ionic Liquids Attractive for CO2Absorption? An Overview[J]. Aust J Chem,2009,62(4):298 - 308.
[3] Blanchard L A,Hancu D,Beckman E J,et al. Green Processing Using Ionic Liquids and CO2[J]. Nature,1999,399(6731):28 - 29.
[4] Jacquemin J,Husson P,Majer V. Infuence of the Cation on the Solubility of CO2and H2in Ionic Liquids Based on the Bis(Trifuoromethylsulfonyl)Imide Anion[J]. J Solution Chem,2007,36(8):967 - 979.
[5] Hong G,Jacquemin J,Deetlefs M,et al. Solubility of Carbon Dioxide and Ethane in Three Ionic Liquids Based on the Bis{(Trifuoromethyl)Sulfonyl}iImide Anion[J]. Fluid Phase Equilib,2007,257(1):27 - 34.
[6] Pérez-Salado Kamps á,Tuma D,Xia Jianzhong,et al. Solubility of CO2in the Ionic Liquid [bmim][PF6][J]. J Chem Eng Data,2003,48(3):746 - 749.
[7] Husson-Borg P,Majer V,Costa Gomes M F. Solubilities of Oxygen and Carbon Dioxide in Butyl Methyl Imidazolium Tetrafluoroborate as a Function of Temperature and at Pressures Close to Atmospheric Pressure[J]. J Chem Eng Data,2003, 48(3):480 - 485.
[8] Baltus R E,Culbertson B H,Dai S,et al. Low-Pressure Solubility of Carbon Dioxide in Room-Temperature Ionic Liquids Measured with a Quartz Crystal Microbalance[J]. J Phys Chem,B,2004,108(2):721 - 727.
[9] Muldoon M J,Aki S N V K,Anderson J L,et al. Improving Carbon Dioxide Solubility in Ionic Liquids[J]. J Phys Chem,B,2007,111(30):9001 - 9009.
[10] Shariati A,Peters C J. High-Pressure Phase Equilibria of Systems with Ionic Liquids[J]. J Supercrit Fluids,2005,34(2):171 - 176.
[11] Gutkowski K I,Shariati A,Peters C J. High-Pressure Phase Behavior of the Binary Ionic Liquid System 1-Octyl-3-Methylimidazolium Tetrafuoroborate + Carbon Dioxide[J]. J Supercrit Fluids,2006,39(2):187 - 191.
[12] Shariati A,Peters C J. High-Pressure Phase Behavior of Systems with Ionic Liquids:Ⅲ. The Binary System Carbon Dioxide + 1-Hexyl-3-Methylimidazolium Hexafuorophosphate[J]. J Supercrit Fluids,2004,30(2):139 - 144.
[13] Anthony J L,Anderson J L,Maginn E J,et al. Anion Effects on Gas Solubility in Ionic Liquids[J]. J Phys Chem,B,2005,109(13):6366 - 6374.
[14] Cadena C,Anthony J L,Shah J K,et al. Why is CO2so Soluble in Imidazolium-Based Ionic Liquids?[J]. J Am Chem Soc,2004,126(16):5300 - 5308.
[15] Aki S N V K,Mellein B R,Saurer E M,et al. High-Pressure Phase Behavior of Carbon Dioxide with Imidazolium-Based Ionic Liquids[J]. J Phys Chem,B,2004,108(52):20355 - 20365.
[16] Bates E D,Mayton R D,Ntai I,et al. CO2Capture by a Task-specific Ionic Liquid[J]. J Am Chem Soc,2002,124(6):926 - 927.
[17] Sanchez L M G,Meindersma G W,de Haan A B. Solvent Properties of Functionalized Ionic Liquids for CO2Absorption[J]. Chem Eng Res Des,2007,85(A1):31 - 39.
[18] Zhang Yi,Wu Zaikun,Chen Shaoli,et al. CO2Capture by Imidazolate-Based Ionic Liquids:Effect of Functionalized Cation and Dication[J]. Ind Eng Chem Res,2013,52(18):6069 - 6075.
[19] Goodrich B F,de la Fuente J C,Gurkan B E,et al. Effect of Water and Temperature on Absorption of CO2by Amine-Functionalized Anion-Tethered Ionic Liquids[J]. J Phys Chem,B,2011,115(29):9140 - 9150.
[20] Romanos G E,Zubeir L F,Likodimos V,et al. Enhanced CO2Capture in Binary Mixtures of 1-Alkyl-3-Methylimidazolium Tricyanomethanide Ionic Liquids with Water[J]. J Phys Chem,B,2013,117(40):12234 - 12251.
[21] Zhang Feng,Fang Chenggang,Wu Youting,et al. Absorption of CO2in the Aqueous Solutions of Functionalized Ionic Liquids and MDEA[J]. Chem Eng J,2010,160(2):691 - 697.
[22] 吳永良,焦真,王冠楠,等. 用于CO2吸收的離子液體的合成,表征及吸收性能[J]. 精細化工,2007,24(4):324 -327.
[23] 陽濤,畢崟,郭開華. 1-氨丙基-3-甲基咪唑溴功能型離子液體對CO2的吸收性能[J]. 化工學報,2012,63(10):3152 - 3157.
[24] 劉延鑫,董立戶,密建國,等. 醇胺分子結構及其CO2捕集能力[J]. 中國科學: 化學,2012,42(3):291 - 296.
[25] Duan Zhenhao, Sun Rui. An Improved Model Calculating CO2Solubility in Pure Water and Aqueous NaCl Solutions from 273 to 533 K and from 0 to 2000 Bar[J]. Chem Geol,2003,193(3/4):257 - 271.
(編輯 鄧曉音)
Absorption Property of 1-Aminopropyl-3-Methylimidazolium Bromide Aqueous Solutions to Carbon Dioxide
Yang Cuilian,Li Song,Bi Yin,Guo Kaihua
(School of Engineering,Sun Yat-Sen University,Guangzhou Guangdong 510006,China)
The absorption property of the aqueous solutions of a functional ionic liquid,1-aminopropyl-3-methylimidazolium bromide([APMim]Br),to CO2was investigated. The results indicated that when the water mass fraction was in the range of 65%-85%,the aqueous solutions had excellent absorption-desorption capacity to CO2. The physical absorption capacity of the solutions to CO2could increase evidently when the water content increased. In the solution systems,the amount of CO2physically absorbed by the [APMim]Br solutions linearly correlated to the pressure rise, which accorded with the Henry’s law. Temperature had remarkable effect on the physical absorption capacity of the [APMim]Br solutions, much greater than that on their chemical absorption capacity. Under a certain pressure,the range of the CO2absorption-desorption in the [APMim]Br solutions widened with increasing the water content. The absorption capacity of the [APMim]Br solutions to CO2is superior to that of alkanolamine solutions under the same conditions.
1-aminopropyl-3-methylimidazolium bromide;functional ionic liquid;carbon dioxide;absorption
1000 - 8144(2014)12 - 1433 - 06
TQ 028.15
A
2014 - 06 - 18;[修改稿日期] 2014 - 09 - 09。
楊翠蓮(1987—),女,山東省菏澤市人,碩士生。聯系人:郭開華,電話 020 - 39332893,電郵 guokh120@163.com。
國家自然科學基金資助項目(51076169);廣東省自然科學基金重點項目(9251027501000001)。

