一株泡葉藻降解菌的篩選及其發酵條件優化
劉露,公春艷,趙宏濤,王鵬,李園園
一株泡葉藻降解菌的篩選及其發酵條件優化
劉露,公春艷,趙宏濤,王鵬,李園園*
青島明月藍海生物科技有限公司,山東青島266400
為了利用微生物降解泡葉藻,本研究以泡葉藻為唯一營養物質從土壤中篩選到一株對泡葉藻有明顯降解效果的菌株,編號2-2。根據其形態學特征、生理生化特性和16S rDNA序列分析鑒定該菌株為巨大芽孢桿菌(Bacillus megaterium)。對菌株的發酵條件進行了優化,最優發酵培養基為:泡葉藻30 g/L、酵母粉6 g/L和葡萄糖4 g/L。搖瓶最佳培養條件為:250 mL三角瓶裝液量50 mL,起始pH 7.5,發酵溫度32℃,發酵48 h有效活菌數為2.4×109CFU/mL。并對發酵液酶活進行了測定,其中纖維素酶活為47.7 U/mL,蛋白酶活為3.4 U/mL,海藻膠裂解酶活為0.721 U/mL。研究結果表明巨大芽孢桿菌2-2同時具有海藻膠裂解酶、蛋白酶和纖維素酶活性,具有良好的應用前景。
泡葉藻降解菌;巨大芽孢桿菌;海藻膠裂解酶;發酵條件
我國海洋資源豐富,海藻加工及其高值化利用成為我國海洋資源綜合利用的重要領域。海藻生長在海洋的環境中,造就了海藻細胞的結構及其化學組成不同于陸地植物。海藻富含糖、蛋白質、脂肪、無機鹽、各種維生素和微量元素[1]。海藻具有促進早期種子萌發與成苗、改善作物形態與產量、提高作物的抗性和延長采收后易腐產品貯存期的作用。海藻除了具有促進作物生長的特性外,還會影響土壤物理、化學和生物特性,進而影響作物的生長[2]。泡葉藻是泡葉藻屬的一種海藻,是比較好的生產海藻肥的原料。
泡葉藻降解的方法有化學法、物理法和生物發酵法。目前最常用的方法是化學提取法,但采用化學提取法最大的劣勢在于強堿高溫會破壞海藻內源物質的活性。生物發酵法是利用微生物在以海藻等為養分的代謝過程中產生的多種酶,將構成海藻的大分子物質降解成小分子、水溶性的物質,最大限度完整地保留了海藻中的生物活性物質和營養物質。以生物降解取代傳統的化學降解已成趨勢,因此海藻的微生物降解有著深遠的理論意義和應用價值。
自1968年Kaiser[3]等首次報道分離自梭菌Clostridium alginolyticum的胞外褐藻膠裂解酶以來,對褐藻膠裂解酶的研究取得了長足的發展。目前,關于生物法海藻降解的研究一般是集中于海藻膠分解菌的篩選、鑒定和海藻膠裂解酶的克隆與表達。能夠降解海藻膠的菌株有很多,主要有黃桿菌(Flavobacterium multivolum)[4]、弧菌(Vibrio sp.)[5]、白蟻菌屬(Isoptericola)[6]、假單胞菌(Pseudomonalginovora)[7]和芽孢桿菌(Bacillus circulans)[8]等。泡葉藻內除含有海藻膠外,還有糖、蛋白質、脂肪、無機鹽等組分,然而對泡葉藻的生物降解的研究卻很少。
本研究篩選出一株降解泡葉藻的細菌,根據其形態學特征、生理生化特性和16S rDNA序列分析對其進行鑒定,并對發酵條件進行優化,同時研究發酵液中纖維素酶、蛋白酶和海藻膠裂解酶的酶活。
1 材料與方法
1.1材料
1.1.1 樣品來源土樣:采自青島膠南蔬菜大棚。
1.1.2 培養基富集培養基與初篩培養基:泡葉藻10 g,瓊脂15 g,水1 L,pH 7.0;復篩培養基:泡葉藻10 g,水1 L,pH 7.0;種子培養基:泡葉藻5 g,酵母粉5 g,葡萄糖5 g,水1 L,pH 7.0;發酵培養基:泡葉藻10 g,水1 L,pH 7.0。
1.2泡葉藻降解菌株的篩選
將連續富集3代的培養液用無菌水按照10-3到10-5進行梯度稀釋,吸取0.1 mL的稀釋液涂布到初篩培養基平板上。32℃恒溫培養72 h后,觀察菌落形態,選取生長良好的菌株進行劃線純化。
1.3菌株2-2的鑒定
1.3.1 形態學特征與生理生化特征鑒定將菌株2-2涂布于初篩培養基平板上,32℃培養48 h,觀察細胞形態和菌落特征,部分生理生化鑒定參照《伯杰細菌鑒定手冊》[9]。
1.3.2 16S rDNA鑒定基因組總DNA提取后,利用正向引物AGAGTTTGATCCTGGCTCAG和反向引物ACGGCTACCTTGTTACGACT進行16S rDNA全序列擴增,PCR產物進行1%瓊脂糖凝膠電泳,檢測擴增效果。將克隆后的樣品送至華大基因進行測序。
將所得序列與GenBank數據庫中序列進行Blast分析比對,并選取相似性較高的菌株,利用Mega 4.0軟件采取Neighbor Joining法構建系統進化樹。
1.4酶活力的測定
1.4.1 纖維素酶活的測定采用DNS法測定纖維素酶活,發酵液3000 r/min離心10 min,離心后的上清液即為粗酶液。取3支大試管,1支作為空白對照,其余2支作為平行樣品管。樣品管中加1.0 mL原樣酶液,然后3支試管中分別加入4.0 mL已預熱至60℃的CMC緩沖液,在60℃水浴鍋中反應20 min取出,每管立即加入3.0 mL DNS顯色液,搖勻后在對照管中再加入1.0 mL原樣酶液。將3支試管放入沸水浴中,顯色5 min后立即取出,流水冷卻,用分光光度計于490 nm處測其OD值。根據葡萄糖標準曲線計算出產生的葡萄糖量。
酶活力單位:1 mL原樣酶液,1 min產生1 μg葡萄糖定義為1個酶活力單位(U)。
U=k×(m1-m0)/20,其中k表示樣品稀釋倍數;m1表示樣品葡萄糖量,單位μg;m0表示對照葡萄糖量,單位μg;20表示酶與底物反應時間,單位min。
1.4.2 蛋白酶活的測定酶活力單位:1 g固體酶粉(或1 mL液體酶),在一定溫度和pH條件下,1 min水解酪素產生1 μg酪氨酸為1個酶活力單位。
L-酪氨酸標準曲線及酶活測定方法參照QB/T 1803-1993[10]。
1.4.3 海藻膠裂解酶活的測定酶活測定方法參照Preiss方法[11]。取0.9 mL 3g/L海藻酸鈉(3 g海藻酸鈉溶于1L 100 mmol/L pH6.0磷酸鹽緩沖液),加入0.1 mL酶液,40℃保溫15 min,以滅活酶液(100℃5 min)作空白,測定反應體系在235 nm的光吸收值。酶活力單位(U)定義為:在以上條件下,使每分鐘光吸收值增加0.1的酶量為1個酶活力單位。
1.5發酵條件優化
1.5.1 碳源對菌株發酵的影響發酵培養基中添加10 g/L泡葉藻,另外分別添加5 g/L葡萄糖、麥芽糖、蔗糖、果糖、可溶性淀粉和玉米淀粉,初始初始pH 7.0,32℃搖瓶發酵培養,48 h后測定發酵液中的活菌數量以確定最佳碳源。
1.5.2 氮源對菌株發酵的影響發酵培養基中添加10 g/L泡葉藻,5 g/L葡萄糖,另外分別添加5 g/L酵母粉、牛肉膏、硫酸銨、蛋白胨和尿素,初始初始pH 7.0,32℃搖瓶發酵培養,48 h后測定發酵液中的活菌數量以確定最佳氮源。
1.5.3 泡葉藻添加量對菌株發酵的影響泡葉藻含量分別為0 g/L、10 g/L、20 g/L、30 g/L、40 g/L和50 g/L,另外加入5 g/L葡萄糖和5 g/L酵母粉,初始初始pH 7.0,溫度32℃,裝液量為250 mL三角瓶裝50 mL培養基,發酵時間48 h。
1.5.4 初始pH對菌株2-2的影響分別選擇初始pH 5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5和9.0,其他發酵條件為:溫度32℃,裝液量為250 mL三角瓶裝50 mL培養基,發酵時間48 h。
1.5.5 發酵溫度對菌株2-2的影響發酵溫度選擇27℃、29℃、31℃、32℃、33℃、35℃和37℃,初始pH 7.0.裝液量為250 mL三角瓶裝50 mL培養基,發酵時間48 h。
1.5.6 裝液量對菌株2-2的影響在250 mL三角瓶中裝液量分別為25、50、75、100和125 mL,發酵溫度為32℃,初始pH 7.0,發酵時間48 h。
2 結果與分析
2.1菌株分離篩選
通過富集培養,從土壤中篩選出5株能在以1%泡葉藻為唯一營養物質的平板上快速生長的菌株,挑取單菌落進行搖瓶復篩,對生長速度及菌數進行比較。結果表明,菌株2-2在1%泡葉藻培養基中生長穩定且菌數較高。如圖1所示,1%泡葉藻液體培養基中,培養40 h后泡葉藻細胞細胞壁被降解,故選擇2-2作為下一步研究的菌株。

圖1 泡葉藻降解前后變化Fig.1 Change of Ascophyllum nodosum degradated by strain 2-2
2.2菌株2-2鑒定
2.2.1 形態學特征菌株2-2在初篩平板上培養48 h后,菌落呈圓形,乳白色,不透明,邊緣整齊,表面光滑濕潤,隆起。菌株2-2為桿狀,鏈狀生長,有芽孢,芽孢端生,無鞭毛,革蘭氏染色陽性。
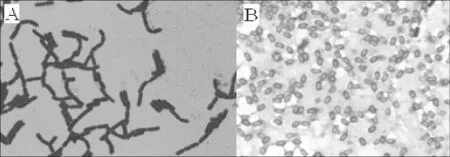
圖2 菌株2-2的光學顯微鏡圖Fig.2 The morphology of strain 2-2 under light microscope
2.2.2生理生化特性菌株2-2的生理生化結果如表1所示。
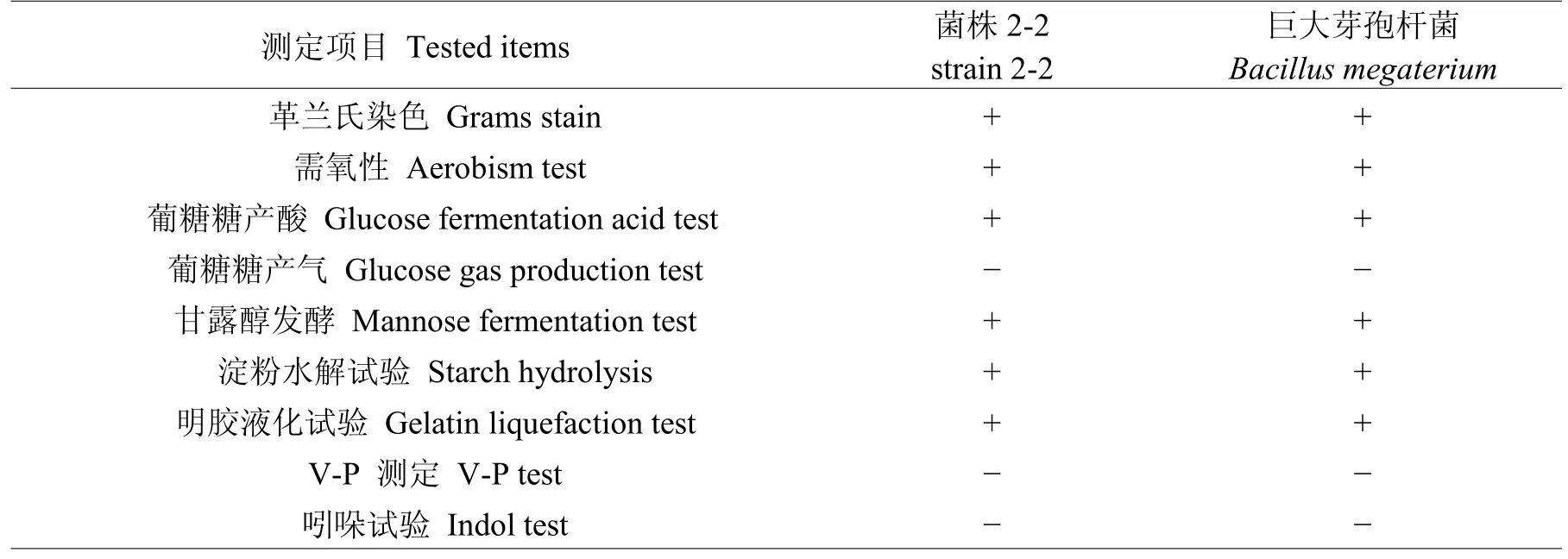
表1 菌株2-2的主要生理生化特征Table 1 The main physiological and chemical characteristics of strain 2-2
2.2.3 16S rDNA基因序列及系統發育樹分析測序得到菌株2-2的16S rDNA基因序列含有1396 bp。系統發育樹表明(圖3),菌株2-2與巨大芽孢桿菌(Bacillus megaterium)親緣關系最近。同時結合菌株的形態學特征和生理生化特性,將其歸類為芽孢桿菌屬,巨大芽孢桿菌。
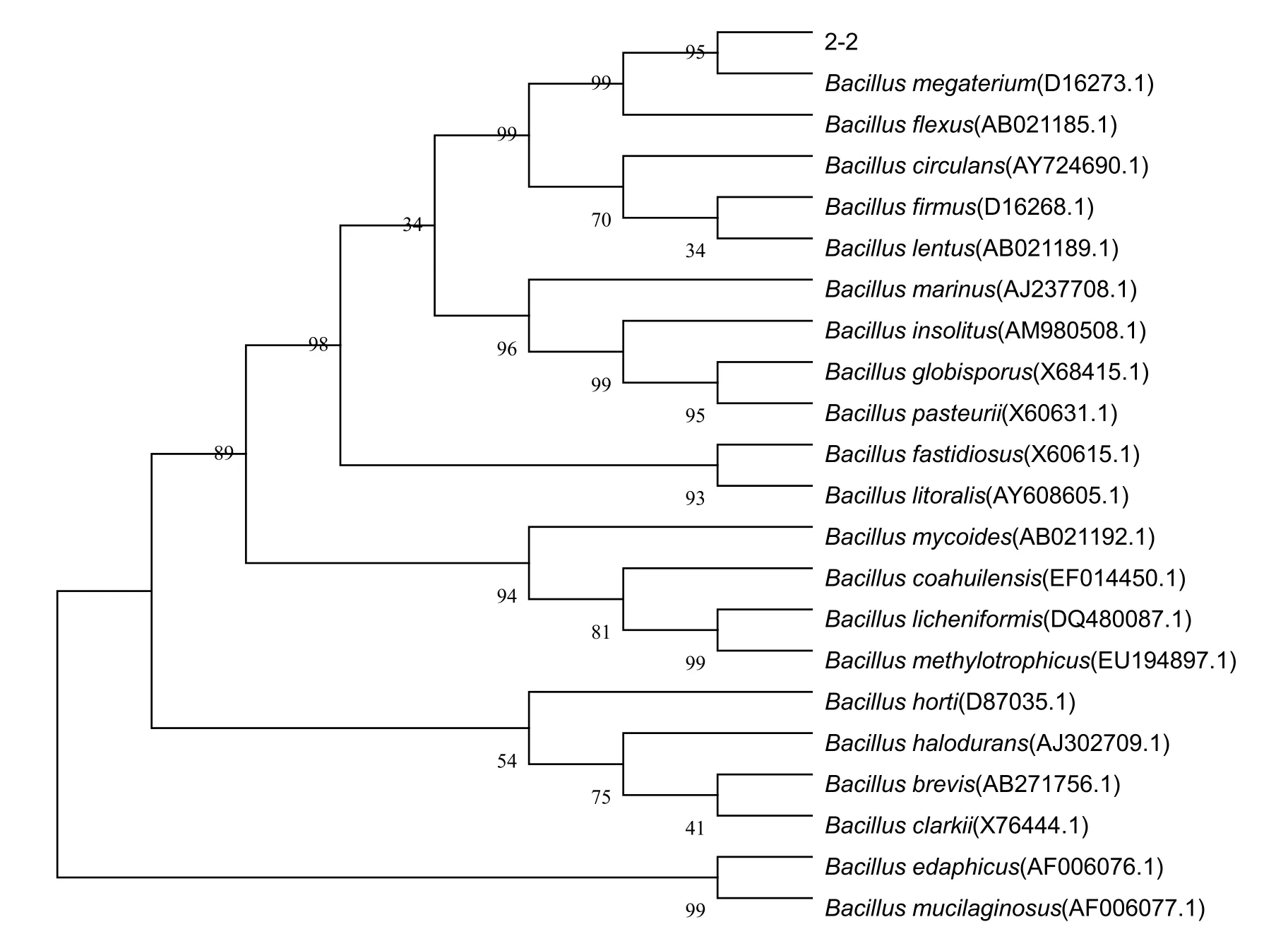
圖3 菌株2-2與相關菌株的系統發育樹Fig.3 The phylogenetic tree of strain 2-2
2.3發酵條件優化
2.3.1 碳源對菌株發酵的影響主要研究了不同碳源對菌株發酵的影響,研究表明,碳源選用葡萄糖時,菌數最高,在此基礎上,進一步研究了不同濃度的葡萄糖對菌株產酶的影響,當葡萄糖濃度為4 g/L時,纖維素酶和海藻膠裂解酶的酶活最高,過多的葡萄糖會使菌數增加,但不利于誘導酶的分泌。
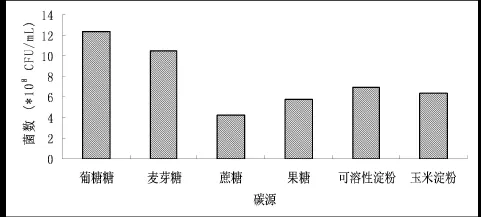
圖4 不同碳源對菌株發酵的影響Fig.4 Effect of different carbon sources on the number of fermentation broth

表2 葡糖糖濃度對菌數和酶活的影響Table 2 Effect of different concentration of glucose on the number of fermentation broth and enzyme activity
2.3.2 氮源對菌株發酵的影響氮源是微生物生長和代謝所需營養物質的重要來源,也是構成酶的重要成分。本文除添加泡葉藻和碳源外,選取無機氮源和有機氮源進行比較。結果顯示,選用酵母粉為氮源時,菌株菌數最高。進一步研究了不同濃度的酵母粉對菌株產酶的影響,當酵母粉濃度為6 g/L時,蛋白酶和海藻膠裂解酶的酶活最高,過多的酵母粉會使菌數增加,但不利于蛋白酶和海藻膠裂解酶的分泌。

圖5 不同氮源對菌株發酵的影響Fig.5 Effect of different nitrogen sources on the number of fermentation broth
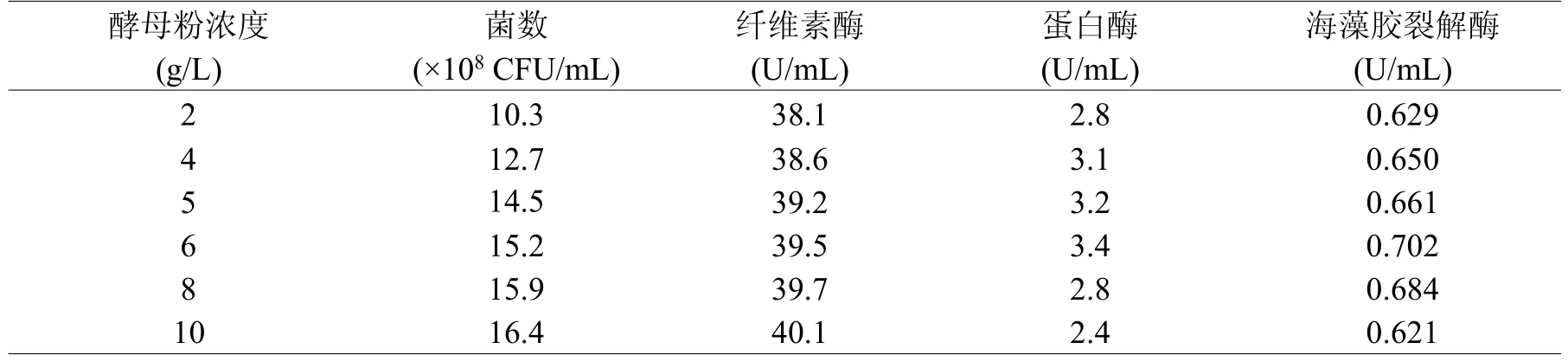
表3 酵母粉濃度對菌數和酶活的影響Table 3 Effect of different concentration of yeast extract on fermentation and enzyme activity
2.3.3 泡葉藻添加量對菌株發酵的影響泡葉藻含量分別為0 g/L、10 g/L、20 g/L、30 g/L、40 g/L和50 g/L,另外加入5 g/L葡萄糖和5 g/L酵母粉,發酵48 h后,已完全產生芽孢。菌數如圖所示。在泡葉藻添加量為30 g/L時,菌數最高,生長狀況最好。

圖6 泡葉藻添加量對菌株發酵的影響Fig.6 Effect of different concentration of ascophyllum nodosum on the number of fermentation broth
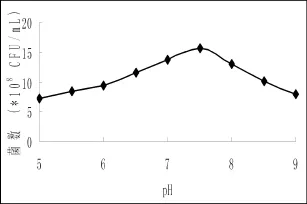
圖7 pH對菌株發酵的影響Fig.7 Effect of different pH on the number of fermentation broth
2.3.4 初始pH對菌株2-2的影響培養基初始pH直接影響著菌體細胞的通透性、穩定性以及代謝產物酶系的活性,而且通過影響培養基中營養物質的離子化程度,間接影響著微生物對營養物質的吸收。研究顯示,菌株2-2生長、產酶最適pH為7.5,這與海藻膠裂解酶的適宜pH均為6-8相一致[12]。
2.3.5 發酵溫度對菌株2-2的影響菌體細胞的生長及酶的合成是由一系列嚴格有序的生化反應組成,而生化反應受溫度影響較大,所以溫度對菌體細胞的生長和產酶具有顯著的影響。將菌株在不同溫度下進行發酵培養,結果顯示,菌株2-2的最佳培養溫度是32℃。
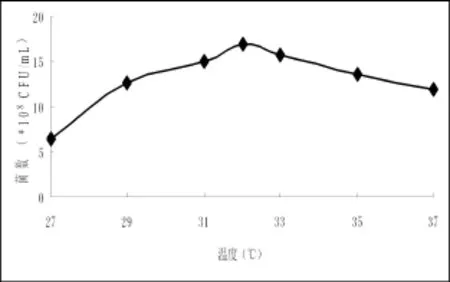
圖8 溫度對菌株發酵的影響Fig.8 Effect of different fermentation temperature on the number of fermentation broth
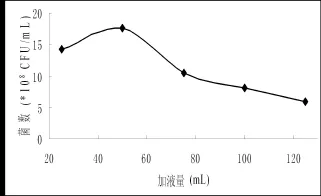
圖9 加液量對菌株發酵的影響Fig.9 Effect of different liquid volume on the number of fermentation broth
2.3.6 裝液量對菌株2-2的影響裝液量是制約菌種生長及產酶的一個重要因素。裝液量過少,水分易揮發,過大則溶氧降低,影響菌體生長,導致產酶下降。于在250 mL三角瓶中分別加入25、50、75、100、125 mL發酵培養基,研究裝液量對菌株2-2的影響,實驗結果表明,裝液量為50 mL時,菌體生長狀況最好。
2.4酶活力測定
泡葉藻內含有39.8~45%的海藻膠和其他碳水化合物、6~7%的纖維素和5~6%的蛋白質,故本研究通過測定發酵液的海藻膠裂解酶、纖維素酶和蛋白酶的酶活作為衡量菌株活性的標準。
初始發酵培養基泡葉藻10 g/L,pH 7.0,32℃培養時,48 h后,菌數為8.2×107CFU/mL纖維素酶活為12 U/mL,蛋白酶活為0.4 U/mL,海藻膠裂解酶活為0.0047 U/mL。調節發酵配方后,泡葉藻30 g/L,葡萄糖4 g/L,酵母粉6 g/L,pH 7.5,48 h后,菌數為2.4×109CFU/mL,纖維素酶活為47.7 U/mL,蛋白酶活為3.4 U/mL,海藻膠裂解酶活為0.721 U/mL,酶活均有明顯提高。
3 討論
本研究以泡葉藻為唯一營養物質,從土樣中篩選出一株能降解泡葉藻的菌株2-2,泡葉藻組織經菌株2-2發酵降解后有明顯的變化,細胞壁破裂。通過形態特征,生理生化特征及16s rDNA序列分析對菌株2-2進行種屬鑒定,將其鑒定為巨大芽孢桿菌。
目前關于海藻降解的研究一般是集中于海藻膠的降解,如詹冬梅等[13]、劉玉佩等[14]和湯海青等[15]通過以海藻酸鈉為唯一碳源篩選出具有海藻膠裂解酶活性的菌株,本研究以泡葉藻勻漿為唯一營養物質,泡葉藻內含有菌株生長所需要的碳源、氮源及無機鹽,篩選出的菌具有海藻膠裂解酶活性,同用Preiss方法檢測海藻膠裂解酶活性,菌株2-2的酶活性與以上篩選出的酶活性相當。此外菌株2-2還具有纖維素酶活性和蛋白質酶活,纖維素酶活性比沈雪亮[16]、李振紅等[17]篩選的纖維素降解菌的酶活稍高。蛋白酶活與已報道的高產酶菌株酶活力還有一定的差距[18-19],可以通過誘變育種等手段進行改造,提高蛋白酶活。菌株2-2有海藻膠裂解酶活、纖維素酶活和蛋白酶活,這為降解泡葉藻奠定了基礎。
菌株2-2為巨大芽孢桿菌,但未見該種具有海藻膠裂解酶活性的報道。說明本研究分離到了比較新穎的資源菌株。另外,有關巨大芽孢桿菌研究內容包括污水處理、農藥降解、生物堆肥、微生物肥料等,近年來關于巨大芽孢桿菌用于土壤解磷的研究日益增多[20-21]。本研究中篩選到的巨大芽孢桿菌是否土壤解磷的功效,有待進一步的研究。
研究表明,菌株2-2可以通過發酵降解泡葉藻,以海藻為養分的代謝過程中產生多種酶,最大限度的保證了海藻內的生物活性物質和營養物質。在作為海藻肥料時,將具有良好的應用前景。目前對生物法降解海藻的研究還處于試驗階段,發酵工藝及生物法降解的海藻肥料的應用效果需進行深入研究,為大工業生產及產業化應用奠定基礎。
[1]汪家銘.綠色有機肥海藻肥生產應用及發展建議[J].化工管理,2010(10):46-52
[2]周二峰,宋秀紅,胡國強,等.天然有機海藻肥的功效及應用前景[J].安徽農業科學,2007,35(9):2671-2671
[3]Kaiser P,Leborgne L,Hardisso C,et al.An exocellular alginate-lyase isolated from Clostridium alginolyticum cultures[J].Comptes Rendus Hebdomadaires Des Seances De LAcademie Des Sciences Serie D,1968,267(3):376-379
[4]Takeuchi T,Murata K,Kusakabe I.A method for depolymerization of alginate using the enzyme system of Flavobacterium multivolum[J].Journal of the Japanese Society for Food Science and Technology,1994,41(7):505-511
[5]Tseng C H,Yamaguchi K,Kitamikado M.Two types of alginate lyase from a marine bacteriumVibrio sp.AL-9[J]. Bulletin of the Japanese Society of Scientific Fisheries,1992,58(4):743-749
[6]魏丹,竇文芳,李恒,等.高效降解褐藻膠新菌種的篩選,鑒定及產酶條件優化[J].食品與發酵工業,2012,38(7):26-31
[7]張瑾,趙玉然,梁君妮,等.海洋假單胞桿菌褐藻膠裂解酶基因在大腸桿菌中的高效表達和活性檢測[J].食品與發酵工業,2007,33(2):5-9
[8]Hansen J B,Doubet R S,Ram J.Alginase enzyme production byBacillus circulans[J].Applied and environmental microbiology,1984,47(4):704-709
[9]布坎南,吉本斯.伯杰細菌鑒定手冊[M].北京:科學出版社,1984:729-759
[10]中華人民共和國輕工業部.工業酶制劑通用試驗方法(QB/T 1803-1993)[S].北京:中國輕工業出版社,1994:1-19
[11]Preiss J.Bacterial alginate lyase[J].Methods in Enzymology,1966(8):641-644
[12]李麗妍,管華詩,江曉路,等.海藻工具酶——褐藻膠裂解酶研究進展[J].生物工程學報,2011,27(6):838-845
[13]詹冬梅,邱兆星,李翹楚.大型海藻的細菌降解試驗[J].齊魯漁業,2007,24(8):50-52
[14]劉玉佩,汪立平,趙勇,等.解淀粉芽孢桿菌產褐藻膠裂解酶的發酵條件優化[J].湖南農業科學,2010(3):17-20
[15]湯海青,歐昌榮,鄭曉冬.1株產褐藻膠裂解酶海洋細菌的分離鑒定及其酶學性質[J].浙江大學學報(農業與生命科學版),2013,39(4):387-395
[16]沈雪亮,夏黎明.產纖維素酶細菌的篩選及酶學特性研究[J].林產化學與工業,2002,22(1):47-51
[17]李振紅,陸貽通.高效纖維素降解菌的篩選[J].環境污染與防治,2003,25(3):133-135
[18]張士偉,黃建飛,羅立新.枯草芽孢桿菌產蛋白酶發酵培養基的優化[J].中國釀造,2013,32(2):20-24
[19]孫佑赫,周開艷,熊智.松毛蟲腸道產蛋白酶菌株的篩選鑒定及培養條件研究[J].中國農學通報,2012,28(14):18-21
[20]Vary P S,Biedendieck R,Fuerch T,et al.Bacillus megaterium-from simple soil bacterium to industrial protein production host[J].Applied microbiology and biotechnology,2007,76(5):957-967
[21]郭德軍,李巖松,王欣,等.巨大芽孢桿菌表達系統的特點及其研究進展[J].生物技術,2010,20(6):92-95
Isolation and Fermentation Optimization of anAscophyllum Nodosum Degrading Strain
LIU Lu,GONG Chun-yan,ZHAO Hong-tao,WANG Peng,LI Yuan-yuan*
Qingdao Mingyue BlueOcean Bio-technology Co.Ltd.,Qingdao 266400,China
To study ascophyllum nodosum degradated by microorganism,a high efficient microorganism was isolated from soil using ascophyllum nodosum as the sole nutrient.Based on the morphological,physiological characteristics and 16S rDNA sequence,the strain was identified asBacillus megaterium.The optimized fermentation medium was composed of ascophyllum nodosum 30 g/L,yeast extract 6 g/L and glucose 4 g/L.The optimal culture condition was that the strain was cultured in 250 mL shake flakes containing 25 mL medium with initial pH 7.5 at 32℃.After 48 h fermentation,the effective number of viable cells was 2.4×109CFU/mL,the activity of cellulose was 47.7 U/mL,the activity of protease was 3.4 U/mL, and the activity of alginate lyase was 0.721 U/mL.Possessing the activity of alginate lyase,cellulose and protease,Bacillus megaterium2-2 was conferred extensive potential applications.
Ascophyllum nodosum degrading bacteria;Bacillus megaterium;alginate lyase;fermentation optimization
Q936
A
1000-2324(2014)04-0515-07
2013-02-22
2013-04-14
劉露(1987-),女,山東濟南人,工學碩士.研究方向:從事海洋功能性農用生物制品開發.E-mail:myhzfliulu@126.com
*通訊作者:Author for correspondence.E-mail:myhzflyy@126.com

