低氧對脂肪間充質干細胞向雪旺細胞分化的影響
陳鷗 胡旭琪 鄭旭浩 蔣良福
雪旺細胞(Schwann cells,SCs)在周圍神經再生中能發揮修復作用,廣泛應用于組織工程。但自體SCs 來源有限,增殖能力低,培養周期長,難以滿足組織工程需要[1],而使用異體SCs 又存在免疫排斥問題。脂肪間充質干細胞(adipose-derived mesenchymal stem cells,ADMSCs)有多向分化能力,目前大量研究發現ADMSCs 經誘導可分化為SCs,并能應用于去細胞異體神經移植,發揮外周神經修復作用[1-3]。但是,去細胞異體神經是一種無血供的移植物,早期不能及時建立血液循環,從而造成了低氧微環境。大部分研究認為間充質干細胞在低氧環境中存活率很低,低氧時3 ~4 d 內就會死亡[4-5]。本研究模擬體內低氧環境,探討低氧對ADMSCs 向SCs 分化能力的影響。
1 材料和方法
1.1 主要試劑和儀器
Ⅰ型膠原酶、全反式維甲酸、地塞米松、抗壞血酸、β-甘油磷酸鈉、胰島素、吲哚美辛及IBMX 均購自美國Sigma 公司。胎牛血清、DMEM/F12 培養基及青鏈霉素均購自美國Gibco 公司,β-巰基乙醇購自美國Amresco 公司。腺苷酸環化酶激活劑、堿性成纖維細胞生長因子、血小板衍生生長因子及神經膠質生長因子均購自英國Peprotech 公司。兔抗大鼠CD44 抗體、兔抗大鼠CD45 抗體及兔抗大鼠CD90 抗體均購自美國Biolegend 公司。兔抗大鼠S-100抗體、兔抗大鼠GFAP 抗體均購自美國Abcam公司,兔抗大鼠GAPDH 抗體購自美國Proteintech Group 公司。茜素紅、油紅O 購自浙江天杭生物科技有限公司。MTT 細胞增殖及細胞毒性檢測試劑盒、DAPI、RIPA 細胞裂解液、BCA 蛋白濃度測定試劑盒、SDS-PAGE 凝膠配制試劑盒、DAB 顯色試劑盒、羊抗兔Ig G 二抗及TBST 緩沖液均購自上海碧云天生物技術有限公司。CX41 倒置顯微鏡、BX51熒光顯微鏡均購自日本奧林巴斯公司。FACS Aria流式細胞儀購自美國BD 公司。ELX808 酶聯免疫檢測儀購自美國Bio-Tek 公司。ChemiDocTMMP 凝膠成像分析系統購自美國Bio-Rad 公司。
1.2 大鼠ADMSCs 的分離
選取清潔級雄性近交系SD 大鼠10 只(購自溫州醫學院實驗動物中心),體質量180 ~200 g,2 月齡。參照參考文獻[6]從大鼠脂肪組織提取ADMSCs 的方法并加以改良,分離ADMSCs:大鼠麻醉后取雙側睪丸周圍脂肪組織,去除肉眼可見血管,剪成1 mm×1 mm ×1 mm 大小方塊,0.1% Ⅰ型膠原酶震蕩消化60 min,等體積DMEM/F12 終止消化。200 目細胞篩過濾,200 ×g 離心10 min,去上清液。用含15%胎牛血清的DMEM/F12 重懸沉淀并接種于25 cm2培養瓶中,5% CO2、37 ℃培養箱培養。48 h 后換液并去除未貼壁細胞,以后每3 天換液1 次。細胞匯合度達80%時用0.25%胰酶消化傳代。
1.3 大鼠ADMSCs 的鑒定
選取傳代后的第3 代細胞置于倒置顯微鏡下觀察細胞形態。流式細胞儀鑒定CD44、CD45 和CD90等細胞表面標志:0.25%胰酶消化細胞,加入100 μL PBS 緩沖液洗滌細胞,1000 r/min (離心半徑18 cm),離心5 min,去上清。分別加入兔抗大鼠CD44、CD45 和CD90 抗體2 μL,室溫避光孵育30 min,加入100 μL PBS 緩沖液洗滌去除多余抗體,上機檢測。成骨、成脂能力的鑒定:細胞經成骨誘導培養基(含0.1 μmol/L 地塞米松,50 μg/mL 抗壞血酸,10 mmol/L β-甘油磷酸鈉)誘導2 周及成脂誘導培養基(含1 μmol/L 地塞米松,200 μmol/L 吲哚美辛,0.5 μmol/L IBMX,10 mg/L 胰島素)誘導2 周后,分別用茜素紅染色以及油紅O 染色。
1.4 分組和誘導
選取傳代后的第3 代細胞按1 ×104/mL 接種于25 cm2培養瓶中,細胞匯合度達80%后,將細胞隨機分成3 組。(1)常氧誘導組:于5% CO2、21% O2、37 ℃條件下誘導。誘導時加入含1 mmol/L β-巰基乙醇的DMEM/F12 培養液誘導,24 h 后去除培養液,PBS 緩沖液清洗,加入含40 ng/mL 全反式維甲酸的DMEM/F12 培養液誘導,72 h 后去除培養液,PBS 緩沖液清洗,加入含5 ng/mL 血小板源性衍生因子、10 ng/mL 堿性成纖維細胞生長因子、14 μmol/L 腺苷酸環化酶激活劑、200 ng/mL 神經膠質生長因子的DMEM/F12 培養液誘導14 d,每3 天換液1 次。(2)低氧處理+常氧誘導組:先將細胞培養于5% CO2、0.5% O2、37 ℃培養箱中24 h[7],隨后轉移至5% CO2、21% O2、37 ℃條件下誘導,誘導方式同常氧誘導組。(3)低氧誘導組:于5% CO2、0.5% O2、37 ℃條件下誘導,誘導方式同常氧誘導組。誘導完成后倒置顯微鏡下觀察細胞形態學變化。
1.5 MTT 法檢測各組細胞增殖情況
誘導結束后,0.25%胰酶消化各組細胞并以1 ×103個/孔的密度接種于96 孔板,每孔200 μL,使用含15% 胎牛血清的DMEM/F12 培養液繼續培養24 h。隨后每孔加入20 μL MTT 試劑,同時設空白調零孔,孵育4 h。加入MTT 溶解液150 μL,低速振蕩10 min,酶聯免疫檢測儀讀取570 nm 波長處A 值。
1.6 免疫熒光染色檢測GFAP 和S-100 表達
各組細胞完成誘導后,制備細胞爬片,4%多聚甲醛固定。羊血清封閉非特異性位點,分別滴加兔抗大鼠GFAP 抗體(1 ∶300)與兔抗大鼠S-100 抗體(1 ∶100),4 ℃孵育過夜,滴加熒光標記的羊抗兔lg G 二抗,常溫孵育1 h,用DAPI 對細胞核染色后在熒光顯微鏡下觀察。
1.7 Western blot 檢測GFAP 和S-100 表達
收集誘導后的細胞,加入RIPA 細胞裂解液,提取細胞內蛋白,BCA 法測定蛋白濃度。配制5%濃縮膠和10%分離膠進行SDS-PAGE 電泳,電泳分離蛋白后,將蛋白條帶電轉移至PVDF 膜。5% 脫脂奶粉封閉,分別加入兔抗大鼠GFAP 一抗(1 ∶300)、兔抗大鼠S-100 一抗(1 ∶100)以及兔抗大鼠GAPDH 一抗(1 ∶8 000),37 ℃孵育2 h,TBST 洗膜3 次,5 min/次。加入羊抗兔IgG 二抗(1 ∶5 000),室溫孵育1 h,TBST 緩沖液洗膜3 次,DAB 顯色試劑盒進行顯色。ChemiDocTMMP 凝膠成像分析系統分析各組蛋白條帶。
1.8 統計學方法
采用SPSS13.0 統計軟件進行數據處理。計量資料以均數±標準差()表示,多組間ADMSCs增殖情況比較采用單因素方差分析。以P <0.05為差異具有統計學意義。
2 結 果
2.1 ADMSCs 鑒定結果
倒置顯微鏡觀察可見分離后的細胞貼壁生長,呈成纖維細胞樣,符合間充質干細胞的形態學特點。流式細胞儀鑒定細胞表面標記發現:細胞表面CD44和CD90 表達陽性,而造血干細胞相關標志物CD45表達陰性(圖1)。成骨及成脂誘導培養基誘導2 周后,細胞茜素紅染色(圖2)及油紅O 染色(圖3)陽性,提示該細胞具有ADMSCs 表型及多向分化能力,證明ADMSCs 分離培養成功。
2.2 誘導后的ADMSCs 形態學觀察
常氧誘導組、低氧處理+常氧誘導組ADMSCs在誘導14 d 后,可見細胞呈梭形生長,出現有光暈的突起,相鄰細胞突起之間相互連接,呈樹杈狀排列,可見兩極突起。低氧誘導組ADMSCs 在誘導14 d后,可見大量細胞呈成纖維細胞樣生長,出現較圓鈍、無明顯光暈的突起,未見兩極突起(圖4)。提示常氧誘導組、低氧處理+常氧誘導組細胞在誘導后出現SCs 形態學表現,低氧誘導組細胞未出現SCs 形態學表現。
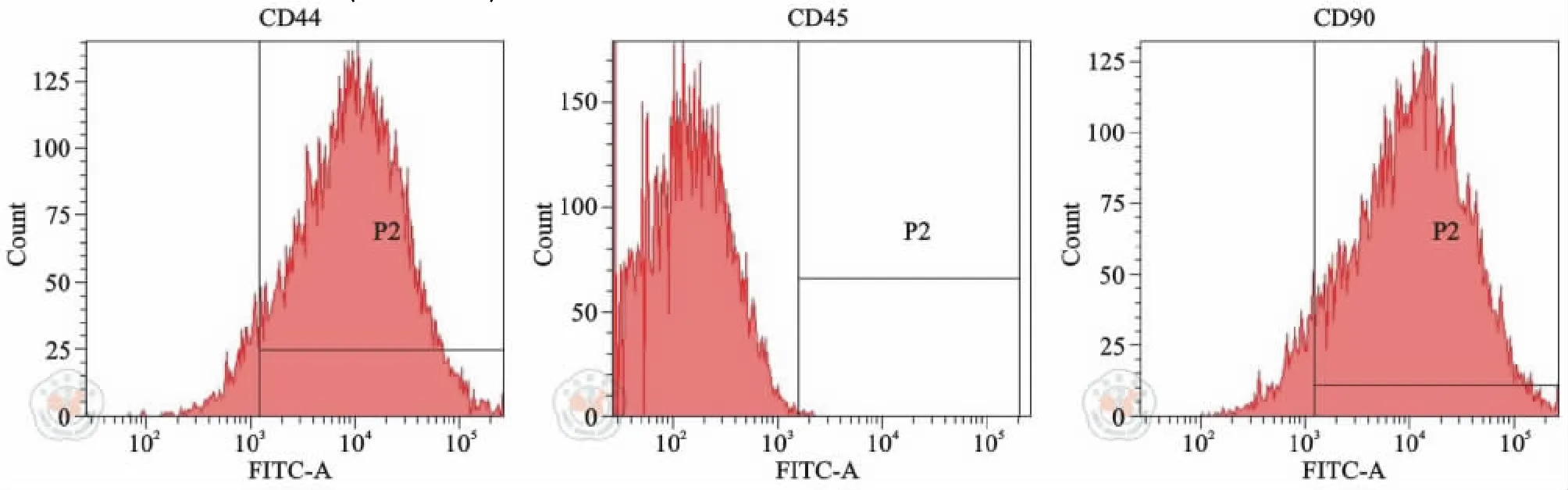
圖1 流式細胞儀檢測脂肪間充質干細胞表面CD44、CD45、CD90 表達
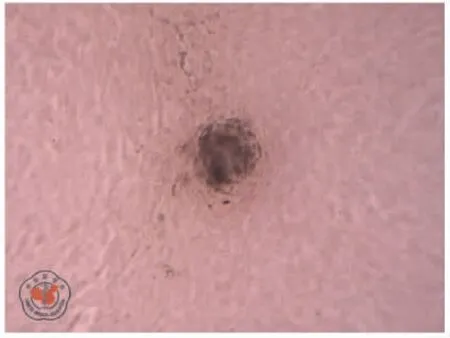
圖2 脂肪間充質干細胞經成骨誘導培養基誘導2 周后茜素紅染色陽性(×100)
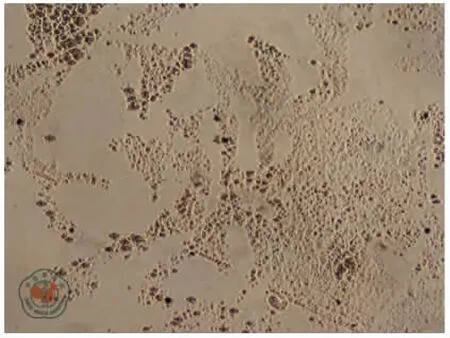
圖3 脂肪間充質干細胞經成脂誘導培養基誘導2 周后油紅O 染色陽性(×100)

圖4 各組脂肪間充質干細胞的形態學觀察(×100)
2.3 各組ADMSCs 的增殖情況
MTT 法檢測結果顯示,低氧處理+常氧誘導組A 值為0. 861 ±0. 039,高于常氧誘導組0. 837 ±0.017,差異具有統計學意義(P <0.05)。低氧誘導組A 值為0.931±0.041,均高于常氧誘導組和低氧處理+常氧誘導組,差異有統計學意義(P 均<0.05)。提示低氧環境可以造成ADMSCs 增殖能力增強。
2.4 各組ADMSCs GFAP 和S-100 的表達情況
免疫熒光染色結果顯示,常氧誘導組和低氧處理+常氧誘導組大量ADMSCs GFAP 和S-100 表達陽性,低氧誘導組僅少量ADMSCs GFAP 和S-100表達陽性(圖5 ~6)。Western blot 檢測發現常氧誘導組S-100 蛋白表達最高,低氧處理+常氧誘導組GFAP 蛋白表達最高,低氧誘導組S-100 蛋白、GFAP蛋白表達最低(圖7 ~8)。
3 討 論
ADMSCs 與骨髓間充質干細胞有相似的干細胞表型,均具有多向分化能力,能向脂肪細胞、成骨細胞、成軟骨細胞等成體細胞分化,還可以向SCs 分化并具有SCs 的功能[6,8-9]。Kingham 等[9]發現體外分化形成的SCs 與NG-108 細胞共培養后,能促進神經軸突的生長。Rosova 等[10]研究認為體內環境氧濃度約為1% ~7%,與體外培養環境供氧條件有明顯的差別,細胞外氧濃度是影響細胞生物學功能的重要因素,低氧濃度影響間充質干細胞的增殖和分化。本研究發現,低氧誘導組ADMSCs 增殖能力最高,低氧處理+常氧誘導組ADMSCs 增殖能力高于常氧誘導組,提示低氧環境能促進誘導后的ADMSCs 增殖。Grayson 等[11-12]通過體外培養人骨髓間充質干細胞發現,低氧能促進其增殖能力,提高干細胞標志性基因表達水平,這與本研究結果較為一致。Valorani 等[13]研究表明,低氧培養雖然縮短間充質干細胞分裂時間,但會降低其分化能力。其可能的機制為:(1)低氧激活ERK1/2、P38 有絲分裂原激活蛋白激酶及PI3K/Akt 信號通路,增強細胞再生能力;(2)低氧抑制Wnt 信號通路和骨形態發生蛋白信號通路;(3)低氧會提高低氧誘導因子2α的表達,進而上調Oct-4 的表達,而Oct-4 是維持間充質干細胞多向分化特性和自我更新的關鍵基因[14-15]。
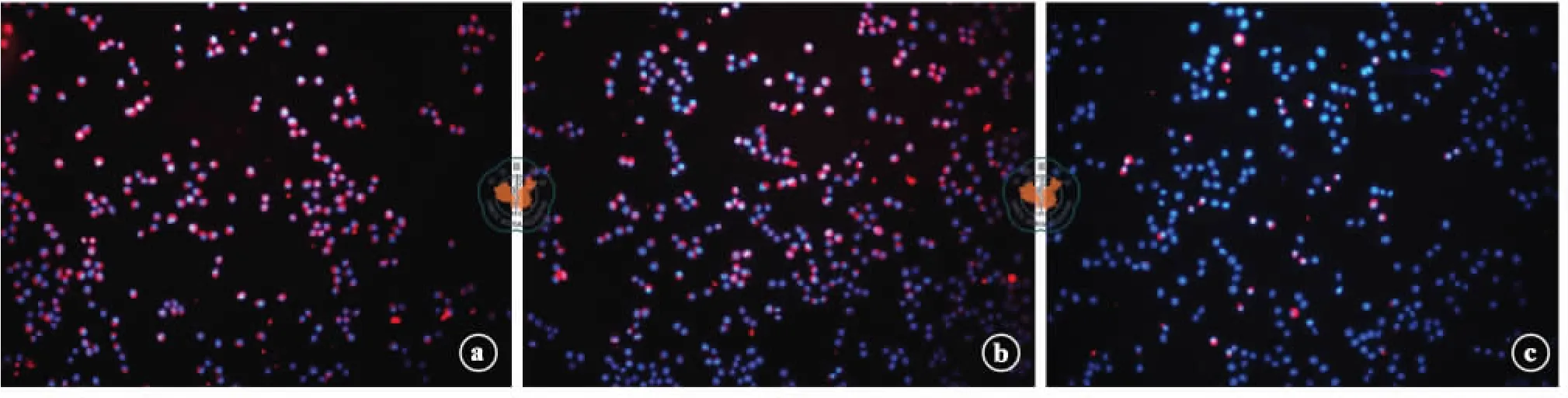
圖5 熒光顯微鏡下各組脂肪間充質干細胞GFAP 表達情況(免疫熒光染色,×200)
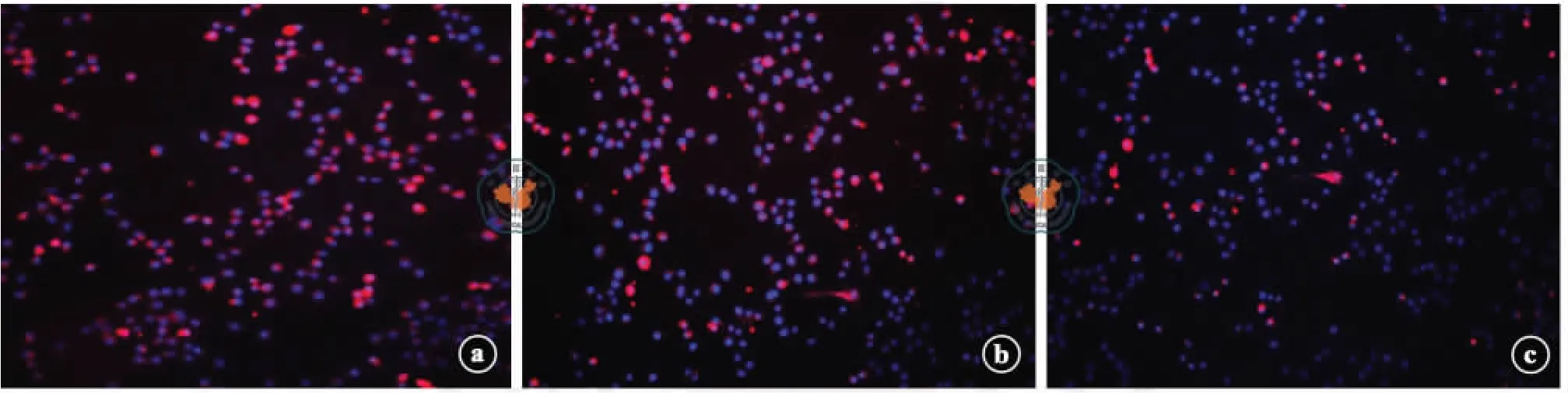
圖6 熒光顯微鏡下各組脂肪間充質干細胞S-100 表達情況(免疫熒光染色,×200)
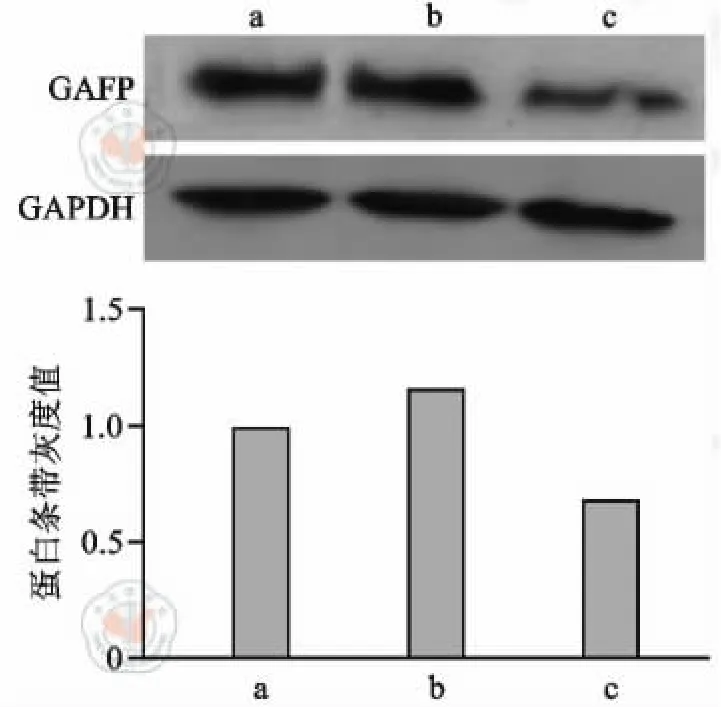
圖7 各組脂肪間充質干細胞GFAP 蛋白條帶及條帶灰度值
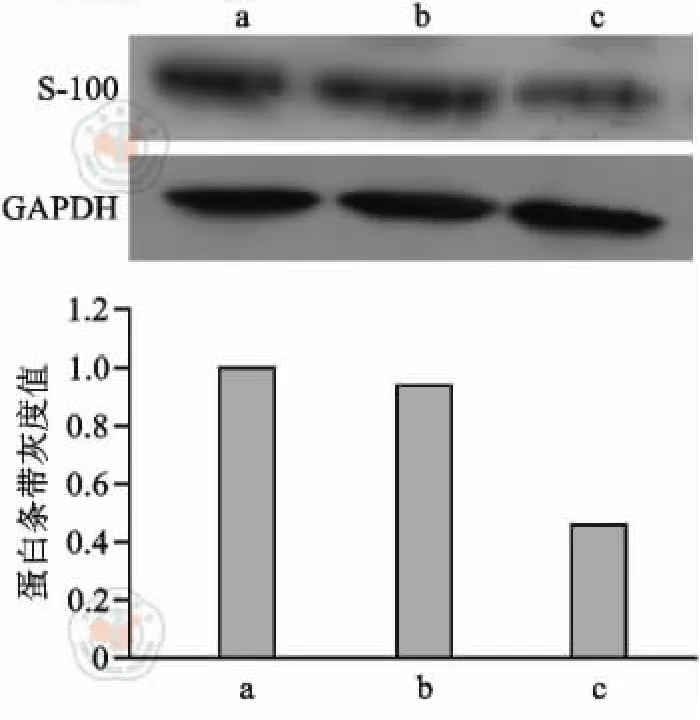
圖8 各組脂肪間充質干細胞的S-100 蛋白條帶及條帶灰度值
GFAP 是一種中間絲蛋白,S-100 是一種酸性鈣結合蛋白,二者均在SCs 中大量表達,是SCs 的重要標記物。本研究中,常氧誘導組和低氧處理+常氧誘導組的GFAP 和S-100 蛋白表達明顯高于低氧誘導組,表明低氧環境抑制ADMSCs 向SCs 分化,但經過低氧預處理的ADMSCs 在恢復正常氧濃度狀態下可繼續向SCs 分化。低氧抑制ADMSCs 向SCs 分化的機制尚待進一步研究。
1 Jiang L,Zhu JK,Liu XL,et al. Differentiation of rat adipose tissuederived stem cells into Schwann-like cells in vitro[J]. Neuroreport,2008,19(10):1015-1019.
2 Razavi S,Ahmadi N,Kazemi M,et al. Efficient transdifferentiation of human adipose-derived stem cells into Schwann-like cells:A promise for treatment of demyelinating diseases[J]. Adv Biomed Res,2012,1:12.
3 Liu Y,Zhang Z,Qin Y,et al. A new method for Schwann-like cell differentiation of adipose derived stem cells[J]. Neurosci Lett,2013,551:79-83.
4 Toma C,Pittenger MF,Cahill KS,et al. Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart[J]. Circulation,2002,105(1):93-98.
5 Das R,Jahr H,van Osch GJ,et al. The role of hypoxia in bone marrow-derived mesenchymal stem cells: considerations for regenerative medicine approaches[J]. Tissue Eng Part B Rev,2010,16(2):159-168.
6 出曉軍,程飚,王會仁. 脂肪來源間充質干細胞向雪旺細胞分化的研究[J]. 中華實驗外科雜志,2011,8(2):315.
7 Chacko SM, Ahmed S, Selvendiran K, et al. Hypoxic preconditioning induces the expression of prosurvival and proangiogenic markers in mesenchymal stem cells[J]. Am J Physiol Cell Physiol,2010,299(6):C1562-1570.
8 Zaminy A,Shokrgozar MA,Sadeghi Y,et al. Transplantation of schwann cells differentiated from adipose stem cells improves functional recovery in rat spinal cord injury[J]. Arch Iran Med,2013,16(9):533-541.
9 Kingham PJ,Kalbermatten DF,Mahay D,et al. Adipose-derived stem cells differentiate into a Schwann cell phenotype and promote neurite outgrowth in vitro[J]. Exp Neurol,2007,207(2):267-274.
10 Rosova I,Dao M,Capoccia B,et al. Hypoxic preconditioning results in increased motility and improved therapeutic potential of human mesenchymal stem cells[J]. Stem Cells,2008,26(8):2173-2182.
11 Grayson WL,Zhao F, Bunnell B, et al. Hypoxia enhances proliferation and tissue formation of human mesenchymal stem cells[J]. Biochem Biophys Res Commun,2007,358(3):948-953.
12 Grayson WL,Zhao F,Izadpanah R,et al. Effects of hypoxia on human mesenchymal stem cell expansion and plasticity in 3D constructs[J]. J Cell Physiol,2006,207(2):331-339.
13 Valorani MG,Germani A,Otto WR,et al. Hypoxia increases Sca-1/CD44 co-expression in murine mesenchymal stem cells and enhances their adipogenic differentiation potential[J]. Cell Tissue Res,2010,341(1):111-120.
14 Liu X,Shen W,Yang Y,et al. Therapeutic implications of mesenchymal stem cells transfected with hepatocyte growth factor transplanted in rat kidney with unilateral ureteral obstruction[J]. J Pediatr Surg,2011,46(3):537-545.
15 Forte G,Minieri M,Cossa P,et al. Hepatocyte growth factor effects on mesenchymal stem cells: proliferation, migration, and differentiation[J]. Stem Cells,2006,24(1):23-33.

