轉(zhuǎn)鐵蛋白偶聯(lián)熒光納米鉆石靶向體系的制備及HeLa細(xì)胞吸收機(jī)制研究
田志梅,曹瑞霞,王東新,李 林,王 青,王志琴,李英奇,
(山西大學(xué) a.分子科學(xué)研究所、化學(xué)生物學(xué)與分子工程教育部重點(diǎn)實(shí)驗(yàn)室; b.化學(xué)化工學(xué)院 太原 030006)
轉(zhuǎn)鐵蛋白偶聯(lián)熒光納米鉆石靶向體系的制備及HeLa細(xì)胞吸收機(jī)制研究
田志梅a,曹瑞霞b,王東新a,李 林a,王 青b,王志琴b,李英奇a,b
(山西大學(xué) a.分子科學(xué)研究所、化學(xué)生物學(xué)與分子工程教育部重點(diǎn)實(shí)驗(yàn)室; b.化學(xué)化工學(xué)院 太原 030006)
以熒光納米鉆石(FND)作為藥物載體和探針,轉(zhuǎn)鐵蛋白(Tf)作為靶向配體,聚賴氨酸(PL)做橋梁,制備了熒光納米鉆石-聚賴氨酸-轉(zhuǎn)鐵蛋白(FND-PL-Tf)靶向納米顆粒;以人宮頸癌細(xì)胞(HeLa cells)為體外模型,研究靶向納米顆粒與細(xì)胞的作用,探討細(xì)胞攝取納米顆粒的轉(zhuǎn)運(yùn)機(jī)制,為納米顆粒靶向輸送藥物和腫瘤檢測提供有價(jià)值的理論依據(jù)。結(jié)果表明細(xì)胞攝取FND-PL-Tf納米顆粒的數(shù)量與顆粒濃度、時間及納米顆粒表面偶聯(lián)轉(zhuǎn)鐵蛋白量有關(guān);由物理吸附或共價(jià)偶聯(lián)Tf獲得的FND-PL-Tf納米顆粒均為網(wǎng)格蛋白決定、轉(zhuǎn)鐵蛋白受體介導(dǎo)機(jī)制進(jìn)入細(xì)胞。這些研究表明FND-PL-Tf納米顆粒具有潛在的靶向輸送藥物和腫瘤靶向檢測功能。
熒光納米鉆石; 聚賴氨酸;轉(zhuǎn)鐵蛋白;細(xì)胞吸收機(jī)制
隨著納米科技的進(jìn)展,納米材料在生物醫(yī)藥方面的應(yīng)用日益受到關(guān)注[1]。近十幾年來,以碳材料為基礎(chǔ)的納米材料,如納米鉆石、炭黑、碳納米管和富勒烯等,針對生物毒性及生物兼容性問題,開始積極測試。 Dai Liming, Zhao Yuliang,Zhang X Y 等課題組證實(shí)納米鉆石具有最低毒性和高生物兼容性[2-5],可能成為生物醫(yī)用中的一項(xiàng)新材料。更可喜的是近來臺灣張教授組通過對大鼠腹腔注射納米鉆石進(jìn)行了長期(5個月)穩(wěn)定性和生物兼容性實(shí)驗(yàn)發(fā)現(xiàn)大鼠沒有表現(xiàn)出任何不良反應(yīng),再次證明納米鉆石的高生物相容性[6]。此外,納米鉆石經(jīng)強(qiáng)酸氧化處理后,表面富含羧基,可進(jìn)一步與蛋白[7-8]、藥物[9-11]等作用,實(shí)現(xiàn)納米鉆石載藥功能。更使人激動的是,經(jīng)過40 keV He+輻照合成的Type1b 納米鉆石,可以使其具有(N-V)-點(diǎn)缺陷中心,這就是其發(fā)紅色熒光機(jī)制[12],因此把它稱作熒光納米鉆石(FND)。熒光納米鉆石具有無光漂白現(xiàn)象、寬的光譜范圍以及熒光壽命長等優(yōu)點(diǎn),所以用FND來標(biāo)記細(xì)胞或生物分子以觀察診斷,如應(yīng)用于細(xì)胞內(nèi)定位和檢測[6,11,12]。
由于FND在細(xì)胞培養(yǎng)基(含10%的血清)中容易聚集導(dǎo)致細(xì)胞吸收率低,但經(jīng)過表面修飾或負(fù)載藥物后可以防止聚集且能進(jìn)入細(xì)胞[11,14]。大量研究表明,納米顆粒與蛋白或具有生物活性的配體偶聯(lián),能提高它們的穩(wěn)定性和細(xì)胞吸收的有效性[15],適合偶聯(lián)納米顆粒的轉(zhuǎn)鐵蛋白是分子量約80 kDa的單肽鏈非血紅素糖蛋白,是脊椎動物體內(nèi)鐵(Ⅲ)的運(yùn)輸者,主要是轉(zhuǎn)鐵蛋白受體介導(dǎo)途徑。轉(zhuǎn)鐵蛋白受體能在人體內(nèi)廣泛表達(dá),但它的表達(dá)量有明顯差別,腫瘤細(xì)胞具有高表達(dá)轉(zhuǎn)鐵蛋白受體特性,是正常細(xì)胞表達(dá)量的2~10倍,利用轉(zhuǎn)鐵蛋白-轉(zhuǎn)鐵蛋白受體專一性結(jié)合已成為一種有效的藥物轉(zhuǎn)運(yùn)途徑[16-18]。因此轉(zhuǎn)鐵蛋白與納米顆粒的偶聯(lián)成為受體介導(dǎo)目標(biāo)藥物和基因運(yùn)輸?shù)牟牧?這些材料包括量子點(diǎn)、碳納米管、磁性納米粒子、金納米以及多孔硅納米顆粒等[19-22],但他們均具有不同程度的毒副作用。Michal Babic等[23]研究了聚賴氨酸(PL)包被納米顆粒進(jìn)入細(xì)胞的效果優(yōu)于單獨(dú)的納米顆粒。
鑒于熒光納米鉆石的高生物兼容性、發(fā)紅色熒光特性和聚賴氨酸正電荷特點(diǎn),我們利用FND作為熒光探針和載體,PL為橋梁,Tf為靶向配體,制備了靶向納米FND-PL-Tf載體,并對其進(jìn)行了表征。以HeLa細(xì)胞為體外模型,對靶向納米材料FND-PL-Tf與細(xì)胞的作用機(jī)制進(jìn)行了探討,為FND-PL-Tf靶向輸送藥物和腫瘤檢測提供理論依據(jù)。
1 實(shí)驗(yàn)部分
1.1 試劑和儀器
熒光納米鉆石(Element Six,由臺灣中央研究院提供,粒徑為~140 nm),人轉(zhuǎn)鐵蛋白(Tf,Sigma),聚賴氨酸(PL,Sigma),1-乙基-3-(3-二甲基氨丙基)-碳化二亞胺(EDC,Sigma),N-羥基琥珀酰亞胺(NHS,Sigma),2-(N-嗎啡啉)乙磺酸(MES,Sigma),細(xì)胞培養(yǎng)基 DMEM(賽默飛世爾生物化學(xué)制品有限公司),胎牛血清(FBS,杭州四季青生物工程材料有限公司),胰蛋白酶(Trypsin,Amresco),EDTA(北京化工廠),實(shí)驗(yàn)中所用化學(xué)試劑均為分析純。細(xì)胞培養(yǎng)用水為三次蒸餾水,其它用水為一次蒸餾水,HeLa 細(xì)胞由山西大學(xué)生物技術(shù)所提供。
電子天平(AL204,上海梅特勒-托利多儀器有限公司),超聲波清洗器(KQ-100DE,江蘇昆山市超聲儀器有限公司),微量高速離心機(jī)(TG16-W,湖南湘儀實(shí)驗(yàn)室儀器開發(fā)有限公司),搖勻儀(DR-MTX,北京昊諾斯生物科技有限公司),pH 計(jì)(DELTA320,上海梅特勒-托利多儀器有限公司),紫外-可見分光光度計(jì)(Cary Eclipse,美國 VARIAN 公司),馬爾文納米粒度儀(ZETSizer,Nano-ZS90,英國馬爾文),激光共聚焦顯微鏡(TCS SP5,德國 Leica 公司),流式細(xì)胞儀(FACSCalibur,美國 BD 公司)。
1.2 靶向材料FND-PL-Tf的制備
1.2.1FND-PL的制備
準(zhǔn)確稱取5 mg 羧基化的FND(經(jīng)強(qiáng)酸氧化)[11]置于離心管中,加入pH為8.40的硼酸3 mL緩沖溶液,超聲分散30 min形成懸濁液,接著向其中加入10 mg EDC、10 mg NHS,繼續(xù)超聲分散30 min,然后加入2.5 mg PL,室溫下?lián)u勻3 h。待反應(yīng)結(jié)束,于高速離心機(jī)上離心,用硼酸緩沖溶液洗滌三次,棄去上清液,得到沉淀物FND-PL納米顆粒懸于5 mL硼酸緩沖液中備用。
1.2.2FND-PL-Tf的制備
共價(jià)偶聯(lián)方法:稱取5 mg Tf溶于1 mL MES(pH 6.0)緩沖液,量取200 μL Tf(5 mg/mL)溶液,加入EDC預(yù)處理Tf 30 min,接著準(zhǔn)確量取1 mL FND-PL懸濁液(1.0 mg/mL),然后將處理的Tf加入FND-PL的懸濁液中,在搖勻儀上反應(yīng)3 h,于15 000 r/min離心5 min,用硼酸緩沖液清洗沉淀三次,收集每次的離心上清液,分別測定其吸光度值,根據(jù)摩爾消光系數(shù)(ε278=93 000 mol-1cm-1)求出游離 Tf 濃度,計(jì)算加入 Tf 總量與上清液中游離的 Tf 量之差,即為 FND-PL偶聯(lián) Tf 的量[11]。所得沉淀即為FND-PL-Tf。將沉淀物懸于硼酸緩沖液中備用。
物理吸附方法:準(zhǔn)確量取制備的FND-PL懸濁液(1.0 mg/mL)1 mL,加入1 mg Tf,在搖勻儀上搖勻3h,反應(yīng)結(jié)束后,處理方法同上。吸附Tf的量為186 μg/mg。
1.3 靶向材料FND-PL-Tf的表征
1.3.1紅外光譜儀測定
用傅里葉變換紅外光譜儀表征納米粒子FND,FND-PL和FND-PL-Tf。
1.3.2激光粒度分析儀測定
將一定質(zhì)量的納米粒子FND,FND-PL和FND-PL-Tf置于去離子水中并超聲分散30 min,使之成為合適濃度的懸濁液,用激光粒度分析儀及高分辨Zeta電位,分別測定納米顆粒的粒徑及表面Zeta電位。
1.4FND-PL偶聯(lián)Tf量的確定及FND-PL-Tf進(jìn)入細(xì)胞的最佳條件
分別準(zhǔn)確量取含F(xiàn)ND-PL納米顆粒 1 mg的懸濁液置于5個2 mL離心管,向其中分別加入EDC預(yù)處理好的不同質(zhì)量的Tf,在搖勻儀上反應(yīng)3 h,反應(yīng)結(jié)束后,處理方法同上。繪制偶聯(lián)曲線。
取對數(shù)生長期 HeLa 細(xì)胞以 1.5×105/dish 的密度接種于35 mm培養(yǎng)皿中,培養(yǎng)16 h后,分別加入偶聯(lián)Tf量為93, 188和238 μg/mg的FND-PL-Tf于 37℃孵育2 h,將細(xì)胞外的納米顆粒吸棄,用冷PBS緩沖液洗滌兩次,而后用胰酶消化,形成細(xì)胞懸液,再用冷的PBS清洗2次,重新懸于冷PBS中,最后將上述樣品用流式細(xì)胞儀檢測,以未做過任何處理的HeLa細(xì)胞作為空白對照。(FND-PL-Tf:激發(fā)波長635 nm,接收波長大于650 nm)。
1.5 細(xì)胞內(nèi)吞FND-PL-Tf 的靶向機(jī)制
取對數(shù)生長期 HeLa 細(xì)胞以 1.5×105/dish 的密度接種于35 mm培養(yǎng)皿中,培養(yǎng)16 h后,向培養(yǎng)皿中加入1 mg 游離Tf預(yù)處理細(xì)胞30 min,接著加入FND-PL-Tf(按FND為50 μg/mL加入)于37℃繼續(xù)與細(xì)胞孵育2 h,只加FND-PL-Tf的細(xì)胞作對照。用流式細(xì)胞儀測定細(xì)胞內(nèi)吞納米顆粒的熒光強(qiáng)度。
1.6 細(xì)胞內(nèi)吞FND-PL-Tf的轉(zhuǎn)運(yùn)機(jī)理
取對數(shù)生長期 HeLa 細(xì)胞以 1.5×105/dish 的密度接種于含蓋玻片的35 mm培養(yǎng)皿中,培養(yǎng)16 h后,分別用0.01 mol/L NaN3和0.05 mol/L 2-deoxy-D-Glucose、0.45 mol/L sucrose預(yù)處理細(xì)胞30 min,再將10 μg/mL FND-PL-Tf 分別加入以上培養(yǎng)皿中,于 37℃繼續(xù)孵育3 h,此外將10 μg/mL FND-PL-Tf加入0℃的培養(yǎng)皿孵育3 h,用 PBS 洗去細(xì)胞表面FND-PL-Tf,加蓋玻片的培養(yǎng)皿用 4%多聚甲醛室溫固定 8 min,冷 PBS 沖洗細(xì)胞三次,取出蓋玻片置于載玻片上,于激光掃描共聚焦顯微鏡下觀察并拍照(激發(fā)波長 535 nm,接受波長 600~700 nm 測定 FND的紅色熒光信號)。用同樣方法處理細(xì)胞,用流式細(xì)胞儀測定細(xì)胞內(nèi)吞納米顆粒的熒光強(qiáng)度。
1.7 細(xì)胞內(nèi)吞FND-PL-Tf 的動力學(xué)
取對數(shù)生長期 HeLa 細(xì)胞以 1.5×105/dish 的密度接種于35 mm培養(yǎng)皿中,培養(yǎng)16 h后,分別加入30 μg/mL FND-PL-Tf 于 37℃分別孵育0,0.5,1,2,3,5,8,17 h,用流式細(xì)胞儀測定細(xì)胞內(nèi)吞納米顆粒的熒光強(qiáng)度。
2 實(shí)驗(yàn)結(jié)果與分析
2.1 FND-PL-Tf的制備及表征
為了探討不同分子制備的靶向納米鉆石材料被細(xì)胞攝取的影響,我們在前期制備的熒光納米鉆石-轉(zhuǎn)鐵蛋白材料的基礎(chǔ)上[11],進(jìn)一步選用聚賴氨酸做交聯(lián)劑,制備了新型納米載體FND-PL-Tf,制備過程示意圖如圖1所示。
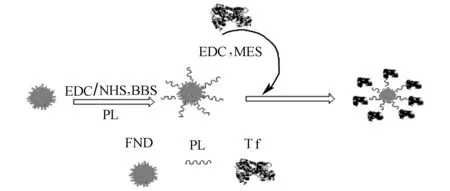
圖1 FND-PL-Tf 納米顆粒制備過程示意圖
采用傅里葉變換紅外光譜儀對其進(jìn)行表征,結(jié)果如圖2所示。其中,a為FND的紅外光譜,可以看到FND表面富含-OH和-COOH; b為FND-PL的紅外光譜,3 255 cm-1為N-H伸縮振動,1 668 cm-1為C=O伸縮振動(酰胺I帶),1 539 cm-1為N-H彎曲振動(酰胺Ⅱ帶);c為FND-PL-Tf的紅外光譜,3 308 cm-1為N-H伸縮振動,1 659 cm-1為C=O伸縮振動(酰胺I帶),1 539 cm-1為N-H彎曲振動(酰胺II帶),而C=O峰依次從1 792 cm-1轉(zhuǎn)變?yōu)? 771 cm-1和1 763 cm-1,且峰強(qiáng)度依次變?nèi)?表明獲得FND-PL-Tf納米顆粒。
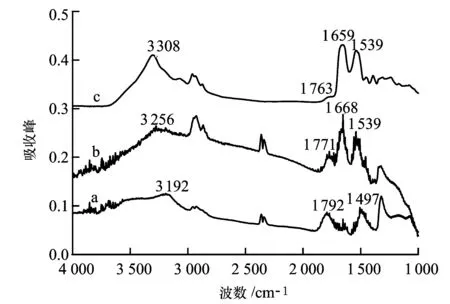
a—FND;b—FND-PL;C—FND-PL-Tf
用激光粒度分析儀測定不同納米顆粒的粒徑大小和Zeta電位值,結(jié)果如表1。由表1可知,隨著PL和Tf依次與FND偶聯(lián),粒徑大小依次增大,FND-PL的Zeta電位值明顯高于羧基化的FND,這是由于PL在去離子水中帶正電荷的緣故,表明PL與FND偶聯(lián);在此基礎(chǔ)上繼續(xù)偶聯(lián)帶負(fù)電荷的Tf,從FND-PL-Tf與FND-PL的Zeta電位值比較,可見前者的電位值顯著低于后者,充分表明FND-PL和FND-PL-Tf已經(jīng)制得。
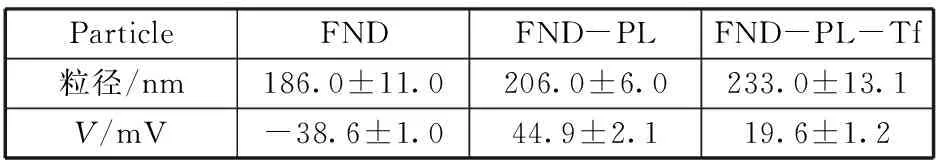
表1 不同納米顆粒的粒徑和Zeta電位值Table 1 The size and Zeta potential of different nanoparticles
為確定FND-PL納米顆粒偶聯(lián)Tf的最大飽和量,用不同質(zhì)量的Tf 與一定質(zhì)量的FND-PL納米顆粒反應(yīng),得到圖3所示的曲線,由圖可見,在一定范圍內(nèi),FND-PL對Tf的吸附量隨Tf量的增加而增加,當(dāng)Tf超過一定量,隨著Tf量的增加FND-PL對Tf的偶聯(lián)量不再增加而趨于恒值,即此時FND-PL偶聯(lián)Tf已達(dá)到飽和,最大偶聯(lián)量約(238±8.95) μg/mg,約是FND直接偶聯(lián)Tf的2.4倍[8],這可能主要與FND和Tf直接偶聯(lián)有空間位阻效應(yīng)有關(guān)。
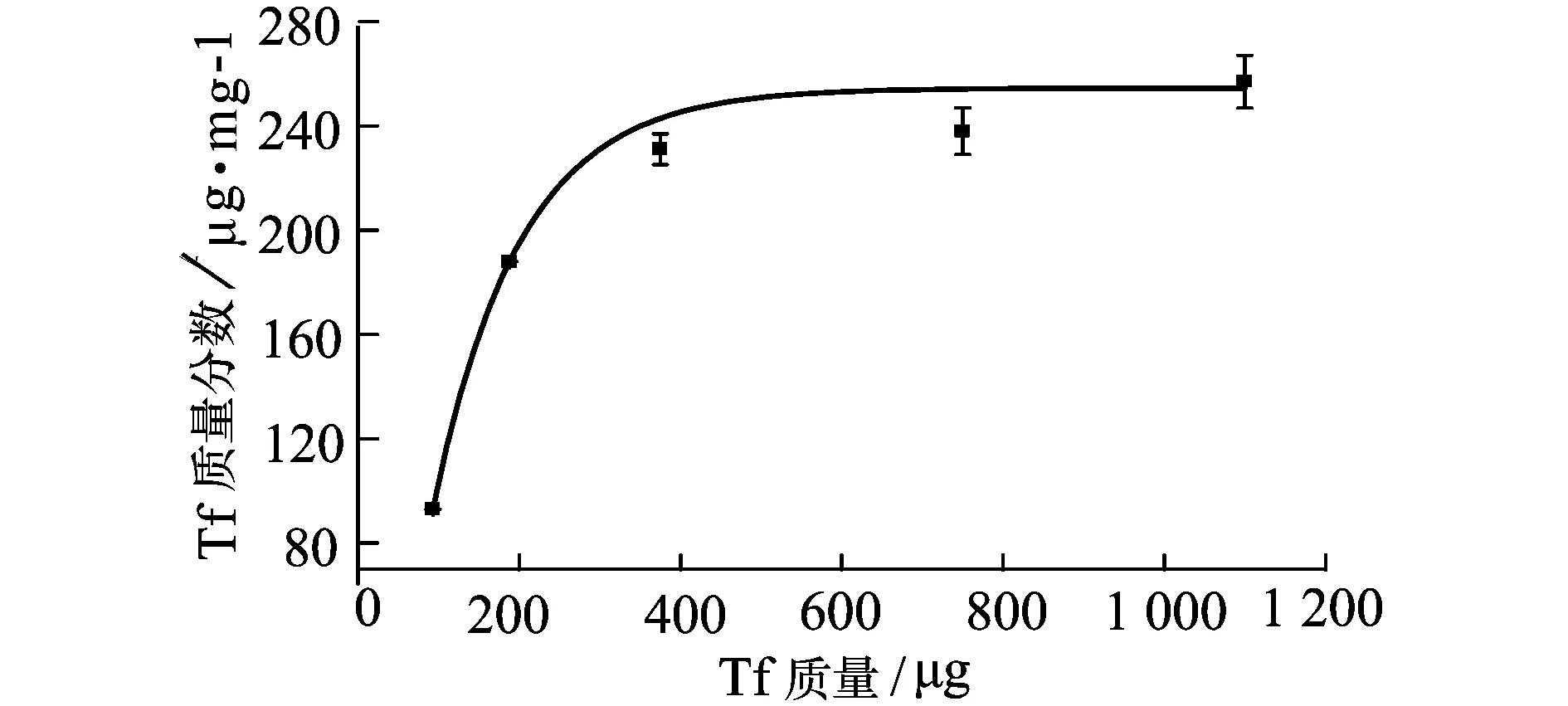
圖3 FND-PL納米顆粒偶聯(lián)Tf的偶聯(lián)曲線
2.2FND-PL-Tf進(jìn)入細(xì)胞的最佳條件和細(xì)胞攝取機(jī)制研究
通過流式細(xì)胞技術(shù)測定FND-PL-Tf納米顆粒在細(xì)胞內(nèi)的熒光強(qiáng)度信號,可以間接反應(yīng)納米顆粒進(jìn)入細(xì)胞的量的多少。為進(jìn)一步研究制備得FND-PL-Tf納米顆粒進(jìn)入細(xì)胞是否與表面偶聯(lián)的Tf量有關(guān),我們選取FND-PL偶聯(lián)Tf的量分別為93, 188 ,238 μg/mg的FND-PL-Tf納米顆粒與HeLa cells作用,結(jié)果如圖4-a所示,隨著納米顆粒濃度的提高,細(xì)胞攝取納米顆粒的數(shù)量增加。有趣的是,偶聯(lián)最多Tf 的FND-PL-Tf納米顆粒,進(jìn)入細(xì)胞的量最少,偶聯(lián)量為188 μg/mg的FND-PL-Tf納米顆粒進(jìn)入細(xì)胞最多,這可能與空間位阻效應(yīng)密切相關(guān)。該實(shí)驗(yàn)結(jié)果充分表明細(xì)胞攝取FND-PL-Tf納米顆粒的多少與表面偶聯(lián)Tf的量有關(guān)。
鑒于以上現(xiàn)象,我們選取偶聯(lián)Tf的量為188 μg/mg的FND-PL-Tf納米顆粒為研究對象,進(jìn)一步研究其進(jìn)入細(xì)胞是否是轉(zhuǎn)鐵蛋白受體介導(dǎo)途徑。根據(jù)轉(zhuǎn)鐵蛋白-轉(zhuǎn)鐵蛋白受體之間的高度親和力,若FND-PL-Tf納米顆粒進(jìn)入細(xì)胞由表面偶聯(lián)的轉(zhuǎn)鐵蛋白決定,則可用游離轉(zhuǎn)鐵蛋白做竟?fàn)巹?研究細(xì)胞攝取FND-PL-Tf納米顆粒的靶向途徑。結(jié)果如圖4-b所示,由于游離轉(zhuǎn)鐵蛋白的存在,FND-PL-Tf納米顆粒進(jìn)入細(xì)胞的熒光強(qiáng)度顯著降低,抑制率達(dá)到87.7%,這是由于游離轉(zhuǎn)鐵蛋白占據(jù)細(xì)胞表面轉(zhuǎn)鐵蛋白受體的緣故,因此可以推斷細(xì)胞內(nèi)吞FND-PL-Tf納米顆粒是轉(zhuǎn)鐵蛋白受體介導(dǎo)機(jī)制。這一結(jié)果預(yù)示FND-PL-Tf納米顆粒能夠被細(xì)胞表面表達(dá)轉(zhuǎn)鐵蛋白受體高的癌細(xì)胞主動識別,提高腫瘤細(xì)胞的檢測效應(yīng)。
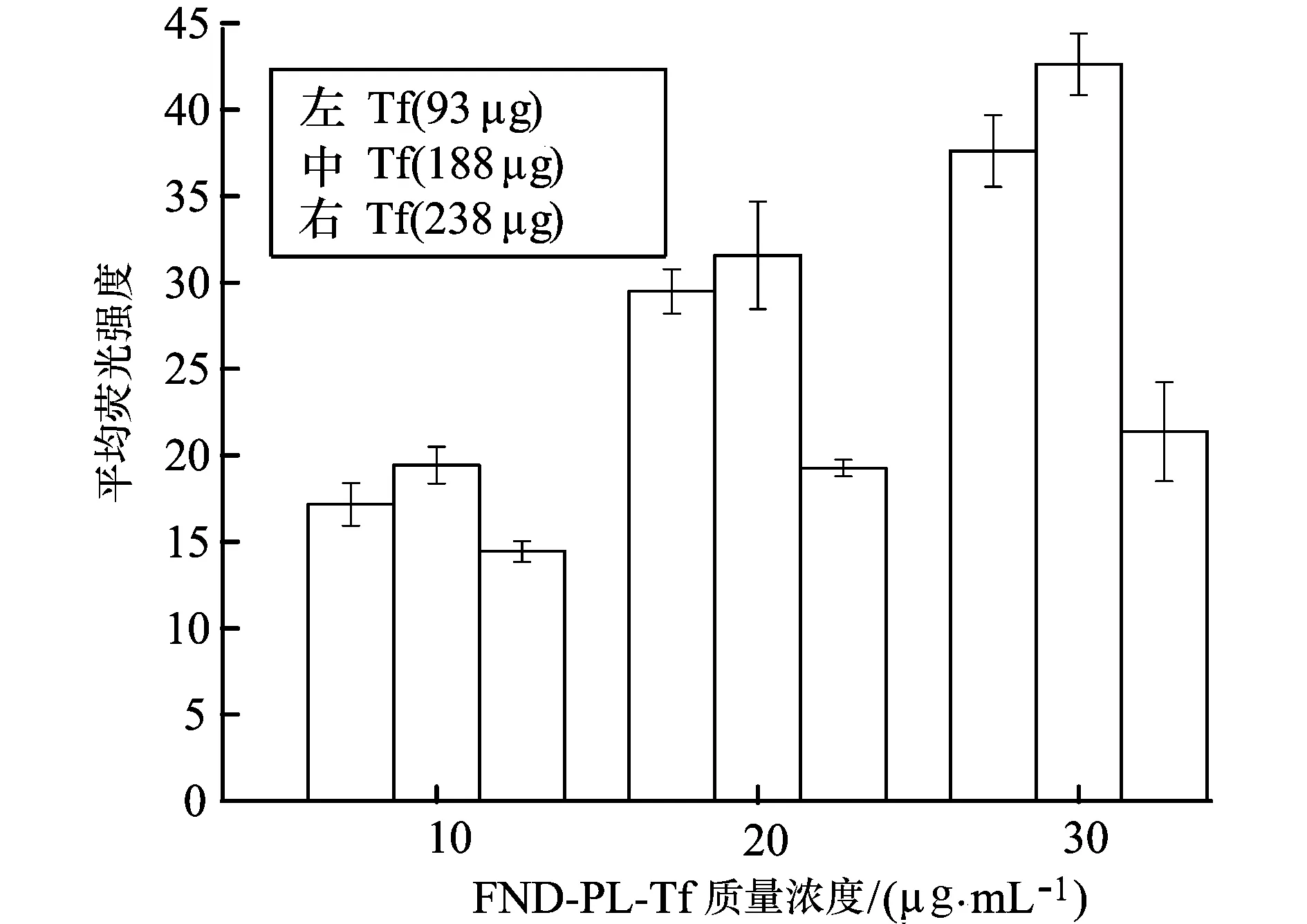
4-a 細(xì)胞對FND-PL-Tf偶聯(lián)不同Tf量的攝取
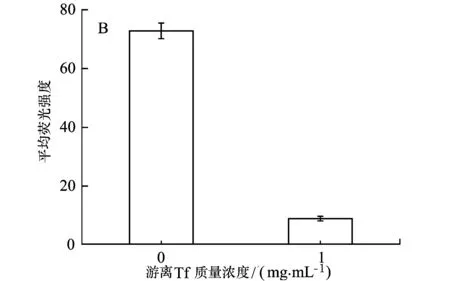
4-b 細(xì)胞攝取FND-PL-Tf (FND-PL共價(jià)偶聯(lián)Tf)的機(jī)制
FND-PL共價(jià)偶聯(lián)Tf形成的FND-PL-Tf納米顆粒是轉(zhuǎn)鐵蛋白受體介導(dǎo)途徑,那么通過FND-PL物理吸附Tf形成的FND-PL-Tf納米顆粒進(jìn)入細(xì)胞的途徑是否相似呢?為了證明這一假設(shè),我們同樣采用游離轉(zhuǎn)鐵蛋白做競爭劑,抑制率達(dá)到84.5%,結(jié)果表明通過FND-PL物理吸附Tf形成的FND-PL-Tf納米顆粒也是轉(zhuǎn)鐵蛋白受體介導(dǎo)途徑(數(shù)據(jù)未顯示)。通過兩種方法制備得FND-PL-Tf納米顆粒進(jìn)入細(xì)胞的靶向性均比FND-Tf[8]提高了約2倍。這個結(jié)果可能由兩種原因引起:
1) 充分表明FND-PL-Tf納米顆粒由于PL做橋梁,克服了轉(zhuǎn)鐵蛋白與納米鉆石直接偶聯(lián)的空間位阻效應(yīng),使得FND-PL-Tf納米顆粒能夠與細(xì)胞表面的轉(zhuǎn)鐵蛋白受體緊密接觸,親和力提高,靶向效果顯著改善;
2) FND-PL-Tf納米顆粒的Zeta電位為正值,FND-Tf的Zeta電位為負(fù)值,而帶負(fù)電荷的細(xì)胞易與帶正電荷的納米顆粒作用。
為了探究細(xì)胞內(nèi)吞FND-PL-Tf納米顆粒的轉(zhuǎn)運(yùn)機(jī)制,選用低溫和不同抑制劑研究了FND-PL-Tf納米顆粒與細(xì)胞的作用,結(jié)果如圖5-a所示。由于0℃下細(xì)胞膜脂流動性會降低,外源性物質(zhì)與細(xì)胞膜的相互作用會受到影響,導(dǎo)致細(xì)胞對外源性物質(zhì)的攝取效率降低[24-25]。由圖5可看出0 ℃時,FND-PL-Tf的細(xì)胞攝取量比37 ℃明顯降低,抑制率達(dá)到67%。NaN3可抑制細(xì)胞色素氧化酶阻斷線粒體呼吸鏈,從而阻斷細(xì)胞內(nèi)ATP的形成。用NaN3預(yù)處理細(xì)胞發(fā)現(xiàn)FND-PL-Tf的細(xì)胞攝取量下降,抑制率達(dá)到50%,說明FND-PL-Tf進(jìn)入細(xì)胞是一個主動的、能量依賴的內(nèi)吞過程。為進(jìn)一步探討FND-PL-Tf以何種內(nèi)吞方式進(jìn)入HeLa細(xì)胞,選用抑制劑蔗糖(Sucrose)預(yù)處理細(xì)胞。Sucrose可擾亂網(wǎng)格蛋白包被小泡(clathrin-coated vesicles)的形成,影響clathrin介導(dǎo)的內(nèi)吞途徑,從圖5A可以看到Sucrose對HeLa攝入FND-PL-Tf的抑制率達(dá)50%,結(jié)果表明FND-PL-Tf進(jìn)入細(xì)胞以clathrin介導(dǎo)的內(nèi)吞途徑。
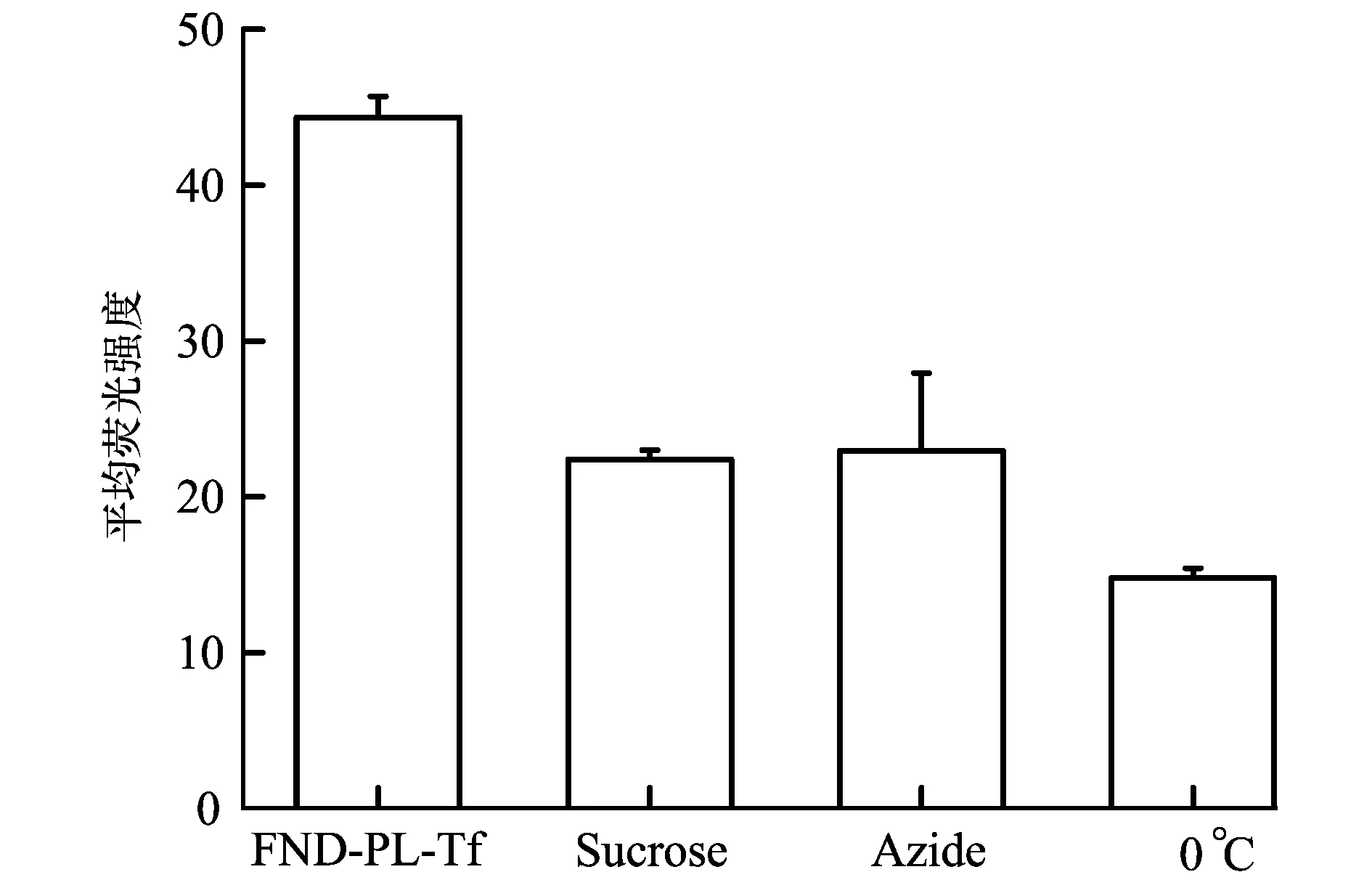
5-a—流式細(xì)胞儀定量檢測低溫(0℃)和不同抑制劑對細(xì)胞攝入FND-PL-Tf的影響
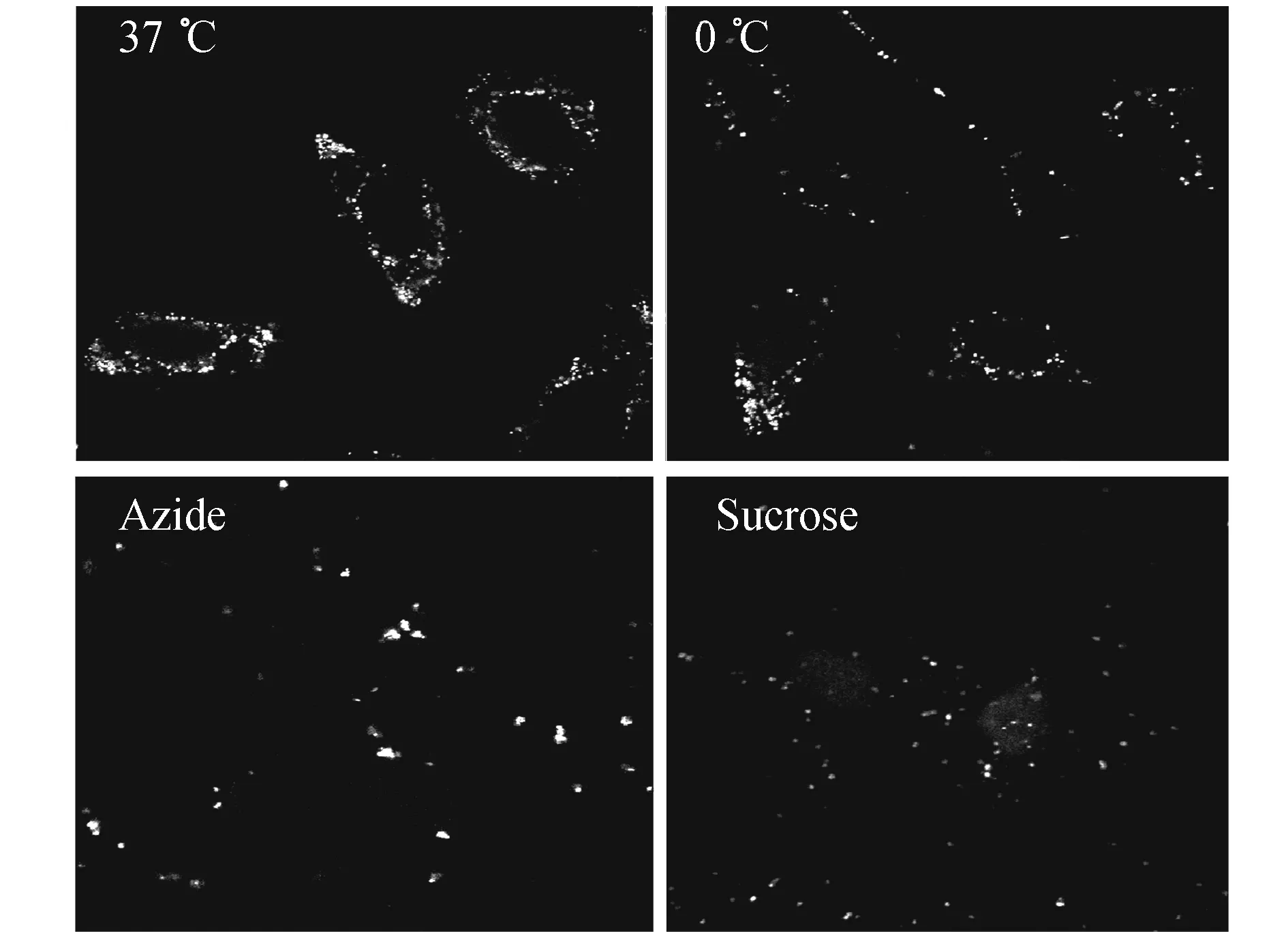
5-b—運(yùn)用激光共聚焦顯微鏡觀察
運(yùn)用激光掃描共聚焦顯微鏡研究FND-PL-Tf的細(xì)胞轉(zhuǎn)運(yùn)機(jī)理,可以觀察到FND-PL-Tf納米顆粒在細(xì)胞內(nèi)主要位于細(xì)胞質(zhì)5B。用0℃、抑制劑NaN3和Sucrose預(yù)處理細(xì)胞后FND-DOX進(jìn)入細(xì)胞的量明顯少于37℃對照,更進(jìn)一步證明了FND-PL-Tf是以clathrin介導(dǎo)的內(nèi)吞途徑進(jìn)入HeLa細(xì)胞。
2.3 FND-PL-Tf進(jìn)入細(xì)胞具有時間依賴性
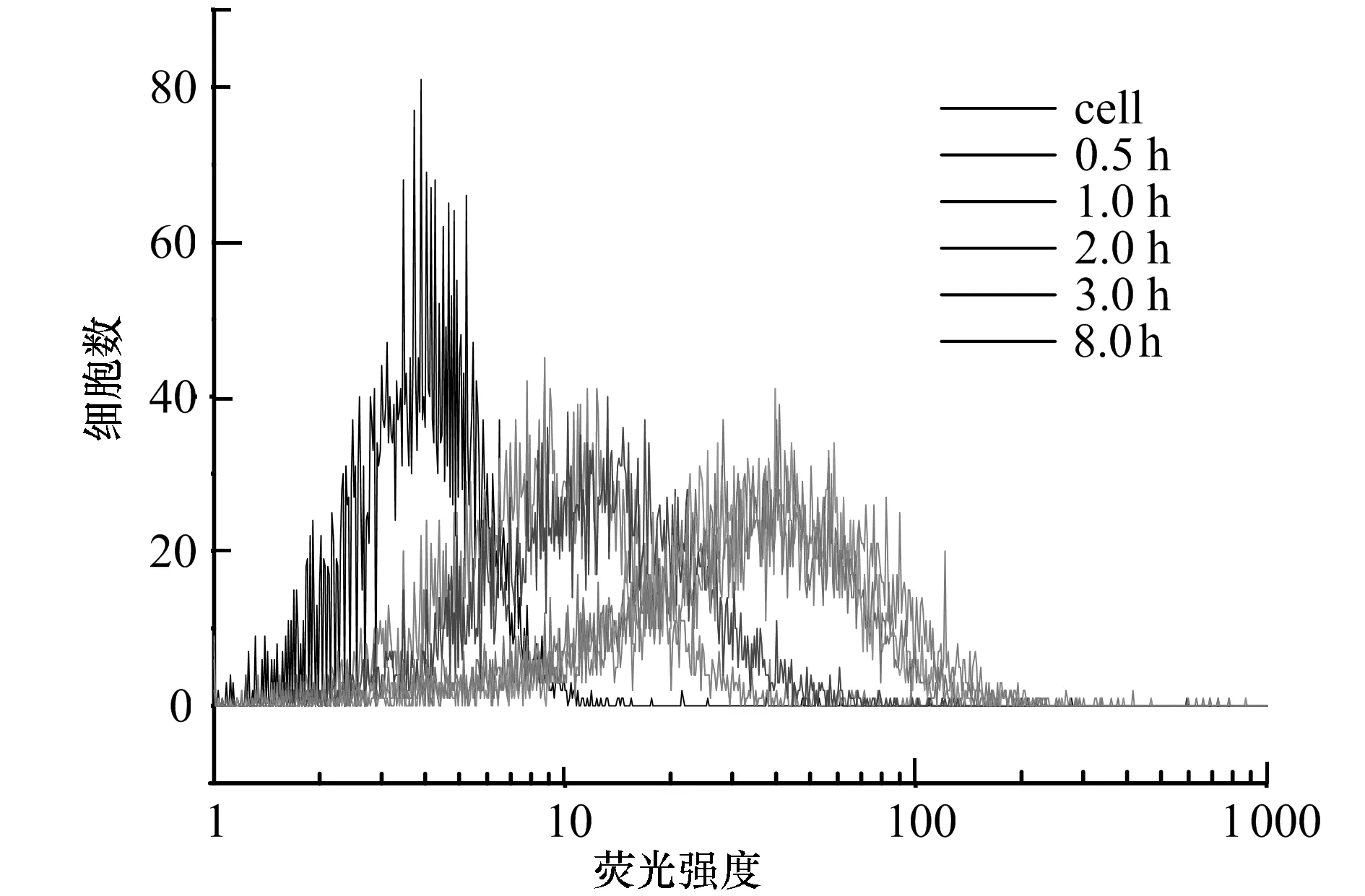
6-a—不同時間細(xì)胞內(nèi)吞FND-PL-Tf納米顆粒的熒光強(qiáng)度
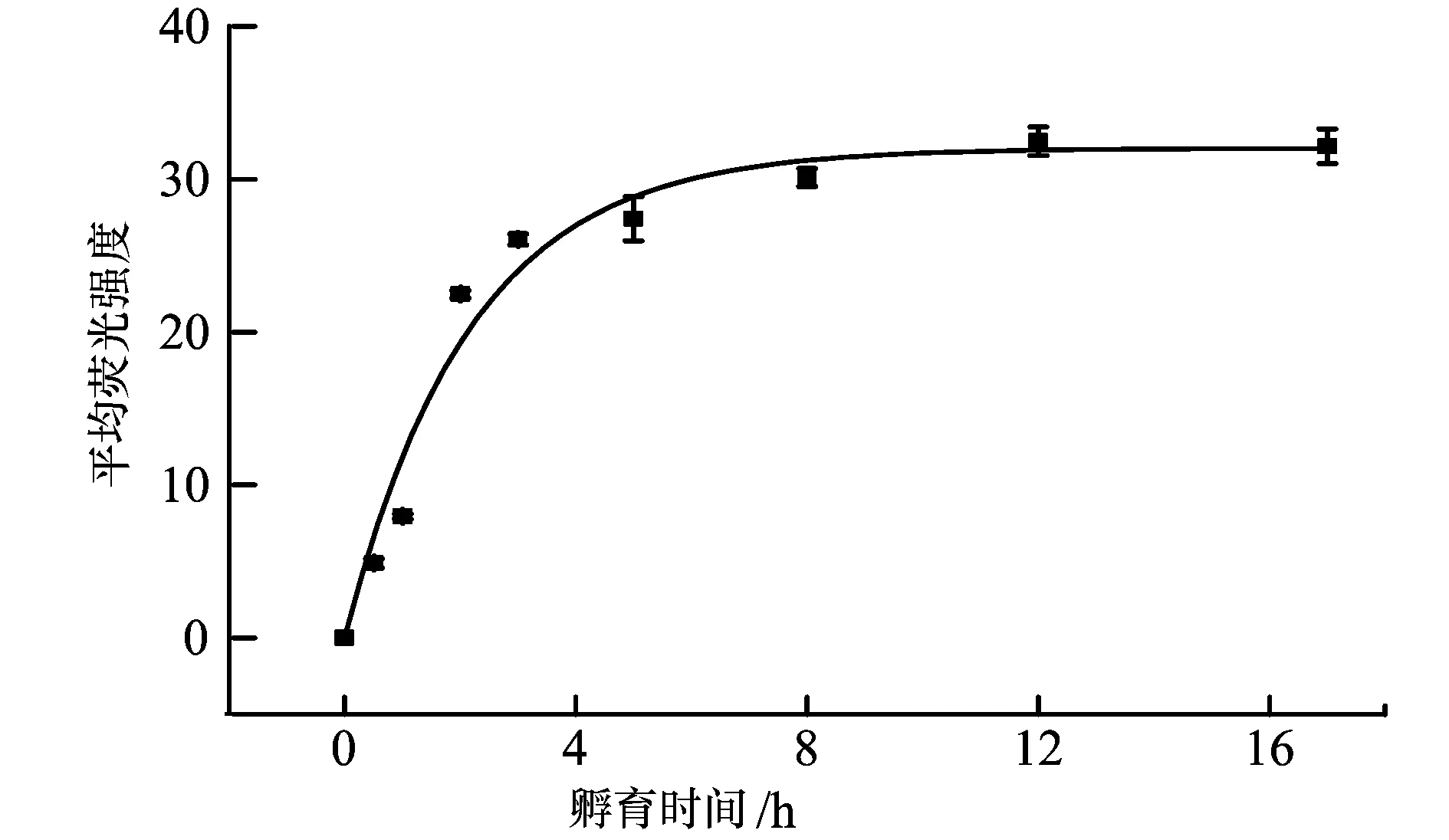
6-b—不同時間細(xì)胞內(nèi)吞FND-PL-Tf納米顆粒的動力學(xué)曲線(數(shù)據(jù)選取圖A)
以共價(jià)偶聯(lián)方式形成的FND-PL-Tf納米顆粒為研究對象,對其進(jìn)入細(xì)胞動力學(xué)做探討,結(jié)果如圖6所示。隨著細(xì)胞與FND-PL-Tf納米顆粒孵育時間的延長,細(xì)胞內(nèi)的熒光強(qiáng)度明顯增強(qiáng)(6-a), 黑色曲線為細(xì)胞自發(fā)熒光,表明FND-PL-Tf進(jìn)入細(xì)胞的量逐漸增加。圖 6-b為圖6-a中細(xì)胞內(nèi)的熒光強(qiáng)度與孵育時間的動力學(xué)曲線示意圖,由圖可見,隨著時間的增加,細(xì)胞攝取的FND-PL-Tf納米顆粒逐漸增多,當(dāng)5 h時FND-PL-Tf進(jìn)入細(xì)胞的量達(dá)到一平臺,熒光強(qiáng)度隨時間延長不再發(fā)生改變,表明FND-PL-Tf進(jìn)入細(xì)胞的量已經(jīng)達(dá)到飽和。按一級反應(yīng)動力學(xué)擬合計(jì)算得到速率常速為k=(0.462±0.046)h-1,比我們曾報(bào)道[8]的FND-Tf進(jìn)入細(xì)胞的速率常數(shù) (0.55±0.067) h-1小。這是由于納米顆粒粒徑越大,網(wǎng)格蛋白包裹時間越長,則其進(jìn)入細(xì)胞速率越慢[26]。盡管FND-PL-Tf納米顆粒的Zeta電位為正值(19.6 mV),FND-Tf的Zeta電位為負(fù)值(-15.0 mV)[8], 與帶負(fù)電荷的細(xì)胞作用時應(yīng)當(dāng)前者更有利,但FND-PL-Tf(~233 nm)納米顆粒粒徑大于FND-Tf(~221 nm)納米顆粒的粒徑[8],可見FND-PL-Tf進(jìn)入細(xì)胞主要受粒徑大小控制,因此FND-PL-Tf進(jìn)入細(xì)胞的速率比FND-f進(jìn)入細(xì)胞的速率慢一些。
3 結(jié)論
我們選用聚賴氨酸做橋梁,首先與強(qiáng)酸氧化后的熒光納米鉆石共價(jià)偶聯(lián)獲得FND-PL納米顆粒,接著共價(jià)偶聯(lián)轉(zhuǎn)鐵蛋白制備了轉(zhuǎn)鐵蛋白修飾的FND-PL-Tf納米顆粒,利用傅里葉變換紅外光譜儀、激光粒度分析儀對FND-PL-Tf進(jìn)行了表征。用不同濃度的轉(zhuǎn)鐵蛋白與FND-PL偶聯(lián)獲得最大偶聯(lián)量為每毫克FND-PL納米顆粒偶聯(lián)(238±8.95)μg Tf。以HeLa細(xì)胞為模型,由偶聯(lián)不同Tf量的FND-PL-Tf與細(xì)胞作用,發(fā)現(xiàn)偶聯(lián)Tf最大的FND-PL-Tf進(jìn)入細(xì)胞最少,這一結(jié)果表明細(xì)胞攝取FND-PL-Tf的量與偶聯(lián)Tf的量有關(guān)。由FND-PL-Tf進(jìn)入細(xì)胞機(jī)理研究,表明通過FND-PL共價(jià)偶聯(lián)或物理吸附Tf形成的FND-PL-Tf均由轉(zhuǎn)鐵蛋白受體介導(dǎo)進(jìn)入細(xì)胞,此外細(xì)胞內(nèi)吞FND-PL-Tf納米顆粒具有能量、時間依賴性和網(wǎng)格蛋白決定的過程,按一級擬合得出FND-PL-Tf進(jìn)入細(xì)胞的速率常數(shù)k=(0.462±0.046)h-1。研究表明獲得的FND-PL-Tf納米顆粒具有潛在的靶向輸送藥物和檢測腫瘤效應(yīng)。
致謝:感謝臺灣中央研究院 H. C. Chang 教授提供的熒光納米鉆石。
[1]Lien Z Y, Hsu T C, Liu K K, et al. Cancer cell labeling and tracking using fluorescent and magnetic nanodiamond[J]. Biomaterials, 2012, 33(26): 6172-6185.
[2]Schrand A M, Huang H, Carlson C, et al. Are diamond nanoparticles cytotoxic[J]. Physical Chemistry B, 2007, 111(1): 2-7.
[3]Schrand A M, Dai L M, Schlager J J. Differential biocompatibility of carbon nanotubes and nanodiamonds[J]. Diamond and Related Material, 2007, 16(12): 2118-2123.
[4]Jia G, Wang H, Yan L, et al. Cytotoxicity of carbon canomaterials: single-wall nanotube, multi-wall Nanotube, and fullerene[J]. Environment Science Technology, 2005, 39(5): 1378-1383.
[5]Zhang X Y, Hu W B, Li J, et al. A comparative study of cellular uptake and cytotoxicity of multi-walled carbon nanotubes, graphene oxide, and nanodiamond[J]. Toxicology Research,2012, 1: 62-68.
[6]Vaijayanthimala V, Cheng P Y, Yeh S H, et al. The long-term stability and biocompatibility of fluorescent nanodiamond as an in vivo contrast agent[J]. Biomaterials, 2012, 33(31): 7794-7802.
[7]Wenga M F, Chiang S Y, Wang N S, et al. Fluorescent nanodiamonds for specifically targeted bioimaging: Application to the interaction of transferrin with transferrin receptor[J]. Diamond and Related Material, 2009, 18(2-3): 587-595.
[8]Li Y Q, Zhou X P. Transferrin-coupled fluorescence nanodiamonds as targeting intracellular transporters: An investigation of the uptake mechanism[J]. Diamond and Related Material, 2010, 19(10): 1163-1167.
[9]Chow E K, Zhang X Q, Chen M, et al. Nanodiamond therapeutic delivery agents mediate enhanced chemoresistant tumor treatment[J]. Science Translational Medicine,2011, 3(73): 73.
[10]Huang H, Pierstorff E, Osawa E, et al. Active nanodiamond hydrogels for chemotherapeutic delivery[J]. Nano Letter, 2007,7(11): 3305-3314.
[11]Li Y Q, Zhou X P, Wang D X. J Nanodiamond mediated delivery of chemotherapeutic drugs[J]. Material Chemistry, 2011, 21: 16406-16412.
[12]Mohan N, Chen C S, Hsieh H H, et al. In vivo imaging and toxicity assessments of fluorescent nanodiamonds in caenorhabditis elegans[J]. Nano Letter, 2010, 10(9): 3692-3699.
[13]Fu C C, Lee H Y, Chen K, et al. Characterization and application of single fluorescent nanodiamonds as cellular biomarkers[J]. PNAS, 2007, 104(3): 727-732.
[14]Wang D X, Tong Y L, Li Y Q, et al. PEGylated nanodiamond for chemotherapeutic drug delivery[J]. Diamond and Related Material, 2013, 36: 26-34.
[15]Chen B, Liu Q L, Zhang Y L, et al. Transmembrane delivery of the cell-penetrating peptide conjugated semiconductor quantum dots[J]. Langmuir, 2008, 24(20): 11866-11871.
[16]Qian Z M, Li H, Sun H,et al. Targeted drug delivery via the transferrin receptor-mediated endocytosis pathway[J]. Pharmacological Reviews,2002, 54(4): 561-587.
[17]Widera A, Norouziyan F, Shen W C. Mechanisms of TfR-mediated transcytosis and sorting in epithelial cells and applications toward drug delivery[J]. Advanced Drug Delivery Reviews,2003, 55(11): 1439-1466.
[18]Abou-Jawde R, Choueiri T, Alemany C, et al. An overview of targeted treatments in cancer[J]. Clinical Therapeutics,2003, 25(8): 2121-2137.
[19]Tekle C, Deurs BV, Sandvig K, et al.Cellular trafficking of quantum dot-ligand bioconjugates and their induction of changes in normal routing of unconjugated ligands[J]. Nano Letter, 2008, 8(7): 1858-1865.
[20]Kam N W S, Jessop T C, Wender P A, et al. Nanotube molecular transporters: internalization of carbon nanotube-rotein conjugates into mammalian Cell[J]. J. Am. Chem. Soc, 2004, 126(22): 6850-6851.
[21]Kohler N, Sun C, Wang J, et al. Methotrexate-modified superparamagnetic nanoarticles and their Intracellular uptake into human cancer cells[J]. Langmuir,2005, 21(19): 8858-8864.
[22]Chithrani D, Chan W C W. Elucidating the mechanism of cellular uptake and removal of protein-coated gold nanoparticles of different sizes and shapes [J]. Nano Letter, 2007, 7(6): 1542-1550.
[23]Babic M, Hor?k D, Trchov? M, et al. Poly(L-ysine)-odified iron oxide nanoparticles for stem cell labeling[J]. Bioconjugate Chemistry, 2008, 19(3): 740-750.
[24]Letoha T, Ga?l S, Somlai C, et al. Membrane translocation of penetratin and its derivatives in different cell lines[J]. J Mol Recognit, 2003, 16(5): 272-279.
[25]Chen B, Liu Qiaoling, Zhang Yuliang, et al. Transmembrane delivery of the cell-enetrating peptide conjugated semiconductor quantum dots [J]. Langmuir, 2008, 24(20): 11866-11871.
[26]Bao G, Bao X R. Shedding light on the dynamics of endocytosis and viral budding[J]. PNAS, 2005, 102(29): 9997-9998.
(編輯:賈麗紅)
PreparationofTransferrin-CoupledFluorescenceNanodiamondandanInvestigationofItsUptakeMechanismbyHeLaCells
TIANZhimeia,CAORuixiab,WANGDongxina,LILina,WANGQingb,WANGZhiqinb,LIYingqia,b
(a.KeyLaboratoryofChemicalBiologyandMolecularEngineeringofMinistryofEducation,InstituteofMolecularScience,ShanxiUniversity;b.CollegeofChemistryandChemicalEngineering,ShanxiUniversity,Taiyuan030006,China.)
The biological applications of fluorescent nanodiamonds (FND) have aroused wide concerns. In this work, the targeting system FND-L-f was prepared with the fluorescent nanodiamond (FND) as a platform for delivery of drug and a probe, transferrin (Tf) as a targeted ligand and polylysine (PL) as a bridge. The interaction between the FND-L-f nanoparticles and human cervical carcinoma cells (HeLa cells) as an in vitro model was studied to explore the cellular uptake mechanism of nanoparticles, which could provide valuable theoretical basis for the targeted drug delivery and cancer detection. The results display that the cellular uptake was dependent on FND-L- Τf particle concentration, transferrin ligand density, and dosing time. In addition, the FND-PL-Tf nanoparticles prepared from FND-PL nanoparticles either physically by adsorbing Tf or covalently conjugating Tf could be internalized by the cells through clathrin-dependent and transferrin receptor-mediated endocytosis. Our study implicates that FND-PL-Tf nanoparticles have potential targeted drug delivery and tumor-targeting recognition functions.
fluorescent nanodiamond; polylysine; transferrin; uptake mechanism
2013-08-26
國家自然科學(xué)基金資助項(xiàng)目(21071091);山西省科技攻關(guān)計(jì)劃(社會發(fā)展)資助項(xiàng)目(20130313021-1);山西省自然科學(xué)基金資助項(xiàng)目(2009011012-3);山西省歸國留學(xué)基金資助項(xiàng)目(201011)
田志梅(1986-),女,山西朔州人,碩士研究生,研究方向:生物無機(jī)化學(xué),(Tel)18734152011
李英奇,女,教授,(E-mail)wkyqli@sxu.edu.cn
1007-9432(2014)02-0226-07
Q599
:A

