乳果糖對乙肝后肝硬化患者肝功能、炎癥及腸道通透性水平的影響
季曉軍,王偉軍
0 引言
隨著慢性乙肝發病率的升高,肝硬化也已經成為我國居民重要的死亡原因之一。肝硬化的發病機制較復雜,迄今國內外尚未完全研究清楚[1]。近年來研究發現,乙肝后肝硬化患者常伴有不同程度炎癥反應和腸道通透性增加,炎癥細胞分泌大量的炎癥因子,通過通透性增加的腸道粘膜進入血,通過介導肝細胞的損傷,在肝硬化的發病機制中發揮極其重要的作用。如何有效地阻斷炎癥反應,減少炎癥因子的分泌,降低腸道粘膜的通透性,保護腸粘膜的屏障功能在肝炎后肝硬化患者的治療和并發癥的預防中顯得尤為重要[2-3]。乳果糖是一種不被小腸黏膜雙糖酶分解的人工合成的雙糖,近年來研究發現,其輔助治療肝硬化具有一定的作用,但其作用機制尚不完全明了[4]。本研究觀察了乳果糖對乙肝后肝硬化患者肝功能、炎癥因子和腸道粘膜的通透性水平的影響,現報道如下。
1 資料與方法
1.1 一般資料 選擇2011年1月至2013年4月在我院消化科門診就診的乙肝后肝硬化患者80例。納入標準:符合2000年全國病毒性肝炎會議制定的肝硬化診斷標準[5],均經實驗室血清指標、肝膽超聲或CT等檢查明確診斷,且具有典型的乙肝后肝硬化臨床表現。排除標準:①治療前4周內有明顯急、慢性感染,腹膜炎或發生消化道出血;②伴發其他基礎代謝疾病;③對藥物成分過敏者;④治療前1個月服用過抗生素、益生菌和促胃腸動力藥。采用隨機數字表法將80例患者隨機分為治療組和對照組,每組40例。兩組患者性別、年齡、病程等一般情況比較差異無統計學意義(P>0.05),具有可比性。見表1。本研究方案均經我院倫理委員會批準通過,納入的所有患者研究前均知情同意,并簽署知情同意書。

表1 兩組患者治療前一般情況比較
1.2 治療方法 兩組患者均行利尿、常規保肝和對癥支持治療,治療組在此基礎上加用乳果糖口服液10 g,2~3次/d,并根據大便情況適當調整乳果糖劑量。對照組除不使用乳果糖口服液外,其余治療均與治療組基本相同。1個月后觀察兩組患者治療前后肝功能、炎癥因子水平和腸道通透性的變化,并比較自發性腹膜炎(SBP)的發生率。
1.3 觀察指標
1.3.1 肝功能的測定 采用全生化分析儀測定丙氨酸轉氨酶(ALT)、天門冬氨酸轉氨酶(AST)和血總膽紅素(TB)。
1.3.2 血清炎癥因子水平的測定 取晨空腹靜脈血5~8 mL,3 000 r/min低溫分離出上層的血清,將血清分裝于EP管內于-20 ℃冰箱保存。采用酶聯免疫法測定血清白介素-6(IL-6)、白介素-8(IL-8)和腫瘤壞死因子-α(TNF-α)的水平,試劑盒分別由深圳晶美生物公司和上海西塘生物公司提供,嚴格按照試劑盒的說明書進行實驗操作。
1.3.3 腸道通透性水平的測定 采用血清內毒素、D-乳酸和降鈣素原(PCT)3個間接指標測定患者的腸道通透性水平。采用偶氮基質顯色法測定血清內毒素水平,試劑盒由上海伊華臨床醫學科技公司提供;用改良酶學分光光度法測定血清D-乳酸水平,試劑盒由Sigma公司提供;采用化學發光法測定血清PCT水平,試劑盒由南京諾爾曼生物技術有限公司提供,均嚴格按照試劑盒的說明書進行實驗操作。
1.3.4 SBP的診斷標準 采用腹水培養多形核白細胞(PMNL)的方法進行間接診斷,如果PMNL計數≥250 cells/m3,排除繼發性腹膜炎可確診SBP。
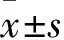
2 結果
2.1 兩組患者治療前后肝功能指標改善情況 兩組患者治療前ALT、AST和TB水平比較差異無統計學意義(P>0.05)。治療1個月后,兩組患者ALT、AST和TB水平較治療前均顯著下降,差異有統計學意義(P<0.05或P<0.01),且治療組患者下降程度顯著高于對照組(P<0.01),見表2。
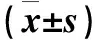
表2 兩組患者治療前后肝功能指標ALT、AST和TB水平的改善情況
2.2 兩組患者治療前后血清炎癥因子改善情況 兩組患者治療前血清炎癥因子IL-6、IL-8和TNF-α水平比較差異無統計學意義(P>0.05)。治療1個月后,兩組血清IL-6、IL-8和TNF-α均較治療前有顯著下降,差異有統計學意義(P<0.05),且治療組下降程度顯著高于對照組(P<0.01),見表3。
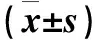
表3 兩組患者治療前后血清炎癥因子IL-6、IL-8和TNF-α水平的改善情況
2.3 兩組患者治療前后腸道通透性指標變化 兩組患者治療前內毒素、D-乳酸和PCT水平比較差異無統計學意義(P>0.05)。治療1個月后,兩組患者內毒素、D-乳酸和PCT水平均較治療前明顯下降,差異有統計學意義(P<0.05或P<0.01),且治療組下降幅度較對照組更明顯(P<0.05)。見表4。
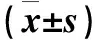
表4 兩組患者治療前后腸道通透性指標血清內毒素、D-乳酸和PCT水平的變化
2.4 兩組患者治療過程中SBP的發生率比較 治療組治療過程中發生SBP 3例(7.5%),對照組發生SBP 10例(25.0%)。治療組的SBP發生率明顯低于對照組,差異有統計學意義(χ2=4.50,P<0.05)。
3 討論
肝炎后肝硬化是臨床常見病和多發病,是肝炎患者病情進展的必經之路。肝炎后肝硬化患者肝功能損傷嚴重,免疫功能低下,并發癥多,易引起腹腔感染發生SBP[6-8]。據統計,肝硬化患者伴SBP的發生率高達10%~25%,病死率更是高達60%,預后較差[9]。近年來研究發現,炎癥因子在SBP的發生和發展過程中起重要作用,主要由于腸黏膜屏障功能受損和腸細菌易位引起血清炎癥因子表達異常引起,其中關系較密切的有IL-6、IL-8和TNF-α[10-11]。IL-6主要由單核巨噬細胞分泌,能激活并促進T、B淋巴細胞和自然殺傷細胞的合成與分化,參與急性肝細胞炎癥反應過程[12]。TNF-α具有增強NK細胞殺傷靶細胞、激活T細胞和B細胞分化、增強吞噬的功能,是參與肝硬化炎癥反應過程的重要炎癥介質之一[13]。IL-8是一種趨化性炎癥因子,具有趨化和激活中性粒細胞作用,參與了肝硬化患者炎癥反應損傷過程[14]。陳銀蕓等[15]研究也發現,肝炎肝硬化合并SBP患者較未合并SBP患者血清、腹腔積液中TNF-α、IL-8和IL-18水平顯著升高。因此,調節血清IL-6、IL-8和TNF-α水平,抑制肝硬化患者的局部炎癥反應過程是治療乙肝后肝硬化患者的新途徑。
乙肝后肝硬化患者腸道粘膜屏障受損,從而削弱了腸道的粘膜屏障功能,增加腸道粘膜的通透性,使腸道細菌和內毒素大量易位,引起腸源性內毒素血癥和肝昏迷等并發癥,加重肝功能損傷,導致肝硬化病情的加重[16-19]。腸粘膜屏障的完整性受損,腸道內的細菌、內毒素、D-乳酸及PCT移位入血,引起血內毒素和D-乳酸及PCT異常升高。因此,血清內毒素和D-乳酸及PCT水平可作為腸粘膜通透性、腸道粘膜屏障異常的主要血清學指標[20-23]。因此,通過調節血清內毒素、D-乳酸和PCT水平,降低腸道粘膜通透性也是治療乙肝后肝硬化患者的新途徑。
乳果糖是一種人工合成的雙糖,口服后在結腸被A-半乳糖苷酶分解成為雙歧桿菌生長所需要的碳源,促進了雙歧桿菌的繁殖,從而使得腸道B族維生素產生增多,起到營養腸道作用[24-26]。徐紅等[27]研究發現,乳果糖能明顯降低乙型肝炎后肝硬化血清內毒素水平,減少腸源性內毒素血癥的發生,輔助治療肝硬化具有較好的療效。孫瑜等[28]通過動物研究發現,乳果糖能通過降低血漿內毒素水平,降低腸道通透性,顯著降低血清炎癥因子TNF-α水平,減輕肝硬化患者的炎癥反應,減少自發性腹膜炎的發生率。本研究結果顯示,治療1個月后,兩組患者ALT、AST和TB水平較治療前均顯著下降,且治療組下降程度顯著高對照組;同時兩組血清IL-6、IL-8和TNF-α均較治療前顯著下降,且治療組下降程度顯著高對照組。提示乳果糖能明顯改善乙肝后肝硬化患者的肝功能指標,促進患者肝功能恢復,降低炎癥因子的水平。同時研究發現,治療1個月后,兩組患者內毒素、D-乳酸和PCT水平均較治療前明顯下降,且治療組下降幅度較對照組更明顯。提示乳果糖能明顯降低乙肝后肝硬化患者血清內毒素、D-乳酸和PCT水平,降低腸道通透性,保護腸粘膜屏障功能。同時研究還發現,治療組的SBP發生率顯著低于對照組(P<0.05)。提示乳果糖能減少乙肝后肝硬化患者自發性腹膜炎的發生率。
總之,乳果糖用于治療乙肝后肝硬化患者,能促進患者肝功能恢復,降低炎癥因子的水平,降低腸道通透性,保護腸粘膜屏障功能,從而減少自發性腹膜炎的發生率。
參考文獻:
[1] 王昱澍,李杰.肝硬化患者細胞因子TNF-α、IL-8檢測的意義[J].中國醫學工程,2011,19(8):61-63.
[2] 孫明珠,黨雙鎖.細胞因子與慢性肝臟疾病的研究進展[J].世界華人消化雜志,2009,281(21):2121-2125.
[3] 蘇英,楊宣,李新月,等.肝硬化腹水患者內毒素、細胞因子水平的檢測及臨床意義[J].臨床肝膽病雜志,2006,22(3):202-204.
[4] 徐義軍,王超.乳果糖對門脈高壓大鼠腸粘膜屏障功能保護作用的研究[J].中外醫療,2012,20(12):18-20.
[5] 中華醫學會傳染病寄生蟲病學會修訂.病毒性肝炎防治方案[J].中華傳染病學雜志,2000,l9(6):241-243.
[6] 張風蘭.恩替卡韋治療失代償期乙型肝炎肝硬化的臨床療效[J].醫學理論與實踐,2011,24(20):2454-2455.
[7] Rau BM,Krüger CM,Hasel C,et al.Effects of Immunosuppressive and immunostimulative treatment on pancreatic injury and mortality in severe acute experimental pancreatitis[J].Pancreas,2006,33(2):174-183.
[8] 胡敏濤,孫彤,裴豪,等.血必凈注射液對乙型肝炎肝硬化腹膜炎患者多種細胞因子的影響[J].實用醫學雜志,2012,28(21):3629-3631.
[9] 崔鳳芹,黃凱,崔海彬,等.肝硬化自發性細菌性腹膜炎的治療和預防[J].中國臨床醫生,2013,41(8):6-7.
[10]González Alonso R,González García M,Albillos Martínez A.Physiopathology of bacterial translocation and spontaneous bacterial peritonitis in cirrhosis[J].Gastroenterol Hepatol,2007,30(2):78-84.
[11]Ancel D,Barraud H,Peyrin-Biroulet L,et al.Intestinal permeability and cirrhosis[J].Gastroenterol Clin Biol,2006,30(3):460-468.
[12]全敏,邢卉春.肝硬化合并自發性細菌性腹膜炎診斷的研究進展[J].中華實驗和臨床感染病雜志(電子版),2012,6(2):156-158.
[13]王西棟,張廣蘭.乙型肝炎患者血清IL-2、IL-6、IL-8和TNF-α水平研究[J].預防醫學論壇,2008,14(4):309.
[14]王文仙,周鋒利.肝硬化患者外周血及腹腔積液TNF-α、IL-6、IL-8與自發性腹膜炎關系的探討[J].中國醫師雜志,2003,5(10):1418-1420.
[15]陳銀蕓,霍繼榮.乙型肝炎肝硬化并發腹膜炎患者血清及腹腔積液TNF-α、IL-8、IL-18水平臨床意義的探討[J].中國當代醫藥,2010,17(14):32-33.
[16]宋于生,賴衛國,曾敏,等.部分性脾栓塞術治療肝炎后肝硬化門脈高壓合并脾功能亢進的臨床療效[J].實用醫學雜志,2013,29(24):4077-4079.
[17]周伏喜,盧方根,吳小平,等.肝炎肝硬化患者腸壁通透性變化與細菌移位的臨床研究[J].中國現代醫學雜志,2008,18(10):1438-1440.
[18]劉樹人,羅顯榮,陳漢先,等.選擇性腸道去污染對肝硬化自發性細菌性腹膜炎腸黏膜通透性的影響[J].胃腸病學和肝病學雜志,2011,20(8):719-721.
[19]鄒俊,李學明,陳海鳴.門靜脈高壓癥脾切除賁門周圍血管離斷術后門靜脈血栓形成的相關因素分析[J].實用醫學雜志,2013,29(4):581-583.
[20]陳秀凱,邱方,程愛國.腸道屏障功能的監測方法的現狀與進展[J].中國煤炭工業醫學雜志,2003,6(7):669-671.
[21]于淑霞,王惠吉.肝硬化患者腸道通透性及乳果糖對其影響的研究[J].臨床肝膽病雜志,2006,22(2):108-110.
[22]高金生,時志民,韓轉葉,等.肝硬化腸黏膜屏障損傷患者血漿D-乳酸、二胺氧化酶及內毒素的變化[J].臨床薈萃,2009,24(3):219-221.
[23]張崴,陳禮明,張世蘭,等.肝硬化伴自發性細菌性腹膜炎患者血漿降鈣素原的檢測及其臨床意義[J].中華醫學雜志,2003,83(7):605-606.
[24]金曉慧,王偉軍.乳果糖對肝硬化患者肝功能及腸黏膜屏障功能的影響[J].中國藥師,2012,15(12):1756-1758.
[25]沈琦,俞亞峰.乳果糖聯合培菲康預防肝硬化自發性細菌性腹膜炎的療效觀察[J].中國微生態學雜志,2013,25(8):943-945.
[26]胡世紅,鄭岳,張順財,等.乳果糖對肝硬化大鼠細菌易位和內毒素的影響[J].中國臨床醫學,2002,9(4):407-409.
[27]徐紅,李睜,金水忠.乳果糖治療乙型肝炎后肝硬化內毒素血癥的療效觀察[J].中國臨床新醫學,2011,4(5):451-453.
[28]孫瑜.乳果糖對肝硬化大鼠血漿內毒素(LPS)、腫瘤壞死因子(TNF)及血清ALT的影響[J].中國臨床新醫學,2008,17(6):4-5.

