自身免疫性甲狀腺炎小鼠發病中調節性T細胞、Th17細胞的變化
楊 榕,范晨玲,畢 美,宋西珠,李玉姝*,單忠艷,滕衛平
0 引言
自身免疫性甲狀腺炎(Autoimmune thyroiditis,AIT)是器官特異性自身免疫性疾病,從免疫學視角探索,本病發病機制是體液免疫和細胞免疫共同作用的結果,如T細胞功能的異常和甲狀腺自身抗體的產生[1]。研究證實,AIT是由CD4+T細胞介導發生,并以甲狀腺內淋巴細胞浸潤和血清中存在甲狀腺特異性自身抗體為特征。最近,學者們開始越來越多地關注CD4+CD25+調節性T細胞、Th17細胞在多種自身免疫性疾病中的作用,研究它們的功能、分化機制對于深入認識機體免疫調節規律,理解疾病發病機制,尋求更有效的疾病干預靶點具有非常重要的意義。NOD.H-2h4小鼠是研究碘致自身免疫性甲狀腺炎的最理想的動物模型[2]。本研究利用碘誘導的NOD.H-2h4小鼠甲狀腺炎模型,觀察在AIT發生發展中CD4+CD25+調節性T細胞、Th17細胞的變化,以探討碘致NOD.H-2h4小鼠發生AIT的可能的免疫學機制。
1 材料和方法
1.1 實驗動物及分組 NOD.H-2h4小鼠購自美國Jackson公司,在中國醫科大學實驗動物中心SPF實驗室內飼養和繁殖。所有動物的飼養以及實驗均根據動物實驗指南并經過動物倫理委員會的批準。選取4周齡NOD.H-2h4雌鼠30只,體重20 g左右,隨機分為對照組15只(給予無菌雙蒸水)和高碘飲水組15只(給予含0.005%碘化鈉的無菌雙蒸水,相當于正常碘攝入量的100倍),每組動物分別于實驗開始后8周麻醉處死。
1.2 標本采集 動物稱重后,10%水合氯醛麻醉,開胸心臟取血。頸部正中切口,分離皮膚和肌肉層,暴露氣管,顯露出甲狀軟骨側后方的兩葉甲狀腺。將氣管和甲狀腺一并取下,迅速剝離甲狀腺,冷生理鹽水沖洗,濾紙吸干,電子天平稱重。同時無菌條件下打開腹腔切取脾臟,剪開后大半脾放入含有PBS的EP管中,用于流式細胞術;小半放入含有RNAlater(Ambion,Austin,USA)的管中,-70 ℃儲存,用于實時定量RT-PCR。
1.3 流式細胞術
1.3.1 小鼠脾臟單個核細胞的制備 將小鼠大半脾臟,在200目鋼網上研磨,用1 640培養液制成細胞懸液,離心,裂解,洗滌,確定活細胞超過90%,計數細胞,并將脾細胞終濃度調至1×107/mL。
1.3.2 小鼠脾細胞的培養 于24孔培養板加入細胞懸液,每只鼠接種6個孔。其中兩孔收集細胞懸液,待測細胞CD4、CD25和Foxp3抗原的表達。另兩孔加乙酸肉豆蔻佛波醇(PMA)5 μL/孔,離子霉素1 μL/孔;在37 ℃,5%CO2條件下培養1 h后,再加入布雷菲德菌素(BFA)10 μL/孔繼續培養4 h,收集細胞,待測CD4、IL-17抗原的表達。余孔作為熒光染色的對照。
1.3.3 流式細胞染色 ①Treg的免疫熒光染色:細胞從孔中吸出轉入流式管,洗滌,離心,棄上清;加入熒光抗體 CD4-FITC、CD25-APC,4 ℃避光孵育,洗滌,離心,棄上清,震蕩混勻。表面染色后固定、破膜加入抗體Foxp3-PE,重復上述步驟后加染色buffer,立即應用FACScan流式細胞儀(BD Biosciences,USA)進行流式細胞分析。數據經winMDI 2.9分析軟件處理。②Th17細胞免疫熒光染色:步驟同上,表面染色加入熒光抗體 CD4-FITC,胞內染色加入抗體IL-17-PE (以上單克隆抗體均購自BD Bioscience,USA)。
1.4 甲狀腺組織的光鏡形態學 小鼠甲狀腺組織經10%甲醛固定,常規石蠟包埋、切片,HE染色。采用BX51FL+DP70 顯微照像系統,應用Image-Pro Plus 5.1軟件測量100倍光鏡下濾泡腔平均面積、等效半徑、平均周長、形狀因子和上皮細胞高度、核長短徑比。淋巴細胞浸潤程度的評估參照文獻[3],根據淋巴細胞浸潤面積,HE染色的甲狀腺組織切片按照如下標準進行評分:0=正常;1+∶1%~10%;2+∶10%~30%;3+∶30%~50%;4+∶>50%。甲狀腺炎評分采用至少3塊非連續的甲狀腺組織切片的評分的均值表示。
1.5 血清中TgAb滴度的測定 通過心臟取血的小鼠室溫靜置至少2 h,離心后分離血清并儲存于-70 ℃的冰箱內待用。小鼠甲狀腺組織勻漿并離心后,應用鹽析法分離小鼠甲狀腺球蛋白(MTg),并用重復凝膠過濾的方法進行純化。應用抗原介入的間接酶聯免疫吸附試驗測定TgAb,TgAb>0.082確定為陽性。
1.6 實時定量RT-PCR分析
1.6.1 脾組織總RNA的提取 應用TRIzol 試劑(Invitrogen,USA)抽提脾組織總RNA。應用核酸定量儀測定各RNA樣品濃度及其260/280 nm波長處吸光度比值在1.9~2.1之間。
1.6.2 合成互補DNA(cDNA) 應用RNA反轉錄試劑盒(PrimeScriptTMRT reagent Kit,TaKaRa)將1 μg總RNA于PCR儀中(ABI 9700 PCR meter)反轉錄為互補DNA(cDNA)。Real-Time RT-PCR:以GAPDH為參比基因,對目的基因Foxp3、IL-17、RORγt進行實時定量檢測,應用SYBR?PremixExTaqTMⅡ試劑盒(Takara)于Lightcycler480實時定量PCR儀上(Roche)采用SYBR Green Ⅰ實時熒光定量PCR法對反轉錄產物進行定量分析。反應體系為18 μL,引物設計與合成:GAPDH:5′-AAGCCTGACCACGCTTTCTA-3′(上游) 和 5′-ATGAAGTGGTTGGGGAATGA-3′(下游);Foxp3:5′-GGC CCT TCT CCA GGA CAG A-3′(上游)和5′-GCT GAT CAT GGC TGG GTT GT-3′(下游);IL-17:5′-AGGCTCAGCAGCAACAG-3′(上游)和5′-ACGCGCAAACATGTCCAG-3′(下游);RORγt:5′-ACC TCC ACT GCC AGC TGT GTG CTG TC-3′(上游)和5′-TCA TTT CTG CAC TTC TGC ATG TAG CC-3′(下游)。上述引物由上海生工生物工程技術服務有限公司合成。反應條件:95 ℃ 5 s;95 ℃ 5 s,60 ℃ 20 s,72 ℃ 30 s,45 個循環;75~95 ℃熔解曲線分析。
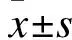
2 實驗結果
2.1 甲狀腺相對重量 隨著周齡的增長,小鼠的體重逐漸增加,但是兩組小鼠體重沒有明顯差異。飲用高碘水8周后的NOD.H-2h4小鼠甲狀腺相對重量(12.04±0.36)mg較同周齡對照組小鼠(8.00±0.22)mg明顯增加(P<0.001)。增大的甲狀腺組織與正常甲狀腺相比顏色變淺、質地變硬。
注:小鼠甲狀腺相對重量=小鼠甲狀腺濕重(mg)/小鼠體重(g)×100。
2.2 血清TgAb滴度的變化 NOD.H-2h4小鼠在予高碘飲水8周后,血清TgAb滴度(OD=0.70±0.10*)較同周齡對照組(OD=0.48±0.08)顯著升高(P<0.001)。
2.3 甲狀腺炎癥評估 HE染色結果顯示,給予高碘飲水8周后,NOD.H-2h4小鼠甲狀腺炎的發生率增高,如表1所示。

表1 NOD.H-2h4小鼠補碘與未補碘組甲狀腺炎發生率(%)
通過觀察HE染色切片,根據淋巴細胞浸潤情況對甲狀腺炎癥程度進行評分顯示,給碘8周甲狀腺內淋巴細胞浸潤程度明顯增加,組織學炎癥評分明顯增高。雖然未補碘組部分小鼠也自發產生甲狀腺炎,但是炎癥程度評分均較低,見圖1及表2。

表2 NOD.H-2h4小鼠補碘與未補碘組甲狀腺炎癥程度組織學評分

圖1 NOD.H-2h4小鼠甲狀腺濾泡光鏡結構 HE染色(×100)
2.4 流式細胞結果分析
2.4.1 CD4+CD25+調節性T細胞比例的變化 小鼠脾細胞CD4+CD25+調節性T細胞流式分析過程如圖2所示。高碘飲水組小鼠8周以后脾細胞CD4+CD25+Foxp3+T細胞百分比與同周齡對照組比較明顯降低[(13.99± 2.19)%vs.(16.97± 3.47)%,P<0.01]。

圖2 NOD.H-2h4小鼠高碘組與對照組調節性T細胞的流式細胞學分析
2.4.2 Th17細胞比例的變化 小鼠脾細胞Th17細胞流式分析過程如圖3所示。高碘飲水組小鼠8周以后脾細胞中CD4+IL-17+的Th17細胞百分比與同周齡對照組比較明顯升高。見表3。

圖3 NOD.H-2h4小鼠高碘組與對照組Th17細胞的流式細胞學分析
表3兩組流式細胞學分析結果(細胞比例,%)

細胞高碘組對照組P值Treg13.99± 2.1916.97± 3.47<0.01Th172.27± 0.890.71± 0.26<0.01
2.5 實時定量結果分析
2.5.1 Foxp3 mRNA表達水平的變化 高碘飲水8周后,AIT小鼠脾組織Foxp3 mRNA表達水平低于同周齡對照組小鼠,見表4。
2.5.2 IL-17 mRNA 表達水平的變化 高碘飲水8周后,AIT小鼠脾組織IL-17 mRNA表達水平高于同周齡對照組小鼠,見表4。
2.5.3 RORγt mRNA表達水平的變化 高碘飲水8周后,AIT小鼠脾組織RORγt mRNA表達水平高于同周齡對照組小鼠,見表4。

表4 NOD.H-2h4小鼠脾細胞各因子mRNA 表達量的變化
3 討論
NOD.H-2h4小鼠是研究碘致自身免疫性甲狀腺炎的最理想的動物模型[2],當給予7~8周齡NOD.H-2h4小鼠0.05%碘化鈉水8周后,幾乎100%NOD.H-2h4小鼠發生SAT[4]。本實驗亦提示碘過量可以誘發和加重具有自身免疫遺傳傾向的易感動物發生AIT。盡管公認NOD.H-2h4小鼠是建立SAT模型的一種良好的動物品系,但是發生SAT的確切免疫學機制尚未闡明。
調節性T細胞是一群具有免疫抑制效應的T細胞亞群,其對維持機體免疫耐受和免疫應答具有非常重要的作用,可以通過一系列機制抑制過強的免疫應答,使機體在自身損傷最小的情況下有效地清除抗原或病原體。Treg作為一種獨特的具有負性調節作用的T細胞亞群,參與了機體外周自身免疫耐受的建立和維持[5]。轉錄因子Foxp3對調節性T細胞的發生和功能發揮著關鍵的分子開關的作用,屬于叉頭翼狀螺旋家族。在小鼠中,外周和胸腺的Foxp3+細胞大部分為CD4+CD25+T細胞,Foxp3的遺傳缺陷可以造成CD4+CD25+T細胞的減少,從而導致自身免疫異常的發生[6-7]。應用CD25抗體在給予NOD.H-2h4小鼠高碘飲水前4 d,將小鼠體內的CD4+CD25+T細胞去除后,發現發生甲狀腺炎的程度和血清TgAb滴度均較對照組加重[8]。如果在去除CD25+T細胞的B10小鼠體內被動轉入CD4+CD25+T細胞,則能恢復其對實驗性自身免疫性甲狀腺炎(EAT)的抵抗[9]。最近的研究報道,可以用小鼠甲狀腺球蛋白(mTg)在抵抗甲狀腺炎發生的小鼠體內去除CD4+CD25+Treg后,誘導其發生甲狀腺炎[10]。自然存在的CD4+CD25+Foxp3+Treg在誘導抗原特異性免疫耐受中發揮著重要的作用[11],同時能夠影響易感小鼠甲狀腺炎的發生。在本項研究中,我們發現,通過高碘飲水誘導發生SAT的NOD.H-2h4小鼠,外周CD4+CD25+Foxp3+T細胞比例較同周齡對照組降低。同時,Foxp3 mRNA的表達亦有類似的變化。缺乏Foxp3的功能性表達可能導致本應發育為Treg的胸腺T細胞分化為自身反應性T細胞,并逃避陰性選擇,攻擊自身抗原而導致自身免疫性疾病[12]。結合以往研究結果,提示在小鼠甲狀腺炎的發生中,CD4+CD25+調節性T細胞可能發揮著關鍵的作用,為治療提供一個新的靶點。
長期以來,學者們認為,Th1細胞介導多種自身免疫性疾病的發生。而Park等[13]對EAE動物模型的研究同樣發現:清除或中和Th1型細胞因子IFN-γ或IL-12的功能,并不能預防或減輕疾病的進展。而IL-23的缺失降低了體內IL-17+T細胞的比例,因此延緩了疾病的進程。Langrish等[14]在定向基因敲除動物模型的研究中發現,IL-23基因缺失的小鼠可以抵抗EAE的發生。在該動物模型的中樞神經系統和引流淋巴結中,IFN-γ+CD4+T細胞數量與野生型小鼠相當,而IL-17、TNF-α和IL-6+CD4+細胞卻檢測不到。在隨后的研究中,給予EAE小鼠抗IL-17抗體處理,可以延緩EAE所致麻痹的發生,并使已經發生的麻痹明顯減輕。以上研究說明缺失IL-17+T細胞可以使EAE的發病受到抑制,從而提示IL-17+T細胞誘導自身免疫病的發生。Th17分泌細胞因子IL-17,RORγt是Th17細胞分化調控的關鍵轉錄因子,其過表達可以誘導IL-17的產生,而缺乏RORγt的細胞只產生少量的IL-17[15]。以往在多種自身免疫病及相應動物模型的血清及組織中均能檢測到IL-17。IL-17通過誘導炎癥介質、趨化因子等導致組織器官的炎性損傷。最近,大量研究證實在組織慢性炎癥中Th17細胞的致病作用,并且已經證實在部分動物模型中的器官特異性或非器官特異性自身免疫病的發病機制中Th17細胞亦發揮著重要的作用。本研究發現,高碘誘發的NOD.H-2h4自身免疫性甲狀腺炎小鼠模型中Th17細胞比例較同周齡對照組小鼠明顯升高。同時,IL-17 mRNA、RORγt mRNA的表達亦有類似的變化。提示在AIT的發生發展中Th17細胞發揮著重要的作用。Th17細胞及其分泌的細胞因子介導炎癥性反應,可能參與多種自身免疫性疾病的重要發病環節。Th17細胞的發現拓寬了我們對AIT發病機制的認識,對尋求更有效的疾病干預靶點具有非常重要的意義。
參考文獻:
[1] 滕衛平.碘攝入量變化對甲狀腺疾病的影響[J].中華內分泌代謝雜志,1998,14:145-146.
[2] Rose NR,Bonita R,Burek CL.Iodine:an environmental trigger of thyroiditis[J].Autoimmunity Reviews,2002,1:97-103.
[3] Yanaba K,Bouaziz JD,Haas KM,et al.A regulatory B cell subset with a unique CD1dhiCD5+ phenotype controls T cell dependent inflammatory responses[J].Immunity,2008,28(5):639-650.
[4] Allen EM,Appel MC,Braverman LE.The effects of iodide ingestion on the development of spontaneous lymphocytic thyroiditis in the diabetes-prone BB/W rats[J].Endocrinology,1986,118:1977-1981.
[5] Zhu J,Paul WE.CD4 T cells:fates,functions,and faults[J].Blood,2008,112:1557-1569.
[6] Fontenot JD,Gavin MA,Rudensky AY.Foxp3 programs the development and function of CD4+CD25+regulatory T cells[J].Nat Immunol,2003,4:330-336.
[7] Fontenot JD,Rasmussen JP,Williams LM,et al.Regulatory T cell lineage specification by the forkhead transcription factor foxp3[J].Immunity,2005,22:329-341.
[8] Nagayama Y,Horie I,Saitoh O,et al.CD4+CD25+naturally occurring regulatory T cells and not lymphopenia play a role in the pathogenesis of iodide-induced autoimmune thyroiditis in NOD-H2h4mice[J].J Autoimmun,2007,29:195-202.
[9] Morris GP,Yan Y,David CS,et al.H2A-and H2E-derived CD4+CD25+regulatory T cells:a potential role in reciprocal inhibition by class II genes in autoimmune thyroiditis[J].J Immunol,2005,174:3111-3116.
[10]Kong YC,Morris GP,Brown NK,et al.Autoimmune thyroiditis:a model uniquely suited to probe regulatory T cell function[J].J Autoimmun,2009,33:239-246.
[11]Morris GP,Brown NK,Kong YC.Naturally-existing CD4+CD25+Foxp3+regulatory T cells are required for tolerance to experimental autoimmune thyroiditis induced by either exogenous or endogenous autoantigen[J].J Autoimmun,2009,33:68-76.
[12]Ramsdell F.Foxp3 and natural regulatory T cells:key to a cell lineage[J].Immunity,2003,19:165-168.
[13]Park H,Li Z,Yang XO,et al.A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J].Nat Immunol,2005,6(11):1133-1141.
[14]Langrish CL,Chen Y,Blumenschein WM,et al.IL-23 drives a pathogenic T cell population that induces autoimmune inflammation[J].J Exp Med,2005,201(2):233-240.
[15]Ivanov II,McKenzie BS,Zhou L,et a1.The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-l7+T helper cells[J].Cell,2006,126(6):1121-1133.

